生理药代动力学核心模型
涉及一种生理药代动力学核心模型的构建方法和全氟化合物类的核心模型。
背景技术:
1、隔室模型可有效用于分析血中药物浓度和尿液排泄数据,以解释体内动力学或制定药物管理计划。然而,构成模型的隔室对实际组织的解剖学意义非常有限,隔室之间的连接也是通过虚拟速率常数而不是血流连接的,从而在反映实际活体中变化的各种因素方面存在局限性。
2、为了解决这些限制,使用生理药代动力学(physiologically-basedpharmacokinetic,pbpk)模型。pbpk模型科学地分析内部剂量与外部剂量之间的相关性,可有效用于从人体获得的生物监测结果中评估有害物质的危害性。内部剂量或内部相应用量(internal dose)是指物质在暴露评估中通过物理或生物过程渗透有机体的吸收屏障(如皮肤、肺组织、胃肠道)而被吸收的量,而外部剂量(external dose)是指对某些人或动物暴露或摄入的物质的量。与隔室模型不同,pbpk模型的优点在于,可以考虑实际体内组织器官的解剖结构和生理化学因素等来解释药物的体内动力学。使用该pbpk模型,可以通过体内残留浓度来评估难以直接对人体进行的有害物质的暴露程度或向靶器官的分布等。
3、然而,由于现有的pbpk模型需要对每个待分析化合物建立模型,因此目前正在为每个物质建立独立的pbpk模型,但pbpk模型的开发需要大量的时间和各种类型的实验,针对多种有害物质开发独立的pbpk模型需要花费大量的时间和费用。因此,为所有有害物质开发独立的模型具有繁琐的局限性。
4、尤其,在有害物质中,已知的全氟化合物类约有20种,其作为用于制备纺织品、地毯、纸张涂料、化妆品和其他各种产品的成分,现代社会中人体广泛接触的风险正在增加。
5、因此,本发明人为了更快速有效地评估人体对这些物质中每一种的暴露情况,开发了一种根据结构对有害物质进行分类并建立和利用每个系列的pbpk模型的核心模型的方法,从而解决了上述问题。
技术实现思路
1、技术问题
2、根据一方面提供一种可共同应用于两种或多种化合物的生理药代动力学核心模型(physiologically based pharmacokinetic core model,pbpk core model),所述化合物的母核包括以下化学式1。
3、另一方面提供一种利用所述生理药代动力学核心模型(physiologically basedpharmacokinetic core model,pbpk core model)提供个体的化合物外部剂量的相关信息的方法。
4、又一方面提供一种生理药代动力学核心模型(physiologically basedpharmacokinetic core model,pbpk core model)的构建方法,其包括:构建具有共同母核的两种或多种化合物的独立的生理药代动力学模型(physiologically basedpharmacokinetic model,pbpk model);通过所述独立的模型结构选择核心模型的隔室;以及利用所述隔室构建生理药代动力学核心模型。
5、技术方案
6、根据一方面提供一种可共同应用于两种或多种化合物的生理药代动力学核心模型(physiologically based pharmacokinetic core model,pbpk core model),所述化合物的母核包括以下化学式1。
7、所述化合物可以为全氟化合物(perfluorinated chemicals,pfcs)。另外,所述化合物的母核可以包括选自以下化学式1至化学式3中的至少一种。
8、【化学式1】
9、
10、【化学式2】
11、
12、【化学式3】
13、
14、如本文所用,术语“全氟化(perfluoro/perfluorinated)”是指分子中链的所有氢原子均变成氟原子的化合物。
15、如本文所用,术语“全氟化合物(perfluorinated chemicals,pfcs)”也称为全氟化化合物(per-and polyfluoroalkyl substances,pfas),是指链中所有c-h均被c-f取代的化合物,结果,其还可以包括可转化成全氟化合物的全氟化合物前体(precursors)。
16、根据一具体实施例,所述全氟化合物可以为选自全氟羧酸(perfluorocarboxylicacids,pfcas)类化合物和全氟烷基磺酸盐(perfluoroalkane sulfonates,pfsas)类化合物中的至少一种。
17、根据一具体实施例,所述全氟烷基磺酸盐(perfluoroalkane sulfonates,pfsas)类化合物可以包括全氟辛基磺酸(perfluorooctanesulfonic acid,pfos)类化合物。
18、根据一具体实施例,所述全氟羧酸(perfluorocarboxylic acids,pfcas)类化合物可以包括全氟辛酸(perfluorooctanoic acid,pfoa)类化合物或全氟戊酸(perfluoropentanoic acid,pfpea)类化合物。
19、如本文所用,术语“pfsas或pfcas类化合物”是指pfsas、pfcas、其盐、其衍生物和可成为pfsas或pfcas的物质。
20、所述全氟辛基磺酸(perfluorooctanesulfonic acid,pfos)可以由以下化学式4表示。以下x表示oh基或盐的形式。
21、根据一具体实施例,所述全氟化合物可以包括全氟化合物的前体(precursor)或衍生物。具体地,所述全氟化合物还可以包括具有分解成pfsas或pfcas潜力的物质,或者由pfsas或pfcas衍生的衍生物。
22、【化学式4】
23、
24、所述全氟辛酸(perfluorooctanoic acid,pfoa)可以由以下化学式5表示。以下x表示oh基或盐的形式。
25、【化学式5】
26、
27、所述“全氟羧酸(perfluorocarboxylic acids,pfcas)”可以由以下化学式6表示。以下x表示oh基或盐的形式。
28、【化学式6】
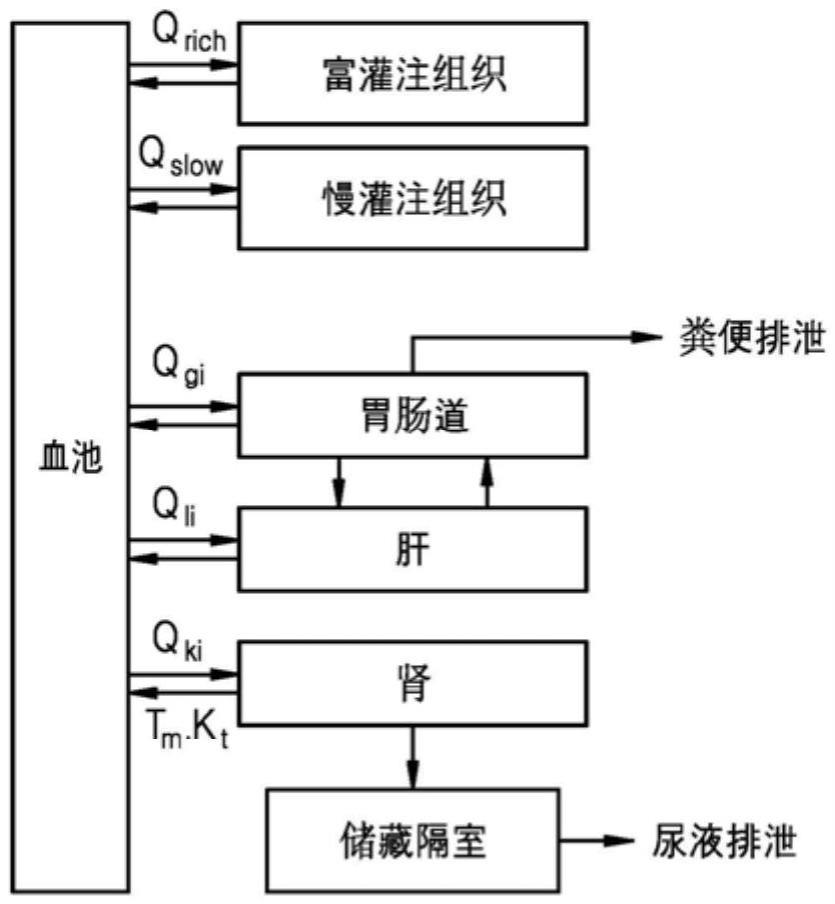
29、
30、所述“全氟烷基磺酸盐(perfluoroalkane sulfonates,pfsas)”可以由化学式7表示。以下x表示oh基或盐的形式。
31、【化学式7】
32、
33、如本文所用,术语“生理药代动力学模型(physiologically basedpharmacokinetic model,pbpk model)”是指,为了准确地预测药物的体内动力学,考虑生理特性,将构成活体的各组织和器官与血流连接以进行建模。与现有的隔室模型或药代动力学模型不同,所述生理药代动力学模型可以将生理特性与药物特性、生物反应特性、代谢、组织和血中分布特性等应用于建模。因此,所述生理药代动力学模型可以根据各种情况预测药物或毒性物质在血中和靶器官中的浓度,利用通过各种动物实验开发的pbpk模型和人体生理特征,可以开发人体pbpk模型并应用于预测药物在血液和靶器官中的浓度。
34、在所述生理药代动力学模型中,每个组织都表示为具有独特生理(如血流、组织或器官的体积)和理化(分配系数等)参数值的隔室。器官和器官系统可以用方框表示,血流或物质去除过程可以用箭头表示。
35、如本文所用,术语“生理药代动力学核心模型”也称为基于生理学的药代动力学核心模型,是指可共同应用于两种或多种化合物的药代动力学模型。
36、如本文所用,术语“隔室(compartment)”是指将身体的器官与具有相似分布特性的器官分组并设置为一个或两个隔间。所述隔室可用于计算药物的浓度趋势。另外,根据充分搅拌模型(well-stirred model),隔室通常可以假设为均匀且完全混合的反应容器。即,物质在一个组织中的浓度可能相同,与静脉血中浓度有特定的分布关系。
37、所述生理药代动力学模型的隔室(compartment)可以包括选自富灌注组织(richperfused tissue)、慢灌注组织(slow perfused tissue)、肾脏(kidney)、储藏隔室(storage compartment)、血池(blood pool)、胃肠道(g.i track)和肝脏(liver)中至少一种。
38、根据一具体实施例,所述隔室可以包括富灌注组织(rich perfused tissue)、慢灌注组织(slow perfused tissue)、肾脏(kidney)、储藏隔室(storage compartment)、血池(blood pool)、胃肠道(g.i track)和肝脏(liver)。
39、所述生理药代动力学核心模型可以包括选自以下数学式1至数学式11中的至少一个的物质平衡微分方程:
40、【数学式1】
41、
42、【数学式2】
43、
44、【数学式3】
45、aoral(t=0)=dose·(1-fu)
46、【数学式4】
47、
48、【数学式5】
49、
50、【数学式6】
51、
52、【数学式7】
53、
54、【数学式8】
55、
56、【数学式9】
57、
58、【数学式10】
59、
60、【数学式11】
61、
62、数学式1为针对血池(blood pool)的微分方程,数学式2和数学式3为针对口服施用的微分方程,数学式4为针对富灌注组织(rich perfused tissue)的微分方程,数学式5为针对慢灌注组织(slow perfused tissue)的微分方程,数学式6为针对肝脏的微分方程,数学式7为针对肾脏的微分方程,数学式8为针对储藏隔室的微分方程,数学式9为针对胃肠道的微分方程,数学式10为针对尿液的微分方程,数学式11为针对粪便的微分方程。
63、如图16和下表5所示,所述k为速率常数(rate constant,1/hr),q为流速(flowrate,l/hr),c为浓度(concentration,mg/l或mmol/l),a为量(amount,mg),ku为尿排泄速率常数(urine excretion rate constant,1/hr),kabs为口服吸收速率常数(oralabsorption rate constant,1/hr)。
64、在下标中,所述he为心脏,所述rb为身体的其余部分(rest of body),所述br为脑,所述li为肝,所述lu为肺,所述ki为肾,所述gi为胃肠道,所述fil为滤液隔室(filtratecompartment),所述oral为口服给药,所述st为储藏隔室(storage compartment),所述urine为尿液。
65、所述参数可以为生理参数、分配系数或生化参数。所述生理参数可以包括吸收速率、代谢参数、组织扩散常数、血清蛋白结合性或代谢。另外,所述代谢参数可以包括一阶或二阶速率常数、最大代谢速率或米氏(michaelis-menten)常数。
66、另一方面提供一种利用所述生理药代动力学核心模型(physiologically basedpharmacokinetic core model,pbpk core model)提供个体的化合物外部剂量的相关信息的方法。
67、所述化合物可以为全氟化合物(perfluorinated chemicals,pfcs)。另外,所述化合物的母核可以包括选自以下化学式1至化学式3中的至少一种。
68、【化学式1】
69、
70、【化学式2】
71、
72、【化学式3】
73、
74、有关所述全氟化合物、剂量、母核和生理药代动力学模型的详细信息与上述相同。
75、提供所述化合物剂量的相关信息的方法,可以包括:计算待分析剂量的化合物的分配系数;
76、利用所述分配系数和生理药代动力学模型,计算待分析剂量的化合物的内部相应剂量;以及
77、将所述内部相应剂量与个体的化合物血中浓度进行比较。
78、所述分配系数可能因个体的种类、性别、体重等而不同。
79、另外,可以包括:1)在所构建的动物pbpk模型中,通过用表3或表4中的一般人类生理参数替代动物生理参数(数学式1至数学式11的v或q),或通过将表6中的动物参数转换为人类参数的种间外推等方法建立人体pbpk模型;2)利用所述人体pbpk模型计算待分析剂量的化合物的内部剂量;3)将所述内部剂量与个体的化合物血中浓度进行比较;以及4)从人体生物监测数据(内部剂量)计算外部剂量。
80、所述内部剂量或内部相应用量(internal dose)是指物质在暴露评估中通过物理或生物过程渗透有机体的吸收屏障(如皮肤、肺组织、胃肠道)而被吸收的量,而外部剂量(external dose)是指对某些人或动物暴露或摄入的物质的量。
81、另一方面提供一种生理药代动力学核心模型(physiologically basedpharmacokinetic core model,pbpk core model)的构建方法,其包括:构建具有共同母核的两种或多种化合物的独立的生理药代动力学模型(physiologically basedpharmacokinetic model,pbpk model);
82、通过所述独立的模型结构选择核心模型的隔室;以及
83、利用所述隔室构建生理药代动力学核心模型。
84、另一方面提供一种所述生理药代动力学核心模型(physiologically basedpharmacokinetic core model,pbpk core model)提供有关个体的化合物外部剂量信息的方法。另外,所述化合物的母核可以包括选自以下化学式1至化学式3中的至少一种。
85、【化学式1】
86、
87、【化学式2】
88、
89、【化学式3】
90、
91、有关所述全氟化合物、剂量、母核和生理药代动力学模型的详细信息与上述相同。
92、所述独立的生理药代动力学模型可以是指,包含在所述化合物中并共享母核的单个化合物的生理药代动力学模型。所述单个化合物的数量可以为两个或多个,例如三个或四个。
93、根据一实施例,经证实,当构建两个或多个独立的生理药代动力学模型时,可以构建可共同应用于共享母核的化合物的基于生理学的核心模型。
94、在所述方法中,所述构建独立的生理药代动力学模型之前,可以预先分析所述化合物的特性。所述化合物可以为一种预期为有害物质的化合物。
95、所述分析化合物的特性,可以参考已知文献或将化合物静脉注射或口服施用给实验动物的数据。
96、在所述方法中,所述建立独立的生理药代动力学模型可以包括:选择待建模型的化合物;所选择的化合物中选择具有共同母核的两种或多种单个化合物;以及构建所选单个化合物的独立的生理药代动力学模型(physiologically based pharmacokineticmodel,pbpk model)。
97、在所述方法中,所述选择核心模型的隔室可以为:通过比较两个或多个独立的生理药代动力学模型的结构、体内动力学特征和adme特征,选择具有相似体内动力学行为的组织和器官作为核心模型的隔室。
98、所述选择可以通过使用曲线拟合来进行。
99、所述隔室(compartment)可以包括选自富灌注组织(rich perfused tissue)、慢灌注组织(slow perfused tissue)、肾脏(kidney)、储藏隔室(storage compartment)、血池(blood pool)、胃肠道(g.i track)和肝脏(liver)中至少一种。
100、根据一具体实施例,所述隔室可以包括富灌注组织(rich perfused tissue)、慢灌注组织(slow perfused tissue)、肾脏(kidney)、储藏隔室(storage compartment)、血池(blood pool)、胃肠道(g.i track)和肝脏(liver)。
101、所述方法还可以包括:计算待测剂量的化合物的理化参数、生理参数或生化参数;以及建立所选隔室的物质平衡微分方程。
102、所述理化参数可以包括分配系数。
103、所述生理参数可以包括血流量或组织体积。作为所述组织的血流量或组织的体积,可以使用已知文献中的值。
104、所述生化参数可以包括蛋白的结合率和km值。
105、所述计算的值可以为通过使用已知文献中的参数或给动物施用有害物质来计算的值,或者可以为通过使用曲线拟合(curve fitting)来计算的值。
106、所述方法可以包括:对从所述构建的生理药代动力学核心模型计算的有害物质的时间-血中浓度预测值与从动物实验获得的有害物质的时间-血中浓度实测值进行曲线拟合(curve fitting);以及评估所述构建的生理药代动力学核心模型。
107、所述评估可以包括:对模型进行验证(verification)和有效性确认(validation)。
108、所述验证和有效性确认可以为对参数和微分平衡方程进行的评价。具体地,可以评价曲线的形状是否与实验值相符,例如测量值与预测值之差的残差图(residuals plot)是否均匀分散,而不以零值为基准向一个方向倾斜。
109、根据一具体实施例,当导出曲线的形状趋于与实验值相符或均匀分散时,可以评价所计算的模型有效。
110、所述方法还可以包括:导出所述隔室的物质平衡微分方程。所述微分平衡方程可以包括选自所述数学式1至数学式11中的至少一个。
111、所述物质平衡微分方程可以包括血流量、器官体积或分配系数等参数值。可以使用本领域已知的值或通过额外的实验来导出所述参数。
112、所述方法可以包括:对所述导出的pbpk核心模型的参数进行曲线拟合。例如,可以包括:通过对目标化合物的体内动力学特征和pbpk核心模型进行曲线拟合来导出最终参数。对所述导出的最终参数还可以进行轴缩放更改等。
113、在所述方法中,所述使用隔室构建生理药代动力学核心模型可以包括:使用所述隔室的微分平衡方程或最终参数导出pbpk核心模型的结构。所述导出方法可以包括对物质平衡微分方程和参数进行编码的方法。
114、所述导出方法可以包括对物质平衡微分方程和参数进行编码的方法。
115、然后,所述方法还可以包括:用导出的pbpk核心模型评估化合物的危害性。
116、又一方面提供一种由所述方法导出的pbpk核心模型,所述模型可用于化合物的危害性评价。
117、有益效果
118、一方面提供一种可共同应用于共享同一母核的两种或多种化合物的生理药代动力学核心模型,和生理药代动力学核心模型的构建方法。根据所述生理药代动力学核心模型和生理药代动力学核心模型的构建方法,其效果在于,无需为每个化合物建立独立的pbpk模型,只需导出分配系数即可容易构建pbpk模型,并且可以有效地进行待评价的有害物质的剂量测试。
- 还没有人留言评论。精彩留言会获得点赞!