一种幽门螺杆菌口服疫苗及其制备方法
1.本发明属于生物工程技术领域,具体涉及一种幽门螺杆菌口服疫苗及其制备方法。
背景技术:
2.幽门螺杆菌或幽门螺旋菌(英文名helicobacterpylori,简称hp)是一种微需氧的革兰氏阴性细菌,能够在人的胃及十二指肠等区域终身持续存在,它会引起胃黏膜轻微的慢性发炎,严重者甚至导致胃及十二指肠溃疡与胃癌。幽门螺杆菌感染是人中最常见的细菌感染性疾病,全球有一半以上人口感染有幽门螺杆菌。这种感染与许多胃疾病,例如慢性萎缩性胃炎、消化性溃疡、胃癌或胃部癌症和黏膜相关性淋巴样组织(mucosaassociatedlymphoidtissue,malt)淋巴瘤相关。
3.幽门螺杆菌产生的外膜囊泡含有一系列致病物质,可以在宿主体内介导促炎症反应,从而有助于细菌的感染。同时,由于外膜囊泡的组分与亲本细菌相似,并且具有免疫刺激能力,因此,外膜囊泡可被作为疫苗的候选抗原靶标。
4.幽门螺杆菌外膜囊泡中含有脲酶a和b亚基、嗜中性粒细胞活化蛋白、空泡细胞毒素相关蛋白和孔蛋白等。较大的外膜囊泡(90nm-450nm)包含许多幽门螺杆菌粘附素,例如saba、baba、铁调节蛋白、hop家族外膜蛋白以及鞭毛蛋白和钩形蛋白,这些蛋白在较小的外膜囊泡中不存在;小型外膜囊泡(20nm-100nm)中仅包含4种蛋白质主要与新陈代谢相关,而与毒力或粘附无关。较大的外膜囊泡富含蛋白质载体,包括致病性蛋白和毒力决定因子,因此是良好的免疫原。外膜囊泡中的内毒素(lipid a)由于其结构特殊,并不会引起宿主产生免疫反应,从而降低疫苗效率。caga基因和ompf基因对于外膜囊泡的产量和大小有影响。如何制备一种高效的幽门螺杆菌疫苗是开发相关疫苗的核心问题。
技术实现要素:
5.针对现有技术中的不足与难题,本发明旨在提供一种幽门螺杆菌突变菌疫苗及其制备方法,该制备方法可以很好的获得幽门螺杆菌突变菌的外膜囊泡,该疫苗主要由lta2b免疫佐剂和幽门螺杆菌突变菌外膜囊泡组成。幽门螺杆菌突变菌为敲除了ompf基因、caga基因、lpxe基因,lpxf基因和futb基因的外膜囊泡。
6.本发明通过以下技术方案予以实现:
7.本发明一方面一种幽门螺杆菌口服疫苗的制备方法方法包括以下步骤:
8.(1)对幽门螺杆菌突变菌进行培养,所述突变菌不含外膜孔蛋白的ompf基因和caga基因,同时改造lipid a结构,敲除相关合成基因lpxe,lpxf和futb;
9.(2)离心处理后得到沉淀为突变菌外膜囊泡粗提取物;
10.(3)再依次进行盐析反应和离心处理后得到沉淀为突变菌外膜囊泡精纯物;
11.(4)以突变菌外膜囊泡精纯物、lta2b免疫佐剂为主要原料制备成壳聚糖-海藻酸钠包裹免疫原微球。
12.进一步地,步骤(1)采用的培养基为液体布氏肉汤培养基,培养温度为37℃,培养至od600=1.5。
13.进一步地,步骤(2)和(3)离心处理中离心力为12000g,离心时间为30min,离心的温度设置为4℃。
14.进一步地,步骤(3)中盐析反应采用pbs复溶沉淀后加35%m/v的硫酸铵;盐析的温度为25℃,时间为20min。
15.进一步地,步骤(4)中lta2b免疫佐剂:突变菌外膜囊泡精纯物的质量比为1∶1000。
16.进一步地,疫苗制备为胶囊制剂,具体步骤为:将所述壳聚糖-海藻酸钠包裹免疫原微球经过真空干燥形成冻干粉体,将所述冻干粉体与辅料混合后装入胶囊中得到幽门螺杆疫苗胶囊。
17.本发明另一方面提供了上述方法制备的幽门螺杆菌口服疫苗。
18.与现有技术相比,本发明有益效果包括:
19.(1)本发明制备方法可以很好的获得幽门螺杆菌突变菌的外膜囊泡。
20.(2)本发明提供的突变菌株不含ompf基因和caga基因以及lpxe,lpxf和futb基因,突变菌能够高效刺激宿主产生免疫反应并分泌外膜囊泡,使幽门螺杆菌外膜囊泡具有疫苗效力高的特性。
具体实施方式
21.下面结合实施例,对本发明作进一步地说明。
22.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
23.以下结合实施例对本发明的特征和性能作进一步的详细描述。
24.实施例1 caga基因敲除
25.1、幽门螺杆菌的培养及基因提取
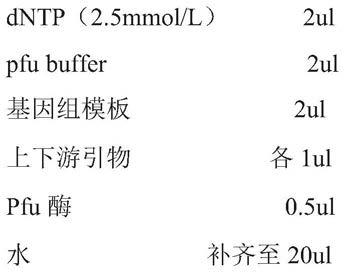
26.将h.pylori 26695冻干的幽门螺杆菌接至布氏肉汤平板中以微需氧环境过夜培养,第二天挑取单菌落接种于布氏肉汤液体培养基中,37℃200r/min培养24-48小时提取细菌的基因组(天根生化的细菌基因组抽提试剂盒,按照说明书的操作步骤进行基因组的抽提)。
27.2、pcr扩展目的基因
28.反应条件:95℃预变性5min,94℃5min,47℃30s,72℃1min,扩增5个循环;然后94℃1min,50℃30s,72℃1min,扩增30个循环;最后72℃延伸10min。
29.反应体系:
[0030][0031]
3、打靶载体的构建
[0032]
以26695的基因组为扩增模板,设计引物1和引物2,加入hind和sal i酶切位点,利用高保真的pfu dna聚合酶扩增出所需caga基因的上游片段大小为364bp,即caga上游同源臂;再经过hind和sal i酶切后,连接到用相同酶切的pet22b载体上,转化到大肠杆菌bl21中,构建得到上游同源臂pet-caga的载体。按照相同的方法构建下游同源臂pet-caga的载体。之后将pet-caga用ecor i和bamh双酶切鉴定后,回收片段。片段包括抗性基因和两侧同源臂为2kb的线性打靶片段,将打靶片段连接到经相同酶切的pblues(+)载体上得到打靶载体质粒pbs-caga。
[0033]
引物1:aagcttgccactactaccaccgacat
[0034]
引物2:gtcgacctatgactaagccactgccg
[0035]
4、电转
[0036]
将2669幽门螺杆菌接种于布氏肉汤培养基中,37℃微氧(5%o210%co285%n2)培养48h,取1ml培养液离心去上清,再用10%的甘油洗涤三次,然后将沉淀用100ul 10%的甘油重悬,4℃冰浴20min,然后取5ul打靶载体质粒pbs-caga与所上述制备的感受态混匀,然后加入到提前冰浴的电机杯中,用1800v,25uf,200ω的电击条件电击一次,然后迅速加入到500ul的布氏肉汤培养基中,37℃微氧(5%o210%co285%n2)培养1h,再涂布到琼脂固体培养基上,37℃微氧(5%o210%co285%n2)培养3天,挑取阳性克隆即为敲除caga基因的幽门螺杆菌突变菌。
[0037]
实施例2
[0038]
按实施例1记载的方法,进一步敲除幽门螺杆菌的ompf、lpxe,lpxf和futb基因。
[0039]
实施例3 敲除caga、ompf、lpxe,lpxf和futb基因的幽门螺杆菌囊泡提取
[0040]
首先,挑单菌落培养突变幽门螺杆菌,隔夜将细菌以1∶500的比例接种于2l液体布氏肉汤培养集中,37℃微需氧(5%o210%co285%n2)环境培养24-48小时至od值为1.5,进行离心,去除菌体,离心条件为4℃,12,000
×
g,30min。去上清,沉淀用100ml的预冷pbs重悬,在加入35g的固体硫酸铵,置于25℃水浴锅中盐析反应20min。盐析反应结束后离心(4℃,12,000
×
g,30min)沉淀即为纯化好的突变幽门螺杆菌囊泡提取物。
[0041]
实施例4 突变幽门螺杆菌疫苗制备
[0042]
在室温下,将实施例3中制备的突变幽门螺杆菌囊泡提取物和lta2b免疫佐剂(1∶1000)与2%的海藻酸钠溶液混匀,加入植物油,植物油与海藻酸钠ags乳液的比例为2∶6。10000r/分钟乳化5分钟后逐滴滴入到cacl2溶液中,800r/分钟搅拌30分钟后,形成o/w乳液,离心取沉淀物洗涤后重悬。将悬液加入到1%浓度的壳聚糖溶液中,800rpm
×
30分钟搅
拌完成再包裹制备出壳聚糖-海藻酸钠包裹免疫原微球,离心洗涤3次后收集。
[0043]
将上诉免疫原微球置于已预冷的真空干燥机内干燥,并缓慢提升温度使水分迅速升华,待气体压力指示计显示无气体生成时取出冻干品,将冻干粉与辅料混合后装入胶囊中得到幽门螺杆疫苗胶囊。
[0044]
实施例5 疫苗接种沙鼠的免疫原性比较
[0045]
沙鼠于末次免疫后10天灌喂制备好的hp菌液。所有实验动物提前24小时断食、断水,每次每只灌喂菌液0.5ml;上、下午各一次,间隔6小时,末次灌喂后2小时供食水。攻毒后第4周所有实验动物均处死并采集标本,处死前24小时断食水,解剖沙鼠,取出鼠胃,沿胃大弯剖开,用生理盐水轻轻冲掉胃内残留物,将胃粘膜组织涂布hp培养基,三线法划线接种,微需氧培养,观察免疫后小鼠hp的定植情况如下表1。
[0046]
表1 免疫后小鼠hp的定植情况
[0047][0048]
结果显示,本实施例制备的突变幽门螺杆菌疫苗的保护率达到90%以上。
[0049]
以上所述仅表达了本发明的优选实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形、改进及替代,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1