一种口腔用药缓释给药系统及其制备方法
1.本发明属于医疗器械技术领域,尤其是指一种口腔用药缓释给药系统及其制备方法。
背景技术:
2.口腔疾病是影响人体健康的常见病、多发病。据调查资料显示,我国儿童乳牙患龋率高达67.0%,中年人群恒牙患龋率达59.9%,老年人群中全口无牙者达6.9%,人群牙龈炎、牙石检出率也较高,口腔健康状况普遍较差。口腔疾病给病人、家庭、社会造成很大的经济负担,给社会经济发展带来不容忽视的影响,是我国现阶段最为突出的健康问题。同时据文献报道,在人的口腔中存在大量的微生物,其中细菌在每毫升分泌物中约有100万到10亿,且种类多达数10种,包括细菌(需氧菌、厌氧菌等)、病毒、螺旋体等常见的微生物,这些微生物在一定的条件下都可以成为感染的病原菌,因此在口腔疾病的治疗中需十分注重抗菌治疗。
3.目前在临床上治疗口腔疾病的药物,如激素类、抗生素类以及维生素类药物等。常规药物治疗主要存在给药困难、给药不及时、药物在患处难于保持有效浓度等问题,导致治疗效果并不理想;如果为了增强整体疗效而增加药物单次剂量或频繁用药,会造成体内药物积累,引起肝肾损伤等问题,危害患者健康。此外在用药过程中由于医用药物材料本身的不便性,限制了患者的正常饮食,大幅度降低了患者的口腔舒适性。为了解决这些问题,本方法提出将缓释模块固定在牙齿上,并利用药物缓释系统,仅通过唾液使药物溶出进行释放,不需要任何额外的刺激响应信号,在使药物高效、长期、稳定地释放的同时无需限制患者的正常饮食并提高患者治疗过程中的舒适性,取得了较好的治疗效果和使用体验。
4.现有常见治疗口腔疾病的给药方法:(1)口服用药,通过循环系统到达口腔所需位置的药物浓度相对较低,且易产生副作用,疗效差;(2)治疗牙周炎的盐酸米诺环素软膏(派丽奥),由于需将药物注射牙周袋中原位凝固,影响患者舒适度;(3)治疗口腔溃疡的醋酸地塞米松双层粘贴片剂,由于贴片粘性问题,影响患者正常饮食(刘国勤,吕玉麟,石建明,陈铁楼,马晓蓬,刘筠,侯惠民,贺芬.醋酸地塞米松粘贴片的研制[j].海军医学杂志,2000(02):138-139.1464-1472.)。
[0005]
综上所述,现有口腔疾病的药物治疗方法要么治疗周期长且整体疗效差,要么治疗方法复杂且口腔舒适性差。这些因素大大地限制了运用给药方法治疗口腔疾病的发展及临床应用。
技术实现要素:
[0006]
为此,本发明所要解决的技术问题在于克服现有技术中口腔疾病治疗时给药方法中所存在的给药困难、给药不及时、药物在患处难于保持有效浓度,从而影响治疗效果,以及影响患者口腔舒适度的问题。
[0007]
为解决上述技术问题,本发明提供了一种治疗口腔疾病的缓释给药方法。
[0008]
一种口腔用药缓释给药系统的制备方法,包括以下步骤:
[0009]
s1:将药物溶解于溶剂中得到药物溶液;
[0010]
s2:将多孔材料浸渍在s1所得药物溶液中,制得载药多孔材料;
[0011]
s3:将s2中所得载药多孔材料与医用口腔材料结合,得到所述口腔用药缓释给药系统。
[0012]
在本发明的一个实施例中,s1中,所述药物包括激素类药物、抗生素类药物或维生素类药物。
[0013]
在本发明的一个实施例中,所述药物选自销酸银、氟化钠、甲硝唑、替硝唑、奥硝唑、四环素、米诺环素、强力霉素、红霉素、交沙霉素、麦白霉素、罗红霉素、阿齐霉素、克拉霉素、乙酰螺旋素、阿莫西林、氟沙星、氧氟沙星、环丙沙星、洛美沙星、左旋氧氟沙星、曲氟沙星、氯己定、洗必泰、锡类散、冰硼散、三氯醋酸、氯化锌、制霉菌素、克霉唑霜、酮康唑、咪康唑和地塞米松中的一种或多种。
[0014]
在本发明的一个实施例中,s1中,所述溶剂选自水、醇类、酰胺类、酯类、植物油类和亚砜类中的一种或多种。
[0015]
在本发明的一个实施例中,所述溶剂选自水、乙醇、丙二醇、甘油、丁醇、苯甲醇、二甲基甲酰胺、二甲基乙酰胺、三醋酸甘油酯、醋酸乙酯、油酸乙酯、苯甲酸苄酯、肉豆蔻酸异丙酯、花生油、玉米油、芝麻油和二甲基亚砜中的一种或多种。
[0016]
在本发明的一个实施例中,s1中,所述药物浓度为0.001mg/ml-100mg/ml。
[0017]
在本发明的一个实施例中,s2中,所述多孔材料选自微孔材料、介孔材料或大孔材料;其中,微孔材料的孔径《2nm,介孔材料的孔径2-50nm,大孔材料的孔径为》50nm。
[0018]
在本发明的一个实施例中,s3中,所述多孔材料的比表面为2~3000m2/g。
[0019]
在本发明的一个实施例中,s3中,所述医用口腔材料选自陶瓷、玻璃离子、丁香油氧化锌粘固粉、磷酸锌粘固粉、银汞合金和复合树脂中的一种或多种。
[0020]
在本发明的一个实施例中,s3中,所述结合的方法包括机械搅拌、加热熔融、溶剂溶解。
[0021]
本发明还提供了所述的制备方法所得口腔用药缓释给药系统。
[0022]
本发明的上述技术方案相比现有技术具有以下优点:
[0023]
本发明中由于使用浸渍法使药物负载在多孔材料上,再将载药多孔材料和医用口腔材料结合制成缓释给药模块;由于加入了医用口腔材料,药物分子从多孔材料的孔中溶出后,需进一步通过医用口腔材料溶出,达到二次控释的目的。使所得的给药模块缓释速率更加稳定,药物的缓释时间大幅度提升,整体疗效远高于常规方法。另外,本方法由于仅需将缓释模块固定在牙齿上,通过唾液使药物溶出进行释放,不需要任何额外的刺激响应信号,大大降低了制备的复杂性及成本,同时无需限制患者的正常饮食并提高患者治疗过程中的舒适性,取得了较好的治疗效果和使用体验。
附图说明
[0024]
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中
[0025]
图1为本发明实施例1所得缓释模块c1样品图。
[0026]
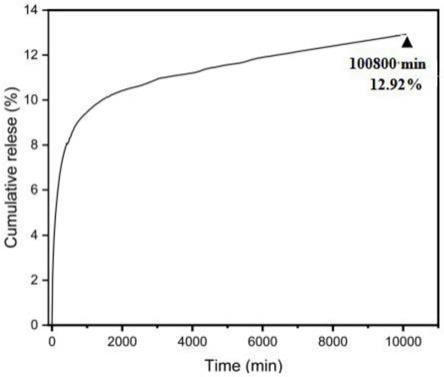
图2为本发明实施例1所得缓释模块c1体外7天缓释曲线图。缓释模块c1室温条件下在ph 7.2的磷酸盐缓冲液中进行体外缓释测试,第7天时溶出的药物仅为药物负载量的12.92%。
[0027]
图3为本发明实施例1所得缓释模块c1体外7天抑菌实验图。将缓释模块c1与粘性放线菌培养基充分接触放于37℃恒温培养箱培养,第7天的时候缓释模块c1对粘性放线菌任有明显的抗菌活性。
[0028]
图4为本发明对比例1、2所得对比模块x1、x2体外3小时缓释曲线图。缓释模块c1室温条件下在ph 7.2的磷酸盐缓冲液中进行体外缓释测试,第3小时时溶出的药物就达到药物负载量的12.75%、45.24%。
具体实施方式
[0029]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0030]
实施例1
[0031]
将0.2g盐酸米诺环素在25℃下,溶解于20ml去离子水得到药物浓度为10mg/ml的溶液a1;将2g sba-15浸渍溶液a1中,得多孔药物载体b1;在常温常压下将0.2g多孔药物载体b1与1.6g医用口腔材料登泰克流体光固化树脂结合,得到缓释给药模块c1。
[0032]
实施例2
[0033]
将0.2g盐酸米诺环素在25℃下,溶解于20ml乙醇得到药物浓度为10mg/ml的溶液a1;将2g sba-15浸渍溶液a1中,得多孔药物载体b1;在常温常压下将0.2g多孔药物载体b1与1.6g医用口腔材料登泰克流体光固化树脂结合,得到缓释给药模块。
[0034]
实施例3
[0035]
将0.2g盐酸米诺环素在25℃下,溶解于20ml甲醇得到药物浓度为10mg/ml的溶液a1;将2g sba-15浸渍溶液a1中,得多孔药物载体b1;在常温常压下将0.2g多孔药物载体b1与1.6g医用口腔材料登泰克流体光固化树脂结合,得到缓释给药模块。
[0036]
实施例4-10
[0037]
按照实施例1的方法,只是改变溶解温度(0℃、15℃、30℃、45℃、60℃、75℃、90℃),得到不同的缓释模块。
[0038]
实施例11-15
[0039]
按照实施例1的方法,只是改变溶液a1药物浓度(0.001mg/ml、1mg/ml、5mg/ml、15mg/ml、饱和溶液浓度),得到不同的缓释模块。
[0040]
实施例16-21
[0041]
按照实施例1的方法,只是改变多孔材料(mcm-41、tdu-1、fsm、fdu-15、zsm-5、活性炭),得到不同的缓释模块。
[0042]
实施例22-27
[0043]
按照实施例1的方法,只是改变多孔材料比表面积(500m2/g、600m2/g、700m2/g、800m2/g、900m2/g、1000m2/g),得到不同的缓释模块。
[0044]
实施例28-32
[0045]
按照实施例1的方法,只是改变医用口腔材料(陶瓷、玻璃离子、丁香油氧化锌粘固
粉、磷酸锌粘固粉、银汞合金),得到不同的缓释模块。
[0046]
实施例33-52
[0047]
按照实施例1的方法,只是改变药物(甲硝唑、替硝唑、奥硝唑、四环素、米诺环素、强力霉素、红霉素、交沙霉素、麦白霉素、罗红霉素、阿齐霉素、克拉霉素、乙酰螺旋素、阿莫西林、氟沙星、氧氟沙星、环丙沙星、洛美沙星、左旋氧氟沙星、曲氟沙星),得到不同的缓释模块。
[0048]
对比例1
[0049]
将0.2g盐酸米诺环素在25℃下,与1.6g医用口腔材料登泰克流体光固化树脂通过机械搅拌混合,制得对比模块x1。
[0050]
对比例2
[0051]
将0.2g盐酸米诺环素在25℃下,溶解于20ml去离子水得到药物浓度为10mg/ml的溶液a1;将2g sba-15浸渍溶液a1中,得多孔药物载体b1,将b1进行压片处理,制得对比模块x2。
[0052]
测试例
[0053]
将实施例1、对比例1、对比例2所得缓释模块进行体外缓释实验,具体实验操作为:将缓释模块室温条件下在ph 7.2的磷酸盐缓冲液中进行体外缓释测试。实验结果见图2和图4,由图2可知,缓释模块c1室温条件下在ph 7.2的磷酸盐缓冲液中进行体外缓释测试,第7天时溶出的药物仅为药物负载量的12.92%。图4可知,对比例1和对比例2在第3小时时溶出的药物就达到药物负载量的12.75%、45.24%。
[0054]
实验结论:单独将药物负载在载体上,或者掺入医用口腔材料中,无法使药物高效、长期、稳定的释放。通过将载体和医用口腔材料结合,达到对药物溶出二次控释的目的,从而给药模块缓释速率更加稳定,药物的缓释时间大幅度提升。
[0055]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1