一种可有效缓解皮肤晒伤的海藻提取物及其制备方法和应用
1.本发明涉及生物医药技术领域,具体涉及一种可有效缓解皮肤晒伤的海藻提取物及其制备方法和应用。
背景技术:
2.随着臭氧层遭到破坏,皮肤长期过量接触紫外线,导致光线性皮肤病、基底细胞癌、鳞状细胞癌等发病率逐年增加。皮肤在日光中受紫外线过度照射后,也常会出现局部急性光毒性皮炎,还易激发多形性日光疹、单纯疱疹、日光性荨麻疹、多形红斑、迟发性皮肤卟啉病、红斑狼疮、白癜风、毛细血管扩张和日射病等。因此,寻找多种措施以有效降低紫外线照射引起皮肤损伤及癌变发生已显得非常重要。
3.外涂防晒化妆品可有效预防皮肤光损伤、减少皮肤癌发生。而防晒化妆品中的防晒剂多含有苯环与不饱和侧链,紫外线照射后也时有变应性接触性皮炎等不良反应发生,一定程度上限制了其广泛使用。而临床上可使用的药物也多是用于预防治疗皮肤光老化,如维a酸类药物、异维a酸、他扎罗汀、视黄醇、抗氧化药(维生素c、维生素e、β-胡萝卜素、辅酶q10、超氧化物歧化酶sod等)、脱色剂(氢醌、熊果苷等)、角质剥落剂(α-羟基酸、β-羟基酸等)、细胞因子(表皮生长因子egf、成纤维细胞生长因子fgf、血小板衍生化生长因子pdgf等)、天然生物提取成分(表没食子儿茶素没食子酸酯egcg、花色苷等)、微量元素(硒)、性激素等,针对皮肤晒伤防护的制剂和药物相对较少。
4.海洋生境独特,蕴藏着丰富的生物资源,是寻找珍贵药物的资源宝库。羊栖菜是褐藻类植物,在我国沿海有广泛分布,它不但具有丰富的营养价值,而且具有显著的医学作用。早在我国古代《神农本草经》等医学著作中就有关于羊栖菜医学功用的记载,羊栖菜也是《中国药典》历次版本均有记载的少数几种海洋中药材之一,具有确切的疗效。药典中确定其功能与主治是“软坚散结、消痰、利水、用于瘿瘤、瘰疬、睾丸肿瘤、痰饮水肿”。检测分析发现,羊栖菜含有丰富的多糖成分、膳食纤维、多种维生素、17种氨基酸、矿物质和微量元素,其具有防癌、抗癌、提高机体免疫力、降压、预防动脉硬化与血栓形成、降糖等多种功效。
技术实现要素:
5.本发明的目的之一在于提供一种海藻提取物,该海藻提取物能有效预防皮肤晒伤,还能促进晒伤修复。该海藻提取物皮肤相容性好,能显著提高紫外线照射后表皮细胞的活力,减少细胞凋亡和坏死发生,并降低真皮炎性浸润与弹性纤维降解,减轻皮肤晒伤。
6.本发明的另一个目的在于提供一种通过沸水浸提、离心、超滤分离制备海藻提取物的方法。该方法简单、成本低廉、绿色环保、生产周期短,适用于工业生产。
7.本发明还有一个目的在于提供一种海藻提取物的应用。该海藻提取物可应用于药品中,药品剂型可包括洗剂、软膏剂、酊剂、擦剂、醑剂、粉剂、油剂、糊剂、硬膏剂、涂膜剂、气雾剂等;该海藻提取物还可应用于化妆品中,化妆品剂型可包括膏霜、乳液、凝胶、啫喱、水剂、喷雾等;该海藻提取物还可应用于生物医用材料中,生物医用材料剂型可包括洗剂、溶
液、敷料、软膏等,敷料类型可包括薄膜、水胶体、水凝胶、海绵、喷雾等。
8.本发明通过以下技术方案实现上述目的:
9.一方面,本发明提供了一种海藻提取物,该海藻提取物水溶性和皮肤相容性好。
10.上述海藻提取物是海藻经过沸水浸提、离心、超滤、浓缩、冻干而成。
11.所述的海藻可以包括但不限于裙带菜、海带、羊栖菜、马尾藻、海蒿子、鹿角菜中的一种或几种的组合。优选地,海藻来源于羊栖菜。
12.所述的海藻可以是晒干或烘干的海藻,也可以是新鲜的海藻。
13.作为一种可选的实施方案,所述海藻提取物的制备方法包括以下步骤:称取一定量的海藻,加入20~50倍质量体积比g/ml的水,沸水浸提0.5h~4h,浸提液冷却后经3000g~10000g离心10min~15min,离心上清液依次经过抽滤、3k-5kda超滤膜超滤,收集超滤截留液,浓缩、冻干,即得。
14.优选的,可将离心上清液先经过抽滤,滤过液再经截留分子量5kda超滤膜过滤,收集截留液(》5kda),进行浓缩、冻干。
15.优选的,可将离心上清液依次经过孔径0.45μm、截留分子量3kda超滤膜过滤,收集截留液(3kda~0.45μm),进行浓缩、冻干。
16.优选的,称取羊栖菜,加入25倍质量体积比g/ml的水,沸水浸提1h,浸提液冷却后经10000g离心10min,离心上清液依次经过抽滤、5kda超滤膜超滤,收集超滤截留液,浓缩、冻干,即得。
17.另一方面,本发明提供了一种具有显著皮肤晒伤防护作用的海藻提取物的应用。
18.由于紫外线照射的皮肤与未经紫外线照射皮肤在生理状态和结构上存在明显差异,目前无报道用于普通皮肤护理的物质也可直接用于紫外线照射皮肤的护理。基于对紫外线照射引起皮肤损伤作用机理、皮肤晒伤修复过程与机制等的了解,本发明人优选沸水浸提获得的海藻提取物用于紫外线照射皮肤的护理上。
19.作为一种可选的实施方案,海藻提取物可用于预防皮肤晒伤。给药终浓度优选为50μg/ml~1600μg/ml。进一步优选为100μg/ml~800μg/ml。
20.作为一种可选的实施方案,海藻提取物还可用于治疗皮肤晒伤。
21.在本发明的一种优选的实施方案中,海藻提取物可用于药品中;优选地,该海藻提取物尤其适用于可有效修复皮肤晒伤的药品中,所述的药品剂型包括洗剂、软膏剂、酊剂、擦剂、醑剂、粉剂、油剂、糊剂、硬膏剂、涂膜剂、气雾剂等。
22.当用于药品中时,海藻提取物在药品中的质量分数为0.01%~0.5%。
23.在本发明的一种优选的实施方案中,海藻提取物可用于化妆品中;优选地,该海藻提取物尤其适用于可有效预防皮肤晒伤的化妆品中,所述的化妆品剂型包括膏霜、乳液、凝胶、啫喱、水剂、喷雾等。
24.当用于化妆品中时,海藻提取物在化妆品中的质量分数为0.005%~0.5%。作为一种优选的实施方式,该海藻提取物在化妆品中的质量分数为0.02%~0.5%。
25.当用于化妆品中时,海藻提取物可与化妆品基质复配,还可与防晒剂复配,所述的防晒剂是指uva防护剂和/或uvb防护剂。
26.所述的uva防护剂优选为2,2
′‑
双-(1,4-亚苯基)1h-苯并咪唑-4,6-二磺酸的二钠盐、亚甲基双-苯并三唑基四甲基丁基酚、对苯二亚甲基二樟脑磺酸、双-乙基己氧苯酚甲氧
苯基三嗪中的一种或几种的组合,其用量为,按化妆品总质量的百分比计,2,2
′‑
双-(1,4-亚苯基)1h-苯并咪唑-4,6-二磺酸的二钠盐0.1%~4.5%、亚甲基双-苯并三唑基四甲基丁基酚0.1%~3.5%、对苯二亚甲基二樟脑磺酸0.1%~4.5%、双-乙基己氧苯酚甲氧苯基三嗪0.2%~4.5%。
27.所述的uvb防护剂优选为苯基苯并咪唑磺酸及其钾、钠和三乙醇胺盐、甲氧基肉桂酸乙基己酯、甲酚曲唑三硅氧烷、tio2中的一种或几种的组合,其用量为,按占化妆品总质量的百分比计,苯基苯并咪唑磺酸及其钾、钠和三乙醇胺盐0.1%~3%、甲氧基肉桂酸乙基己酯0.02%~8%、甲酚曲唑三硅氧烷0.2%~8%、tio
2 0.5%~6%。
28.上述uva防护剂、uvb防护剂和化妆品基质均可市购。
29.在本发明的一种优选的实施方案中,海藻提取物还可用于生物医用材料中;优选地,该海藻提取物尤其适用于可有效修复皮肤晒伤的生物医用材料中,所述的生物医用材料剂型包括洗剂、溶液、敷料、软膏等,所述的敷料类型包括薄膜、水胶体、水凝胶、海绵、喷雾等。
30.当用于生物医用材料中时,海藻提取物在生物医用材料中的质量分数为0.005%~0.5%。作为一种优选的实施方式,该海藻提取物在生物医用材料中的质量分数为0.02%~0.5%。
31.值得一提的是,本发明提供的海藻提取物作为功能性成分,其不会引起皮肤过敏和光敏性反应,还可明显降低紫外线照射表皮细胞中活性氧水平,稳定胞内钙离子浓度及线粒体膜电位,改善细胞周期阻滞,减少表皮细胞凋亡和坏死。该海藻提取物还可显著提高紫外线照射皮肤中cat等抗氧化酶的活性,使皮肤组织中8-ohdg等dna氧化损伤产物大幅减少,表皮增厚、真皮炎性浸润与胶原降解等症状明显缓解,具有显著的减轻皮肤晒伤作用。
32.因此,当本发明海藻提取物应用于化妆品或生物医用材料中时,对于化妆品基质成分、生物医用材料原料的种类、用量、制备工艺等的选择较为宽泛。化妆品和生物医用材料中所使用的所有成分应是皮肤可接受且不影响本发明原有海藻提取物的性能,即当与人的皮肤接触时或者与其他组分配伍时,不会导致不适当的毒性、不相容性、不稳定性和变应性反应等。
33.本发明的解决方案是基于发明人对皮肤晒伤与修复机制、海藻提取物量效关系、皮肤光敏性等的了解,结合现代化妆品、生物医用材料和药理学的研究成果,通过大量创造性实验,寻找、挖掘、制备并优选出与皮肤相容性好、无致敏性和光敏性,且具有显著预防和治疗皮肤晒伤功效的海藻提取物。
34.本发明具有以下有益效果:
35.(1)率先挖掘海藻提取物对皮肤晒伤的预防和治疗作用。从裙带菜、海带、羊栖菜、马尾藻、海蒿子、鹿角菜等众多海藻中,优选出羊栖菜,并利用沸水浸提、离心、抽滤、超滤分离技术,制备获得海藻提取物。该海藻提取物可迅速浸润皮肤表层,发挥防晒、减轻炎症、晒伤修复等多重功效。该海藻提取物在较低剂量(50μg/ml)时,即能显著提高皮肤天然屏障功能与抵御紫外线能力,有效减轻皮肤晒伤。
36.本发明利用常温水提、沸水浸提、稀碱浸提、稀酸浸提、超声波处理、纤维素酶酶解、果胶酶酶解、蜗牛酶酶解8种方法制备的海藻提取物,虽然沸水浸提制备获得的海藻提取物在体外抗氧化活性并非最佳,但是在提高紫外线照射细胞活性、缓解紫外线照射引起
小鼠皮肤晒伤功效方面表现最为优异,显著好于其他7种制备方法。
37.(2)本发明的海藻提取物的制备工艺简单、成本低廉、绿色环保、生产周期短,适用于大批量工业生产,具有极大的应用前景。将海藻沸水浸提液经过截留分子量5kda或3kda超滤膜处理,可将无显著提高紫外线照射细胞活性的成分(多含盐类、游离氨基酸、脂肪酸等)去除,使获得的海藻提取物生理功效更好,排放的污染物也极少。
38.本发明在实施例中进行了对比试验,与实施例3获得的海藻提取物ys相比,经过乙醇沉淀处理制备获得的海藻提取物两个组分(沉淀、上清液),缓解紫外线照射引起细胞损伤的作用并未得到显著改善,反而其功效有所降低,说明作为沉淀+上清液的海藻提取物ys整体组合物而言,能发挥更佳的效果。
39.本发明还对3k-5kda超滤膜超滤前和超滤后的滤过液与超滤膜的截留液相比较,发现获得的海藻提取物(截留液组分)缓解紫外线照射引起细胞损伤的作用最佳,其防晒作用显著优于未经超滤处理制备的海藻提取物,以及超滤滤过液组分海藻提取物。
40.由此说明,本发明的海藻提取物获得了出人预料的效果。
41.(3)本发明的海藻提取物水溶性与皮肤相容性好、不引起皮肤刺激、不致敏、无光敏性且功效显著,可在化妆品和生物医用材料中广泛应用。采用超滤分离技术,可使海藻提取物高度富集,在提高生理功效的同时,大幅减少其用量,进而有效降低在化妆品和生物医用材料配制过程中对该海藻提取物的稳定性、配伍性等的要求和操作难度。
附图说明
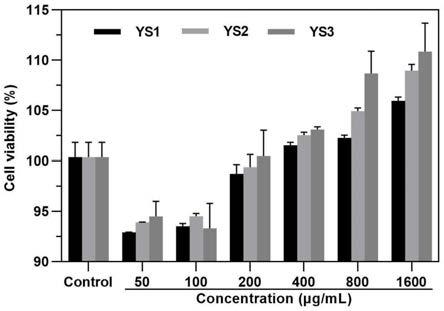
42.图1是实施例4中海藻提取物对hacat细胞活性的影响(ys1:实施例1制备的海藻提取物;ys2:实施例2制备的海藻提取物;ys3:实施例3制备的海藻提取物)
43.图2是实施例5中海藻提取物对uvb照射hacat细胞活性的影响(ys1:实施例1制备的海藻提取物;ys2:实施例2制备的海藻提取物;ys3:实施例3制备的海藻提取物);(与uvb模型组相比,
*
p《0.05,
**
p《0.01)。
44.图3是实施例6中海藻提取物对uvb照射hacat细胞存活状态的影响(control:空白对照;uvb:uvb模型;uvb+ys-l:uvb造模后给药200μg/ml海藻提取物;uvb+ys-h:uvb造模后给药800μg/ml海藻提取物);(calcein-am:荧光显示活细胞;pi:荧光显示死细胞;merged:荧光显示细胞活/死状态)。
45.图4是实施例7中小鼠皮肤he染色图片(100
×
)(control:空白对照;uvb:uvb模型;uvb+ys1:uvb造模后给药实施例1制备的海藻提取物;uvb+ys2:uvb造模后给药实施例2制备的海藻提取物;uvb+ys3:uvb造模后给药实施例3制备的海藻提取物)。
46.图5是实施例9中小鼠皮肤he染色图片(100
×
)(control:空白对照;uvb:uvb模型;uvb+placebo:uvb造模后涂抹凝胶基质;uvb+sfp:uvb造模后涂抹海藻提取物凝胶)。
47.图6是实施例9中皮肤组织中8-ohdg含量测定(control:空白对照;model:uvb模型;placebo:uvb造模后涂抹凝胶基质;sfp:uvb造模后涂抹海藻提取物凝胶);(
*
p《0.05,
**
p《0.01;与control相比,
#
p《0.05)。
48.图7是实施例9中皮肤组织中sod酶活性测定(control:空白对照;model:uvb模型;placebo:uvb造模后涂抹凝胶基质;sfp:uvb造模后涂抹海藻提取物凝胶);(
*
p《0.05,
**
p《0.01;与control相比,
##
p《0.01)。
49.图8是实施例9中与uvb模型组相比转录组测序sfp给药组显著差异表达mrna的kegg通路富集分析(day 7)。
50.图9是对比例1中制备的海藻提取物抗氧化活性评价(dpph radical scavenging effect:dpph自由基清除活性;superoxide anion scavenging effect:超氧阴离子自由基清除活性;abts radical scavenging effect:abts自由基清除活性;ferric reducing antioxidant power:铁离子还原抗氧化能力;hydroxyl radical scavenging effect:羟基自由基清除活性;linoleic acid peroxidation inhibitory effect:亚油酸过氧化抑制活性);(rm water:常温水提;boiling water:沸水浸提;naoh:稀碱浸提;hcl:稀酸浸提;ultrasonic wave:超声波处理;cellulase:纤维素酶酶解;pectinase:果胶酶酶解;snailase:蜗牛酶酶解);(与boiling water组相比,
*
p《0.05,
**
p《0.01)。
51.图10是对比例1中制备的海藻提取物对uvb照射hacat细胞活性的影响(control:空白对照;model:uvb模型;rm water:常温水提;boiling water:沸水浸提;naoh:稀碱浸提;hcl:稀酸浸提;ultrasonic wave:超声波处理;cellulase:纤维素酶酶解;pectinase:果胶酶酶解;snailase:蜗牛酶酶解);(
**
p《0.01)。
52.图11是对比例2中制备的海藻提取物对hacat细胞活性的影响(
**
p《0.01)。
53.图12是对比例2中制备的海藻提取物对uvb照射hacat细胞活性的影响(
*
p《0.05,
**
p《0.01;与uvb模型组相比,
##
p《0.01)。
54.图13是对比例3中制备的海藻提取物对uvb照射hacat细胞活性的影响(
*
p《0.05,
**
p《0.01;与uvb模型组相比,
#
p《0.05,
##
p《0.01)。
具体实施方式
55.以下结合附图对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的方法所作的等同的变化或变通都应视为本发明保护的范畴。以下所用原料,除特殊指明外,均为市售。
56.在本发明的一种实施方案中,将海藻提取物与生理盐水混合制成溶液(水剂),对皮肤湿敷。结果显示,与不含海藻提取物的对照品(uvb模型组,敷贴仅有生理盐水的纱布)相比,敷贴浸有海藻提取物的纱布后,紫外线照射后第2天,皮肤损伤程度明显减轻,仅表现为表皮肥厚、角化过度、真皮层炎细胞浸润(uvb模型组可见表皮及真皮组织浅层或中层坏死,大量胶原纤维断裂、排列紊乱,毛囊及皮脂腺上皮坏死,全层炎细胞浸润);紫外线照射后第5天,炎细胞数量已恢复正常(uvb模型组仍见表皮增厚、角化过度、结痂,棘细胞增生,真皮及皮下组织炎细胞浸润);紫外线照射后第7天,小鼠皮肤与空白对照组无明显差异(uvb模型组仍可见表皮增厚,真皮层炎细胞数量减少、新生毛囊数量增加明显)。
57.在本发明的优选实施方案中,以海藻提取物为功能成分,可以配以常规化妆品基质,制成化妆品作为实验样品;对照样品为不含有海藻提取物的化妆品基质。结果显示,与对照样品相比,含有海藻提取物的实验样品所处理的小鼠皮肤表皮厚度降低35.89%(约11.7μm)、成纤维细胞数量增加65.00%(约19.5个/视野)。
58.在本发明的优选实施方案中,以海藻提取物为功能成分,还可以配以常规生物医用材料基质,制成生物医用材料为实验样品;对照样品为不含有海藻提取物的生物医用材料基质。结果显示,与对照样品相比,含有海藻提取物的实验样品所处理的小鼠皮肤在紫外
线照射后第5天损伤程度明显变轻(与空白对照组无明显差异),表皮无炎性渗出、脱屑、结痂等现象。
59.为了进一步阐明本发明的方案,以及便于使用,以下实施例以制备溶液(水剂)、乳液、凝胶为例,辅以化妆品或生物医用材料基质与海藻提取物进行复配。但本领域技术人员应当认可的是这些例子所含的组分并不能作为本发明方案的限制,而仅仅是一种可实施的可替代的方式。
60.本发明所采用的海藻提取物通过常规工艺与任意多种化妆品或生物医用材料基质组分均质或混合,即可制成具有显著皮肤晒伤防护作用的化妆品或生物医用材料。例如,将实施例8中除了海藻提取物之外的其他物质进行常规替换,制成其他类型或相同类型的化妆品;将实施例9中除了海藻提取物之外的其他物质进行常规替换,制成其他类型或相同类型的生物医用材料,也将具有类似的有益效果。
61.实施例1
62.取符合我国相关海产品使用标准的可食用的羊栖菜晒干藻体,蒸馏水清洗3~4次,烘干、粉碎,获得干粉。称取干粉200g,加入10l蒸馏水,100℃沸水煮0.5h。浸提液冷却后,3000g离心15min。将离心上清液抽滤(滤过定性滤纸),滤过液再经截留分子量5kda的超滤膜过滤,收集超滤截留液,浓缩、冻干,获得海藻提取物。
63.研究发现,本实施例制备的海藻提取物生物相容性好,无致敏性,不引起皮肤光敏反应,可显著改善紫外线照射引起的细胞凋亡和坏死现象,并降低紫外线照射后真皮炎性渗出与胶原、弹性纤维降解,减轻皮肤经大剂量紫外线照射后引起的红斑、炎症、渗液、脱屑、结痂等不良反应,有效缓解皮肤晒伤。
64.实施例2
65.称取符合我国相关海产品使用标准的可食用的新鲜羊栖菜200g,去离子水清洗3~4次,搅碎,加入4l去离子水,100℃沸水浴4h。冷却后,8000g离心12min。离心上清液再依次经过孔径0.45μm、截留分子量3kda的超滤膜过滤。收集3kda~0.45μm的截留液,浓缩、冻干,获得海藻提取物。
66.研究发现,本实施例制备的海藻提取物生物相容性好,无致敏性,不引起皮肤光敏反应,可显著改善紫外线照射引起的细胞凋亡和坏死现象,降低紫外线照射后真皮炎性渗出与胶原、弹性纤维降解,减轻皮肤经大剂量紫外线照射后引起的红斑、炎症、渗液、脱屑、结痂等不良反应,有效缓解皮肤晒伤。
67.实施例3
68.称取符合我国相关海产品使用标准的可食用的羊栖菜晒干藻体200g,蒸馏水浸泡30min,清洗3~4次,蒸馏水再次浸泡30min。将羊栖菜藻体搅碎,加入5l蒸馏水,100℃沸水煮1h。浸提液冷却后,10000g离心10min。将离心上清液抽滤(滤过定性滤纸),滤过液再经截留分子量5kda的超滤膜过滤。收集超滤截留液,浓缩、冻干,获得海藻提取物。
69.研究发现,本实施例制备的海藻提取物生物相容性好,无致敏性,不引起皮肤光敏反应,可显著改善紫外线照射引起的细胞凋亡和坏死现象,降低紫外线照射后真皮炎性渗出与胶原、弹性纤维降解,减轻皮肤经大剂量紫外线照射后引起的红斑、炎症、渗液、脱屑、结痂等不良反应,有效缓解皮肤晒伤。
70.实施例4
71.研究本发明制备获得的海藻提取物对细胞活性的影响。
72.采用cck-8法测定细胞活性:将密度为6
×
104个/ml的hacat细胞悬液接种于96孔培养板中(100μl/孔),置37℃、5%co2培养箱中培养24h。每孔吸弃50μl,样品组加入相应浓度海藻提取物(实施例1-3制得)样品溶液(终浓度分别为50、100、200、400、800、1600μg/ml,需经孔径0.45μm针头式过滤器除菌),50μl/孔。空白对照组则分别加入dmem完全培养液,50μl/孔。各组置于co2培养箱中继续培养24h后,采用荧光倒置相差显微镜ckx41(日本奥林巴斯公司),观察细胞形态。随后,每孔加入10μl cck-8溶液,继续培养4h,采用酶标仪multiskan go(thermo fisher scientific公司),测定每孔吸光度,测定波长450nm,参考波长650nm,每组6个平行孔。
73.研究发现,随着本发明制备获得的海藻提取物给药剂量的增加,海藻提取物处理组hacat细胞活性也随之提升(图1)。说明本发明制备的海藻提取物生物相容性好,无明显细胞毒性。
74.实施例5
75.研究本发明制备获得的海藻提取物对uvb照射细胞活性的影响。
76.uvb照射hacat细胞损伤造模:使用皮肤光老化试验仪hope-med 8140a(天津开发区合普工贸有限公司),uvb-313el灯管(波长290~315nm),照射剂量20mj/cm2。
77.采用cck-8法测定细胞活性:将密度为6
×
104个/ml的hacat细胞悬液接种于96孔培养板中(100μl/孔),置37℃、5%co2培养箱中培养24h。每孔吸弃50μl,非细胞损伤模型组(阴性对照组)用锡纸包住培养板,与细胞损伤模型各组(uvb+样品组、uvb模型组)一起按照20mj/cm2剂量进行uvb照射。uvb照射结束后,uvb+样品组加入相应浓度海藻提取物(实施例1、2、3制得)样品溶液(终浓度分别为50、100、200、400、800、1600μg/ml,需经孔径0.45μm针头式过滤器除菌),50μl/孔。阴性对照组和uvb模型组则分别加入dmem完全培养液,50μl/孔。各组置于co2培养箱中继续培养24h后,采用荧光倒置相差显微镜ckx41(日本奥林巴斯公司),观察细胞形态。随后,每孔加入10μl cck-8溶液,继续培养4h,采用酶标仪multiskan go(thermo fisher scientific公司),测定每孔吸光度,测定波长450nm,参考波长650nm,每组6个平行孔。
78.研究发现,随着本发明制备获得的海藻提取物给药剂量的增加,海藻提取物处理组uvb照射后hacat细胞活性也显著提升,且与uvb模型组相比具有显著差异(图2)。说明本发明制备获得的海藻提取物可显著缓解紫外线照射对细胞活性的不良影响。
79.实施例6
80.研究本发明制备获得的海藻提取物对uvb照射hacat细胞状态的影响。
81.按照实施例5的实验方法,进行uvb照射hacat细胞损伤造模。将密度为0.9
×
105个/ml的细胞悬液接种于6孔培养板中,2ml/孔,置37℃、5%co2培养箱中培养24h。吸弃培养基,加入新鲜dmem完全培养液,1.5ml/孔。非uvb损伤模型组用锡纸包住,与uvb损伤模型各组(uvb+样品组、uvb模型组)一起置入皮肤光老化试验仪,紫外照射前用紫外辐照计测定皮肤光老化试验仪的紫外强度,根据公式换算出20mj/cm2紫外剂量对应的照射时间。照射结束后,每孔补加500μl新鲜dmem完全培养液(uvb模型组)或含海藻提取物(实施例3制得,uvb+样品组)样品培养液(需经孔径0.22μm针头式过滤器除菌),置co2培养箱中继续培养24h。吸弃培养液,pbs洗涤1次,2ml/孔。吸弃pbs,每孔加入1ml calcein am检测工作液,于培养
箱中避光孵育30min,吸弃上清液,每孔1ml pi染色液,避光孵育5min,吸弃上清液荧光显微镜下观察,拍照,用image j计算荧光强度。
82.研究发现,海藻提取物处理组uvb照射后hacat细胞存活状态发生明显改善,且与uvb模型组相比具有极显著差异(图3)。说明本发明制备获得的海藻提取物可显著改善紫外线照射后hacat细胞的存活状态。
83.实施例7
84.利用uvb照射balb/c小鼠皮肤损伤实验模型,对实施例1-3制备获得的海藻提取物进行功效评价。
85.本试验涉及的与动物试验相关的内容和程序遵从实验动物使用和管理的相关法律法规及本机构实验动物伦理委员会的相关规定,保证实验动物的福利。
86.从广东省医学实验动物中心购入spf级balb/c小鼠65只,雄性,16~18g。检疫3天,每天观察1次,发现不健康的动物立即剔除。分组:空白对照组(5只)、uvb模型组(15只)、uvb+样品组(共45只,15只/样品)。动物饲养条件:3只/箱,群养。饲养温度与湿度:20℃~26℃,40%~70%,采用12h:12h昼夜间断照明;饲养室条件始终保持稳定,小鼠自由进食饮水。
87.脱毛:day 1,动物检疫合格、分组后,用剃毛器剃去动物背部被毛,面积约为2
×
2cm2。试验过程中,若发现动物毛发生长至影响给予样品和观察的操作,亦需进行剃毛操作。脱毛过程应轻柔,避免损伤皮肤。
88.给予样品:动物脱毛后第2天开始给药。uvb+样品组,取0.8ml(1只小鼠的用量)海藻提取物样品(浓度1.6mg/ml,溶剂为生理盐水)润湿面积约为2
×
2cm2的三层纱布,将该纱布敷贴在小鼠脱毛皮肤上后用玻璃纸覆盖,再用胶带固定,敷贴持续3小时。结束后撤去胶布、玻璃纸和纱布,并用清水洗净残留样品。空白对照组、uvb模型组动物根据同样操作方法给予生理盐水。每天给药1次,连续6天(day 2-day 7)。
89.照射uvb:day 8,动物给药30min后,uvb模型组、uvb+样品组动物均腹腔注射戊巴比妥钠麻醉(剂量为60mg/kg体重),麻醉后固定于皮肤光老化试验仪hope-med8140a(天津开发区合普工贸有限公司)内进行uvb照射,uvb照射强度为0.174mw/cm2,照射时长28.7min,累积照射剂量为300mj。照射过程用纱布遮盖小鼠眼部,避免眼睛受到紫外线伤害。照射完毕30min后,动物再次按照上述方法给药。
90.uvb照射后第2、5、7天(即day 10、day 13、day 15),uvb模型组、uvb+样品组各取5只动物,颈椎脱臼处死。取小鼠背部经脱毛、给药、照射的皮肤,置于中性甲醛固定,作石蜡切片并he染色,进行病理检测。
91.研究发现,与uvb模型组相比,本发明制备获得的海藻提取物处理组小鼠背部皮肤,在紫外线照射后第2天损伤程度明显减轻(uvb模型组表皮及真皮组织浅层或中层坏死),第5天炎细胞数量恢复正常(图4,uvb模型组棘细胞增生,真皮及皮下组织炎细胞浸润),第7天小鼠皮肤与空白对照组无明显差异(uvb模型组表皮增厚,真皮层炎细胞数量减少)。
92.说明本发明制备获得的海藻提取物可有效缓解紫外线照射引起皮肤红斑、炎性浸润、弹性纤维降解、脱屑、结痂等不良反应。
93.实施例8
94.选取实施例3制备获得的海藻提取物为原料,制备防晒功能化妆品。
95.组成化妆品的成分,按质量分数100%计,包括:
96.a相:4-甲基苄亚基樟脑0.5%、脂肪醇聚氧乙烯醚3%、c12-15苯甲酸酯(cas#:68411-27-8)9%、碳酸二辛酯2%、微晶蜡0.8%、水解丝蛋白/pg-丙基甲基二羟基硅氧烷交聚物0.5%、ve醋酸酯0.7%。
97.b相:1,3-丁二醇5%、丙二醇4%、edta-2na 0.1%、亚甲基双-苯并三唑基四甲基丁基酚3.5%、peg-40氢化蓖麻油0.2%、nacl 0.8%、去离子水余量。
98.c相:海藻提取物0.5%、尿囊素0.4%、vc磷酸酯镁0.3%。
99.d相:香精0.2%、尼泊金丁酯0.1%。
100.工艺过程:分别加热a相、b相到80℃,搅拌条件下将a相加入到b相中,均质10min。冷却至60℃时加入c相。冷却至40℃后加入d相,混匀制得化妆品。
101.将制备的上述海洋生物化妆品(记为a)及其对照样(记为a,用去离子水替代海藻提取物,其它基质成分及用量均与a相同)进行功效评价。
102.取40只balb/c小鼠,随机分为4组:空白对照组、uvb模型组、uvb+海洋生物化妆品、uvb+对照样,10只/组。按照实施例7的方法,进行脱毛和uvb造模处理。给药方式(uvb照射前给药)则由湿敷改为涂抹给药,给药剂量200mg化妆品/只小鼠。空白对照组、uvb模型组不给药。涂抹后玻璃纸覆盖,再用胶带固定,敷贴持续3小时,结束后撤去胶布、玻璃纸和纱布,并用清水洗净残留,1次/日。uvb照射后第2天,将小鼠颈椎脱臼处死,取背部经脱毛、给药、照射的皮肤,置于中性甲醛固定。
103.将封固试样置于10倍镜下观察皮肤整体形态,再于40倍镜下从视野观察到的皮肤最上端开始拍第一张图片,之后每移动标尺2mm拍取一张,拍取5张后用显微图像分析系统选取每张图片上的5个点,测量其表皮厚度,每张图片共测量25个点,取平均值记为表皮厚度。每张图片取6个视野,计数每个视野内成纤维细胞数,取平均值记为每个视野真皮层成纤维细胞数(表1)。
104.表1海洋生物化妆品对uvb照射balb/c小鼠表皮厚度与真皮成纤维细胞的影响
[0105][0106]
注:与空白对照比较,
*
p《0.05,
**
p《0.01;与uvb模型组比较,
#
p《0.05,
##
p《0.01。
[0107]
研究发现,与空白对照组相比,uvb模型组、uvb+对照样组小鼠表皮厚度明显增加,而真皮层成纤维细胞数量显著降低。而与uvb模型组、uvb+对照样组相比,uvb+海洋生物化妆品组小鼠表皮厚度明显降低,而真皮层成纤维细胞数量显著提高,其与空白对照组无显著性差异。
[0108]
说明应用本发明海藻提取物制备的化妆品可有效缓解紫外线照射引起的真皮炎性浸润、弹性纤维降解、表皮角化过度等不良反应,可用于预防皮肤晒伤。
[0109]
实施例9
[0110]
选取实施例3制备获得的海藻提取物为原料,制备晒伤修复凝胶(生物医用材料)。
[0111]
海藻提取物凝胶的成分,按质量分数100%计,包括:中等粘度海藻酸钠(麦克林,cp,粘度200
±
20mpa.s)2%、海藻提取物0.16%、去离子水余量。先称取海藻提取物,加入去离子水,搅匀后,再加入海藻酸钠,缓慢溶解并搅匀,制成凝胶。
[0112]
凝胶基质:2%中等粘度海藻酸钠溶液(用去离子水替代同等含量的海藻提取物)。
[0113]
取60只balb/c小鼠,随机分为4组:空白对照、uvb模型、uvb+凝胶基质、uvb+海藻提取物凝胶,15只/组。
[0114]
day 1,用剃毛器剃去动物背部被毛,面积约为2
×
2cm2,脱毛过程应轻柔,避免损伤皮肤。
[0115]
day 2,在小鼠背部皮肤脱毛处,uvb+凝胶基质组涂抹凝胶基质,uvb+海藻提取物凝胶组涂抹海藻提取物凝胶,给药剂量200mg凝胶/只小鼠。空白对照组、uvb模型组不给药。
[0116]
day 3,uvb模型组、uvb+凝胶基质组、uvb+海藻提取物凝胶组动物腹腔注射3mg/ml戊巴比妥钠麻醉(注射体积:20ml/kg体重),麻醉后固定于皮肤光老化试验仪内进行uvb照射累积剂量300mj。照射过程用纱布遮盖小鼠眼部,避免眼睛受到紫外线伤害。空白对照组动物仅注射戊巴比妥钠麻醉,但不进行uvb照射。空白对照组、uvb模型组、uvb+凝胶基质组、uvb+海藻提取物凝胶组动物紫外线照射完毕30min后,给药方式同上。每天给药1次,并观察动物的存活、体形、被毛、皮肤、粪便、肌肉张力、步态、精神等状况。
[0117]
紫外线照射后第2、5、14天(即day 4、day 7、day 16),从各组分别取5只动物,剃去背部毛发后,拍照,取冻存的血清用试剂盒检测其中8-ohdg含量。同时,剪取背部造模、给药区域的皮肤组织:部分置于中性甲醛固定液中固定,随后分别进行he染色、masson’s trichrome染色;部分液氮速冻后,-80℃冻存,测定超氧化物歧化酶sod活性;部分液氮速冻后,-80℃冻存,进行rna-seq、rt-qpcr检测。
[0118]
研究发现,与uvb模型组、uvb+凝胶基质组相比,uvb+海藻提取物凝胶组小鼠皮肤在紫外线照射第5天(即day 7)损伤程度明显变轻,炎症反应和胶原纤维降解较少,皮肤组织弹性纤维排列有序并部分维持网状交织结构,表皮无明显炎性渗出、脱屑、结痂等现象,与空白对照组无显著差异(图5)。
[0119]
此外,与uvb模型组、uvb+凝胶基质组相比,uvb+海藻提取物凝胶组小鼠皮肤组织中8-ohdg(dna氧化损伤产物之一)含量显著降低(图6),抗氧化酶(sod、cat等)活性显著提高(图7),皮肤组织红肿等不良症状改善明显。
[0120]
采用转录组分析(rna-seq)、rt-qpcr验证,研究发现海藻提取物可通过调控toll样受体通路、趋化因子信号通路、细胞因子-细胞因子受体相互作用等通路,抑制mapk/ap-1激活、nf-κb核易位(图8),下调tnf、mmps、il-6、il-1b等表达,进而减轻炎症反应和胶原降解,有效缓解皮肤晒伤。
[0121]
由此可见,本发明制备获得的海藻提取物无细胞毒性,无致敏性,不引起皮肤光敏反应,可显著改善紫外线照射引起的细胞凋亡和坏死现象,降低真皮炎性渗出与胶原、弹性纤维降解,减轻皮肤经大剂量紫外线照射后引起的红斑、炎症、渗液、脱屑、结痂等不良反应,有效缓解皮肤晒伤。
[0122]
对比例1
[0123]
羊栖菜干粉制备:取晒干羊栖菜藻体,去离子水清洗3~4次,再经烘干、粉碎而成。
[0124]
常温水提:称取4g羊栖菜干粉放入锥形瓶中,加入160ml蒸馏水,混匀后常温放置
1h。3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(rm water)。
[0125]
沸水浸提:称取4g羊栖菜干粉放入锥形瓶中,加入160ml蒸馏水,混匀后100℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(boiling water)。
[0126]
稀碱浸提:称取4g羊栖菜干粉放入锥形瓶中,加入160ml 0.1mol/l naoh溶液,混匀后90℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(naoh)。
[0127]
稀酸浸提:称取4g羊栖菜干粉放入锥形瓶中,加入160ml 0.1mol/l hcl溶液,混匀后90℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(hcl)。
[0128]
超声波处理:称取4g羊栖菜干粉放入烧杯中,加入160ml蒸馏水,50℃超声波处理1h(功率为120w)。3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(ultrasonic wave)。
[0129]
纤维素酶酶解:称取2g羊栖菜干粉放入锥形瓶中,加入80ml 0.05mol/l,稀盐酸调节ph4,纤维素蛋白酶(3000u/g海藻),37℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(cellulase)。
[0130]
果胶酶酶解:称取2g羊栖菜干粉放入锥形瓶中,加入80ml 0.05mol/l,稀盐酸调节ph3,果胶酶(3000u/g海藻),37℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(pectinase)。
[0131]
蜗牛酶酶解:称取2g羊栖菜干粉放入锥形瓶中,加入80ml 0.05mol/l,稀盐酸调节ph6,蜗牛酶(3000u/g海藻),37℃水浴1h。反应液冷却至室温,3000g离心15min,上清液过滤、超滤(截留分子量3kda),截留液冻干,获得海藻提取物(snailase)。
[0132]
将上述不同方法制备的海藻提取物进行抗氧化活性评价:
[0133]
(1)清除dpph自由基活性测定:将0.6ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入1.4ml蒸馏水和2ml 0.1mol/l dpph乙醇溶液,震荡混匀后,于37℃避光水浴30min。反应结束后,在517nm下测定其吸光度(as)。用2ml蒸馏水和2ml无水乙醇混合液调零,空白对照为2ml蒸馏水和2ml 0.1mol/l dpph乙醇溶液,其在517nm波长处的吸光度记为(ac)。每个样品平行测3次,对dpph自由基的抑制率(%)=(1-as/ac)
×
100%,as为样品测得a
517nm
,ac为空白a
517nm
。
[0134]
(2)清除超氧阴离子自由基活性测定:将0.4ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入0.6ml的tris-hcl缓冲液(16mmol/l,ph8),1ml 78μmol/l的nadh溶液(溶剂为16mmol/l,ph8 tris-hcl缓冲液),1ml 50μmol/l的nbt溶液(溶剂为16mmol/l,ph8 tris-hcl缓冲液)和1ml 10μmol/l的pms溶液(溶剂为16mmol/l,ph8 tris-hcl缓冲液)。震荡混匀后,25℃水浴5min。反应结束后,在560nm波长处测定吸光度(as)。用tris-hcl缓冲液(16mmol/l,ph8)调零,空白对照用0.4ml的tris-hcl缓冲液(16mmol/l,ph8)替代同等体积的待测液,其它保持不变。空白对照反应混合液在560nm处吸光度记为(ac)。每个样品平行测3次,对o
2-·
的抑制率(%)=(1-as/ac)
×
100%,as为样品测得a
560nm
,ac为空白a
560nm
。
[0135]
(3)清除羟自由基(oh
·
)活性测定:将0.06ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入0.04ml蒸馏水、0.2ml的kh2po
4-koh缓冲液(100mmol/l,ph7.4),0.2ml 15mmol/l的α-脱氧核糖,0.2ml 500mmol/l的fecl3溶液,0.1ml 1mmol/l的edta溶液,0.1ml 1mmol/l维生素c溶液,0.1ml 10mmol/l的h2o2溶液,震荡混匀,37℃水浴1h。反应结束后,在混合液中加入1ml 1%(w/v)tba溶液和1ml 2.8%(w/v)tca溶液,混匀,80℃水浴20min。混合液在532nm波长处测定吸光度(as)。用蒸馏水调零,空白对照用0.06ml蒸馏水替代同等体积的待测液,其它保持不变。空白对照反应混合液在532nm波长处吸光度记为(ac)。每个样品平行测3次,对oh
·
的抑制率(%)=(1-as/ac)
×
100%,as为样品测得a
532nm
,ac为空白a
532nm
。
[0136]
(4)抑制亚油酸过氧化活性测定:将1ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入4ml pbs缓冲液(0.04mol/l,ph7.0)和5ml亚油酸乳液(含0.15%亚油酸,0.154%吐温-20,溶剂为pbs缓冲液),震摇混匀,37℃水浴12h。反应完成后,取0.1ml反应混合液置于10ml带塞刻度试管中,加入4.7ml的75%(v/v)乙醇溶液,0.1ml的30%(w/v)硫氰酸铵溶液,0.1ml 0.02mol/l fecl2溶液(溶剂为3.5%v/v盐酸溶液)。迅速混匀,在500nm波长处测定吸光度(as)。用0.3ml蒸馏水和4.7ml 75%(v/v)乙醇溶液混合液调零,空白对照用1ml的pbs缓冲液(0.04mol/l,ph7.0)替代同等体积的待测液,其它保持不变。空白对照反应混合液在500nm处吸光度记为(ac)。每个样品平行测3次,对亚油酸过氧化的抑制率(%)=(1-as/ac)
×
100%,as为样品测得a
500nm
,ac为空白a
500nm
。
[0137]
(5)还原fe
3+
能力测定:将0.06ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入0.04ml蒸馏水,3ml反应液(取300ml 300mmol/l,ph3.6醋酸缓冲液、30ml 100mmol/l tptz溶液、30ml 20mmol/l fecl3溶液,混匀即可,现配现用),震荡混匀。混合液37℃水浴5min后,在593nm波长处测定吸光度(as)。用300mmol/l,ph3.6醋酸缓冲液调零,空白对照用0.06ml蒸馏水替代同等体积待测液,其它保持不变。空白对照反应混合液在593nm波长处吸光度记为(ac)。每个样品平行测3次,对fe
3+
还原率(%)=(1-as/ac)
×
100%,as为样品测得a
593nm
,ac为空白a
593nm
。
[0138]
(6)总抗氧化能力测定:将0.03ml海藻提取物溶液(200μg/ml)置于10ml带塞刻度试管中,加入3ml反应液(7.0mmol/l abts溶液和2.45mmol/l过硫酸钾溶液各180ml,避光混匀12h,用100mmol/l,ph7.4 kh2po
4-koh缓冲液调整吸光度为0.7即可使用,现配现用),震摇混匀。静置30min,在734nm波长处测定反应混合液吸光度(as)。用100mmol/l,ph7.4 kh2po
4-koh缓冲液调零,空白对照用0.03ml蒸馏水替代同等体积待测液,其它保持不变。空白对照反应混合液在734nm波长处吸光度记为(ac)。每个样品平行测3次,对abts的抑制率(%)=(1-as/ac)
×
100%,as为样品测得a
734nm
,ac为空白a734
nm
。
[0139]
研究发现(图9),在清除dpph自由基活性方面,与沸水浸提(boiling water)制备获得的海藻提取物相比,稀酸浸提(hcl)以及纤维素酶酶解(cellulase)制备获得的海藻提取物活性更佳(p《0.05)。
[0140]
在清除超氧阴离子自由基活性方面,与沸水浸提(boiling water)制备获得的海藻提取物相比,常温水提(rm water)、稀酸浸提(hcl)、纤维素酶酶解(cellulase)、果胶酶酶解(pectinase)以及蜗牛酶酶解(snailase)制备获得的海藻提取物活性更佳(p《0.01)。
[0141]
在清除abts自由基活性方面,与沸水浸提(boiling water)制备获得的海藻提取
物相比,稀碱浸提(naoh)制备获得的海藻提取物活性更佳(p《0.01)。
[0142]
在还原铁离子活性方面,与沸水浸提(boiling water)制备获得的海藻提取物相比,稀碱浸提(naoh)以及稀酸浸提(hcl)制备获得的海藻提取物活性更佳(p《0.01)。
[0143]
在清除羟基自由基活性方面,与沸水浸提(boiling water)制备获得的海藻提取物相比,稀酸浸提(hcl)制备获得的海藻提取物活性更佳(p《0.01)。
[0144]
在抑制亚油酸过氧化活性方面,与沸水浸提(boiling water)制备获得的海藻提取物相比,稀酸浸提(hcl)制备获得的海藻提取物活性更佳(p《0.05)。
[0145]
然而,值得注意的是,在以上8种制备方法中,沸水浸提制备获得的海藻提取物虽然在体外抗氧化活性并非最佳,但是在提高紫外线照射细胞活性(图10,参照实施例5的方法进行测定)、缓解紫外线照射引起小鼠皮肤晒伤功效方面表现最为优异(与对比例中制备获得的海藻提取物相比,均有显著性差异)。
[0146]
对比例2
[0147]
乙醇沉淀:称取符合我国相关海产品使用标准的可食用的羊栖菜晒干藻体200g,去离子水浸泡30min,清洗3~4次,去离子水再次浸泡30min。将羊栖菜藻体搅碎,加入5l去离子水,100℃沸水煮1h。浸提液冷却后,10000r/min离心10min。离心上清液依次经过抽滤(滤过定性滤纸)、截留分子量5kda超滤膜过滤。超滤截留液浓缩至200ml,加入600ml预冷4℃无水乙醇,4℃静置沉淀24h,3000g离心15min,沉淀用无水乙醇清洗1-2次,冻干,获得海藻提取物ys75,离心上清液浓缩、冻干,获得海藻提取物ym。
[0148]
采用实施例4、5的实验方法,对本对比例制备获得的海藻提取物ys75、ym与实施例3制备获得的海藻提取物(ys)进行细胞活性评价。
[0149]
研究发现(图11),在低剂量(50μg/ml、100μg/ml、200μg/ml、400μg/ml)时,对比例中制备获得的海藻提取物(ym)提高hacat细胞活性均高于实施例3制备获得的海藻提取物(ys);然而在高剂量(800μg/ml、1600μg/ml)时,实施例3制备获得的海藻提取物(ys)提高hacat细胞活性显著高于对比例中制备获得的海藻提取物ym、ys75(p《0.01)。
[0150]
让我们感到意外的是(图12),在剂量(50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml、1600μg/ml)时,实施例3制备获得的海藻提取物(ys)提高uvb照射hacat细胞活性均显著高于对比例制备获得的海藻提取物ym、ys75以及uvb模型组(p《0.05或p《0.01)。
[0151]
由此可见,与实施例3获得的海藻提取物ys相比,经过乙醇沉淀处理制备获得的海藻提取物两个组分(沉淀、上清液),缓解紫外线照射引起细胞损伤的作用并未得到显著改善,反而其功效有所降低。
[0152]
对比例3
[0153]
沸水浸提(不超滤):称取符合我国相关海产品使用标准的可食用的羊栖菜晒干藻体200g,蒸馏水浸泡30min,清洗3~4次,蒸馏水再次浸泡30min。将羊栖菜藻体搅碎,加入5l蒸馏水,100℃沸水煮1h。浸提液冷却后,10000g离心10min。将离心上清液抽滤(滤过定性滤纸),滤过液经浓缩、冻干,获得海藻提取物yc。
[0154]
按照实施例3的方法,制备获得海藻提取物ys。
[0155]
而按实施例3的方法中,滤过液再经截留分子量5kda的超滤膜过滤,收集经5kda超滤膜滤过液,经浓缩、冻干,获得海藻提取物yd。
[0156]
采用实施例5的实验方法,将本对比例制备获得的海藻提取物yc、海藻提取物yd与
实施例3制备获得的海藻提取物ys,进行细胞活性评价。
[0157]
研究发现(图13),在剂量(100μg/ml、200μg/ml、400μg/ml、800μg/ml、1600μg/ml)时,实施例3制备获得的海藻提取物ys提高uvb照射hacat细胞活性,均显著高于对比例制备获得的海藻提取物yd、海藻提取物yc以及uvb模型组(p《0.05或p《0.01)。
[0158]
综上,经过超滤处理获得的海藻提取物(截留液组分),缓解紫外线照射引起细胞损伤的作用最佳,其防晒作用显著优于未经超滤处理制备的海藻提取物,以及超滤滤过液组分海藻提取物。
[0159]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1