临床试验开发计划生成方法、系统和设备与流程
1.本技术涉及临床试验技术领域,尤其涉及一种临床试验开发计划生成方法、系统和设备。
背景技术:
2.临床试验,意在发现或验证某种试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄,以确定药物的疗效与安全性的系统性试验。
3.良好的临床试验计划和实施源于对临床研究的既定原则的关注,其中包括保护研究受试者的权利、安全性和福祉以及科学的标准,例如:需要明确预先确定的研究目的,以解决主要的科学问题;选择具有正在研究的疾病、状况或分子/基因谱的合适的受试者;使用最小化偏倚的方法,例如:随机化、盲法或遮蔽、和/或控制混杂;终点是明确且可测量的,评估这些终点的方法是准确、可以最少的报告或测量偏倚来实施的。
4.一个药物研发计划描述一个产品从目标产品概况至批准后活动的研发活动的所有方面。该计划的准备通常是前瞻性的,并根据研发过程的进行和新信息的获取而更新。该计划通常包括剂型研发的特征描述,支持人体临床研究中的产品评估以及支持产品批准所需的非临床研究,支持相关患者人群中有效性和安全性数据的临床研究,特殊人群中的研究(如儿童人群),产品商业化的地区考虑因素(例如:健康技术评估)和批准后研究。
5.临床试验是整个新药研发中花费时间和成本最高的地方,因此,一个新药的开发的成败与临床试验的成功与否息息相关。
6.而目前,在整个临床试验行业上缺少全面准备的临床试验开发计划的制定方法,临床试验的计划不足,导致临床试验的失败、临床试验的效率降低,最终导致新药开发的失败。
技术实现要素:
7.本技术提供一种临床试验开发计划生成方法、系统和设备,以解决现有技术中,因无法制定全面的临床试验开发计划,从而导致临床试验效率低、增加新药开发周期的问题。
8.本技术的上述目的是通过以下技术方案实现的:第一方面,本技术实施例提供一种临床试验开发计划生成方法,包括:获取用于临床试验开发计划的基础数据;其中,所述基础数据为基于预设标准确定数据类型后,从多个数据源中获取的;将所述基础数据进行标准化,得到并存储标准数据;调取并整合所述标准数据,生成临床试验开发计划。
9.进一步的,所述预设标准包括国际人用药品注册技术协调会标准、美国食品药品监督管理局标准、国家药品监督管理局标准和过程要素原则标准;所述过程要素原则标准包括过程原则标准、第一要素原则标准和第二要素原则标
准;所述过程原则标准包括:计划、设计、执行、分析、报告和解释;所述第一要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法和统计分析;所述第二要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法、统计分析、研究目的、研究类型和数据源。
10.进一步的,所述获取用于临床试验开发计划的基础数据,包括:建立临床试验开发计划数据库;通过多个预设基本要素数据模块对接临床试验开发计划数据源,采集基础数据;或通过人员的编辑填写采集基础数据;基于美国食品药品监督管理局和国家药品监督管理局审核报告质量管理规范要求,对所述基础数据的属性进行判断,并将符合所述要求的数据录入至所述数据库中。
11.进一步的,所述将所述基础数据进行标准化,得到并存储标准数据,包括:对所述基础数据进行筛选变量和对变量间的层级关系进行标识;基于筛选和标识结果,将基础数据转换为标准数据,得到并存储临床试验开发计划标准数据集。
12.进一步的,还包括:对所述标准数据进行排版和汇总,生成可编辑图表;通过所述可编辑图表获取用户键入的信息,整合并存储所述可编辑图表和所述用户键入的信息。
13.进一步的,所述调取并整合所述标准数据,生成临床试验开发计划,包括:调用所述临床试验开发计划标准数据集和/或整合后的所述可编辑图表和所述用户键入的信息;基于调用的数据,整合生成临床试验开发计划文档。
14.第二方面,本技术实施例提供一种临床试验开发计划生成系统,包括:电子数据采集模块、数据存储模块、转化模块、图表生成模块、信息键入模块、中央数据整合中心、图表数据库和计划生成模块;所述电子数据采集模块,用于采集临床试验开发计划中涉及的基础数据;所述数据存储模块,用于存储所述基础数据;所述转化模块,用于对所述基础数据进行转化处理,得到预设标准形式的标准数据;所述图表生成模块,用于对所述标准数据进行排版并汇总生成可编辑图表;所述信息键入模块:用于供用户对所述可编辑图表进行信息键入;所述中央数据整合中心,用于采集并整合所述用户键入的信息和对应的标准数据,并将整合结果存储至所述图表数据库中;所述图表数据库,用于存储所述中央数据整合中心整合后的数据信息;所述计划生成模块,用于基于所述整合后的数据信息生成并输出临床试验开发计划。
15.进一步的,还包括:更新模块和判断模块;所述更新模块,用于当所述可编辑图表内生成用户自定义输入模块后,根据用户
键入的信息对所述基础数据进行识取并存至所述数据存储模块中;其中,所述自定义输入模块为所述信息键入模块在所述可编辑图表内生成的;所述判断模块,用于基于美国食品药品监督管理局和国家药品监督管理局审核报告质量管理规范要求,对所述基础数据进行属性判定,将不符合所述规范要求的数据信息进行过滤,并将符合所述规范要求的数据录入至所述数据存储模块中。
16.进一步的,所述电子数据采集模块包括多个基本要素数据模块;所述多个基本要素数据模块用于分别采集对应的基础数据;其中,所述基础数据的类型为基于国际人用药品注册技术协调会标准、美国食品药品监督管理局标准、国家药品监督管理局标准和过程要素原则标准确定的;其中,所述过程要素原则标准包括过程原则标准、第一要素原则标准和第二要素原则标准;所述过程原则标准包括:计划、设计、执行、分析、报告和解释;所述第一要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法和统计分析;所述第二要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法、统计分析、研究目的、研究类型和数据源。
17.第三方面,本技术实施例提供一种临床试验开发计划生成设备,包括:处理器、存储器、输入接口和输出接口;所述存储器用于存储程序,所述程序至少用于实现如上述提到的任意一种临床试验开发计划生成方法;所述处理器用于调用并执行所述存储器存储的所述程序;所述输入接口用于连接外部输入设备,用于供管理员和/或用户输入信息数据和对所述临床试验开发计划生成设备进行维护;所述输出接口用于连接外部输出设备,用于展示所述程序运行结果和/或程序运行过程。
18.本技术的实施例提供的技术方案可以包括以下有益效果:本技术的实施例提供的技术方案中,首先获取用于临床试验开发计划的基础数据;其中,所述基础数据为基于预设标准确定数据类型后,从多个数据源中获取的;然后将所述基础数据进行标准化,得到并存储标准数据;最后,调取并整合所述标准数据,生成临床试验开发计划。如此,基于预设标准,从多个数据源中采集获取临床试验开发计划中涉及的所有相关的基础数据,然后对标准数据进行标准化,最后基于标准数据,调取整合,生成临床试验开发计划。通过本技术提供的方法,基于多方面多维度的基础数据,实现根据每个流程中的具体要求,进行详细制定临床试验开发计划,提高了临床试验的成功率和药物开发的成功率,缩短了临床试验开发的时间和降低临床试验成本。
19.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
20.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施
for pharmaceuticals for human use, ich)标准、美国食品药品监督管理局(food and drug administration,fda)标准、国家药品监督管理局(national medical products administration ,nmpa)标准,等发布的相关法律法规作为指导原则和执行标准,进行确定的。在实际应用中,可以通过预设的电子数据采集系统进行基础数据的采集,电子数据采集系统可以包括临床试验开发计划的多个基本要素数据模块,各个模块可以通过对接临床试验开发计划中相关数据的所有临床试验相关的数据采集系统或通过人员的编辑填写实现基础数据的收集。
27.在实际应用中,为了提高临床试验开发计划生成效率,在基础数据采集阶段,对数据按照预设标准或要求进行筛选和选择,得到更加实用的基础数据或称之为基本要素数据,完成数据采集工作。
28.在一些具体的实施过程中,采集的基本要素数据可以包括一般考虑;剂量与临床药理学;剂量效应评估;对照、真值标准和依从性;随机化和盲法;受试者群体和特殊人群;统计分析计划;临床试验质量管理规范;不良药物经历和报告;加快药物开发计划等。需要说明的是,以上仅是对临床试验计划制定过程中所要收集的数据的多样性的举例的描述,以说明临床试验计划制定过程中的数据采集是具有严格的规范要求和标准化内容的,在具体的实施过程中,可以参照依据ich、fda和nmpa等发布的相关法律法规以及作为指导原则和执行标准,进行相应的扩充,在此不再一一赘述。
29.s102、将所述基础数据进行标准化,得到并存储标准数据;s103、调取并整合所述标准数据,生成临床试验开发计划。
30.基于fda和nmpa审评报告质量管理规范的要求以及实际需求,对基础数据进行标准化,得到含有变量和变量标签的标准数据,其中,变量标签是由字符串组成。
31.具体的,将通过预设的电子数据采集系统和转化系统,采集临床试验开发计划中涉及的所有相关的基础数据并转换为标准格式数据时,可以将数据存储在预设的数据存储模块中。在进行临床试验开发计划生成时,通过预设的中央数据整合中心,调取数据存储模块中的临床试验计划相关数据计算得出临床试验开发计划。
32.本技术实施例提供的临床试验开发计划生成方法,基于ich即上述ich标准、fda即上述fda标准、nmpa即上述nmpa标准和过程要素原则标准即上述“669”原则标准,确定用于生成临床试验开发计划的全部基础数据种类,通过多个基础要素模块分别进行采集,然后将基础数据进行标准化,得到含有变量和变量表示的标准数据,最后基于标准数据生成临床试验开发计划,如此,通过多数据源采集临床试验开发计划元数据即基础数据,对元数据进行标准化为标准元数据即标准数据,整合临床试验开发计划标准元数据为临床试验开发计划,提高临床试验的成功率和药物开发的成功率,缩短临床试验开发的时间和降低临床试验成本,解决了背景技术中存在的缺陷,填补了技术背景中临床试验行业的空白。
33.图2为本技术另一实施例提供的临床试验开发计划生成方法的流程示意图,如图2所示,本技术在另一些实施例过程中,获取用于临床试验开发计划的基础数据,具体包括:s201、建立临床试验开发计划标准元数据库。
34.s202、将多数据源采集到的数据录入到临床试验开发计划标准元数据库。
35.s203、筛选变量并对变量间的层级关系进行标识。
36.s204、将临床试验开发计划标准元数据库中的数据转化为临床试验开发计划标准
数据集。
37.具体的,上述元数据即对应基础数据,而标准元数据即对应标准数据,首先,建立临床试验开发计划数据库,通过多个预设基本要素数据模块对接临床试验开发计划数据源,采集基础数据;或通过人员的编辑填写采集基础数据;然后基于fda和nmpa的good review practice既审核报告质量管理规范要求,对所述基础数据的属性进行判断,并将符合所述要求的数据录入至所述数据库中。其中,可以通过判断模块对基础数据进行属性判定,判断基础数据的属性是否符合fda和nmpa审评报告质量管理规范的要求,不符合的数据信息不予录入数据存储模块,通过数据筛选,获取有用数据。
38.需要说明的是,采集临床试验开发计划标准元数据含有变量和变量标签,而且变量标签是由字符串组成。标准化的过程包括对所述基础数据进行筛选变量和对变量间的层级关系进行标识;然后基于筛选和标识结果,将基础数据转换为标准数据,得到并存储临床试验开发计划标准数据集。
39.在一些具体的实施过程中,例如,可以通过预设图表生成模块对得到的标准数据进行排版并汇总生成可编辑图表;然后,通过预设的信息键入模块供用户对可编辑图表进行信息键入;在用户键入信息后,预设中央数据整合中心采集用户的键入信息以及对应的标准数据,并进行数据整合,将整合后的数据信息存入预设图表数据库。
40.进一步的,还可以通过预设的更新模块,更新模块根据用户输入内容进行基础数据识取并存入数据存储模块,具体的,可以当信息键入模块在可编辑图表内生成用户自定义输入模块后,更新模块再对数据进行识取并存入数据存储模块中,如此,便于系统的数据更新,提升系统的生成计划的准确性。
41.需要说明的是,在一些实施例中,在多个数据源采集临床试验开发计划元数据时,该元数据包括同类药物临床试验、本药物临床前数据。
42.s205、调用临床试验开发计划标准数据集,生成临床试验开发计划文档。
43.最后利用预设的计划生成模块,调用所述临床试验开发计划标准数据集和/或整合后的所述可编辑图表和所述用户键入的信息;根据调用的数据,整合生成临床试验开发计划文档。
44.基于同一个发明构思,本技术实施例还提供的一种临床试验开发计划生成系统,包括:电子数据采集模块、数据存储模块、转化模块、图表生成模块、信息键入模块、中央数据整合中心、图表数据库和计划生成模块;所述电子数据采集模块,用于采集临床试验开发计划中涉及的基础数据;所述数据存储模块,用于存储所述基础数据;所述转化模块,用于对所述基础数据进行转化处理,得到预设标准形式的标准数据;所述图表生成模块,用于对所述标准数据进行排版并汇总生成可编辑图表;所述信息键入模块:用于供用户对所述可编辑图表进行信息键入;所述中央数据整合中心,用于采集并整合所述用户键入的信息和对应的标准数据,并将整合结果存储至所述图表数据库中;所述图表数据库,用于存储所述中央数据整合中心整合后的数据信息;所述计划生成模块,用于基于所述整合后的数据信息生成并输出临床试验开发计划。
45.进一步的,本技术实施例提供的临床试验开发计划生成系统,还包括:更新模块和判断模块;
所述更新模块,用于在所述信息键入模块在所述可编辑图表内生成用户自定义输入模块后,根据用户键入的信息对所述基础数据进行识取并存至所述数据存储模块中;所述判断模块,用于基于fda和nmpa审核报告质量管理规范要求,对所述基础数据进行属性判定,将不符合所述规范要求的数据信息进行过滤,并将符合所述规范要求的数据录入至所述数据存储模块中。
46.在实际应用中,所述电子数据采集模块包括多个基本要素数据模块;具体的,所述多个基本要素数据模块用于分别采集对应的基础数据,然后对基础数据进行筛选和选择,得到基本要素数据;其中,所述基本要素数据的类型为基于ich、fda、nmpa和过程要素原则标准确定的;其中,所述过程要素原则标准包括过程原则标准、第一要素原则标准和第二要素原则标准;所述过程原则标准包括:计划、设计、执行、分析、报告和解释;所述第一要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法和统计分析;所述第二要素原则标准包括:研究人群、干预、对照组、反应变量、减少或评估偏倚方法、统计分析、研究目的、研究类型和数据源。
47.另外,在另一些实施例中,采集临床试验开发计划标准元数据时,还包括设置项目环境、项目信息、各类文件保存位置和试验数据读取周期,其中,所述项目环境和项目信息是依据临床试验项目来设置。
48.本技术实施例提供的临床试验开发计划生成系统,通过电子数据采集和转化系统搜集临床试验开发计划的相关基本要素数据模块并将非标准格式的临床试验开发计划相关数据统一为标准格式的临床试验开发计划相关数据,将临床试验开发计划相关数据保存至数据存储模块中;然后通过中央数据整合中心调取数据存储模块中的临床试验开发计划相关数据通过计划生成模块计算获取临床试验开发计划,从而能够快速准确的实现临床试验开发计划的生成。
49.此外,基于同一个发明构思,本技术还公开了一种电子设备,即一种临床试验开发计划生成设备,包括处理器、存储器、输入接口和输出接口;所述存储器用于存储程序,所述程序至少用于实现如上述实施例提供的临床试验开发计划生成方法;所述处理器用于调用并执行所述存储器存储的所述程序;所述输入接口用于连接外部输入设备,用于供管理员和/或用户输入信息数据和对所述临床试验开发计划生成设备进行维护;所述输出接口用于连接外部输出设备,用于展示所述程序运行结果和/或程序运行过程。
50.具体的,图3为本技术实施例提供的临床试验开发计划生成设备的结构示意图,如图3所示:本实施例的电子设备100包括:处理器(cpu)101、内存102、硬盘103、输入接口104、输出接口105以及网络接口106.处理器101是执行存储在内存102中的程序的运算装置。处理器101通过执行应用程序来实现电子设备100的各种功能。
51.内存102是易失性存储元件的ram,暂时存储处理器101所执行的应用程序和执行应用程序时所使用的数据。
52.硬盘101是机械硬盘(hdd)、闪存硬盘(ssd)等大容量且非易失性的存储设备用于长期存储处理器101在执行程序时所使用的数据(例如,图4所示的临床试验开发计划元数据11、元数据描述文件12)、以及处理器101所执行的程序。即,程序从硬盘103读出,被加载
到内存102,由处理器101执行,由此实现电子设备100的各功能。
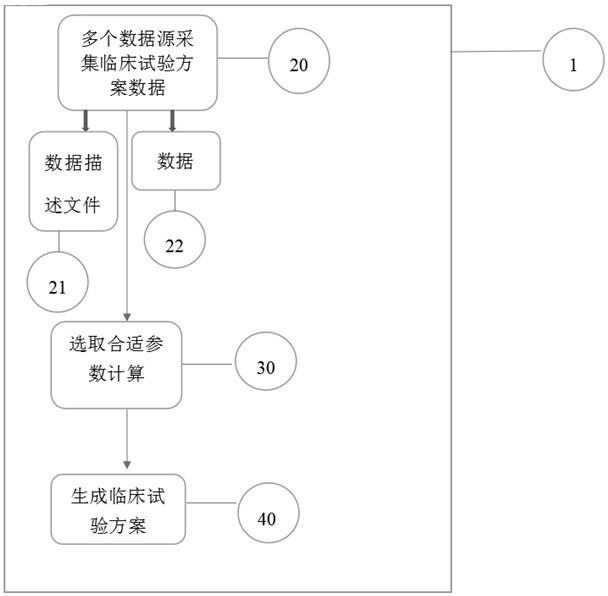
53.输入接口104是连接有键盘、鼠标等输入装置并接受管理员的输入的接口。输出接口105是连接有显示器并以管理员能够观看的形式输出结果的接口。电子设备100的输入接口104和输出接口105仅用于管理员安装和运维电子设备100的应用程序。其他用户使用经由网络接口106与电子设备100连接的终端提供的输入装置和输出装置对系统进行操作。
54.处理器101所执行的应用程序经由网络提供给电子设备100,并存储在硬盘103中。
55.电子设备100是在物理上的一个计算机上或者多个计算机上构成的计算机系统,也可以在多个物理计算机资源上构建的虚拟计算机上运行。
56.基于同一个发明构思,本技术还提供一种临床试验开发计划生成装置,用于将临床试验过程中多数据源采集临床试验开发计划元数据整合为临床试验开发计划,如图4所示,本技术实施例提供的临床试验开发计划生成装置,用于从多个数据源采集临床试验开发计划元数据,基于采集结果得到元数据和元数据描述文件,然后将元数据和元数据描述文件转换为标准元数据,包括标准元数据和标准元数据描述文件,最后基于标准元数据和标准元数据描述文件,整合得到为临床试验开发计划。
57.可以理解的是,上述各实施例中相同或相似部分可以相互参考,在一些实施例中未详细说明的内容可以参见其他实施例中相同或相似的内容。
58.需要说明的是,在本技术的描述中,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性。此外,在本技术的描述中,除非另有说明,“多个”的含义是指至少两个。
59.流程图中或在此以其他方式描述的任何过程或方法描述可以被理解为,表示包括一个或更多个用于实现特定逻辑功能或过程的步骤的可执行指令的代码的模块、片段或部分,并且本技术的优选实施方式的范围包括另外的实现,其中可以不按所示出或讨论的顺序,包括根据所涉及的功能按基本同时的方式或按相反的顺序,来执行功能,这应被本技术的实施例所属技术领域的技术人员所理解。
60.应当理解,本技术的各部分可以用硬件、软件、固件或它们的组合来实现。在上述实施方式中,多个步骤或方法可以用存储在存储器中且由合适的指令执行系统执行的软件或固件来实现。例如,如果用硬件来实现,和在另一实施方式中一样,可用本领域公知的下列技术中的任一项或他们的组合来实现:具有用于对数据信号实现逻辑功能的逻辑门电路的离散逻辑电路,具有合适的组合逻辑门电路的专用集成电路,可编程门阵列(pga),现场可编程门阵列(fpga)等。
61.本技术领域的普通技术人员可以理解实现上述实施例方法携带的全部或部分步骤是可以通过程序来指令相关的硬件完成,所述的程序可以存储于一种计算机可读存储介质中,该程序在执行时,包括方法实施例的步骤之一或其组合。
62.此外,在本技术各个实施例中的各功能单元可以集成在一个处理模块中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个模块中。上述集成的模块既可以采用硬件的形式实现,也可以采用软件功能模块的形式实现。所述集成的模块如果以软件功能模块的形式实现并作为独立的产品销售或使用时,也可以存储在一个计算机可读取存储介质中。
63.上述提到的存储介质可以是只读存储器,磁盘或光盘等。
64.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本技术的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
65.尽管上面已经示出和描述了本技术的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本技术的限制,本领域的普通技术人员在本技术的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1