一种用于治疗阿尔茨海默病的中药组合物及其制备方法和应用
1.本发明涉及一种中药组合物及其制备方法和用途,特别涉及一种用于治疗阿尔茨海默病的中药组合物及其制备方法和应用。本发明属于中药研究技术领域。
背景技术:
2.阿尔茨海默病是一种常见的老年性疾病(hampel h,vassar r,de strooperb,et al.the beta-secretase bace1 in alzheimer's disease[j].biol psychiatry,2021,89(8):745-756.),多与脑组织不同区域β-淀粉样蛋白含量增加有一定关系 (busche ma,hyman bt.synergy between amyloid-beta and tau in alzheimer'sdisease[j].nat neurosci,2020,23(10):1183-1193.)。β-淀粉样蛋白是阿尔茨海默病非常强大的刺激因子(chen wt,lu a,craessaerts k,et al.spatialtranscriptomics and in situ sequencing to study alzheimer's disease[j].cell,2020, 182(4):976-991.),会促进机体脑组织形成与炎症反应密切相关的正反馈效应环,β-淀粉样蛋白含量会继续增加(breijyeh z,karaman r.comprehensive reviewon alzheimer's disease causes and treatment[j].molecules,2020,25(24):5789.),不断加重脑组织的无菌性炎症反应,进而引起相应的症状及其体征。
[0003]
研究资料显示,阿尔茨海默病多伴有学习能力下降(kent sa,spires-jonestl,durrant cs.the physiological roles of tau and abeta:implications for alzheimer'sdisease pathology and therapeutics[j].acta neuropathol,2020,140(4):417-447.),近期发生的事情极其容易忘记,这与脑组织炎症介质含量增加并造成海马区域损伤有一定关系,也与脑组织β-淀粉样蛋白前体蛋白含量增加有一定关系,而脑组织炎症介质及其β-淀粉样蛋白前体蛋白出现异常增多,多与脑组织不同区域β-淀粉样蛋白含量正反馈增加引起学习能力下降(roussarie jp,yao v,rodriguez
‑ꢀ
rodriguez p,et al.selective neuronal vulnerability in alzheimer's disease a network
‑ꢀ
based analysis[j].neuron,2020,107(5):821-835)存在密切的相关性。
[0004]
随着机体年龄增加,脑组织自由基的产生量也会逐渐增加,星形胶质细胞结构异常会引起血脑屏障结构异常(serrano-pozo a,das s,hyman bt.apoe andalzheimer's disease advances in genetics pathophysiology and therapeuticapproaches[j].lancet neurol,2021,20(1):68-80.),伴有脑组织胆碱系统失衡,乙酰胆碱代谢酶含量异常(ren jm,zhang sl,wang xl,et al.expression levelsof the alpha7 nicotinic acetylcholine receptor in the brains of patients with alzheimer'sdisease and their effect on synaptic proteins in sh-sy5y cells[j].mol med rep,2020, 22(3):2063-2075.),引起自由基含量继续增加(uversky vn,elrashdy f,aljadawia,et al.severe acute respiratory syndrome coronavirus 2infection reaches the humannervous system how[j].j neurosci res,2021,99(3):750-777.),进而促发脑组织自由
基的瀑布式反应,加重机体的炎症反应。
[0005]
实际上,年老体弱者多伴有情志失调,病理性产物积聚是比较正常的生理现象,而这与小胶质细胞活化有一定关系(bartels t,de schepper s,hong s.microgliamodulate neurodegeneration in alzheimer's and parkinson's diseases[j].science,2020, 370(6512):66-69.),小胶质细胞活化会促使白介素-1β含量增加(rahman ma, islam k,rahman s,et al.neurobiochemical cross-talk between covid-19andalzheimer's disease[j].mol neurobiol,2021,58(3):1017-1023.),促进脑组织炎症反应,还可以促进β-淀粉样蛋白前体蛋白逐渐分解成β-淀粉样蛋白(hur jy, frost gr,wu x,et al.the innate immunity protein ifitm3 modulates gamma
‑ꢀ
secretase in alzheimer's disease[j].nature,2020,586(7831):735-740.),促使神经元外侧形成大量的老年斑,诱使机体脑组织病变程度加重,促进机体脑组织乙酰胆碱含量增加对阿尔茨海默病是有好处的(lanni c,masi m,racchi m,etal.cancer and alzheimer's disease inverse relationship an age-associated divergingderailment of shared pathways[j].mol psychiatry,2021,26(1):280-295.),会改善β-淀粉样蛋白诱导阿尔茨海默病,这就需要乙酰胆碱代谢酶含量降低,同时胆碱乙酰化酶含量增加。
[0006]
已经证实,阿尔茨海默病脑组织的病变主要集中海马区域(richetin k,steulletp,pachoud m,et al.tau accumulation in astrocytes of the dentate gyrus inducesneuronal dysfunction and memory deficits in alzheimer's disease[j].nat neurosci,2020, 23(12):1567-1579.)。海马区域通常可以分为多个神经分区,其中海马1区和海马3区与阿尔茨海默病关系极为密切(lyssenko nn,pratico d.abca7 and thealtered lipidostasis hypothesis of alzheimer's disease[j].alzheimers dement,2021, 17(2):164-174.)。海马区域自由基的产生量增加、β-淀粉样蛋白含量增加(ruanz,pathak d,venkatesan kalavai s,et al.alzheimer's disease brain-derived extracellularvesicles spread tau pathology in interneurons[j].brain,2021,144(1):288-309.)、白介素-1β含量增加等,均可以快速诱导机体出现非常明显的症状及其体征,很多研究者多在海马1区和海马3区注射大量的β-淀粉样蛋白建立常规的阿尔茨海默病模型。
[0007]
众所周知,很多药物对β-淀粉样蛋白诱导阿尔茨海默病效果较好,包括抗β
‑ꢀ
淀粉样蛋白药物(lozupone m,solfrizzi v,durso f,et al.anti-amyloid-beta proteinagents for the treatment of alzheimer's disease:an update on emerging drugs[j].expertopin emerg drugs,2020,25(3):319-335.)、雌激素、维生素b6、维生素c(yujt,xu w,tan cc,et al.evidence-based prevention of alzheimer's disease systematicreview and meta-analysis of 243observational prospective studies and 153randomisedcontrolled trials[j].j neurol neurosurg psychiatry,2020,91(11):1201-1209.)、抗氧化剂、白藜芦醇(han y,chu x,cui l,et al.neuronal mitochondria-targetedtherapy for alzheimer's disease by systemic delivery of resveratrol using dual-modifiednovel biomimetic nanosystems[j].drug deliv,2020,27(1):502-518.)、新型纳米硒等,但是很多药物具有一定的副作用。近年来,很多研究者为了克服这些副作用,于是选择副作用很小、具有整体性调节功能、靶点相对较多的药
物开展防治β-淀粉样蛋白诱导阿尔茨海默病的研究。
[0008]
中医理论认为,阿尔茨海默病多为本虚标实,具体而言是肾气不足(冯奕钧,郑伟,王兴佳,等.补肾法治疗阿尔茨海默型痴呆研究进展[j].四川中医,2021,39 (2):214-217.),这与老年人年龄偏大有一定关系。肾气充沛则肾阳充足,学习能力较强,避免髓海空虚,有助于缓解老年人的学习能力减退,因此治疗阿尔茨海默病需要选择具有补肾的药物。老年人饮食消化功能常常较弱,致使营卫失和,肾精亏虚,神明失养(陈慧泽,谈世进,孟胜喜.中西医结合防治阿尔茨海默病的研究进展[j].中西医结合心脑血管病杂志,2021,19(12):2025-2029.),β-淀粉样蛋白逐渐沉积于脑组织内部,加重机体的症状及其体征,所以治疗阿尔茨海默病需要选择具有健胃润肠的药物。老年人肾气虚也,湿毒、瘀毒等逐渐堆积(张译戈,梁雨晴,李雅黎,等.从肾虚痰瘀浅谈阿尔茨海默病的中医病机演变[j].世界科学技术-中医药现代化,2021,23(1):159-164),这与老年人体内气机不畅,阴阳失调有一定关系(赵明,李浩,刘南阳,等.浅析升清降浊法防治老年性痴呆的理论与应用[j].环球中医药,2021,14(2):278-281.),进而促进海马区域自由基的产生量增加、β-淀粉样蛋白含量增加、白介素-1β含量增加等,诱发阿尔茨海默病。因此治疗阿尔茨海默病需要散瘀、祛湿。综合分析,治疗β-淀粉样蛋白诱导阿尔茨海默病需要补肾散瘀、健胃润肠、祛湿理气。
[0009]
为此,本发明提供了包括6味中药材组成的中药组合物,其包括墨早莲10
‑ꢀ
15重量份、刘寄奴3-8重量份、草豆蔻2-6重量份、冬葵子5-15重量份、香加皮 2-6重量份以及八月札10-15重量份。动物实验结果表明,本发明的中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)可改善β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠学习能力、β-淀粉样蛋白前体蛋白表达水平、白介素-1β表达水平、乙酰胆碱代谢酶表达水平,同时中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠的主要脏器指数和体重无影响,说明本发明的中药组合物可用于治疗阿尔茨海默病并且无副作用。
技术实现要素:
[0010]
本发明所要解决的技术问题是提供一种用于防治阿尔茨海默病的中药组合物及其制备方法和用途。
[0011]
为了达到上述目的,本发明采用了以下技术手段:
[0012]
本发明的一种用于治疗阿尔茨海默病的中药组合物,其特征在于,所述的中药组合物由以下重量份的各原料药组成:墨早莲10-15重量份、刘寄奴3-8重量份、草豆蔻2-6重量份、冬葵子5-15重量份、香加皮2-6重量份以及八月札10
‑ꢀ
15重量份。
[0013]
其中,墨早莲,别名旱莲草,性寒,味酸、味甘,归属于肾经、肝经,具有补肾、凉血、滋肝、止血的基本功效;刘寄奴,别名六月雪,性微温,味苦、味辛,归属于脾经、心经、肝经,具有散瘀、通经、化积、止痛、破血、消食的基本功效;草豆蔻,别名草蔻仁,性温,味辛,归属于胃经、脾经,具有健胃、消痞、燥湿、温中的基本功效;冬葵子,性寒,味甘,归属于小肠经、大肠经、膀胱经,具有润肠、通淋、利水、下乳的基本功效;香加皮,别名杠柳皮,性微温,味苦、味辛,归属于心经、肾经、肝经,具有祛湿、强筋、利水、祛风、消肿、壮骨的基本功效;八月札,性寒,味甘、味苦,归属于肾经、脾经、肝经,具有理气、止痛、疏肝、活血的基本功效。在本发明的中药组合物中,君药墨早莲、刘寄奴,具有补肾散瘀的基本功效;臣药草豆蔻、冬葵子,具有健胃润肠的基本功效;佐药香加皮,具有祛湿的基本功效;使药八月札,具有理气的
基本功效。诸药配伍能够产生补肾散瘀、健胃润肠、祛湿理气的功效。
[0014]
其中,优选的,所述的中药组合物由以下重量份的各原料药组成:墨早莲12.5 重量份、刘寄奴6重量份、草豆蔻4重量份、冬葵子10重量份、香加皮4.5重量份以及八月札12重量份。
[0015]
行为学测试实验结果表明,与不给药对照组比较,模型验证组昆明小鼠潜伏期明显延长(p<0.05),模拟手术组昆明小鼠潜伏期改变不明显(p>0.05);与模型验证组比较,西药干预组、中药组合物高剂量组、中药组合物中剂量组昆明小鼠潜伏期明显缩短(p<0.05),中药组合物低剂量组昆明小鼠潜伏期改变不明显(p>0.05),说明中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37 g/kg)可以改善β-淀粉样蛋白诱导阿尔茨海默病清洁级昆明小鼠模型的学习记忆能力。
[0016]
酶联免疫吸附实验结果表明,与不给药对照组比较,模型验证组昆明小鼠β
‑ꢀ
淀粉样蛋白前体蛋白含量明显增加(p<0.05)且白介素-1β含量明显增加(p< 0.05),模拟手术组昆明小鼠β-淀粉样蛋白前体蛋白含量和白介素-1β含量改变不明显(p>0.05);与模型验证组比较,西药干预组、中药组合物高剂量组、中药组合物中剂量组昆明小鼠β-淀粉样蛋白前体蛋白含量和白介素-1β含量明显降低 (p<0.05),组合物低剂量组昆明小鼠β-淀粉样蛋白前体蛋白含量和白介素-1β含量改变不明显(p>0.05),说明中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)可以改善β-淀粉样蛋白诱导阿尔茨海默病清洁级昆明小鼠模型的β-淀粉样蛋白前体蛋白含量和白介素-1β含量,提示中药组合物高剂量(12.74 g/kg)、中药组合物中剂量(6.37g/kg)可以改善β-淀粉样蛋白诱导阿尔茨海默病清洁级昆明小鼠模型炎症介质水平及其减少老年斑沉积,这与减弱小胶质细胞及星形胶质细胞活化水平有关。
[0017]
免疫组化和基因检测结果表明,与不给药对照组比较,模型验证组昆明小鼠乙酰胆碱代谢酶蛋白和基因表达量明显增加(p<0.05),胆碱乙酰化酶蛋白和基因表达量明显减少(p<0.05),模拟手术组昆明小鼠乙酰胆碱代谢酶和胆碱乙酰化酶蛋白和基因表达量改变不明显(p>0.05);与模型验证组比较,西药干预组、中药组合物高剂量组、中药组合物中剂量组昆明小鼠乙酰胆碱代谢酶蛋白和基因表达量明显减少(p<0.05),胆碱乙酰化酶蛋白和基因表达量明显增加(p<0.05),组合物低剂量组昆明小鼠乙酰胆碱代谢酶和胆碱乙酰化酶蛋白和基因表达量改变不明显(p>0.05),说明机体脑组织胆碱乙酰化酶、机体脑组织乙酰胆碱代谢酶表达异常会引起机体脑组织乙酰胆碱含量异常,干预机体脑组织胆碱乙酰化酶、机体脑组织乙酰胆碱代谢酶表达,有助于中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)改善β-淀粉样蛋白诱导阿尔茨海默病。
[0018]
评估中药组合物改善β-淀粉样蛋白诱导阿尔茨海默病的副作用,这与评估体重和脏器指数有关。结果表明,与不给药对照组比较,模型验证组与模拟手术组昆明小鼠重要器官心、肺、肾、肝指数和体重改变不明显。经过中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)、中药组合物低剂量(3.19g/kg) 治疗后,各组昆明小鼠重要器官心、肺、肾、肝指数和体重改变不明显,说明中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)、中药组合物低剂量(3.19g/kg)治疗β-淀粉样蛋白诱导阿尔茨海默病清洁级昆明小鼠没有副作用。
[0019]
综上所述,由6味原药材墨组成的中药组合物可以有效治疗β-淀粉样蛋白诱导阿
尔茨海默病且无副作用。
[0020]
进一步的,本发明还提出了所述的中药组合物在制备防治阿尔茨海默病的药物中的应用。
[0021]
其中,优选的,所述的阿尔茨海默病是由β-淀粉样蛋白诱导产生的。
[0022]
更进一步的,本发明还提出了一种制备所述的中药组合物的方法,包括以下步骤:
[0023]
(1)按照以上所述的重量份称取各原料药,将各原料药混合均匀后,加入药物重量20-30倍的蒸馏水,浸泡2.5-3.5h后,煎煮2.5-3.5h,冷却;
[0024]
(2)将步骤(1)冷却后的药液用纱布过滤,得到第一次滤液;
[0025]
(3)步骤(2)剩余的药物残渣,重复步骤(1)和(2)得到第二次滤液,合并二次滤液;
[0026]
(4)合并第一次滤液和第二次滤液,使用干燥箱60-70℃烘烤6-8天,获得中药组合物干膏;
[0027]
(5)将得到的干膏放在粉碎机内粉碎,得到所述中药组合物的干粉。
[0028]
其中,优选的,步骤(2)中所述的用纱布过滤是指依次用3层纱布过滤、5 层纱布过滤、8层纱布过滤、10层纱布过滤。
[0029]
更进一步的,本发明还提出了一种临床上适宜的用于治疗阿尔茨海默病的中药制剂,其由以上所述的中药组合物加入制剂成型所需的辅料,按照制备药物制剂的常规方法制成。
[0030]
其中,优选的,所述的制剂为粉剂、水煎剂、胶囊剂、丸剂、颗粒剂、片剂或口服液。
[0031]
相较于现有技术,本发明的有益效果是:
[0032]
本发明公开了一种用于治疗阿尔茨海默病,特别是β-淀粉样蛋白诱导的阿尔茨海默病的中药组合物及其制备方法及应用。本发明的中药组合物基本组成包括 6味中药,分别是墨早莲、刘寄奴、草豆蔻、冬葵子、香加皮、八月札。本发明的中药组合物具有补肾散瘀、健胃润肠、祛湿理气的基本功效。动物实验结果表明,中药组合物高剂量(12.74g/kg)、中药组合物中剂量(6.37g/kg)可改善β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠学习能力、β-淀粉样蛋白前体蛋白表达水平、白介素-1β表达水平、乙酰胆碱代谢酶表达水平,同时中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠的主要脏器指数和体重无影响,说明本发明的中药组合物治疗阿尔茨海默病有效并且无副作用。
附图说明
[0033]
图1为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠学习能力的影响;
[0034]
注:横坐标是组别;纵坐标是潜伏期(s);
[0035]
图2为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠β-淀粉样蛋白前体蛋白含量的影响;
[0036]
注:横坐标是组别;纵坐标是β-淀粉样蛋白前体蛋白(ng/l);
[0037]
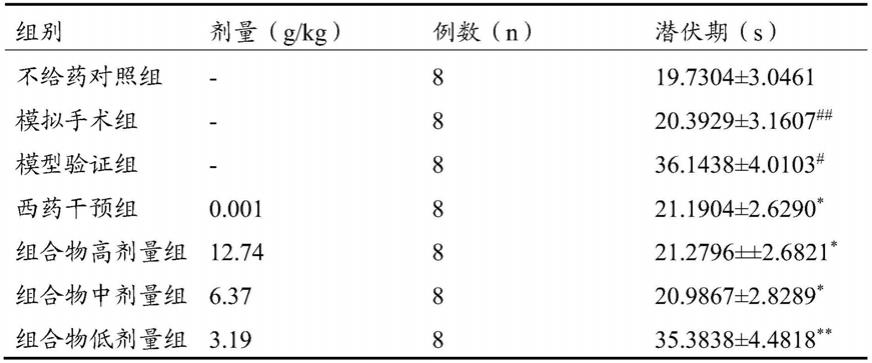
图3为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠白介素-1β含量的影响;
[0038]
注:横坐标是组别;纵坐标是白介素-1β(pg/ml);
[0039]
图4为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶含量的影响;
[0040]
注:横坐标是组别;纵坐标是胆碱乙酰化酶(平均光密度值);
[0041]
图5为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶的影响;
[0042]
注:横坐标是组别;纵坐标是乙酰胆碱代谢酶(平均光密度值);
[0043]
图6为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶基因的影响;
[0044]
注:横坐标是组别;纵坐标是胆碱乙酰化酶(基因表达量);
[0045]
图7为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶基因的影响;
[0046]
注:横坐标是组别;纵坐标是乙酰胆碱代谢酶(基因表达量);
[0047]
图8为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠心指数、肺指数的影响;
[0048]
注:横坐标是组别;纵坐标是心指数、肺指数(mg/g);
[0049]
图9为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠肾指数、肝指数的影响;
[0050]
注:横坐标是组别;纵坐标是肾指数、肝指数(mg/g);
[0051]
图10为中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠体重的影响;
[0052]
注:横坐标是组别;纵坐标是0天、14天、28天昆明小鼠体重(g)。
具体实施方式
[0053]
下面进一步描述本发明,本描述中介绍的实施案例仅是范例性的,并不对本发明的范围构成限制。本专业技术人员应该理解的是,在不偏离本发明原理和方法的情况下,对本发明技术方案的细节和形式进行部分修改或替换,但基于此修改或替换均属于本发明的保护范围内。
[0054]
实施例1一种用于防治阿尔茨海默病的中药组合物的制备
[0055]
所述的中药组合物由以下重量的各原料药组成:墨早莲12.5g、刘寄奴6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札12g。
[0056]
实施例2一种用于防治阿尔茨海默病的中药组合物的制备
[0057]
所述的中药组合物由以下重量的各原料药组成:墨早莲10g、刘寄奴8g、草豆蔻3g、冬葵子8g、香加皮6g以及八月札15g。
[0058]
实施例3一种用于防治阿尔茨海默病的中药组合物的制备
[0059]
所述的中药组合物由以下重量的各原料药组成:墨早莲15g、刘寄奴5g、草豆蔻5g、冬葵子15g、香加皮4g以及八月札10g。
[0060]
实施例4一种用于防治阿尔茨海默病的中药组合物(干粉)的制备
[0061]
(1)墨早莲12.5g、刘寄奴6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札12g,每份49g,需要购买5份,一共245g。
[0062]
(2)将墨早莲、刘寄奴、草豆蔻、冬葵子、香加皮、八月札的中药组合物245g,放入20000ml大容量圆底烧瓶(蒸馏水6000ml)中浸泡3小时,然后煎煮3小时,3层纱布过滤、5层纱布过滤、8层纱布过滤、10层纱布过滤,获得第一次滤液。
[0063]
(3)将药物残渣放入20000ml大容量圆底烧瓶(蒸馏水6000ml)中浸泡3 小时,然后煎煮3小时,3层纱布过滤、5层纱布过滤、8层纱布过滤、10层纱布过滤,获得第二次滤液。
[0064]
(4)合并第一次滤液及第二次滤液,使用干燥箱(65℃)烘烤7天,获得中药组合物干膏68.35g。
[0065]
(5)将中药组合物干膏68.35g放入粉碎机内粉碎,获得中药组合物干粉 65.24g。
[0066]
(6)分装中药组合物干粉65.24g,每袋10g,最后一袋5.24g。-80℃冰箱保存。
[0067]
实施例5本发明的中药组合物在治疗阿尔茨海默病中的用途
[0068]
1实验材料
[0069]
1.1实验动物及其仪器
[0070]
昆明小鼠56只(scxk(京)2012-0001),体重(19.6857
±
0.6887)g,清洁级,雄性,北京维通利华公司,常规饲养于黑龙江中医药大学实验动物中心。培养箱,上海五久公司,型号bc-j160s;电子天平,青岛精诚公司,型号jc-tp;脑立体定位仪,河北慧采公司,型号zh-c;水迷宫,淮北正华公司,型号mwm101;彩色分析系统,武汉千屏公司,型号hmias;离心机,上海安亭公司,型号tgl-16g,其他仪器由张英博副教授提供。
[0071]
1.2实验药品及其试剂
[0072]
墨早莲12.5g、刘寄奴6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札 12g,购买于黑龙江中医药大学第一附属医院,田明对墨早莲12.5g、刘寄奴 6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札12g进行鉴定,栗明分析墨早莲12.5g、刘寄奴6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札12g可以配伍使用。盐酸多奈哌齐片,卫材药业公司;β-淀粉样蛋白前体蛋白、白介素
‑ꢀ
1β试剂盒,南京建成公司;乙酰胆碱代谢酶、胆碱乙酰化酶,美国santa公司;其他试剂由张英博副教授提供。
[0073]
2实验方法
[0074]
2.1实验动物分组及其模型制备
[0075]
昆明小鼠56只,随机分为不给药对照组、模拟手术组、模型验证组、西药干预组、组合物低剂量组、组合物中剂量组、组合物高剂量组,每组8只。使用β-淀粉样蛋白
1-42海马注射及其猫吓鼠方法制备β-淀粉样蛋白诱导阿尔茨海默病模型,每天上午对模型验证组、西药干预组、组合物低剂量组、组合物中剂量组、组合物高剂量组进行β-淀粉样蛋白
1-42海马(80pmol/μl)注射,模拟手术组注射无菌生理盐水,不给药对照组不做干预,持续20天。每天下午对模型验证组、西药干预组、组合物低剂量组、组合物中剂量组、组合物高剂量组采用猫吓鼠方法进行干预,不给药对照组与模拟手术组不采用猫吓鼠方法,持续 20天。
[0076]
2.2中药组合物干粉
[0077]
同实施例4。
[0078]
2.3计算给药剂量及其动物给药
[0079]
按照0.0026:1计算给药剂量,中药组合物墨早莲12.5g、刘寄奴6g、草豆蔻4g、冬葵子10g、香加皮4.5g、八月札12g,合计49g,中药组合物的给药剂量是49g*0.0026*50=6.37g/kg,中药组合物中剂量为6.37g/kg,中药组合物高剂量为12.74g/kg,中药组合物低剂量为3.19g/kg。多奈哌齐的给药剂量为 0.001g/kg。不给药对照组、模拟手术组、模型验证组给予等量生理盐水进行灌胃;西药干预组给予0.001g/kg多奈哌齐进行灌胃;组合物低剂量组给予 3.19g/kg进行灌胃;组合物中剂量组给予6.37g/kg进行灌胃;组合物高剂量组
给予12.74g/kg进行灌胃。给药持续时间为28天。
[0080]
2.4评估动物学习能力
[0081]
使用水迷宫评估各组昆明小鼠的学习能力,昆明小鼠用墨汁着色头部,始终保持水迷宫内外参照物一致,在水迷宫第i、ii、iii象限进行维持4天的训练时间,每次60秒,第5天计算各组昆明小鼠的潜伏期,评估评估动物学习能力。
[0082]
2.5评估β-淀粉样蛋白前体蛋白及白介素-1β表达水平
[0083]
水迷宫评估各组昆明小鼠的学习能力后,抓取昆明小鼠,无菌下取材全脑,剥离出海马,匀浆离心,取上清液,450nm波长处使用酶标仪分析吸光度值(od),进一步评估β-淀粉样蛋白前体蛋白及白介素-1β表达水平。
[0084]
2.6评估乙酰胆碱代谢酶、胆碱乙酰化酶蛋白水平
[0085]
实验人员戴上手套,水迷宫评估各组昆明小鼠的学习能力后,抓取昆明小鼠,昆明小鼠心脏灌注生理盐水90ml后,匀速灌注4%多聚甲醛约50ml,经过常规石蜡切片处理后,按照试剂盒基本方法测定乙酰胆碱代谢酶、胆碱乙酰化酶含量。
[0086]
2.7评估乙酰胆碱代谢酶、胆碱乙酰化酶基因水平
[0087]
实验人员戴上手套,水迷宫评估各组昆明小鼠的学习能力后,抓取昆明小鼠,取材全脑及其海马,提取乙酰胆碱代谢酶、胆碱乙酰化酶mrna,反转录成cdna,设计针对乙酰胆碱代谢酶、胆碱乙酰化酶的引物,设置针对乙酰胆碱代谢酶、胆碱乙酰化酶的反应参数,包括50℃经过反应2min,95℃经过反应 10min,95℃经过反应15s,60℃经过反应1min,经理42个基本循环,使用仪器测定乙酰胆碱代谢酶、胆碱乙酰化酶基因表达水平。
[0088]
2.8评估脏器指数及体重
[0089]
水迷宫评估各组昆明小鼠的学习能力后,抓取昆明小鼠,称量各组昆明小鼠0天、14天、28天体重,断头处死,取材昆明小鼠心脏、肺脏、肾脏、肝脏,按照公式计算肝指数、肾指数、心指数、肺指数。肝指数、肾指数、心指数、肺指数计算公式:心脏、肺脏、肾脏、肝脏的脏器指数(mg/g)=心脏、肺脏、肾脏、肝脏的脏器质量(mg)/昆明小鼠体重(g)。
[0090]
2.9数据统计分析
[0091]
实验采用spss19.0软件分析本实验相关的数据(采用x
±
s表示),多组间数据比较采用单因素方差分析。
[0092]
3实验结果
[0093]
3.1中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠学习能力的影响
[0094]
实验结果表明,与不给药对照组比较,模型验证组昆明小鼠潜伏期明显延长(p<0.05),模拟手术组昆明小鼠潜伏期改变不明显(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠潜伏期明显缩短(p<0.05),组合物低剂量组昆明小鼠潜伏期改变不明显(p>0.05)。见表1。见图1。
[0095]
表1中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠学习能力的影响
[0096][0097]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0098]
3.2中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠β-淀粉样蛋白前体蛋白的影响
[0099]
实验结果表明,与不给药对照组比较,模型验证组昆明小鼠β-淀粉样蛋白前体蛋白含量明显增加(p<0.05),模拟手术组昆明小鼠β-淀粉样蛋白前体蛋白含量改变不明显(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组病昆明小鼠β-淀粉样蛋白前体蛋白含量明显降低(p< 0.05),组合物低剂量组昆明小鼠β-淀粉样蛋白前体蛋白含量改变不明显(p> 0.05)。见表2。见图2。
[0100]
表2中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠β-淀粉样蛋白前体蛋白含量的影响
[0101][0102]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0103]
3.3中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠白介素-1β的影响
[0104]
实验结果表明,与不给药对照组比较,模型验证组昆明小鼠白介素-1β含量明显增加(p<0.05),模拟手术组昆明小鼠白介素-1β含量改变不明显(p> 0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠白介素-1β含量明显降低(p<0.05),组合物低剂量组昆明小鼠白介素
‑ꢀ
1β含量改变不明显(p>0.05)。见表3。见图3。
[0105]
表3中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠白介素-1β含量的影响
[0106][0107]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0108]
3.4中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶的影响
[0109]
结果表明,与不给药对照组比较,模型验证组昆明小鼠胆碱乙酰化酶平均光密度值明显减少(p<0.05),模拟手术组昆明小鼠胆碱乙酰化酶平均光密度值改变不明显(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠胆碱乙酰化酶平均光密度值明显增加(p< 0.05),组合物低剂量组昆明小鼠胆碱乙酰化酶平均光密度值改变不明显(p> 0.05)。见表4。见图4。
[0110]
表4中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶的影响
[0111][0112]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0113]
3.5中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶的影响
[0114]
结果表明,与不给药对照组比较,模型验证组昆明小鼠乙酰胆碱代谢酶平均光密度值明显增加(p<0.05),模拟手术组昆明小鼠乙酰胆碱代谢酶平均光密度值改变不明显
(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠乙酰胆碱代谢酶平均光密度值明显减少(p< 0.05),组合物低剂量组昆明小鼠乙酰胆碱代谢酶平均光密度值改变不明显(p >0.05)。见表5。见图5。
[0115]
表5中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶的影响
[0116][0117]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0118]
3.6中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶基因的影响
[0119]
结果表明,与不给药对照组比较,模型验证组昆明小鼠胆碱乙酰化酶基因表达量明显减少(p<0.05),模拟手术组昆明小鼠胆碱乙酰化酶基因表达量改变不明显(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠胆碱乙酰化酶基因表达量明显增加(p<0.05),组合物低剂量组昆明小鼠胆碱乙酰化酶基因表达量改变不明显(p>0.05)。见表6。见图6。
[0120]
表6中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠胆碱乙酰化酶基因的影响(2-δδct
法)
[0121][0122][0123]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p
>0.05
[0124]
3.7中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶基因的影响
[0125]
结果表明,与不给药对照组比较,模型验证组昆明小鼠乙酰胆碱代谢酶基因表达量明显增加(p<0.05),模拟手术组昆明小鼠乙酰胆碱代谢酶基因表达量改变不明显(p>0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组昆明小鼠乙酰胆碱代谢酶基因表达量明显减少(p< 0.05),组合物低剂量组昆明小鼠乙酰胆碱代谢酶基因表达量改变不明显(p> 0.05)。见表7。见图7。
[0126]
表7中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠乙酰胆碱代谢酶基因的影响(2-δδct
法)
[0127][0128]
注:与不给药对照组比较:
#
p<0.05,
##
p>0.05;与模型验证组比较:
*
p< 0.05,
**
p>0.05
[0129]
3.8中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠心指数、肺指数的影响
[0130]
结果表明,与不给药对照组比较,模型验证组昆明小鼠心指数、肺指数改变不明显(p>0.05),模拟手术组昆明小鼠心指数、肺指数改变不明显(p> 0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组、组合物低剂量组昆明小鼠心指数、肺指数改变不明显(p>0.05)。见表8。见图8。
[0131]
表8中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠心指数、肺指数的影响(n=8)
[0132][0133]
注:与不给药对照组比较:
#
p>0.05;与模型验证组比较:
*
p>0.05
[0134]
3.9中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠肾指数、肝指数的影响
[0135]
结果表明,与不给药对照组比较,模型验证组昆明小鼠肾指数、肝指数改变不明显(p>0.05),模拟手术组昆明小鼠肾指数、肝指数改变不明显(p> 0.05);与模型验证组比较,西药干预组、组合物高剂量组、组合物中剂量组、组合物低剂量组昆明小鼠肾指数、肝指数改变不明显(p>0.05)。见表9。见图9。
[0136]
表9中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠肾指数、肝指数的影响(n=8)
[0137][0138]
注:与不给药对照组比较:
#
p>0.05;与模型验证组比较:
*
p>0.05
[0139]
3.10中药组合物对β-淀粉样蛋白诱导阿尔茨海默病昆明小鼠体重的影响
[0140]
结果表明,与不给药对照组0天、14天、28天比较,模型验证组0天、14 天、28天昆明小鼠体重改变不明显(p>0.05),模拟手术组0天、14天、28 天昆明小鼠体重改变不明显(p>0.05);与模型验证组0天、14天、28天昆明小鼠体重比较,西药干预组、组合物高剂量组、组合物中剂量组、组合物低剂量组0天、14天、28天昆明小鼠体重改变不明显(p>0.05)。见表10。见图 10。
[0141]
表10中药组合物对β-淀粉样蛋白诱导阿尔茨海默病清洁级昆明小鼠体重的影响 (n=8)
[0142][0143]
注:与不给药对照组比较:
#
p>0.05;与模型验证组比较:
*
p>0.05。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1