铋基金属有机框架材料在作为光控药物载体中的应用
1.本发明属于药物载体技术领域,具体涉及铋基金属有机框架材料在作为光控药物载体中的应用。
背景技术:
2.这里的陈述仅提供与本发明相关的背景技术,而不必然地构成现有技术。
3.药物治疗仍是目前临床治疗的主要方法,通常,传统的给药方法需要定期给药,药物在体内的非特异性分布会导致剂量高、清除率快、副作用大等问题。
4.现有药物载体材料主要分为无机材料(沸石、fe3o4、介孔二氧化硅和金纳米材料)和有机材料(脂质体、胶束、凝胶和囊泡),然而,这些材料存在稳定性差、释放不受控、生物相容性差等问题,限制了其广泛的应用。近年来,科学家们提出了以多孔金属-有机骨架材料(mofs)作为理想的可控药物载体的想法。目前可以用于药物控制释放的刺激主要包括化学物质(ph值、葡萄糖或特定酶的存在)、光、热、磁、超声和机械力,这些都可以用来控制生物材料的药物传递速率。每一种刺激都可以简单而准确地从外部控制,或者在内部作为药物释放的刺激。但是目前还没有可行的采用光作为刺激的可控药物载体的方案。
技术实现要素:
5.针对现有技术存在的不足,本发明的目的是提供铋基金属有机框架材料在作为光控药物载体中的应用。
6.为了实现上述目的,本发明是通过如下的技术方案来实现:
7.第一方面,本发明提供铋基金属有机框架材料在作为光控药物载体中的应用。
8.第二方面,本发明提供一种药物载体,包括所述铋基金属有机框架材料。
9.第三方面,本发明提供一种光控释放药物,包括铋基金属有机框架材料以及负载于铋基金属有机框架材料上的药物。
10.第四方面,本发明提供一种药物吸附方法,包括如下步骤:在药物溶液中加入所述铋基金属有机框架材料和/或药物载体进行吸附,吸附完成后,固液分离即可。
11.第五方面,本发明提供一种光控药物释放的装置,包括:负载有药物的铋基金属有机框架和光照装置。
12.上述本发明的以上一种或多种实施例取得的有益效果如下:
13.首次公布铋基金属有机框架材料作为光控药物载体的应用,由于药物分子与铋基金属有机框架材料中的羰基氧形成氢键,具有较高的药物负载量,另外光照可以改变其电子结构,降低铋基金属有机框架材料中羰基氧的电子云密度,进而使药物分子与铋基金属有机框架材料羰基之间的氢键断裂,从而实现光控药物释放,并且可以通过调节光照时间及光波长实现药物释放量的控制。
14.光可以以极高的空间和时间精度远程应用,此外,广泛的参数范围(波长,光强度,曝光时间和光束直径)可以调整,以调制药物释放量。
附图说明
15.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
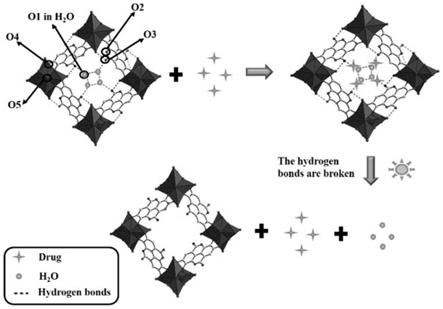
16.图1为本发明实施例1对铋基金属有机框架材料进行的密度-泛函理论计算得到的态密度图,其中a为tdos和不同原子的pdos,b为tdos和不同种类氧原子的pdos;
17.图2为本发明实施例2中对环丙沙星吸附效果验证结果图;
18.图3为本发明实施例3中对环丙沙星光控释放效果验证结果图,其中a为全光(full)、可见光(vis)以及近红外光(nir)照射下环丙沙星释放的动力学过程,b为全光(full)、可见光(vis)以及近红外光(nir)照射下环丙沙星总释放量的对比图,c为不同波长单色光照射下环丙沙星释放量的对比图;
19.图4为本发明的铋基金属有机框架对药物负载及光控释放的原理图;
20.图5为实施例4铋基金属有机框架材料对不同药物(cip:环丙沙星,nor:诺氟沙星,tet:四环素,dox:盐酸阿霉素,amo:阿莫西林)吸附能力(a)以及全光下不同药物释放量的对比图(b)。
具体实施方式
21.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
22.第一方面,本发明提供铋基金属有机框架材料在作为光控药物载体中的应用。
23.铋基金属有机框架材料为以鞣花酸作为有机配体,醋酸铋作为铋源合成的铋基mofs。具体制备方法为:具体的制备方法是:鞣花酸+醋酸铋+体积分数6%的醋酸水溶液,室温搅拌48小时得到。
24.铋基金属有机框架材料具有化学稳定性好,无毒具有生物相容性,粒径大小适合静脉给药并且具有光敏感性,药物分子可以和铋基金属有机框架材料中的羰基氧形成氢键,提高药物吸附量,另外光可以调节铋基金属有机框架材料的电子结构,降低羰基氧的电子云密度,使得羰基氧与药物分子之间的氢键断裂,因此铋基金属有机框架材料适用于作为光控药物载体的应用。
25.铋基金属有机框架材料作为光控药物载体的应用,其具有较高的药物负载量并且光照可以控制药物释放,通过改变光照时间及波长可以调节药物释放量,铋基金属有机框架材料对药物负载及光控释药的原理图如图4所示。
26.在一些实施例中,所述药物包括但不限于环丙沙星、诺氟沙星、四环素、盐酸阿霉素和阿莫西林。
27.第二方面,本发明提供一种药物载体,包括所述铋基金属有机框架材料。
28.第三方面,本发明提供一种光控释放药物,其特征在于:包括铋基金属有机框架材料以及负载于铋基金属有机框架材料上的药物;
29.优选的,所述药物包括但不限于环丙沙星、诺氟沙星、四环素、盐酸阿霉素和阿莫西林;
30.优选的,所述药物为环丙沙星、诺氟沙星或盐酸阿霉素;
31.进一步优选为,所述药物为环丙沙星或诺氟沙星。
32.第四方面,本发明提供一种药物吸附方法,包括如下步骤:在药物溶液中加入所述铋基金属有机框架材料和/或药物载体进行吸附,吸附完成后,固液分离即可。
33.在一些实施例中,所述药物包括但不限于环丙沙星,诺氟沙星,四环素,盐酸阿霉素和阿莫西林;
34.优选的,所述药物为环丙沙星、诺氟沙星或盐酸阿霉素;
35.进一步优选为,所述药物为环丙沙星或诺氟沙星。
36.在一些实施例中,药物吸附过程为在黑暗中搅拌吸附。
37.进一步的,所述药物溶液的浓度为2.5-20mg/l。
38.进一步的,铋基金属有机框架材料和/或药物载体加入药物溶液后的质量百分数为0.02%-0.07%。
39.在一些实施例中,药物溶液的温度为15-25℃。
40.第五方面,本发明提供一种光控药物释放的装置,包括:负载有药物的铋基金属有机框架和光照装置。
41.在一些实施例中,所述光照装置为全光光源或单色光光源。
42.以下通过具体的实施例对本发明的技术方案进行说明。以下各实施例中所用的原料都可通过商购获得。
43.实施例1
44.理论计算:
45.采用维也纳从头算模拟软件包(vasp)和冻结核全电子投影增强波(paw)方法进行dft计算。采用广义梯度近似(gga)的perdew-burke-ernzerhof(pbe)描述交换势和相关势。平面波基组的截止能量设置为450ev。采用原始细胞c28bi4o26,monkhorst-pack k-point采样设置为1
×1×
3。进行几何优化,直到每个离子上的力降低到以下。所得的结构被用来计算电子结构。
46.通过计算总态密度(tdos)和局部态密度(pdos)来揭示su-101的电子结构(如图1所示)。从tdos图中可以看出,计算出bi-mba的带隙为1.6ev,略小于紫外-可见漫反射分析的测试结果。从pdos图中可以发现,bi原子对边界轨道的贡献很小,而有机配体中的宽价带和导带都主要由o和c原子组成。此外,通过对不同氧原子的pdos的研究发现,o3(羰基中的氧原子)只贡献价带,而其他氧原子o2和o4不仅贡献价带,还贡献导带。而o1和o5对导带和价带的贡献较小。这意味着在光照下o3的电子云密度会降低,这是氢键断裂的原因。
47.实施例2
48.环丙沙星药物吸附:
49.铋基金属有机框架材料(su-101)(25mg)粉末加入到环丙沙星水溶液(50ml,10mg/l)中,在黑暗中搅拌,吸附过程在室温(25℃)下进行。在吸附过程中,每经过30min取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
50.本实施例中,su-101作为环丙沙星的药物载体,对10mg/l的环丙沙星溶液具有最高的吸附量,3h到达吸附解吸平衡,吸附量达71%,如图2所示。
51.实施例3
52.光照控制环丙沙星药物释放
53.1.全光下药物释放实验
54.su-101(25mg)粉末加入到环丙沙星水溶液(50ml,10mg/l)中,在黑暗中搅拌3h建立吸附解吸平衡,吸附过程在室温(25℃)下进行。300瓦氙弧灯作为光源,每经过30min取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
55.2.可见光下药物释放实验
56.su-101(25mg)粉末加入到环丙沙星水溶液(50ml,10mg/l)中,在黑暗中搅拌3h建立吸附解吸平衡,吸附过程在室温(25℃)下进行。配备420nm截止滤光片的300瓦氙弧灯作为光源,每经过30min取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
57.3.近红外光下药物释放实验
58.su-101(25mg)粉末加入到环丙沙星水溶液(50ml,10mg/l)中,在黑暗中搅拌3h建立吸附解吸平衡,吸附过程在室温(25℃)下进行。配备800nm截止滤光片的300瓦氙弧灯作为光源,每经过30min取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
59.4.单色光下药物释放实验
60.su-101(25mg)粉末加入到环丙沙星水溶液(50ml,10mg/l)中,在黑暗中搅拌3h建立吸附解吸平衡,吸附过程在室温(25℃)下进行。使用5w单色器(可产生365nm、385nm、420nm、450nm、485nm、520nm、595nm和630nm的单色光)作为光源,每经过30min取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
61.本实施例中,通过实验得知,全光条件下环丙沙星的释放量最高,达95.56%,可见光次之,释放量为36.36%,在近红外光下几乎没有环丙沙星被释放出来,进一步利用不同波长的单色光进行药物释放实验,发现不同波长的光对药物释放量的影响与su-101的光吸收能力相一致(如图3中c所示)。
62.实施例4
63.五种药物的吸附实验:
64.五份铋基金属有机框架材料(su-101)(25mg)粉末分别加入到环丙沙星、诺氟沙星、四环素、盐酸阿霉素和阿莫西林的水溶液(50ml,15mg/l)中,在黑暗中搅拌,吸附过程在室温(28℃)下进行,搅拌吸附3h后,每种药物水溶液均取出1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
65.五种药物的全光药物释放实验:
66.五份铋基金属有机框架材料(su-101)(25mg)粉末分别加入到环丙沙星、诺氟沙星、四环素、盐酸阿霉素和阿莫西林的水溶液(50ml,9mg/l)中,在黑暗中搅拌3h建立吸附解吸平衡,吸附过程在室温(22℃)下进行。
67.吸附完成后,采用300瓦氙弧灯作为光源,每经过30min取出各药物溶液1.5ml悬浮液。离心后用紫外-可见分光光度计(uv-2550,shimadzu)检测溶液在270nm处的吸光度变化。
68.图5为铋基金属有机框架材料对不同药物(cip:环丙沙星,nor:诺氟沙星,tet:四环素,dox:盐酸阿霉素,amo:阿莫西林)吸附能力(a)以及全光下不同药物释放量的对比图(b)。由图5可知,铋基金属有机框架材料对环丙沙星的吸附率可达85.8%,全光药物释放率达95.56%;对诺氟沙星的吸附率可达91%,全光药物释放率达95.45%;对阿莫西林的吸附率最高为27.9%,全光药物释放率达100%;对四环素的吸附率最高为23.2%,全光药物释放率达100%;对盐酸阿霉素的吸附率最高为91%,全光药物释放率最高为78%。
69.所以,该铋基金属有机框架材料对环丙沙星和诺氟沙星的吸附及光控释放率都较好,对盐酸阿霉素的光控释放率稍差。
70.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1