一种新型抗肿瘤转移多肽及其应用
1.本发明属药物领域,具体涉及一种抗肿瘤转移的多肽。
背景技术:
2.肿瘤的转移和侵袭一般是指肿瘤细胞从原发部位扩散至正常的局部组织,或者转移到附近的淋巴结或器官,在内皮细胞的适宜部位进行驻留,诱导血管生成,最终形成转移灶。与癌症相关的死因中,肿瘤转移是其中极为重要的一种。在肿瘤治疗过程中,肿瘤一旦发生转移,相对应的治疗方案就要进行改变,用药的种类和剂量就要大大增加,而使病人饱受折磨,最终的治疗结果可能也不尽如人意。
3.细胞内部存在一类转移抑制因子,专门负责调节肿瘤转移进程,在转移灶中的表达量远低于原发肿瘤,被认为是治疗肿瘤转移的潜在靶点。nm23(non-metastatic clone23)基因是1988年由美国国立癌症研究所的steeg等在小鼠黑色素瘤k-1735的亚细胞克隆株中用消减杂交法分离出来的一种与恶性肿瘤转移有关的基因,它在低转移细胞株中的表达量是高转移株的10倍。nm23-h1是第一个被发现的抑制肿瘤转移的基因,它一直被认为是抑制肿瘤转移的有力靶点。在多种恶性肿瘤中过表达nm23-h1可以降低肿瘤细胞的侵袭能力;而敲除nm23-h1后,明显增加其转移能力。在胃癌、卵巢癌、乳腺癌等众多肿瘤患者中统计nm23-h1的表达水平,发现侵袭性与表达水平呈负相关。nm23-h1具有多种生物活性,如核苷二磷酸激酶(ndpk)活性、组氨酸激酶活性(hpk)和3
’‑5’
核酸外切酶活性,目前大多数研究证明组氨酸蛋白激酶活性、3'-5'核酸外切酶活性和核苷二磷酸激酶(ndpk)活性与转移抑制相关。nm23蛋白的多种功能让它在细胞周期和迁移、凋亡及吞噬、转录调控、dna修复和维持基因组稳定方面都发挥重要作用。nm23-h1的抗肿瘤转移功能已经得到了证实,而且相关的研究一直在进行当中[yul,wangx,zhangw,khane,lin c,guo c.the multiple regulation ofmetastasis suppressornm23-h1 in cancer.life sci.2021mar 1;268:118995.]。目前关于nm23-h1相关的药物开发途径主要有两种,基因治疗法和药物提高nm23-h1的表达水平。已报道两种nm23-h1的基因治疗法包括腺病毒(aav)和非病毒纳米粒子介导的转染。前一种方法利用转染aav-nm23-h1的卵巢腺癌细胞系构建小鼠原位移植瘤模型;纳米粒子递送法则是将带正电的氧化铁纳米粒子ionp-pl与带负电的dna组成复合物通过静脉注射被分布到小鼠的大脑、肺、脾脏等多个器官。两种方法都使nm23-h1的表达量显著升高,肿瘤细胞转移明显受抑制,小鼠的生存期大大延长[li j,zhou j,chen g,wang h,wang s,xing h,gao q,lu y,he y,ma d.inhibition ofovarian cancer metastasis by adeno-associated virus-mediated gene transfer ofnm23h1 in an orthotopic implantation model.cancer gene ther.2006mar;13(3):266-72.]。
[0004]
目前需要开发新的治疗策略来预防、中断或缩小肿瘤转移灶的形成。因此上调nm23-h1表达水平也是个有效的策略。用醋酸甲羟孕酮(mpa)激活糖皮质激素受体促进nm23-h1在三阴性乳腺癌细胞中表达已有报道。mpa与糖皮质激素受体和糖皮质激素反应元件结合,改变了核小体结构并促进转录因子与其结合位点的结合。mpa治疗的副作用包括体
重增加和骨密度降低。基于这些结果,mpa的剂量化疗研究已进入ii期临床试验。硫黄酮、阿曼托黄素及天然产物多糖lmpab还能增加移植b16f-10黑色素瘤细胞小鼠的存活率,并在分子水平提高nm23-h1表达量。体外数据也确定了抗炎类药物吲哚美辛和乙酰水杨酸,抗氧化剂l-肌肽和γ-亚麻酸均可以上调nm23-h1。但这些化合物都是非特异性的,可能会产生其他的作用机制,其风险和收益共同决定治疗效果[ouatas t,halverson d,steeg ps.dexamethasone and medroxyprogesterone acetate elevate nm23-h1 metastasis suppressor gene expression in metastatic human breast carcinoma cells:new uses for old compounds.clin cancerres.2003sep 1;9(10pt 1):3763-72.]。这些提高nm23-h1表达量的方法技术不是较为成熟或者治疗效果不稳定,例如用药物提高nm23-h1表达量后,nm23-h1依然存在降解的问题。
[0005]
一些研究表明nm23-h1以sumo化修饰的方式进行降解,抑制其降解过程可以提高其在细胞中的蛋白含量[paul c,khera l,kaul r.hepatitis c virus core protein interacts with cellular metastasis suppressor nm23-h1 and promotes cell migration and invasion.arch virol.2019may;164(5):1271-1285.]。小泛素样相关修饰物(small ubiquitin-relatedmodifier,sumo)是一种广泛存在的蛋白质翻译后修饰形式,涉及复杂的信号通路调节过程,是细胞对应激反应的重要调节机制。sumo化修饰是一个动态可逆的过程,sumo分子通过在e1活化酶、e2结合酶和e3连接酶的参与下共价结合到底物蛋白赖氨酸残基上,调控底物蛋白的结构与功能,而senps则通过特异性地对底物靶蛋白去sumo化修饰,与sumo分子共同调节底物蛋白的sumo化状态,进而调控细胞功能。我们研究首次发现hsp90aa1蛋白与nm23-h蛋白存在相互作用,hsp90aa1蛋白可以通过抑制nm23-h1蛋白的sumo化修饰从而抑制nm23-h1蛋白的降解,在肿瘤细胞中过表达hsp90aa1蛋白可以抑制肿瘤细胞转移。hsp90aa1基因编码人类应激诱导型90kda热休克蛋α(hsp90a)。由组成型表达的旁系同源物hsp90b补充,该同源物具有超过85%的氨基酸序列同一性,当细胞经历蛋白毒性应激时,hsp90a表达就开始了。hsp90aa1通常以同源二聚体的形式存在于细胞质中行使分子伴侣的职能,此前发现hsp90aa1在正常细胞中表达含量较低,在某些肿瘤中表达水平会特异性增加,因此认为hsp90aa1与肿瘤的发生发展联系紧密,并且其与nm23-h1一同参与细胞内多种信号转导途径。此外,hsp90蛋白家族还包括葡萄糖调节蛋白94(glucoseregulatedprotein 94,grp94)和肿瘤坏死因子受体相关蛋白-1(tumor necrosis factor receptor-associatedprotein-1,trap-1),二者分别存在于内质网和线粒体中,发挥的功能比较特异。这种现象为我们提供了一种治疗肿瘤转移的新思路,我们可以通过抑制nm23-h1蛋白的降解来达到抑制肿瘤转移的效果。
技术实现要素:
[0006]
发明目的
[0007]
本发明的创新点和目的在于提供一种抑制抗肿瘤转移蛋白nm23-h1降解的多肽,达到抗肿瘤转移的目的。
[0008]
技术方案
[0009]
hsp90aa1在制备nm23-h1蛋白抑制剂的应用。
[0010]
hsp90aa1在制备肿瘤转移药物中的应用。
[0011]
一种抗肿瘤转移的多肽,其特征在于:其氨基酸序列为seq id no.4、seq id no.5、seq id no.6,seq id no.7、seq id no.8或seq id no.9。
[0012]
所述的多肽在制备nm23-h1蛋白抑制剂中的应用。
[0013]
所述权利要求4在制备抗肿瘤转移药物中的应用,
[0014]
所述的应用,其特征在于:所述肿瘤为转移性强且nm23-h1蛋白表达量低的肿瘤,包括三阴性乳腺癌、肝癌、胃癌、非小细胞肺癌、血液系统恶性肿瘤、鼻咽癌、直肠癌、前列腺癌、食道癌、胰腺癌、甲状腺癌以及黑色素瘤。
[0015]
具体来说:
[0016]
一种抗肿瘤转移的多肽,其特征在于:其氨基酸序列为t21:seq id no.4,t22:seq id no.5,t23:seq id no.6。
[0017]
进一步选择:
[0018]
一种nm23-h1蛋白的降解抑制多肽与穿膜肽形成融合多肽,其特征在于:其氨基酸序列为opt21:seq id no.7,opt22:seq id no.8,opt23:seq id no.9。
[0019]
其中所述穿膜肽的氨基酸序列为seq id no.10。
[0020]
所述的抗肿瘤转移的多肽在制备治疗抑制肿瘤转移药物种的应用。
[0021]
所述为转移性强且nm23-h1蛋白表达量低的肿瘤包括三阴性乳腺癌、肝癌、胃癌、非小细胞肺癌、血液系统恶性肿瘤、鼻咽癌、直肠癌、前列腺癌、食道癌、胰腺癌、甲状腺癌以及黑色素瘤等。
[0022]
基因序列为
[0023]
t21:gagatgttgcaacaaagcaaaattttgaaagttatcaggaagaatttggtcaaaaaatgcttagaactctttactgaactggcggaagataaagagaactacaagaaattctatgagcagttctctaaaaacataaagcttggaatacacgaagactctcaaaatcggaagaagctttcagagctgttaaggtactacacatctgcctctggtgatgagatggtttctctcaaggactac
[0024]
t22:gagatgttgcaacaaagcaaaattttgaaagttatcaggaagaatttggtcaaaaaatgcttagaactctttactgaactggcggaagataaagagaactacaag
[0025]
t23:aaattctatgagcagttctctaaaaacataaagcttggaatacacgaagactctcaaaatcggaagaagctttcagagctgttaaggtactacacatctgcctctggtgatgagatggtttctctcaaggactac
[0026]
多肽序列为
[0027]
t21:emlqqskilkvirknlvkkclelftelaedkenyk kfyeqfskniklgihedsqnrkklsellryytsasgdemvslkdy
[0028]
t22:emlqqskilkvirknlvkkclelftelaedkenyk
[0029]
t23:kfyeqfskniklgihedsqnrkklsellryytsasgdemvslkdy
[0030]
穿膜肽序列为rqikiwfqnrrmkwkkc;
[0031]
opt21:rqikiwfqnrrmkwkkcemlqqskilkvirknlvkkclelftelaedkenykkfyeqfskniklgihedsqnrkklsellryytsasgdemvslkdy
[0032]
opt22:rqikiwfqnrrmkwkkcemlqqskilkvirknlvkkclelftelaedkenyk。
[0033]
opt23:rqikiwfqnrrmkwkkckfyeqfskniklgihedsqnrkklsellryytsasgdemvslkdy
[0034]
有益效果
[0035]
目前关于抑制nm23-h1蛋白降解的研究还相对较少,绝大部分都是在研究提高
nm23-h1蛋白表达的药物。ml-792是一种特异性的小泛素样修饰物(sumo)活化酶(sae)抑制剂。ml-792有效选择性抑制sae/sumo1和sae/sumo2,从而ml-792可以显著抑制nm23-h1蛋白的降解。上述说明抗肿瘤转移蛋白nm23-h1蛋白通过sumo化修饰的方式进行降解,所以获得启示:通过抑制其sumo化的过程就可以抑制其降解。
[0036]
而本发明是是全新的设计理念:
[0037]
本发明首次发现hsp90aa1蛋白与nm23-h1蛋白存在相互作用,hsp90aa1蛋白可以通过与nm23-h1蛋白上的sumo化位点相结合,从而抑制nm23-h1蛋白的sumo化。在转移性强的肿瘤细胞中过表达hsp90aa1蛋白可以抑制nm23-h1蛋白的降解,从而抑制肿瘤细胞转移。然而hsp90aa1蛋白的表达量并非越高越好,其在肿瘤细胞中的表达量高到一定程度之后反而会有促进瘤生长的作用,即hsp90aa1蛋白只能在有限含量范围发挥作用。考虑到安全性,hsp90aa1蛋白直接作为nm23-h1蛋白抑制剂在临床上并不可行。
[0038]
故本发明根据hsp90aa1蛋白与nm23-h1蛋白的分子对接结果和hsp90aa1的蛋白结构进一步优化后设计了与sumo化酶竞争性结合在nm23-h1蛋白的赖氨酸位点的hsp90aa1蛋白截短体t22和t23,从而抑制其降解,达到抑制肿瘤转移的效果。但上述多肽的治疗效果不好,原因在于只能部分进入细胞内发挥作用。
[0039]
为此发明人进一步研究,通过化学方法合成了opt22和opt23多肽,该多肽为穿膜肽和截短体(t22或t23)的融合多肽,其通过穿膜肽的作用,使融合蛋白更容易进入细胞内,通过与细胞内的nm23-h1蛋白相互作用,抑制nm23-h1蛋白进行sumo化修饰,进而抗肿瘤转移。
[0040]
具体来说:融合多肽opt22和opt23增加了t22和t23进入细胞的能力,从而达到较好的抑制肿瘤转移的效果。本发明以opt22和opt23为例进行细胞迁移实验,细胞侵袭实验和抑制细胞内nm23-h1蛋白降解实验,发现opt22和opt23具有抑制nm23-h1蛋白降解和抑制肿瘤转移以及侵袭的功能。
附图说明
[0041]
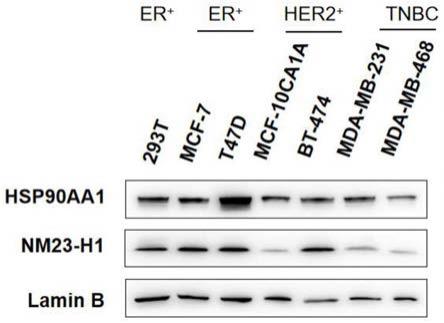
图1为293t、mcf-7、t47d、mcf-10ca1a、bt474、mda-mb-231和mda-mb-468细胞的hsp90aa1蛋白与nm23-h1蛋白表达量情况;可以发现在不同细胞系中nm23-h1蛋白的表达量与hsp90aa1蛋白表达量存在一定的相关性。
[0042]
图2为过表达hsp90aa1的293t和mcf-10ca1a的细胞系的nm23-h1蛋白表达量的western blot检测;结果表明过表达hsp90aa1会提高nm23-h1蛋白的表达量。
[0043]
图3hsp90aa1蛋白与nm23-h1蛋白的预测结合位点。
[0044]
图4多肽的结构域图示。
[0045]
图5为检测293t细胞中nm23-h1的降解情况;其中a为在chx的作用下293t细胞中nm23-h1的降解结果;b为在ml-792的作用下293t细胞中的nm23-h1降解被显著抑制。说明nm23-h1是通过sumo化修饰进行降解。
[0046]
图6为western blot检测mcf-10ca1a control、mcf-10ca1ahsp90aa1、mcf-10ca1ahsp90aa1 t21、mcf-10ca1a hsp90aa1 t22和mcf-10ca1a hsp90aa1 t23过表达稳转细胞系中nm23-h1蛋白表达水平。
[0047]
图7多肽作用于肿瘤细胞对nm23-h1表达水平影响的结果;其中a为在只加chx不加
opt22的作用下mcf-10ca1a细胞中nm23-h1蛋白的表达水平;b为在opt22不同时间作用下mcf-10ca1a细胞中nm23-h1蛋白的表达水平。c为在只加chx不加opt22的作用下mda-mb-231细胞中nm23-h1蛋白的表达水平;d为在opt22不同时间作用下mda-mb-231细胞中nm23-h1蛋白的表达水平。表明多肽对于不同肿瘤细胞都可以抑制其nm23-h1降解。
[0048]
图8为多肽作用于肿瘤细胞的划痕实验结果,可以验证多肽对于肿瘤细胞迁移的抑制效果;其中a为在opt22和opt23作用下mcf-10ca1a细胞的划痕创伤愈合结果;b为在opt22和opt23作用下mda-mb-231细胞的划痕创伤愈合结果;c为在opt22和opt23作用下4t1细胞的划痕创伤愈合结果。结果表明多肽对于肿瘤细胞的划痕创伤愈合结果有明显抑制作用。
[0049]
图9为多肽作用于肿瘤细胞的transwell实验结果,可以验证多肽对于肿瘤细胞侵袭的抑制效果;其中a为在opt22和opt23作用下mcf-10ca1a细胞的transwell实验结果;b为在opt22和opt23作用下mda-mb-231细胞的transwell实验结果;c为在opt22和opt23作用下4t1细胞的transwell实验结果。结果表明多肽对于肿瘤细胞的侵袭活性有明显抑制作用。
具体实施方式
[0050]
本发明涉及的opt22,opt23由金斯瑞合成。
[0051]
实施例1293t、mcf-7、t47d、mcf-10ca1a、bt474、mda-mb-231和mda-mb-468细胞的hsp90aa1蛋白与nm23-h1蛋白表达量验证,可以检测肿瘤细胞自然状态下hsp90aa1蛋白与nm23-h1蛋白表达量的相应关系。
[0052]
前一天将培养好的不同肿瘤细胞,用完全培养基重悬细胞计数,将细胞浓度调整为8
×
105个/ml,将细胞悬液接种到6孔板中,每孔100μl,并于37℃,5%co2培养箱中培养过夜。次日用预冷的pbs清洗细胞,弃pbs,每1
×
106细胞加250ul ripa,冰上3min-5min后用细胞刮勺刮下细胞,用1.5mlep管收集,冰上30min,12000rpm离心5min,收集上清即为总蛋白液,按照bca法测定蛋白含量。加入5
×
蛋白loadingbuffer,混匀后在金属浴上100℃煮沸10min,保存在-20℃备用。
[0053]
根据待测蛋白分子量大小配制合适的凝胶浓度,本实验采用的浓度为12.5%的分离胶,将胶板取出安装到垂直电泳槽,在两块板中间加满电泳缓冲液,然后将尺梳拔出。根据浓度,按照40μg蛋白量计算各组蛋白的上样体积进行加样,在合适泳道加入3μl蛋白marker。加入电泳缓冲液没过电泳槽电极,进行恒压电泳。先使用90v恒压在浓缩胶中电泳30min,接着调整电压至100v,直到蛋白marker跑出清晰的条带,溴酚蓝跑至接近泳道底端,约60min。在4℃预冷半干转缓冲液(turbo缓冲液),电泳结束后将合适大小的pvdf膜浸泡在无水甲醇中进行活化,接着将滤纸片浸泡在turbo缓冲液中,按照滤纸-pdvf膜-蛋白胶-滤纸的顺序由下而上依次铺好,每一层都要保证中间没有气泡,将半干转转膜仪装好,恒压20v进行转膜。转膜时间根据蛋白大小不同而调整。将pdvf膜取出并剪去多余的膜,并在膜的一侧做上标记。封闭液使用1
×
tbst溶液配制5%脱脂奶粉,将膜放到抗体孵育盒中,加入封闭液室温摇床振摇1小时。一抗用一抗稀释液按适宜比例稀释。倒去封闭液,用1
×
tbst溶液洗膜三次,每次10min。加入稀释过的一抗进行孵育,4℃摇床孵育过夜或室温2h。将一抗溶液倒掉,先用1
×
tbst溶液清洗膜三次,每次10min。二抗用1
×
tbst按比例稀释,室温摇床振摇2小时。二抗孵育结束后吸出,并用1
×
tbst溶液洗三次,每次10min,在膜上均匀滴加新
鲜配置的ecl曝光液,用凝胶成像仪对pvdf膜进行成像,拍照分析。
[0054]
实验结果见图1,不同肿瘤细胞中的hsp90aa1蛋白的表达量与nm23-h1蛋白表达量存在一定的关系。
[0055]
实施例2过表达hsp90aa1的293t和mcf-10ca1a细胞系的nm23-h1蛋白表达量验证,可以检测在细胞中过表达hsp90aa1对于nm23-h1蛋白表达量的影响。
[0056]
引物设计:人工合成
[0057]
hsp90aa1-fp:aagattctagagctagcgaattcatgcctgaggaaacccagaccca
[0058]
hsp90aa1-rp:ccgcggatccttattagatatcttaagcgtaatctggaacatcgtatgggtagtcgacgtctacttcttccatgcgtga
[0059]
重组质粒构建:pcdh载体对hsp90aa1进行过表达,其自带cmv启动子并且能够表达gfp绿色荧光蛋白便于后续稳转细胞系的筛选和鉴定。选用ecor i和ecor
ⅴ
两种酶切位点对载体进行双酶切,以hek-293t细胞cdna为模板,用pcr扩增出目的片段hsp90aa1并带有ha标签序列,采用同源重组的方法将载体和目的片段连接,随后挑选测序正确的单克隆细菌提取质粒用于转染。
[0060]
重组病毒的包装;取对数生长期的293t细胞,按1.5
×
106个/板细胞数接种在直径10cm细胞培养板内,加入10ml不含抗生素的dmem培养基,于37℃、5%co2培养箱内培养。次日当细胞汇合度为70%-80%时,利用脂质体lipofectaminetm2000将plk-cmv-hs p90aa1质粒、包装质粒pspax2、包膜质粒pmd2g、包膜质粒prtr按照5:3:1:1的比例共转染293t细胞。于转染14h更换新鲜的含抗生素的培养基。转48h后利用荧光显微镜观察绿色荧光蛋白(green fluorescent protein,gfp)的表达情况。转染48h和72h后分别收集细胞培养上清,将两次收集的上清混合后加入polybrene至终浓度为6μg/ml,然后经过0.45μm滤器过滤后分装,于-80℃保存备用。将所获得的慢病毒命名为cmv-hsp90aa1(表达hsp90aa1的重组慢病毒)
[0061]
将293t细胞和mcf-10ca1a细胞以0.5
×
106/孔接种于6孔板中,用完全培养基培养。当细胞汇合度达70%-80%时去除培养基,更换为不含双抗的dmem完全培养基。将(2)所述方法得到的慢病毒经4℃,7000rpm离心30分钟后,收集病毒cmv-hsp90aa1接种于6孔板中,用以感染293t和mcf-10ca1a细胞,24h后吸弃上清,加入新鲜的完全培养基。于48h后经荧光显微镜观察gfp的表达情况;感染72h后,以汇合度达75%的293t和mcf-10ca1a细胞(约10
6-107)为对象,进行传代冻存。
[0062]
将构建好的细胞系进行培养,用例1中所述的western blot实验方法检测细胞系中nm23-h1蛋白表达量。
[0063]
实验结果见附图2,在293t细胞和mcf-10ca1a细胞中过表达hsp90aa1蛋白,可以发现nm23-h1蛋白表达量比未过表达hsp90aa1蛋白高,说明hsp90aa1蛋白与nm23-h1蛋白存在一定的对应关系。
[0064]
实施例3sumo化抑制剂ml-792抑制细胞中nme1降解,检测nm23-h1蛋白的降解方式。
[0065]
前一天将培养好的293t,用完全培养基重悬细胞计数,将细胞浓度调整为2.5
×
105个/ml,将细胞悬液接种到12孔板中,每孔100μl,并于37℃,5%co2培养箱中培养过夜。将ml-792和chx用完全培养基稀释到各个预定浓度。待细胞完全贴壁后,将ml-792和chx分别
加入12孔板中。ml-792的终浓度为0.5μm,chx的终浓度为10μg/ml。阴性对照组为只加chx的完全培养基,在37℃,5%co2培养箱中培养。
[0066]
分别在0h,1h,2h,4h,8h和12h提取细胞蛋白质。用预冷的pbs清洗细胞,吸弃pbs,每1
×
106细胞加250ul ripa,冰上3min-5min后用细胞刮勺刮下细胞,用1.5ml ep管收集,冰上30min,12000rpm离心5min,收集上清即为总蛋白液,按照bca法测定蛋白含量。加入5
×
蛋白loadingbuffer,混匀后在金属浴上100℃煮沸10min,保存在-20℃备用。
[0067]
根据实施例1中所述的westernblot实验方法检测293t细胞中nm23-h1蛋白表达量。
[0068]
实验结果见附图5a-b,环己酰亚胺(chx),别称放线菌酮,一种化学物质,是一种干扰蛋白质生物合成过程的细菌毒素,一些细胞也用它构建蛋白质以执行不同功能。当chx作用于细胞后,可以抑制细胞中新生蛋白的形成,此时细胞内原有蛋白会因发生翻译后修饰降解从而含量减少,所以chx可以与相应抑制剂合用检测蛋白的翻译后修饰方式。ml-792如前所述具有抑制蛋白进行sumo化修饰的作用,当给与293t细胞ml-792后发现nm23-h1蛋白的降解被显著抑制,说明nm23-h1蛋白存在sumo化修饰。
[0069]
实施例4构建过表达mcf-10ca1a-hsp90aa1、mcf-10ca1a-hsp90aa1-t21、mcf-10ca1a-hsp90aa1-t22和mcf-10ca1a-hsp90aa1-t23的细胞系,检测优化后的截短体对于nm23-h1蛋白降解的影响。
[0070]
引物设计:人工合成
[0071]
hsp90aa1-fp:aagattctagagctagcgaattcatgcctgaggaaacccagaccca
[0072]
hsp90aa1-rp:ccgcggatccttattagatatcttaagcgtaatctggaacatcgtatgggtagtcgacgtctacttcttccatgcgtga
[0073]
hsp90aa1-t21 fp:aagattctagagctagcgaattcatgactgaactggcggaagataa
[0074]
hsp90aa1-t21 rp:ccgcggatccttattagatatcttaaaccatctcatcaccagaggca
[0075]
hsp90aa1-t22 fp:aattcatgactgaactggcggaagataaagagaactacaagtaagat
[0076]
hsp90aa1-t22-rp:atcttacttgtagttctctttatcttccgccagttcagtcatg
[0077]
hsp90aa1-t23-fp:aagattctagagctagcgaattcatgaaattctatgagcagttctc
[0078]
hsp90aa1-t23-rp:ccgcggatccttattagatatcttaaaccatctcatcaccagaggca
[0079]
按照例2中所述的方法构建细胞系,进行western blot检测。
[0080]
实验结果见图6,在mcf-10ca1a中过表达hsp90aa1可以提高nm23-h1蛋白表达量,而在mcf-10ca1a中过表达hsp90aa1蛋白的截短体hsp90aa1-t21、hsp90aa1-t22和hsp90aa1-t23明显提高nm23-h1蛋白表达量,说明hsp90aa1蛋白的截短体对提高nm23-h1蛋白表达量的效果更加明显。
[0081]
实施例5opt22和opt23抑制多种肿瘤细胞中nm23-h1的降解,
[0082]
采用westernblot实验检测opt22和opt23对肿瘤细胞中nm23-h1的降解的抑制作用,包括乳腺癌细胞mcf-10ca1a、乳腺癌细胞mda-mb-231。
[0083]
前一天将培养好的肿瘤细胞,用胰酶消化收集,用完全培养基重悬细胞计数,将细胞浓度调整为2.5
×
106个/ml,将细胞悬液接种到12孔板中,每孔100μl,并于37℃,5%co2培养箱中培养过夜。将多肽和chx用完全培养基稀释到各个预定浓度。待细胞完全贴壁后,将opt22和chx分别加入6孔板中。opt22和opt23的终浓度为125nm,chx的终浓度为10μg/ml。阴
性对照组为只加chx的完全培养基,在37℃,5%co2培养箱中培养。
[0084]
分别在0h,1h,2h,4h,8h和12h提取细胞蛋白质。按照实施例1中所述方法进行westernblot检测。
[0085]
实验结果见附图7,检测多肽对于nm23-h1降解的抑制能力,如图可以发现多肽可以明显的抑制不同肿瘤细胞中nm23-h1蛋白的降解。
[0086]
实施例6细胞划痕实验检测多肽抑制多种肿瘤细胞的迁移能力
[0087]
(1)6孔板中加入2mldmem培养基,以3
×
106个/孔细胞数将肿瘤细胞接种于6孔板中,37℃5%co2培养。
[0088]
(2)次日当细胞长至80%汇合度时,去除原培养基,加入dmem不完全培养基和opt22和opt23,opt22和opt23的终浓度为125nm。用200ul枪头在6孔板底部平行划线,每组3个重复孔。分别在0h、24h和48h在荧光显微镜下观察划痕愈合程度。
[0089]
其中n
test
为测试组的划痕愈合程度、n
control
为空白对照组的划痕愈合程度。
[0090]
数据统计:
[0091]
试验独立重复3次,试验得到的结果计算mean
±
sd,并进行统计t-test检验,p《0.05为显著性差异,p《0.01为极显著性差异。实验结果见表1和附图8。
[0092]
表1细胞划痕实验法检测opt22和opt23抑制不同肿瘤细胞迁移的结果
[0093][0094]
细胞划痕实验可以检测肿瘤细胞的迁移能力,当多肽作用于肿瘤细胞可以检测多肽对于肿瘤细胞迁移的抑制能力。由表1可以看出当多肽作用于肿瘤细胞后,其划痕愈合程度降低,说明opt22和opt23一定程度上可以抑制肿瘤细胞迁移。
[0095]
实施例7三维transwell法检测opt22和opt23抑制肿瘤细胞侵袭的活性
[0096]
肿瘤细胞用含5%胎牛血清的dmem培养基,在37℃、5%co2的培养箱中培养至90%以上的汇合度时,采用transwell法检测多肽抑制肿瘤细胞侵袭的活性,具体操作如下:
[0097]
(1)用10mg/mlmatrigel用dmem培养基以1:4稀释,涂布于transwell小室膜上,室温风干;
[0098]
(2)将培养到对数生长期的肿瘤细胞用pbs洗涤两次再用胰酶消化,收集,用含5%胎牛血清的dmem培养基重悬,在显微镜下计数,将细胞浓度调整到1
×
105个/ml;
[0099]
(3)配制各组的试验用液,用含5%胎牛血清的dmem培养基稀释到100μl;
[0100]
分组如下:
[0101]
空白对照组:为不含药物的细胞培养基;
[0102]
opt22和opt23组:配制125nm;
[0103]
(4)将细胞接种到transwell小室中,每孔100μl,并且将各组试验用液加入小室中。24孔板中加入0.5ml含5%胎牛血清的dmem培养基刺激细胞迁移,于5%co2,37℃孵育分别孵育12h、24h、36h;
[0104]
(5)弃去孔中培养液,用4%多聚甲醛常温固定15min,0.1%结晶紫常温染色20min,用pbs清洗小室3遍,用棉签轻轻擦掉上层未迁移细胞,显微镜下观察并选择四个视野拍照计数,按照公式计算迁移抑制率(migration inhibition,mi):
[0105]
其中n
test
为测试组的细胞迁移数,n
control
为空白对照组的细胞迁移数。
[0106]
数据统计:
[0107]
试验独立重复3次,试验得到的结果计算mean
±
sd,并进行统计t-test检验,p《0.05为显著性差异,p《0.01为极显著性差异。实验结果见表2和附图9。
[0108]
表2transwell法检测opt22和opt23抑制肿瘤细胞侵袭的结果
[0109][0110][0111]
transwell实验实验主要应用于各种细胞因子对恶性肿瘤细胞侵袭和转移的影响及一些抑制血管生成的研究。本实验可以检验当多肽作用于肿瘤细胞对于肿瘤细胞侵袭的抑制能力。由表2可以看出当多肽作用于肿瘤细胞后,其迁移抑制率明显提高,说明opt22和opt23一定程度上可以抑制肿瘤细胞侵袭。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1