一种治疗肿瘤的靶点及其应用、肿瘤治疗制剂
1.本发明属于抗肿瘤药物研发与治疗技术领域,具体涉及一种位于cd38蛋白上的抗肿瘤靶点及其应用和肿瘤治疗制剂。
背景技术:
2.cd38是一个定位于膜上的单链跨膜糖蛋白、多功能的膜分子。cd38是t细胞活化的标志分子;可以作为一个受体分子,与其配体或单克隆抗体结合产生多种生物学效应;具有粘附分子特性,在淋巴细胞再循环及淋巴细胞归巢中发挥一定的作用;介导跨膜信号传递。起初cd38被认为是骨髓瘤、慢性淋巴细胞白血病(cll)诊断和预后判断的一个可靠的生物标志分子,fda已批准两种cd38抗体(daratumumab和isatuximab)用于治疗多发性骨髓瘤。最近,近年来,随着研究的深入,发现cd38在实体瘤的发生、发展中也扮演着重要角色,如鼻咽癌、肺癌、宫颈癌、脑胶质瘤等多种实体瘤中都存在异常表达。研究者发现了一种新机制,在对pd-l1抗体有反应的荷瘤小鼠,肿瘤细胞cd38表达上调,导致小鼠产生免疫耐受和pd-l1的抵抗。因此pd-l1联合cd38抗体治疗能否在临床前或临床环境中克服pd-l1耐药性还需要进一步探讨。虽有研究开始联合pd-l1和cd38抗体治疗的肺癌患者的临床结果,但是结果并不令人满意。因此,cd38在实体瘤中作用的内在机制值得进一步探索。迄今为止,尚无报道关于cd38在实体瘤中作用的内在机制,需要进一步探索cd38在实体瘤作为抗肿瘤治疗靶点。
3.prmt5属于蛋白质精氨酸甲基化转移酶家族的一种,该家族共有9个。蛋白质精氨酸甲基转移酶(prmt)可以催化甲基从辅因子s-腺苷-1-蛋氨酸(adomet)移至到多种底物,包括组蛋白和转录因子。prmt5作为ii型中最主要酶不仅可以让组蛋白对称地二甲基化还可以对称地二甲基化非组蛋白,研究发现在淋巴瘤细胞中,prmt5是bcl6的新型相互作用蛋白分子,用prmt5抑制剂处理后,bcl6的许多靶基因被抑制,prmt5和bcl6抑制剂的组合是一种潜在的肿瘤治疗策略。因此prmt5也可作为一个潜在的抗肿瘤治疗靶点。
4.cd38和prmt5均是潜在的肿瘤的干预靶点,但是这两个蛋白之间相互作用及其生物意义至今未见报道。本发明采用免疫共沉淀-高通量质谱分析技术(靶向蛋白质组学技术)筛选鼻咽癌细胞、宫颈癌cd38的相互作用蛋白,发现prmt5是cd38的互做蛋白,免疫共沉淀实验验证证实prmt5是鼻咽癌、宫颈癌、肺癌细胞cd38的互做蛋白,在hek293细胞中外源性prmt5与cd38也存在相互作用,激光共聚焦实验证实prmt5与cd38在细胞膜处发生共定位。蛋白质互作是细胞生化反应网络的一个主要组成部分,参与调节细胞各种生理功能,如蛋白质互作通过调控蛋白质修饰、稳定性和亚细胞定位等调控细胞的功能及其信号传导。研究表明,蛋白质互作不仅与肿瘤密切相关,而且是重要的药物靶点,调控蛋白质修饰的多肽有望成为新的抗癌药物,因此,基于prmt5与cd38是重要的肿瘤基因以及两者相互作用,阻断prmt5与cd38相互作用很可能研发出新的抗肿瘤药物。
技术实现要素:
5.本发明的首要目的是提供一种治疗肿瘤的新靶点,为cd38蛋白的第58位氨基酸。该位点氨基酸为精氨酸。
6.进一步地,所述的肿瘤包括鼻咽癌、宫颈癌和肺癌。
7.本发明的第二个目的是提供突变cd38蛋白的第58位氨基酸,或者阻断cd38蛋白的第58位氨基酸甲基化的试剂在制备肿瘤治疗制剂中的应用。
8.进一步地,所述的肿瘤包括鼻咽癌、宫颈癌和肺癌。
9.进一步地,所述的突变cd38蛋白的第58位氨基酸的试剂包括:将cd38蛋白第58位精氨酸的变为甘氨酸的突变体。
10.例如:包括但不限于用于突变的载体pcdna-cd38-r58g。
11.进一步地,所述的阻断cd38蛋白的第58位氨基酸甲基化的试剂包括:阻断prmt5与cd38蛋白结合或者阻断prmt5甲基化功能,进而阻止cd38蛋白第58位精氨酸发生甲基化的制剂。
12.例如:包括但不限于干扰prmt5表达试剂(si-prmt5),或者抑制或者阻断prmt5甲基化功能试剂gsk591。
13.本发明的第三个目的是提供一种肿瘤治疗制剂,包括:突变cd38蛋白的第58位氨基酸,或者阻断cd38蛋白的第58位氨基酸甲基化的试剂。
14.进一步地,所述的肿瘤包括鼻咽癌、宫颈癌和肺癌。
15.进一步地,所述的突变cd38蛋白的第58位氨基酸的试剂包括:将cd38蛋白第58位精氨酸的变为甘氨酸的突变体。
16.进一步地,所述的阻断cd38蛋白的第58位氨基酸甲基化的试剂包括:阻断prmt5与cd38蛋白结合或者阻断prmt5甲基化功能,进而阻止cd38蛋白第58位精氨酸发生甲基化的制剂。
17.本发明靶点精氨酸所在的具体多肽为:rfpetvlar,小写字母“r”是甲基化的精氨酸。第58位的精氨酸相对应的碱基是cga,突变为:gga即甘氨酸。
18.本发明第四个目的是提供突变cd38蛋白的第58位氨基酸,或者阻断cd38蛋白的第58位氨基酸甲基化的试剂在制备抑制cd38自身酶活性制剂中的应用。
19.本发明第五个目的是提供突变cd38蛋白的第58位氨基酸,或者阻断cd38蛋白的第58位氨基酸甲基化的试剂在制备促进nad水平升高制剂中的应用。
20.本发明是基于发现了一种新的机理:prmt5与cd38相互作用,prmt5通过影响cd38的第58位氨基酸甲基化,促进cd38的酶活性功能,影响nad-sirt1-p53轴促进肿瘤细胞的增殖。依据此机理发明一种cd38定点突变抗肿瘤,阻断prmt5使cd38的第58位氨基酸甲基化,抑制cd38的酶活性功能,影响nad-sirt1-p53轴发挥抑制肿瘤细胞增殖的作用。
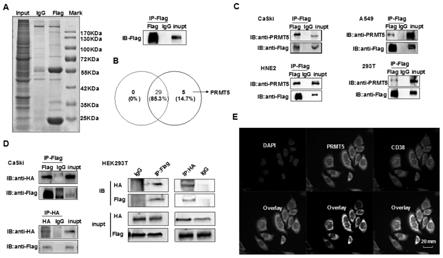
21.本发明采用靶向蛋白质组学技术筛选鼻咽癌、宫颈癌cd38的相互作用蛋白,发现prmt5是cd38的互做蛋白,免疫共沉淀实验验证证实prmt5是鼻咽癌、宫颈癌、肺癌细胞cd38的互做蛋白,在hek293细胞中外源性prmt5与cd38也存在相互作用,激光共聚焦实验证实prmt5与cd38在细胞膜处发生共定位,见图1。
22.本发明采用免疫共沉淀方法分析了cd38的区域截短与prmt5的相互作用,结果发现cd38的跨膜区域与prmt5的相互作用。在鼻咽癌、宫颈癌、肺癌细胞中cd38的蛋白水平不
影响prmt5的蛋白水平,而prmt5的蛋白水平的影响cd38的蛋白水平,且prmt5的甲基化功能也影响cd38的蛋白水平。见图2。
23.本发明发现了prmt5影响cd38的蛋白水平的机制:即prmt5使cd38的第58位氨基酸发生精氨酸甲基化。见图3。
24.本发明确定了prmt5通过调控cd38蛋白r58甲基化状态影响cd38的酶活性和nad水平:构建了cd38蛋白第58位精氨酸的突变体,通过点突变技术,将精氨酸变为甘氨酸,使cd38蛋白第58位氨基酸无法再发生精氨酸甲基化,发现cd38蛋白第58位氨基酸的改变,影响了cd38蛋白的酶活性功能,进而影响了nad水平。见图4。
25.本发明确定了prmt5通过调控cd38蛋白第58位氨基酸甲基化状态促进恶性肿瘤细胞的增殖:nad+作为细胞存活重要底物,nad+水平的改变,细胞的生存能力也发生相应改变。通过edu、活性氧以及凋亡实验发现,与野生型cd38相比,cd38蛋白第58位氨基酸的改变抑制肿瘤细胞的增殖。见图5。
26.本发明发现了prmt5-cd38影响肿瘤细胞增殖的可能机制:nad+作为cd38的底物,nad+水平的改变会影响sirt1的蛋白水平,sirt1可以通过p53以nad+依赖的方式在c端赖氨酸-382残基去乙酰化与p53特异相互作用,改变构象以阻止其与dna结合,降低了p53介导的转录活性,并降低了其下游蛋白如p21(细胞周期抑制因子)的表达。与野生型cd38相比,cd38蛋白第58位氨基酸的改变,p53的乙酰化水平以及p21的蛋白水平降低。相应的恢复实验也同样证实了此结果。见图5。
27.本发明还发现cd38蛋白第58位氨基酸的改变对致瘤性的影响:裸鼠皮下成瘤实验发现,与野生型cd38相比,cd38蛋白第58位氨基酸的改变,抑制肿瘤的增殖。见图6。
28.综上所述,本发明发现在鼻咽癌、宫颈癌、肺癌细胞中prmt5与cd38相互作用,使cd38蛋白发生精氨酸甲基化,影响cd38自身酶活性。具体是cd38蛋白第58位氨基酸发生精氨酸甲基化。研究结果为cd38蛋白第58位氨基酸的突变,作为鼻咽癌、宫颈癌、肺癌的治疗靶点提供了新的理论和实验依据。
29.本发明发现cd38蛋白第58位精氨酸变为甘氨酸的突变体进入肿瘤细胞,使prmt5无法使cd38蛋白第58位精氨酸发生甲基化,抑制cd38自身酶活性,进而影响了nad水平,显著影响鼻咽癌、宫颈癌、肺癌细胞的增殖以及体内致瘤性。见图7。
30.本发明通过一系列研究发现,鼻咽癌、宫颈癌、肺癌细胞中prmt5与cd38相互作用,prmt5使cd38蛋白发生精氨酸甲基化,影响cd38自身酶活性。具体是cd38蛋白第58位氨基酸发生精氨酸甲基化。体内和体外实验证实,cd38蛋白第58位精氨酸变为甘氨酸的突变体进入肿瘤细胞,使prmt5无法使cd38蛋白第58位精氨酸发生甲基化,抑制cd38自身酶活性,进而通过影响nad-sirt1-p53轴促进肿瘤细胞的增殖以及体内致瘤性,达到治疗肿瘤的效果。此抗肿瘤cd38定点靶点作用明显,无明显的毒副作用。
附图说明
31.图1.发现并证实prmt5与cd38蛋白相互作用的结果图;
32.a为sds-page电泳分离cd38相互作用的蛋白;
33.b为flag泳道和igg泳道差异分子分布图;
34.c为免疫共沉淀技术证实宫颈癌caski、肺癌a549、鼻咽癌hne2、hek293细胞系中
prmt5与cd38蛋白相互作用;
35.d为免疫共沉淀技术证实宫颈癌caski、hek293t细胞中外源性prmt5与cd38蛋白相互作用;
36.e为激光共聚焦实验证实在宫颈癌细胞系中prmt5与cd38发生共定位。
37.其中input表示总蛋白水平,flag代表flag标签;igg泳道代表与igg抗体一起孵育好的琼脂糖珠子所结合的蛋白(阴性对照);ip表示免疫共沉淀蛋白水平;ip-flag为加入的抗体为flag,ib代表immunoblotting免疫印迹,即western blotting(显示目的蛋白);ib-flag代表用flag抗体检测flag蛋白;用western blot检测的抗体为ha,用western blot检测共沉淀下来的cd38;ha代表ha标签;dapi标记细胞核(蓝色)、cd38为红色,ha-prmt5为绿色,两者共定位为黄色。ib:anti-prmt5代表用prmt5抗体检测prmt5蛋白;ib:anti-flag代表flag抗体检测flag蛋白;ib:anti-ha代表ha检测ha蛋白。
38.图2.prmt5与cd38的跨膜结构域结合,并且影响cd38的蛋白表达水平结果图;
39.a为cd38不同的截短的区域;
40.b为免疫共沉淀技术检测prmt5与cd38的相互作用区域;
41.c为western blot检测过表达cd38对prmt5蛋白水平的影响,d为western blot检测干扰prmt5对cd38蛋白水平的影响,
42.其中cd38fl代表cd38全长;d1为1-21氨基酸的胞内区域,d2为22-45氨基酸的跨膜区域,d3为46-300氨基酸的胞外区域;vector为过表达对照;si-nc为干扰对照,si-prmt5为干扰prmt5;β-actin作为内参。
43.图3.prmt5的甲基化功能影响cd38的蛋白水平、同时cd38在r58处发生二甲基化的结果图;
44.a为western blot检测用gsk591(抑制prmt5甲基化功能)处理后的cd38蛋白水平;
45.b为western blot检测用gsk591(抑制prmt5甲基化功能)不同浓度处理后的cd38蛋白水平;
46.c为免疫共沉淀技术检测cd38发生对称精氨酸二甲基化;
47.d为sds-page电泳分离cd38;
48.e为cd38蛋白的质谱鉴定了r58处甲基化;
49.f为构建a549/pcdna-cd38和a549/pcdna-cd38-r58g稳转细胞系,并通过western blot实验进行检测;
50.g为免疫共沉淀技术验证cd38的对称性二甲基化。
51.其中dmso为对照组;gsk591为抑制prmt5甲基化功能组;oe为过表达cd38;mu为过表达cd38突变体;gapdh为内参,β-actin作为内参;sym10是通用型精氨酸甲基化抗体;ip-sym10代表用sym10抗体进行免疫沉淀实验。
52.图4.prmt5通过调控cd38 r58甲基化影响cd38的酶活性和nad水平结果图;
53.a为nad+/nadh检测试剂盒检测过表达cd38后细胞内nad+水平;
54.b为nad+/nadh检测试剂盒检测在肺癌a549细胞中干扰prmt5后细胞内nad+水平;
55.c为nad+/nadh检测试剂盒检测在肺癌a549细胞中抑制prmt5甲基化功能后细胞内nad+水平;
56.d为nad+/nadh检测试剂盒检测在肺癌a549细胞、宫颈癌caski细胞中cd38蛋白的
第58位氨基酸突变后细胞内nad+水平;
57.e为cd38酶活性试剂盒检测在肺癌a549细胞中干扰prmt5后cd38酶活性;在鼻咽癌hne2细胞抑制prmt5甲基化功能后cd38酶活性;
58.f为cd38酶活性试剂盒检测在鼻咽癌hne2细胞中cd38蛋白的第58位氨基酸突变后cd38酶活性;
59.其中nc为过表达对照组,r58g为cd38蛋白的第58位精基酸变为甘氨酸,r58g+cd38为在cd38蛋白的第58位精基酸变为甘氨酸基础上恢复cd38的功能。
60.图5.体外实验证实prmt5通过调控cd38 r58g甲基化状态影响cd38-nad-sirt1-p53-p21信号轴活性促进恶性肿瘤细胞的增殖结果;
61.a为edu实验检测干扰prmt5和cd38肺癌细胞的增殖能力;
62.b为edu试剂盒检测在宫颈癌细胞中抑制prmt5甲基化功能的增殖能力;
63.c和d为edu试剂盒检测宫颈癌和肺癌细胞中抑制prmt5甲基化功能的细胞增殖能力;
64.e为edu试剂盒检测在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中cd38蛋白的第58位氨基酸突变后细胞增殖能力;
65.f为活性氧试剂盒检测在肺癌a549细胞中cd38蛋白的第58位氨基酸突变后细胞活性氧含量;
66.g为凋亡试剂盒检测在肺癌a549细胞中cd38蛋白的第58位氨基酸突变后细胞凋亡能力;
67.h为western blot检测过表达cd38后宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中sirt1的蛋白水平;
68.i为western blot检测cd38蛋白的第58位氨基酸突变后sirt1、p53、ac-p53、p21蛋白水平。
69.其中hoechst33324标记的是染细胞核显示的是蓝色,edu染色增殖细胞显示的是红色,merge是细胞核和edu的重合。
70.图6.体内实验证实cd38蛋白第58位氨基酸的改变对致瘤性的影响结果;
71.a为构建裸鼠皮下成瘤模型,绘制小鼠体重曲线图;
72.b为分离肿瘤组织,拍照肿瘤组织,绘制肿瘤生长曲线。
73.图7.prmt5通过影响cd38蛋白r58位点甲基化状态促进恶性肿瘤细胞增殖的机制模式图。
具体实施方式
74.以下结合实施例旨进一步说明本发明,而非限制本发明。
75.实施例1
76.图1a是cd38免疫沉淀复合物的sds-page电泳考染图;采用含10%胎牛血清的1640培养基培养稳定表达flag-cd38宫颈癌caski细胞,48h后制备了细胞提取物,采用抗flag亲和凝胶珠子以此来沉淀flag-cd38以及和cd38相互作用的蛋白,并取适量蛋白作为阳性对照,剩余的蛋白则分成两等份分别与igg和flag亲和凝胶珠子进行孵育,然后取出适量用western技术鉴定是否富集到flag-cd38,为了鉴定和识别蛋白纯化物,利用sds-丙烯酰胺
凝胶电泳将所得的蛋白进行分离,然后用考马斯进行考染后进行脱色。发现在72kda位置出现了明显的差异条带。western blot实验显示已成功富集到flag-cd38。
77.图1b是flag泳道和igg泳道差异分子分布图:将72kda位置的差异条带切下胶内酶解,上机对其蛋白进行分析与鉴定,flag和igg泳道两组数据交集共得到34个蛋白,flag泳道所特有的一共有5个蛋白,其中prmt5表达丰度最高(表1-1),提示prmt5与cd38存在相互作用的可能。以72kda位置的差异条带切下胶内酶解,上机对其蛋白进行分析与鉴定,flag和igg泳道两组数据交集共得到34个蛋白,flag泳道所特有的一共有5个蛋白(图1b),其中prmt5表达丰度最高(表1-1)。
78.表1-1 flag泳道特有的蛋白
[0079][0080]
图1c是免疫共沉淀技术证实宫颈癌caski、肺癌a549、鼻咽癌hne2、hek293细胞系中prmt5与cd38蛋白相互作用:将带有flag标签的cd38质粒转染到caski细胞中,培养48h后收细胞蛋白,将适量蛋白取出来作为阳性对照,剩下得到蛋白平均分为两份分别与igg和flag亲和凝胶珠子进行孵育,然后用prmt5抗体进行免疫印迹(ib)。具体实验步骤如下:
[0081]
将带有flag标签的cd38质粒(购买于湖南快迈生物科技)转染到细胞中,48h后收集蛋白,向100mm中添加已经准备好的650μl的western及ip细胞裂解液,将贴壁细胞以移液枪温和吹下,放置ep管中内,在冰上进行裂解,时间30min-60min,以离心机离心且保持4℃,其转速维持12000rpm时间20min后将离心下来的溶液留下来,插在冰块里等待后续实验操作。取30μl的proteina+g珠子与1.5ml离心管中,滴入western及ip细胞裂解液于离心管内,放在dna混合仪内转5min,保证转速为2000rpm且离心3分钟。取3μg igg抗体加入上上述的离心管中,向离心管中添加200μl western及ip细胞裂解液,放在dna混合仪上孵育2h,室温。取30μl的抗flag m2亲和凝胶(已与flag抗体交联好的珠子),每个离心管中添加已准备好的1ml western及ip细胞裂解液,放在dna混合仪上持续5min,随后保障其转速维持在2000rpm时间是3min。向上述含有flag和igg的离心管中加入等量的蛋白,放在dna混合仪上4℃孵育12-14h,留20μl蛋白放置于-80℃中,作为阳性对照。加入5
×
loading buffer混合,保持100℃持续5min。采用western blot检测两个蛋白的相互作用。
[0082]
结果显示:发现flag可以沉淀下内源性prmt5蛋白,表明:cd38与prmt5内源性存在相互作用。
[0083]
图1d为免疫共沉淀技术证实宫颈癌caski、hek293细胞中外源性prmt5与cd38蛋白相互作用:将flag-cd38和ha-prmt5分别共同转染至caski、293t细胞内,培养48h后收集细胞裂解物,将适量蛋白取出来作为阳性对照,剩下的蛋白平均分成四等分,分别与带igg和flag、igg和ha抗体孵育好的珠子结合,通过western blot实验证实了anti-flag抗体可以沉淀下ha蛋白,同样的anti-ha抗体可以沉淀下flag蛋白。实验结果进一步证实了cd38与
prmt5存在外源性互作。
[0084]
图1e为激光共聚焦实验证实在宫颈癌细胞系中prmt5与cd38发生共定位:将带有flag标签的cd38载体,与带有ha标签的prmt5载体共转染到caski细胞,在转染48小时后,使用激光共聚焦显微镜(比例尺为20mm)分析了宫颈癌caski细胞中外源flag-cd38(红色)和ha-prmt5(绿色)的共定位(黄色)。具体实验步骤如下:
[0085]
将flag-cd38质粒和ha-prmt5共转染到肿瘤细胞中,36h,把细胞消化下来接着种在有无菌爬片的在六孔板内,2
×
105个/孔细胞,培养。等细胞贴壁后,以pbs荡洗,一共洗三次。用4%多聚甲醛加以固定,30min。用pbs洗细胞三次,加入0.5%triton-x-100溶液,室温孵育30min,以pbs洗三次,添加准备好的适量的正常山羊血清封闭约30min。滴加已经配置好的一抗试剂,并将其移至湿盒内在4℃的冰箱中放置一宿。以pbs连续洗三次,然后滴入准备好的荧光二抗反应,37℃。pbs轻轻洗涤三次。加dapi染液,避光孵育3min,室温。pbs轻轻洗涤三次,吸干残留pbs,加入适量荧光封片剂。以调整好的激光共聚焦显微镜仪器来完成拍照操作。
[0086]
结果显示:cd38为红色定位在胞膜上,prmt5细胞膜上,胞浆内都有些表达。cd38与prmt5在宫颈癌caski细胞中存在共定位,且主要共定位在细胞膜上。
[0087]
本发明采用靶向蛋白质组学技术筛选鼻咽癌、宫颈癌细胞cd38的相互作用蛋白,发现prmt5是cd38的相互作用蛋白,免疫共沉淀技证实在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞系中prmt5与cd38蛋白相互作用。
[0088]
实施例2
[0089]
图2a为cd38不同的截短的区域:cd38作为跨膜蛋白,由胞内结构域、跨膜结构域以及胞外结构域构成,因此将cd38分成三段,分别为d1(胞内段)、d2(跨膜段)、d3(胞外段),构建成带有flag并且融合表达flag的载体。将flag-cd38全长、flag-d1、flag-d2、flag-d3瞬转到293t细胞中,48h收集细胞裂解物,采用western blot实验验证构建三段结构域是否成功。已成功构建cd38蛋白的胞内、跨膜、胞外结构域。
[0090]
flag-cd38全长:代表的是带有flag的cd38载体,其cd38的全长氨基酸如下
[0091]
mancefspvsgdkpccrlsrraqlclgvsilvlilvvvlavvvprwrqqwsgpgttkrfpetvlarcvkyteihpemrhvdcqsvwdafkgafiskhpcniteedyqplmklgtqtvpcnkillwsrikdlahqftqvqrdmftledtllgyladdltwcgefntskinyqscpdwrkdcsnnpvsvfwktvsrrfaeaacdvvhvmlngsrskifdknstfgsvevhnlqpekvqtleawvihggredsrdlcqdptikelesiiskrniqfsckniyrpdkflqcvknpedssctsei,见seq id no.1所示。
[0092]
flag-d1:(1-21氨基酸)代表的是带有flag的d1(胞内段)载体,其cd38的d1(胞内段)氨基酸如下:mancefspvsgdkpccrlsrr,见seq id no.2所示。
[0093]
flag-d2:(22-45氨基酸)代表的是带有flag的d2(跨膜段)载体,其cd38的d2(跨膜段)氨基酸如下:aqlclgvsilvlilvvvlavvvpr,见seq id no.3所示。
[0094]
flag-d3:(45-300氨基酸)代表的是带有flag的d3(胞外段)载体,其cd38的d3(胞外段)氨基酸如下:
[0095]
wrqqwsgpgttkrfpetvlarcvkyteihpemrhvdcqsvwdafkgafiskhpcniteedyqplmklgtqtvpcnkillwsrikdlahqftqvqrdmftledtllgyladdltwcgefntskinyqscpdwrkdcsnnpvsvfwktvsrrfaeaacdvvhvmlngsrskifdknstfgsvevhnlqpekvqtleawvihggredsrdlcqdptikelesi
iskrniqfsckniyrpdkflqcvknpedssctsei,见seq id no.4所示。
[0096]
图2b为免疫共沉淀技术检测prmt5与cd38的相互作用区域:将flag-cd38全长、flag-d1、flag-d2、flag-d3瞬转到293t细胞中,培养48h后,将细胞裂解物收集,以抗flag亲和凝胶珠子进行ip实验。cd38的全长和cd38的d2载体的flag可以沉淀到prmt5,提示prmt5与cd38的跨膜结构域相结合。
[0097]
图2c为western blot检测过表达cd38对prmt5蛋白水平的影响:在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中稳定过表达cd38,采用western blot实验来检测cd38对prmt5蛋白水平表达的影响。在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中稳定过表达cd38,prmt5的蛋白水平并没有发生明显的改变,结果表明:在恶性肿瘤细胞中,cd38与prmt5发生互作后,cd38不影响prmt5的蛋白水平。
[0098]
图2d为western blot检测干扰prmt5对cd38蛋白水平的影响:在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中干扰prmt5,western blot检测prmt5蛋白水平。具体实验步骤如下:
[0099]
1:构建稳定过表达cd38的宫颈癌caski、肺癌a549、鼻咽癌hne2细胞系:在hkt293t细胞种在100mm的细胞培养皿内并添加10ml的dmem培养基。放在细胞培养箱中培养16-20h,把7.5μg的pmd2.g质粒(慢病毒包装载体,购买于湖南快迈生物科技)、7.5μg的pspax2(慢病毒包装载体,购买于湖南快迈生物科技,和pmd2.g质粒一起组成病毒包装系统)以及10μg的cd38质粒混合,转染到hkt293t细胞。培养48h后进行离心(1000rpm、10min)。
[0100]
把上述离心下来的液体用0.45μm孔径的过滤器进行过滤,过滤到准备好的新离心管内,加入到将要感染慢病毒的肿瘤细胞的6孔板中,放到细胞培养箱中继续培养。第二天,更换成新鲜的病毒过滤液继续培养。在感染48h后,用嘌呤霉素进行挑选已经感染上的细胞。
[0101]
2.sirna瞬时转染:在6孔板中种入处理好的细胞。在细胞培养箱中培养,等细胞贴壁的密度为50-70%就可以进行转染了。稀释sirna:将120μl的1
×
ribofecttmcp buffer稀释5μl 20μm sirna储存液,混匀,室温放置5min。制备混合液:加入12μl ribofecttmcp reagent,混匀,放置15min。在进行转染之前以d-hanks洗清6孔板三次,倒去d-hanks后在每个孔中添加1863μl的细胞培养液。在6孔板中添加制备好的混合液,培养48-72h后,收细胞并提取细胞蛋白。
[0102]
在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中干扰prmt5后,cd38蛋白水平出现了明显的下调。结果表明:在恶性肿瘤细胞中,cd38与prmt5发生互作后,prmt5可以进一步影响cd38的蛋白水平。
[0103]
本发明发现prmt5与cd38的跨膜结构域结合,并且影响cd38的蛋白表达水平。
[0104]
实施例3
[0105]
图3a是western blot检测用gsk591(抑制prmt5甲基化功能)处理后的cd38蛋白水平:在稳定过表达cd38的caski、hne2细胞系,以及a549细胞,使用gsk591(prmt5抑制剂)和dmso处理,发现prmt5的甲基化活性被抑制后cd38的蛋白水平也出现了明显的下调。
[0106]
图3b是western blot检测用gsk591(抑制prmt5甲基化功能)不同浓度处理后的cd38蛋白水平:在稳定过表达cd38的caski、hne2细胞系,以及a549细胞,使用不同浓度的gsk591(prmt5抑制剂)和dmso处理,cd38蛋白水平随着gsk591的浓度的升高而降低,并浓度
为500nm时cd38的蛋白水平降低的最为明显。
[0107]
图3c为免疫共沉淀技术检测cd38发生对称精氨酸二甲基化:flag-cd38质粒瞬时转染至293t细胞内48h后就收集细胞裂解物,取适量蛋白做阳性对照,剩余分为四等分,分别与带igg和flag、igg和sym10(对称地二甲基化抗体)抗体孵育好的珠子结合,通过western blot实验检测cd38。结果显示cd38可被对称性二甲基化。
[0108]
图3d为sds-page电泳分离cd38:在稳定过表达cd38的宫颈癌caski细胞中瞬时转染si-prmt5(si-prmt5序列为:5
’‑
gaggtgcagttcatcatca-3’见seq id no.5所示,购买于广州锐博生物技术有限公司,si-nc购买于广州锐博生物技术有限公司),48h后收集细胞进行sds-page电泳并进行考染。其prmt5的干扰成功的,并且co-ip实验富集到flag-cd38。
[0109]
图3e是免疫共沉淀技术验证cd38的对称性二甲基化:从凝胶上切下对应于的cd38条带,并进行胰蛋白酶消化。胰蛋白酶肽在反相柱上分离,并使用orbitrap fusion tribrid质谱仪获得高能碰撞解离光谱。使用proteome discoverer(v 1.3,thermoscientific)在人类蛋白质数据库中搜索了数据,以1%的错误发现率过滤结果。显示了对应于cd38的rfpetvlar的肽段发生二甲基化,其对应cd38的精氨酸58(r58),小写字母“r”是甲基化的精氨酸。
[0110]
图3f为将pcdna-cd38质粒和pcdna-cd38-r58g质粒(购买于湖南快迈生物科技)转a549细胞系中,并通过western blot实验进行检测。gapdh作为内参。结果显示转染成功。
[0111]
图3g为免疫共沉淀技术验证cd38的对称性二甲基化:在pcdna-cd38和pcdna-cd38-r58g稳转细胞中分别转染si-nc和si-prmt5,48h后收取细胞裂解物,取50μg蛋白做input,平分剩余蛋白与提前交联好的igg琼脂糖珠子和sym10(对称性二甲基化抗体)琼脂糖珠子结合,进行免疫纯化,通过western blot检测实验验证cd38的对称性二甲基化。结果显示在过表达cd38的a549稳转细胞中,cd38的对称性二甲基化水平增高,进一步敲低prmt5之后,cd38的对称性二甲基化水平明显降低。而当在a549细胞中稳定过表达r58g时,cd38的对称性二甲基化水平并无增高,且敲低prmt5和敲低nc对cd38的对称性二甲基化并无明显影响。表明prmt5能使cd38的r58位点发生对称性二甲基化。
[0112]
本发明发现prmt5的甲基化功能影响cd38的蛋白水平、同时cd38在r58处发生二甲基化。
[0113]
实施例4
[0114]
图4a为nad+/nadh检测试剂盒检测过表达cd38后细胞内nad+水平:稳定过表达cd38和vector(空白载体即nc组)宫颈癌caski细胞、肺癌a549细胞、鼻咽癌hne2细胞内nad+水平检测,利用nad+/nadh检测试剂盒检测,用蛋白浓度进行标化。记录数值并对其进行归一化和分析。***p<0.001,****p<0.0001。实验重复3次。结果显示过表达cd38后nad+的水平均下降。
[0115]
图4b为nad+/nadh检测试剂盒检测在肺癌a549细胞中干扰prmt5后细胞内nad+水平:瞬时干扰prmt5后肺癌a549细胞内nad+水平检测,利用nad+/nadh检测试剂盒检测,以蛋白浓度标化。记录数值并对其进行归一化和分析。**p<0.01。实验重复3次。结果显示在a549细胞中干扰prmt5后,nad+的水平出现明显升高。
[0116]
图4c为nad+/nadh检测试剂盒检测在肺癌a549细胞中抑制prmt5甲基化功能后细胞内nad+水平:抑制prmt5甲基化活性后肺癌a549细胞内nad+水平检测,利用nad+/nadh检
测试剂盒检测,用蛋白浓度进行标化。记录数值并进行归一化和分析。**p<0.01。实验重复3次。发现在a549细胞中用gsk591处理后,nad+水平升高。
[0117]
图4d为nad+/nadh检测试剂盒检测在肺癌a549细胞、宫颈癌caski细胞中cd38蛋白的第58位氨基酸突变后细胞内nad+水平:在宫颈癌caski细胞、肺癌a549细胞,过表达野生型cd38、r58g和恢复实验后nad+水平检测,利用nad+/nadh检测试剂盒检测,用蛋白浓度进行标化。记录数值并进行归一化和分析。*p<0.05。实验重复3次。结果显示在过表达cd38-r58g后,nad+水平升高,恢复实验中,进一步恢复野生型cd38的表达,nad+水平明显降低。
[0118]
图4e为cd38酶活性试剂盒检测在肺癌a549细胞中干扰prmt5后cd38酶活性;在稳定过表达cd38和vector的宫颈癌caski细胞,使用dmso和gsk591(prmt5活性抑制剂)处理,利用cd38酶活性试剂盒检测prmt5对cd38的甲基化对cd38酶活性的影响;用蛋白浓度进行标化;用蛋白浓度进行标化。记录数值并进行归一化和分析。*p<0.05,****p<0.0001。实验重复3次。结果显示在a549细胞中转染si-prmt5后,对比转染si-nc,cd38的酶活性有明显的降低;在hne2细胞使用dmso和gsk591(prmt5活性抑制剂)处理,结果发现cd38的酶活性并无变化,而过表达cd38后,gsk591处理使得cd38的酶活性降低。表明:prmt5的甲基化可影响cd38的酶活性。
[0119]
图4f为cd38酶活性试剂盒检测在鼻咽癌hne2细胞中cd38蛋白的第58位氨基酸突变后cd38酶活性:在鼻咽癌hne2细胞中,过表达野生型cd38、r58g和恢复实验后cd38酶活性检测,利用cd38酶活性检测试剂盒进行检测,用蛋白浓度进行标化;用蛋白浓度进行标化。记录数值并进行归一化和分析。*p<0.05,***p<0.001。实验重复3次。结果显示:过表达cd38-r58g组相较于过表达野生型cd38组,cd38酶活性降低,恢复野生型cd38的表达后,cd38的酶活性水平恢复升高。
[0120]
本发明发现prmt5通过调控cd38 r58甲基化影响cd38的酶活性和nad水平。
[0121]
实施例5
[0122]
图5a是edu实验检测干扰prmt5和cd38肺癌细胞的增殖能力:在肺癌a549细胞中,分别干扰prmt5和cd38(si-cd38序列:gtgtggaagtccataattt,见seq id no.6所示),使用edu检测试剂盒联合免疫荧光检测肺癌细胞的增殖能力。记录数值进行归一化和分析,**p<0.01,实验重复3次。标尺:20μm。具体步骤如下:
[0123]
将1
×
10
5-3
×
106细胞接种于6孔板的每个孔中,培养46小时后,加入10μm的edu(cell light edu dna成像试剂盒,中国广州日博生物)培养基培养2h。然后根据以下方案对细胞进行染色:弃去edu培养基混合物,添加4%多聚甲醛在室温下固定细胞30分钟,在振荡器中用甘氨酸(2mg/ml)洗涤5分钟,添加0.2%trion x-10010分钟,用pbs洗涤两次,添加反应缓冲液(tris
–
hcl,ph 8.5,100mm;cuso4,1mm;488/555/594/647aazide(组分b)100mm;1
×
缓冲液添加物,100mm)避光保存10
–
30分钟,用0.5%triton x-100清洗3次,在室温下用hoechst(5mg/ml)染色30分钟,再用0.5%triton x-100清洗5次,最后加入150ml pbs。使用high content imaging pathway 855(bd,美国)拍摄并分析图像。
[0124]
结果显示在a549细胞中将cd38或者将prmt5干扰,a549细胞的增殖能力受到了抑制。
[0125]
图5b为edu试剂盒检测在宫颈癌细胞中抑制prmt5甲基化功能的增殖能力:在稳定过表达vector和cd38的宫颈癌细胞中分别用dmso和gsk591(prmt5活性抑制剂)处理,使用
edu检测试剂盒联合免疫荧光检测肺癌细胞的增殖能力。记录数值进行归一化和分析,****p<0.0001,实验重复3次。标尺:20μm。在宫颈癌caski细胞,采用gsk591处理后,其细胞增殖能力并没有受到任何影响;但宫颈癌caski细胞过表达cd38后,其增殖能力增强,同时采用gsk591处理后、其增殖能力受到抑制。
[0126]
图5c和d是edu试剂盒检测宫颈癌和肺癌细胞中抑制prmt5甲基化功能的细胞增殖能力:在稳定过表达vector和cd38的宫颈癌细胞和肺癌细胞中分别用dmso和gsk591(prmt5活性抑制剂)处理,使用edu检测试剂盒联合免疫荧光检测肺癌细胞的增殖能力。记录数值进行归一化和分析,***p<0.001,****p<0.0001,实验重复3次。具体步骤如下:
[0127]
将1
×
10
5-3
×
106细胞接种于6孔板的每个孔中,培养46小时后,加入10μm的edu(cell light edu dna成像试剂盒,中国广州日博生物)培养基培养2h。按照试剂制作商要求,用胰酶消化细胞消化,用1%bsa-pbs洗三次,加入1ml4%多聚甲醛固定细胞30min。用1%bsa-pbs溶液清洗三次。加入0.5%triton-x-100溶液室温避光孵育20min。按照说明书将5
×
click-itedu缓冲液(稀释成1
×
click-itedu缓冲液,现用现配。加入1mlclick-it(tris
–
hcl,ph 8.5,100mm;cuso4,1mm;488/555/594/647aazide(组分b)100mm;1
×
缓冲液添加物,100mm)反应混合物混匀,避光孵育30min。用1%bsainpbs来洗细胞一共三次,然后离心把离心下来的沉淀留下上清移除干净,用1ml的pbs(1%bsa)来进行重悬细胞,混合后进行流式细胞术上机检测并分析。
[0128]
在肺癌a549细胞中用gsk591处理后细胞的增殖能力受到抑制,过表达后cd38可恢复增殖能力,提示prmt5可通过影响cd38的甲基化状态来调控恶性肿瘤细胞的增殖能力。
[0129]
图5e为edu试剂盒检测在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中cd38蛋白的第58位氨基酸突变后细胞增殖能力:在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中,过表达野生型cd38、r58g和r58g+cd38流式细胞术检测细胞增殖能力。记录数值进行归一化和分析,*p<0.05,**p<0.01。实验重复3次。结果显示相比较于cd38组、r58g后肿瘤细胞的增殖能力降低,而r58g+cd38的肿瘤细胞增殖能力有所恢复。
[0130]
图5f为活性氧试剂盒检测在肺癌a549细胞中cd38蛋白的第58位氨基酸突变后细胞活性氧含量:在肺癌a549细胞中,过表达野生型cd38、r58g和r58g+cd38流式细胞术检测细胞活性氧水平。green:cd38,blue:r58g,red:r58g+cd38,实验重复3次。具体实验步骤如下:
[0131]
配制含dcfh-da荧光探针的无血清培基,按1000:1的比例在无血清培养基中加入10mm dcfh-da,混匀,使探针终浓度为10μm。取出六孔板,吸去原有培养基,每孔加入1ml含dcfh-da的培养基,阴性对照组则加入不含探针的无血清培基,摇晃均匀,放回细胞培养箱(37℃,5%co2),孵育2h。用pbs缓冲液清洗一遍,胰酶消化培基重悬细胞至1.5ml ep管中,做好标记。1000g离心5min,去除上清,加入1ml pbs缓冲液重悬细胞沉淀,离心,重复两次。最后细胞沉淀加入400μl pbs缓冲液重悬后,直接上机检测其荧光值。
[0132]
结果显示相比较于cd38组、r58g后肿瘤细胞活性氧含量的降低,而r58g+cd38的肿瘤细胞活性氧含量有所恢复。
[0133]
图5g为凋亡试剂盒检测在肺癌a549细胞中cd38蛋白的第58位氨基酸突变后细胞凋亡能力:在肺癌a549中,过表达野生型cd38、r58g和r58g+cd38,流式细胞术检测细胞的凋亡。图中r5区为凋亡细胞数。记录数值进行归一化和分析,**p<0.01。实验重复3次。
[0134]
具体实验步骤如下:
[0135]
按照说明书配制1
×
染色缓冲液工作液,取出六孔板,收集细胞于1.5ml ep管,做好标记。800g离心5min,得到细胞沉淀,用pbs缓冲液清洗两次。细胞样本沉淀加入1ml 1
×
染色缓冲液工作液进行重悬。每个样本加入10μl hoechst 33342染色液a,混匀。4℃,避光孵育10min。再加入10μl pi染色液b,混匀。4℃,避光孵育10min。800g离心5min,pbs缓冲液清洗两次。细胞沉淀用pbs缓冲液重悬后,可直接放入流式细胞仪进行上机检测。
[0136]
结果显示相比较于cd38组、r58g后肿瘤细胞的凋亡能力增加,而r58g+cd38的肿瘤细胞凋亡能力有所恢复。
[0137]
图5h为western blot检测过表达cd38后宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中sirt1的蛋白水平:在宫颈癌caski、肺癌a549、鼻咽癌hne2细胞中过表达cd38,48h后收集细胞裂解物,取50ug细胞裂解物利用western blot检测cd38和sirt1蛋白水平。gapdh作为内参。在caski、a549、hne2细胞中发现过表达cd38后使sirt1的蛋白水平下调。
[0138]
图5i为western blot检测cd38蛋白的第58位氨基酸突变后sirt1、p53、ac-p53、p21蛋白水平:在肺癌a549细胞中,过表达野生型cd38、r58g和r58g+cd38后,取50ug细胞裂解物利用western blot检测cd38和sirt1、p53、ac-p53、p21蛋白水平。gapdh作为内参。结果显示相比较于过表达cd38组,cd38的r58发生r58g突变后,p53的乙酰化水平以及p21的蛋白水平降低,而cd38+cd38 r58g组的p53的乙酰化水平以及p21的蛋白水平有所恢复。
[0139]
本发明发现在体外prmt5通过调控cd38 r58甲基化状态影响cd38-nad-sirt1-p53-p21信号轴活性促进恶性肿瘤细胞的增殖。
[0140]
实施例6
[0141]
图6a为构建裸鼠皮下成瘤模型,绘制小鼠体重曲线图:构建了裸鼠皮下成瘤模型,4周龄的雌性balb/c裸鼠被随机分成3组,分别为a549稳定转染空载细胞组、a549稳定转染野生型cd38细胞组、a549稳定转染突变型r58g细胞组,每组3只裸鼠。细胞消化离心,并用生理盐水洗一次,在裸鼠的皮下注射200ul细胞悬液(3x106个细胞)。每隔两天记录小鼠体重变化,并绘制小鼠体重曲线图。在裸鼠成瘤后,处死小鼠,并进行拍照。
[0142]
图6b为分离肿瘤组织,拍照肿瘤组织,绘制肿瘤生长曲线:注射9天后密切观察注射部位皮下结节,每隔两天测量一次肿瘤大小(肿瘤体积计算公式:长x宽2x0.52),并绘制肿瘤生长曲线。注射后38天处死所有小鼠,分离肿瘤组织,pbs清洗后并拍照。取部分肿瘤组织用4%多聚甲醛固定后,经石蜡包埋后用作免疫组化;其余肿瘤组织保存于液氮中。并拍照肿瘤组织。结果发现cd38组的小鼠瘤子相比较对照组nc,瘤子较大,然而相比较cd38组的r58g组的小鼠瘤子较小。表明在体内实验中,cd38的r58突变后的是可以抑制肿瘤细胞的增殖的,这与体外细胞实验一致。
[0143]
本发明发现在体内cd38蛋白第58位氨基酸的改变抑制致瘤性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1