具有改进的稳定性和免疫原性的疫苗组合物的制作方法
具有改进的稳定性和免疫原性的疫苗组合物
1.本技术是申请日为2016年9月6日、申请号为201680062822.x、发明名称为“具有改进的稳定性和免疫原性的疫苗组合物”的发明专利申请的分案申请。
2.相关申请的交叉引用
3.出于全部目的,本技术整体并入2015年9月3日提交的美国临时申请序列号62/213,947、2015年11月16日提交的第62/255,786号、2016年3月16日提交的第62/309,216号以及2016年6月16日提交的第62/350,973号的公开内容。
4.电子提交的文本文件的说明
5.以电子方式提交的文本文件的内容通过引用整体并入本文:序列表的计算机可读格式拷贝(文件名:novv_060_03us_seqlist_st25.txt,date recorded:september 6,2016;file size:91 kilobytes)。
技术领域
6.本公开一般地涉及用于刺激免疫响应的纳米颗粒。纳米颗粒提供抗原,例如与去污剂核心结合的糖蛋白抗原,并且通常使用重组方法产生。纳米颗粒具有改善的稳定性和增强的表位呈递。本公开还提供了包含纳米颗粒的组合物,制备它们的方法以及刺激免疫响应的方法。
7.背景
8.传染性疾病在全世界仍然是一个问题。虽然在开发针对某些病原体的疫苗方面取得了进展,但许多疫苗仍然对人类健康构成威胁。最众所周知的是hiv,针对其的疫苗仍然难以捉摸。已经尝试为某些病原体生产疫苗,但导致了引起额外病理学的失败。其他病原体也是一个问题,包括埃博拉病毒,其偶尔会出现流行-特别是在非洲-并导致生命损失和全球经济影响。流感病毒是另一种病毒,针对其现有的疫苗提供一定的保护,但生产病毒的技术挑战意味着季节性流感疫苗可能不能提供足够的保护。
9.部署一种有效的疫苗取决于成果的组合。疫苗必须刺激有效的免疫响应,其减少感染或疾病的量足以有益。疫苗还必须足够稳定,可用于无法制冷的具有挑战性的环境中。
10.因此,对生产针对全球公共卫生问题的疫苗一直存在兴趣,并且仍然需要生产稳定性良好的有效疫苗。
11.发明概述
12.本公开提供适用于诱导针对病原体的免疫响应的纳米颗粒。纳米颗粒提供改进的稳定性以及有效的免疫原性。在特定方面,病原体是病毒,并且通常用于产生病毒纳米颗粒的抗原是病毒糖蛋白。
13.一方面,本公开提供了具有增强的稳定性的含有病毒蛋白的纳米颗粒。在一些实施方案中,本公开包含疫苗组合物,其包含含有非离子去污剂、病毒糖蛋白和药物缓冲剂的纳米颗粒。在典型的实施方案中,非离子去污剂可以选自ps20、ps40、ps60、ps65和ps80。在一些实施方案中,组合物不包含任何游离的非离子去污剂。一个或多个糖蛋白抗原分子包围去污剂核心,其含有非离子去污剂,并且这提供了促进免疫原性并抑制抗原降解的纳米
颗粒结构。
14.在一些实施方案中,抗原选自rsv f蛋白、流感ha蛋白、流感na蛋白及其组合。可以使用其他抗原,包括埃博拉病毒。通常,抗原是糖蛋白。
15.任选地,rsv f蛋白是三聚体rsv f蛋白。rsv f蛋白诱导产生中和抗体。在进一步的实施方案中,中和抗体识别处于融合后状态和/或融合前状态的rsv f蛋白。另一方面,每个ps80颗粒可包含4至7个rsv f蛋白。
16.在一些实施方案中,rsv f组合物可以包含浓度为15mm至25mm的磷酸钠;浓度为125mm至175mm的nacl;0.25%至2%w/v的组氨酸;并且组合物的ph在5.8和7.2之间。
17.在一些实施方案中,ha或na流感病毒组合物可以包含浓度为15mm至25mm的磷酸钠;浓度为125mm至300mm的nacl;0.25%至2%w/v的组氨酸;并且组合物ph高于ph6.8并且通常低于约ph8.0。
18.在一些实施方案中,组合物包含佐剂。在进一步的实施方案中,佐剂是明矾或martrix m
tm
。在一些实施方案中,组合物不包含佐剂。
19.在一些实施方案中,预防感染的方法包括施用一个或多个剂量的疫苗组合物。在该方法的一些实施方案中,施用单剂量的组合物并诱导保护性免疫响应。在该方法的一些实施方案中,每个剂量由约100μg至约150μg的蛋白抗原组成。在该方法的其他实施方案中,所述一个或多个剂量皮下施用。在该方法的一些实施方案中,组合物包含佐剂。在该方法的另一个实施方案中,佐剂是明矾。在该方法的一些实施方案中,组合物不含佐剂。
20.在该方法的一些实施方案中,将一个或多个剂量的组合物施用至成人。在该方法的进一步的实施例中,成人是女性,并且女性可能怀孕的。在该方法的进一步实施方案中,成人年龄超过65岁或超过60岁。在该方法的一些实施方案中,将一个或多个剂量的组合物施用至儿童。在该方法的进一步实施例中,儿童是新生儿或婴儿。
21.对于rsv疫苗,在一些实施方案中,组合物包含至少3种rsv f纳米颗粒类型的异源群体,其中每个纳米颗粒包含围绕包含ps80的含去污剂核心的至少一种rsv f蛋白三聚体,并且其中所述第一rsv f纳米颗粒类型包含各向异性棒,其中第二rsv f纳米颗粒类型包含球形寡聚物,第三rsv纳米颗粒类型包含各向异性棒和球形寡聚物的中间体。
22.在一些实施方案中,制备rsv f蛋白纳米颗粒的方法包括使用第一去污剂从宿主细胞制备rsv f蛋白提取物并将第一去污剂交换成第二去污剂,其中第二去污剂是ps80,并且由此纳米颗粒表现出增强的稳定性。在该方法的另一个实施方案中,第一去污剂是np-9。在该方法的一些实施方案中,增强的稳定性选自蛋白酶抗性、氧化压力抗性、热压力抗性和对搅拌的抗性。在该方法的一些实施方案中,ps80:rsv f蛋白的摩尔比率为约35至约65。
23.在一些实施方案中,rsv f纳米颗粒包含一个或多个与ps80去污剂核心结合的rsv f蛋白三聚体。通过动态光散射测量,rsv f纳米颗粒,纳米颗粒具有约20nm至约60nm的平均直径。在rsv f纳米颗粒的一些实施方案中,每个rsv f蛋白三聚体包含选自具有对应seq id no:2的残基137-146的1-10个氨基酸的缺失的rsv f蛋白。在rsv f纳米颗粒的一些实施方案中,每个rsv f蛋白三聚体包含选自具有对应seq id no:2的残基137-146的1-10个氨基酸的缺失和失活的主要融合切割位点的rsv f蛋白。
24.在rsv f纳米颗粒的一些实施方案中,rsv f蛋白包含对应seq id no:2的残基137-146的10个氨基酸的缺失和通过将位置133、135和136的精氨酸突变为谷氨酰胺的主要
弗林蛋白酶切割位点的失活。在rsv f纳米颗粒进一步的一些实施方案中,rsv f蛋白包含seq id no:19或由其组成,其为成熟的肽。在rsv f纳米颗粒的一些实施方案中,rsv f蛋白包含seq id no:8或由其组成。含有rsv f纳米颗粒的疫苗制剂基本上包含具有一些全长肽的成熟肽(seq id no:8)。随着时间的推移,由于蛋白水解作用可能产生少量的截短的rsv f肽。然而,有利地,本文公开的rsv f纳米颗粒使这种降解最小化并且提供了延长的稳定性。
25.本技术还公开了增强的热稳定性的流感纳米颗粒。与之前的流感纳米颗粒不同,本文提供的方法和组合物显示出对胰蛋白酶的抗性和增强的热稳定性和因此的免疫原性。
26.对于埃博拉病毒,埃博拉病毒纳米颗粒包含附着于非离子去污剂核心的埃博拉病毒糖蛋白(gp)三聚体以及含有纳米颗粒的疫苗组合物,任选地与基质m皂苷佐剂组合。此外,本公开内容提供了通过施用含有埃博拉病毒纳米颗粒和皂苷佐剂的组合物来诱导针对人中埃博拉病毒的免疫响应的方法。还提供了防止埃博拉病毒感染的方法。
27.同样,提供含流感蛋白、ha、na或二者的纳米颗粒。提供显示胰蛋白酶抗性的ha纳米颗粒,其为正确折叠的指标。还提供了在疫苗制剂中使用流感纳米颗粒防止流感感染的方法。
28.附图简述
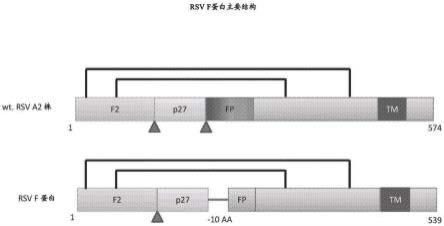
29.图1a和1b描述了rsv f蛋白的主要蛋白结构,伴随着多肽序列。图1a描绘野生型rsv a2株对比修饰的rsv f蛋白的主要蛋白结构。弗林蛋白酶切割位点由三角形表示。图1b描述了修饰的rsv f蛋白(seq id no:19)的氨基酸序列;其中f1域在浅色阴影文本中(残基1-84),f2域在深色阴影文本中(残基85-539),黑线连接的半胱氨酸形成二硫键,下划线天冬酰胺表明n连接的糖基化位点,浅色阴影垂直虚线表示弗林蛋白酶切割位点,且暗色阴影垂直虚线表示主要的切割位点。
30.图2描述了通过反相hplc的rsv f蛋白的分离峰,其中鉴定了四个主要物质并对应4个主要的峰。包含最低分子量物质(~51.2kda-~51.3kda)的峰是可溶三聚体;接下来的峰包含缺乏脂肪酸的全长三聚体(~64.5kda),且最终两个主要的峰为全长三聚体,其中所述三聚体分别包含棕榈油酸(~64.7kda)和棕榈酸(64.788kda)。
31.图3描述了在还原sds-page中rsv f蛋白的分离。最大分子量的蛋白包含高分子量物质;其后为包含f1和f2域的变体,随后是仅f1域及其变体,其后为仅f2域。
32.图4描述了覆盖包含rsv f蛋白的主要蛋白结构的90%氨基酸的lc-uv肽作图的色谱图输出。包括早期洗脱肽的组合的序列覆盖度发现为98%,确认了rsv f蛋白的氨基酸序列。
33.图5描述了与荧光检测(fld)组合的hplc的纯化rsv f蛋白的糖分析。检测到的主要聚糖结构是岩藻糖基化的man3聚糖。
34.图6是具有与ps80的核心结合的rsv f蛋白三聚体的rsv f纳米颗粒的电子显微照片。该图进一步描绘了
35.图7描述了rsv f纳米颗粒的粒径的动态光散射(dls)测量。dls测量显示纳米颗粒的大小通过可用的ps80和rsv f浓度来调节。在固定浓度的rsv f浓度下ps80的增加导致平均纳米颗粒大小(z-ave)的降低。
36.图8描述了纳米颗粒的样品浓度比分子量的离散分子量分布,其中rsv f的浓度和
ps80的百分比是变化的。纳米颗粒的最大信号强度用0.2%ps80和1mg/ml rsv f实现,表明纳米颗粒具有更高的均一性,并且确认粒度随ps80和rsv浓度组合的调节。
37.图9a和9b描绘了用可变ps80百分比和rsv f浓度产生的rsv f纳米颗粒类型的形状。图9a显示使用0.2%ps80和0.22mg/ml rsv f的组合物产生三种主要类型,单体/二聚体各向异性棒、球形寡聚物和它们的中间体。图9b揭示了使用0.05%ps80和0.22mg/ml rsv的组合物导致以单体/二聚体各向异性棒为主的群体,而使用0.05%ps80和1.0mg/ml的组合物导致主要为球形寡聚物的群体。
38.图10描述了应激物对纳米颗粒中rsv f蛋白的特定子部分的影响,如与对照相比具有相对丰度的减少的lys-c肽图中所示。应激物为50℃达2周,ph 3.7于25℃达1周,ph 10于25℃达1周,在25℃由过氧化氢氧化蛋白1周,并在25℃搅拌1周。
39.图11说明暴露于多种压力条件下的抗原性位点2(帕利珠单抗位点)的稳定性。与对照相比,百分比表示为相对丰度。越接近100%或更高,根据压力条件的弹性越大。数据说明纳米颗粒保持优异的抗原位点一致性,因此产生稳定的免疫响应。nsellslindmpitndqk/k;seq id no:20和lmsnn(seq id no:21)是抗原性位点ii的部分。
40.图12a、12b、12c和12d描述了在纳米颗粒组合物暴露于环境压力后通过显示鼠类免疫原性的rsv f纳米颗粒组合物的稳定性。小鼠对于抗-rsvf igg在第21天取样,对于pca滴度在第35天取样,且对于rsv/a中和滴度在第35天取样。图12a描绘了-70℃对照的结果。图12b描绘了暴露于50℃达两周的组合物的结果。图12c描述了在25℃下暴露于ph 10两周的组合物的结果。图12d描述了在25℃暴露于0.5%过氧化氢一周的组合物的结果。
41.图13描述了具有较高ps80的纳米颗粒的增强的蛋白酶抗性。经过18个月的时间,相对于在较低ps80百分比(0.015%)存在下配制的rsv f纳米颗粒,在存在较高ps80百分比(0.03%)存在下配制的rsv f纳米颗粒显示出较低的蛋白酶降解,如通过sds-page评估。另外,观察到较高的ps80量的高分子量(hmw)结构较少。
42.图14描述了相比rsv fa株病毒蛋白,mab与rsv f纳米颗粒结合的比较,其中位点i、ii和iv抗体的平衡解离常数揭示在每个位点的mab抗体结合是可比较的。
43.图15描述了竞争性结合测定的结果,其中将来自暴露于安慰剂条件、rsv/a感染、甲醛失活的rsv、rsv f纳米颗粒和rsv f纳米颗粒伴随明矾的棉鼠的血清中存在的抗体与位点i、ii和iv的结合进行了相互比较。
44.图16示出了本文公开的制造纳米颗粒的方法的工艺流程图。
45.图17示出了本文公开的制备ha纳米颗粒的方法的流程图。使含有杆状病毒表达的ha的sf9细胞生长,然后使用非离子去污剂np9提取ha。提取物在凝集素亲和柱上经历顺序纯化和去污剂交换步骤,然后过滤并配制成原料药物。
46.图18a至18f说明使用ha糖蛋白作为实例使用生产流感纳米颗粒的方法获得的步骤和结果。图18a显示了从细胞感染,通过细胞裂解和三种管柱用于提供纯化的纳米颗粒(tmae(三甲基氨基乙基),其次是小扁豆凝集素,随后是硫酸盐(so3-)柱)的连续纯化步骤。图18b说明使用tmae柱获得的色谱图。图18c说明使用小扁豆凝集素柱纯化步骤获得的色谱图。图18d说明使用硫酸盐柱纯化步骤获得的色谱图。图18e显示tmae和ll柱阶段的凝胶(右上图)。底部显示凝胶的蛋白质印迹。条带如左上图所示。图18f显示了具有来自so3-柱的洗脱液的凝胶。
47.图19a至19j示出了使用不同亚型和不同昆虫细胞系产生的ha纳米颗粒的纯度分析。图19a显示了含有a/新罕布什尔/1/2015ha的ha纳米颗粒对于ha和gp64的凝胶、蛋白质印迹。图19b显示ha带的定量,并且显示通过密度测定法ha纯度为99.1%。图19c显示含有a/瑞士/9715293/2013ha的ha纳米颗粒对于ha和gp64的凝胶、蛋白质印迹。图19d显示了ha带的量化并且显示通过光密度测定法ha纯度为94.5%。图19e显示含有a/香港/4801/2014ha的ha纳米颗粒对于ha和gp64的凝胶、蛋白质印迹。图19f显示了ha带的量化并且显示通过密度测定法ha纯度为93.3%。图19g显示了在sf9和sf22a细胞中含有b/普吉岛/3073/2013ha的ha纳米颗粒对于ha和gp64的凝胶、蛋白质印迹。右图显示了ha条带的量化,并显示通过密度测定法ha纯度为95.4%。图19h显示了在sf9细胞中含有b/布里斯班/60/2008ha的ha纳米颗粒对于ha和gp64的凝胶、蛋白质印迹。右图显示了ha条带的量化,并显示通过密度测定法ha纯度为96.7%。图19i使用rp-hplc测量ha纯度。图19j总结了使用三种流感a亚型和两种流感b亚型的ha纳米颗粒的数据。
48.图20显示了电子显微照片中的ha纳米颗粒。
49.图21a和21b显示了将ha纳米颗粒的ha三聚体对接至cryoem结构上(图21a)和将ha三聚体对接至包含ha和na蛋白二者的流感vlp上的比较(图21b)。
50.图22说明含有rsvf纳米颗粒的纳米颗粒组合物和ha纳米颗粒的代表的组合的研究。
51.图23a至23f说明根据图22中的研究获得的结果。图23a显示针对同源菌株的hai效价。图23b显示针对异源菌株的异源hai效价。图23c显示帕利珠单抗竞争性抗体。图23d显示针对rsv a株的中和抗体。图23e显示了针对rsv f蛋白的t细胞响应。用基质辅助的纳米颗粒获得的响应非常突出。图23f显示针对流感蛋白的t细胞响应。
52.图24a-24c说明获得具有增强的稳定性的ha纳米颗粒的过程和结果。值得注意的是,该纯化过程中的ph范围在ph7.0至ph7.4的中性范围内。图24a显示了使用表达ha蛋白的解冻细胞直至原料药物(bds)产物的纯化步骤。图24b显示了使用a/新罕布什尔/1/2015株的代表性纳米颗粒的色谱图。收集来自色谱柱的流出物,留下不需要的产物。图24c显示了小扁豆凝集素柱上去污剂交换步骤的色谱图。来自该柱的流出物与洗涤物一样被丢弃。用0.01%ps80进行洗脱。缓冲液如下:a1:25mm磷酸钠,ph7.2,150mm nacl,0.01%ps80,a2:25mm磷酸钠,ph7.2,500mm nacl,0.5%np9,a3:25mm磷酸钠,ph7.2,150mm nacl,0.1%ps80,b1∶25mm磷酸钠,ph7.2,150mm。然后将ha纳米颗粒浓缩并保存在0.05%ps80缓冲液中,如图24a所示。
53.图25a-25d显示了从几个株纯化抗胰蛋白酶纳米颗粒的结果。图25a显示了h1n1亚型的代表性株a/新罕布什尔/1/2015。图25b显示了b型流感的代表性株b/布里斯班/60/08ha。图25c显示了h1n1亚型的代表性株a/新罕布什尔/1/2015。在每种情况下,数据显示出高水平的生产和极好的纯度。
54.图25d提供了胰蛋白酶抗性纳米颗粒与使用将其暴露于低ph(约ph6.0)的方法产生的纳米颗粒的差示扫描量热法(dsc)比较。dsc数据显示使用中性ph方法的更高的热稳定性,确定了纳米颗粒中的ha蛋白正确折叠。
55.图26a-26c显示了来自在sf9细胞中表达的几种菌株的抗胰蛋白酶纳米颗粒对胰蛋白酶抗性增强的结果。在sf9昆虫细胞中制备的纯化的ha纳米颗粒是ha0。当暴露于胰蛋
白酶时,ha0在h1中的argaa344处被切割成ha1和ha2。正确折叠的ha三聚体当与增加浓度的胰蛋白酶一起温育时将抵抗进一步的切割。图26a显示中性ph纯化的b/布里斯班/60/08对胰蛋白酶具有抗性,因此被正确折叠(左图),而酸性ph纯化的b/布里斯班/60/08ha1对胰蛋白酶敏感,因此被错误折叠(右图)。图26b显示来自a/香港/4801/2014的经酸纯化但未经中性纯化的ha纳米颗粒被错折叠。图26c显示中性pha/新罕布什尔/1/2015(h1n)ha纳米颗粒的胰蛋白酶抗性。对应的酸性ph纯化的纳米颗粒对胰蛋白酶敏感(未显示)。
56.图27显示了商品蛋纯化流感疫苗(左图)和商业重组流感(右图)的胰蛋白酶敏感性。ha0在左侧图中被切割为ha1和ha2。然而,正确折叠的ha1对进一步的胰蛋白酶具有抗性。相反,商业重组疫苗显示ha1由胰蛋白酶降解,表明疫苗中存在错误折叠的蛋白。
57.图28a-28c显示抗体的诱导和免于感染的保护。在第0、14和28天,用5μg ebov/mak gp、使用50μg alpo4佐剂化的5μg ebov gp或使用5μg基质-m佐剂化的5μg ebov/mak gpsc免疫小鼠。在第28天获得血清并通过elisa评估抗ebov/mak gp igg(图28a)或抗埃博拉病毒中和抗体(图28b)。黑色条形图代表组gmt,误差条代表gmt的95%置信区间。在第42天,用1,000pfu小鼠适应的扎伊尔埃博拉病毒株1976 mayinga感染小鼠。攻击后,每天观察小鼠的发病率和死亡率,为期21天。图28c显示感染小鼠的kaplan-meier存活曲线。
58.图29a-29c显示了基质-m增强的ebov/mak gp特异性igg和igg亚类响应。小鼠在第0天和第21天用5μg的ebov/mak gp单独免疫或与2.5或5μg基质-m或50μgalpo4组合免疫。小鼠接受pbs作为安慰剂对照。在第一次注射后第21、28和60天,收集血清样品并测试ebov/mak gp-igg(图29a)、igg1(图29b)和igg2a(图29c)。结果代表两个单独的实验。黑色条形图代表组gmt,误差条代表gmt的95%置信区间。
59.图30a-30d显示了具有基质-m诱导的强cd4+t细胞和cd8+t细胞响应和多功能t细胞的埃博拉纳米颗粒。用覆盖整个gp序列的埃博拉/makgp肽池刺激脾细胞。使用培养基或pma(50ng/ml)加离子霉素(200ng/ml)作为阴性和阳性对照。计数第28天(图30a)和第60天(图30b)的ifn-γ阳性斑点并用elispot阅读器和相关软件分析。培养基对照的背景编号从肽刺激的孔的数目中减去,平均值来自一式三份。在第28天将来自同一组的所有五只小鼠的细胞集合,并且与单独的培养基或gp肽池或pma加离子霉素一起在37℃在bd golgi-stop/golgi-plug存在下一起温育6小时。然后收获细胞并对细胞表面标记和细胞内细胞因子进行染色。细胞因子的频率使用flowjo软件和flowjo boolean函数通过对活cd3+cd44+cd62-cd4+效应记忆t细胞或活cd3+cd44+cd62-cd8+效应记忆t细胞门控来分析。(图30c和30d)。单细胞因子、双细胞因子或三细胞因子的值代表表达三种细胞因子(ifn-γ,tnfα和il-2)中的任何一种、三种细胞因子中的任何两种细胞因子或全部三种细胞因子的细胞的频率的总和。结果代表了两个独立的实验。黑色条形表示组平均值,误差条表示标准偏差。
60.图31a-31e显示了基质-m增强的生发中心(gc)细胞响应。将新鲜脾细胞针对gc b细胞进行染色,并如材料和方法中所述获得数据。数据用flowjo软件进行分析。用invitrogen live/dead
tm
可固定黄色染料分析排除死细胞。(图31a),在b220
+
b细胞门控上将gc细胞定义为cd95
+
gl-7
+
,并且代表性小鼠的点图中的数字表示第28天同一组中所有五只小鼠的gc频率的平均值和标准偏差。显示了第28天(图31b)和第60天(图31c)的来自单个小鼠的gc细胞频率。通过乘以脾脏中脾细胞总数内的gc细胞频率来计算第28天(图31d)和第60天(图31e)的每脾的绝对gc细胞数。黑色条形图表示组平均值,误差条表示标准偏差。
61.图32a-32e:基质-m增强了脾脏中t
fh
细胞的频率和绝对数量。在第28天和第60天在脾脏中鉴定了定义为b220-cd49b-cd3+cd4+t细胞门控内的cxcr5
+
pd-1
+
t细胞的t
fh
细胞。显示了来自各组的t
fh
细胞分析的代表性点状图(图32a)。点状图中的数字是第28天的平均频率和标准偏差。显示了第28天(图32b)和第60天(图32d)的cd4+t细胞群体内t
fh
细胞的频率。通过乘以脾中脾细胞总数内的t
fh
细胞频率来计算第28天(图32c)和第60天(图32e)每脾的绝对t
fh
细胞数。黑色条形表示组平均值,误差条表示标准偏差。
62.图33a-33b显示骨髓中基质-m诱导的长寿浆细胞。将脾脏和骨髓细胞在ebov/mak gp涂覆的elispot板中温育过夜。通过与山羊抗小鼠igg-hrp温育然后进行点发育来检测ebov/mak gp特异性igg斑点。使用elispot阅读器对斑点数进行计数和分析。显示了每百万细胞中抗体分泌细胞(asc)的数量。(图33a)脾中第60天ebov/mak gp-igg asc数目;(图33b)骨髓中第60天ebov/mak gp-iggasc数目。黑色条形表示组平均值,误差条表示标准偏差。
63.图34a-34b显示埃博拉糖蛋白的特征。图34a显示了域结构。图34b显示具有切割的信号肽和成熟蛋白的n-和c-末端以及弗林蛋白酶切割序列的gp的氨基酸序列(seq id no:22)。
64.图35a-35c显示了本公开的纳米颗粒的电子显微照片。请注意,图35b说明非离子去污剂核心,其中至多5个三聚体与核心附接。在某些情况下,额外的三聚体不在视野之内。图35c示出了将gp三聚体覆盖到来自电子显微照片的纳米颗粒上的对接研究。
65.图36显示了三种单克隆抗埃博拉抗体检测埃博拉纳米颗粒的能力。
66.图37显示用于抗体与埃博拉gp纳米颗粒(seq id no:23-25)的表位结合的表面等离子体共振(spr)数据。
67.图38说明13c6抗体与本公开的纳米颗粒结合的高效力。
68.图39说明狒狒免疫原性研究设计。第1组为60μg gp纳米颗粒,无佐剂。第2组为60μggp纳米颗粒和800μg alpo4佐剂。第3组是60μg gp纳米颗粒和50μg基质-m佐剂。第4组为5μg gp纳米颗粒和50μg基质-m佐剂。
69.图40a-40b说明图39中狒狒免疫原性研究的结果。在第21天,第2组和第3组的ec90滴度增加。图40a两组的滴度大致相同,并且也针对含有来自makona埃博拉病毒和mayinga株的糖蛋白的纳米颗粒,所述mayinga株是埃博拉扎伊尔株的原型变体应变。到第31天,免疫响应在所有情况下都是显著的,特别是对于含有gp和基质m佐剂的组合物。值得注意的是,较低剂量的gp(5μg)以及较高剂量(60μg)强调了基质-m的剂量保留效应。
70.图41说明纳米颗粒组合物实现的持久免疫响应。数据显示在第0天和第21天施用后igg的ec 50 gmt响应。具有gp和基质-m的纳米颗粒显示出比明矾佐剂更好的响应,并且响应保持较高的时间。
71.图42说明涉及释放ifnγ的细胞的免疫响应的刺激。基质m与5μg gp纳米颗粒组合给予最大响应,然后是高剂量gp纳米颗粒(60μg)。使用明矾提供了分泌ifn-γ的外周血单核细胞(pbmc)低但可检测到的增加。
72.图43说明从狒狒中分离的cd4+和cd8+t细胞的ifnγ和tnf-α释放概貌,所述狒狒施用含有本文公开的gp纳米颗粒的疫苗组合物
73.图44说明从狒狒中分离的t细胞的细胞因子释放概貌,所述狒狒施用含有本文公
开的gp纳米颗粒的疫苗组合物。数据显示基质m-佐剂化的gp纳米颗粒组合物刺激具有更宽的细胞因子释放概貌的免疫响应。
74.图45显示在食蟹猴中进行的疫苗试验设计。动物在第0和21天施用5μg gp+50μg基质-m的疫苗组合物,然后在第42天进行攻击。用疫苗组合物处理动物33360、33362和33355。将安慰剂施用于动物33356。
75.图46显示了在食蟹猴试验中获得的igg滴度。到第28天,ec50滴度已超过105。
76.图47显示从处理的猕猴分离的ifn-γ分泌性pbmc细胞的诱导。集合来自埃博拉扎伊尔gp的肽并用于该测定。还测试了来自扎伊尔和苏丹株的共有肽。显示的数据说明了细胞在第0周(上图),第3周(中图)和第5周(下图)对这些肽的响应。注射安慰剂的对照动物显示基本无响应。相比之下,疫苗处理的动物显示在响应测试的多种肽中释放ifn-γ的细胞的强烈增加。
77.图48显示了猕猴的病毒载量和存活率。在攻击后第7天,安慰剂动物表现出病毒核酸的显着增加,表明埃博拉病毒感染。到第9天,动物被安乐死。所有接种的动物都存活下来。只有动物33360表现出可检测到的病毒核酸增加,其约为检测极限。到第10天,即使在那一只动物中,在rt-pcr检测它们的能力下,病毒rna水平也下降了。
78.图49显示了一项额外的猕猴研究的疫苗试验设计。给动物施用盐水或5μg gp+50μg基质-m。f组在第0周和第6周接受疫苗。g组在第0周和第3周接受疫苗。两组均在施用加强疫苗后6周进行了攻击。
79.图50显示了第二项研究的结果。在两组中,获得了抗-埃博拉gp的显着增加。在用活病毒攻击后的第18天,盐水对照动物的存活率为0%。相反,f组和g组的每只动物都存活,证明疫苗组合物具有保护性。
80.发明详述
81.本文公开了用于诱导免疫响应的纳米颗粒,用于生产和施用它们的方法以及含有它们的疫苗组合物。纳米颗粒提供围绕去污剂核心并与其结合的抗原,其导致通过多种措施提供增强的稳定性的结构。去污剂核心和抗原经由通过抗原和去污剂的性质介导的物理-化学相互作用结合。此外,纳米颗粒为免疫系统提供特别良好的抗原呈递,不受理论束缚,认为其来自去污剂核心周围抗原的定向。
82.一方面,本公开提供了含有重组病毒糖蛋白纳米颗粒的组合物。在特定方面,糖蛋白在合适的宿主细胞中重组表达。在一个实施方案中,宿主细胞是昆虫细胞。在一个示例性实施方案中,昆虫细胞是sf9细胞。
83.在具体的方面,本公开提供了免疫原性组合物,其包含纳米颗粒结构中的一种或多种病毒糖蛋白物质,其中糖蛋白为三聚体形式,并且每个纳米颗粒含有至少一种与非离子去污剂核心结合的三聚体。在特定方面,纳米颗粒由仅来自一种病原体的抗原如病毒糖蛋白组成。
84.纳米颗粒可用于预防和/或治疗病毒感染。因此,另一方面,本公开内容提供了引发针对病毒的免疫响应的方法。该方法涉及将免疫有效量的含有纳米颗粒的组合物施用至受试者。
85.本公开提供了包含纳米颗粒的疫苗组合物。组合物可含有具有来自多种病原体的抗原的纳米颗粒。在一些方面,疫苗组合物可以含有具有来自相同病毒种的多于一种病毒
株的抗原的纳米颗粒。在一些方面,疫苗组合物可以含有具有来自不同病毒种的抗原纳米颗粒。在另一个实施方案中,公开内容提供了药物包装或试剂盒,其包含填充有疫苗组合物的一种或多种组分的一个或多个容器。
86.在另一个实施方案中,本公开提供了配制对哺乳动物诱导针对感染或其至少一种疾病症状的免疫力的疫苗组合物的方法,其包括向所述组合物中添加有效剂量的纳米颗粒。所公开的纳米颗粒可用于制备刺激免疫响应的组合物,所述免疫响应赋予对感染剂的免疫力或实质性免疫力。因此,在一个实施方案中,本公开提供了诱导受试者中对感染或其至少一种疾病症状的免疫力的方法,其包括施用至少一种有效剂量的纳米颗粒。
87.在一些实施方案中,纳米颗粒与佐剂一起施用。在其他方面,纳米颗粒在没有佐剂的情况下施用。在一些方面,佐剂可以例如通过非共价相互作用与纳米颗粒结合。在其他方面,佐剂与纳米颗粒共同施用,但佐剂和纳米颗粒基本不相互作用。
88.本文还提供了制造纳米颗粒和疫苗组合物的方法。有利地,所述方法提供基本上不被其他蛋白污染的纳米颗粒,如与杆状病毒/sf9系统中蛋白的重组表达相关的蛋白。
89.定义
90.如本文以及所附权利要求中所使用的,除非上下文另外明确指出,否则单数形式“一”,“一个”和“所述”包括复数所指。因此,例如,对“一种蛋白”的指代可以指一种蛋白或这种蛋白的混合物,并且对“所述方法”的指代包括对本领域技术人员已知的等同步骤和/或方法的指代等等。
91.如本文所用,术语“佐剂”指当与免疫原组合使用时增强或以其他方式改变或修饰诱导针对免疫原的免疫响应的化合物。免疫响应的修饰可包括增强或扩大抗体和细胞免疫响应中任一种或两种的特异性。
92.如本文所使用的,当在数值之前时,术语“约”或“大约”表示该值加上或减去10%的范围。例如,“约100”包含90和110。
93.如本文所用,术语“免疫原”,“抗原”和“表位”是指诸如蛋白质的物质,包括糖蛋白和能够引发免疫响应的肽。
94.如本文所用,“免疫原性组合物”是包含抗原的组合物,其中组合物施用于受试者导致受试者体内发展对抗原的体液和/或细胞免疫响应。
95.如本文所用,“亚基”组合物,例如包含一种或多种选定抗原但不是来自病原体的全部抗原的疫苗。这样的组合物基本上不含完整病毒或此类细胞或颗粒的裂解物,并且通常由至少部分纯化的,通常基本上纯化的来自病原体的免疫原性多肽制备。本文公开的亚单位组合物中的抗原通常使用杆状病毒系统重组制备。
96.如本文所用,“基本上”是指分离物质(例如化合物,多核苷酸或多肽),使得物质形成其所含样品的大部分百分比。例如,在样品中,基本纯化的组分占样品的85%,优选85%-90%,更优选至少95%-99.5%,最优选至少99%。如果实质上更换组分,则样品中剩余的量少于或等于约0.5%至约10%,优选少于约0.5%至约1.0%。
97.如本文所用的术语“治疗(treat)”、“治疗(treatment)”和“治疗(treating)”是指用于获得有益的或期望的结果的方法,例如临床结果。为了本公开的目的,有益的或期望的结果可以包括抑制或压制感染或疾病的发生或进展;改善或减少感染或疾病症状的发展;或其组合。
98.如本文所用,“预防(prevention)”可与“预防(prophylaxis)”互换使用,并且可意指完全预防感染或疾病,或预防该感染或疾病症状的发展;感染或疾病或其症状发作的延迟;或随后发展的感染或疾病或其症状的严重程度降低。
99.如本文所用,“有效剂量”或“有效量”是指足以诱导减少病原体感染的至少一种症状的免疫响应的免疫原的量。例如通过测量中和分泌和/或血清抗体的量,例如通过空斑中和、补体固定、酶联免疫吸附(elisa)或微中和测定,可以确定有效剂量或有效量。
100.如本文所用,术语“疫苗”是指免疫原性组合物,如源自病原体的免疫原,其用于诱导针对提供保护性免疫的病原体的免疫响应(例如,保护受试者免于病原体感染和/或降低由病原体感染引起的疾病或病况的严重程度)。保护性免疫响应可以包括形成抗体和/或细胞介导的响应。取决于上下文,术语“疫苗”还可以指施用于脊椎动物以产生保护性免疫的免疫原的悬浮液或溶液。
101.如本文所用,术语“受试者”包括人类和其他动物。通常,受试者是人。例如,受试者可以是成人、青少年、儿童(2岁至14岁)、婴儿(1个月至24个月)或新生儿(至多1个月)。在某些方面,成年人是约65岁或65岁以上的老年人,或者大约60岁或更老。在某些方面,受试者是孕妇或预期怀孕的女性。在其他方面,受试者不是人类;例如非人灵长类动物;例如,狒狒、黑猩猩、大猩猩或猕猴。在某些方面,受试者可以是宠物,例如狗或猫。
102.如本文所用,术语“药物上可接受的”是指由美国联邦或州政府的管理机构批准或在美国药典、欧洲药典或其他公认的药典中列出的用于哺乳动物,并且更特别用于人的术语。这些组合物可用作用于在脊椎动物中诱导保护性免疫响应的疫苗和/或抗原组合物。
103.如本文所使用的,术语“约”是指所示数值加或减10%。
104.概述
105.来自病原体的抗原与非离子去污剂组合以提供具有改善的稳定性和优异的免疫原性的围绕去污剂核心的纳米颗粒。本公开还提供用于针对病原体接种受试者的方法和组合物。在特定方面,病原体是病毒。抗原通常是蛋白,通常是糖蛋白。还公开了含有发现可用作疫苗组合物的纳米颗粒的组合物。还公开了生产纳米颗粒和生产疫苗组合物的方法。
106.纳米颗粒结构和形态学
107.本公开的纳米颗粒包含与非离子去污剂核相关的抗原。图6上图显示了与去污剂核心结合的多种rsv f抗原的实例。图35显示了埃博拉纳米颗粒。有利地,纳米颗粒具有改善的对环境压力的抗性,使得它们提供增强的稳定性。
108.在具体的实施方案中,纳米颗粒由围绕非离子去污剂核心的多蛋白三聚体组成。例如,每个纳米颗粒可以含有1、2、3、4、5、6、7、8、9、10、11、12或15个三聚体。通常,每个纳米颗粒含有2至9个三聚体。在具体的实施方案中,每个纳米颗粒含有2至6个三聚体。本文公开的组合物可以含有具有不同数量的三聚体的纳米颗粒。例如,组合物可以含有纳米颗粒,其中三聚体的数量为2-9;在其他实施方案中,组合物中的纳米颗粒可以含有2-6个三聚体。在具体的实施方案中,组合物包含具有每纳米颗粒2至6个三聚体或每纳米颗粒2至9个三聚体的纳米颗粒的异质群体。在其他实施方案中,组合物可以含有基本上均质的纳米颗粒群体。例如,群体可能含有约95%具有5个三聚体的纳米颗粒。
109.这些抗原与纳米颗粒的含有非离子去污剂的核心结合。通常,去污剂选自聚山梨醇酯-20(ps20)、聚山梨醇酯-40(ps40)、聚山梨醇酯-60(ps60)、聚山梨醇酯-65(ps65)和聚
山梨醇酯-80(ps80)。去污剂的存在通过形成组织和呈递抗原的核心促进纳米颗粒的形成。因此,在某些实施方案中,纳米颗粒可以含有组装成多寡聚糖蛋白-ps80蛋白-去污剂纳米颗粒的抗原,其头部区域向外突出并且疏水区域和ps80去污剂形成由抗原包围的中心核心。
110.本文公开的纳米颗粒的z-ave大小的范围为约20nm至约60nm,约20nm至约50nm,约20nm至约45nm或约25nm至约45nm。除非另有说明,粒度(z-ave)通过使用malvern zetasizer的动态光散射(dls)测量。
111.本文公开的疫苗组合物中可包含几种纳米颗粒类型。在某些方面,纳米颗粒类型是各向异性棒状的形式,其可以是二聚体或单体。在其他方面,纳米颗粒类型是球形寡聚物。在其他方面,纳米颗粒可被描述为具有介于前两种类型之间的沉降特性的中间纳米颗粒。纳米颗粒类型的形成可以通过控制生产过程中的去污剂和蛋白浓度来调节。纳米颗粒类型可以通过测量沉降系数来确定。参见图9a和9b,例如显示rsv f纳米颗粒。另参见图8,通过调节去污剂和蛋白浓度说明对纳米颗粒大小的控制。
112.纳米颗粒的产生
113.本公开的纳米颗粒是非天然存在的产物,其组分在自然界中不会一起出现。通常,本文公开的方法使用去污剂交换方法,其中使用第一去污剂来分离蛋白,然后将第一去污剂换成第二去污剂以形成纳米颗粒。
114.包含在纳米颗粒中的抗原通常通过在宿主细胞中重组表达产生。可以使用标准重组技术。通常,使用杆状病毒系统在昆虫宿主细胞中表达蛋白。在优选的实施方案中,杆状病毒是组织蛋白酶-l敲除杆状病毒。在其他优选的实施方案中,所述杆状病毒是几丁质酶敲除杆状病毒。在其他优选的实施方案中,杆状病毒的组织蛋白酶-l和几丁质酶双重敲除。在昆虫细胞表达系统中可以获得高水平的表达。昆虫细胞的非限制性实例是草地贪夜蛾(spodoptera frugiperda)(sf)细胞,例如sf9、sf2 1、粉纹夜蛾(trichoplusia ni)细胞,例如high five细胞和果蝇s2细胞。
115.典型的转染和细胞生长方法可用于培养细胞。可以根据本领域公知的方法将载体,例如包含编码融合蛋白的多核苷酸的载体转染到宿主细胞中。例如,可以通过磷酸钙共沉淀、电穿孔、显微注射、脂质转染和使用多胺转染试剂的转染来实现将核酸引入真核细胞。在一个实施方案中,载体是重组杆状病毒。
116.生长宿主细胞的方法包括但不限于分批、分批进料、连续和灌注细胞培养技术。细胞培养是指细胞在生物反应器(发酵室)中生长和繁殖,其中细胞繁殖并表达蛋白(例如重组蛋白)用于纯化和分离。通常,细胞培养在无菌、受控的温度和大气条件下在生物反应器中进行。生物反应器是用于培养细胞的腔室,其中可以监测如温度、大气、搅拌和/或ph的环境条件。在一个实施例中,生物反应器是不锈钢腔室。在另一个实施方案中,生物反应器是预先灭菌的塑料袋(例如wave biotech,bridgewater,n.j.)。在其他实施例中,预先灭菌的塑料袋是大约50l至3500l的袋子。
117.纳米颗粒的去污剂提取和纯化
118.在宿主细胞生长后,可以使用去污剂和纯化方案从宿主细胞中收集蛋白。一旦宿主细胞生长48至96小时,将细胞从培养基中分离出来,加入含去污剂的溶液以溶解细胞膜,在去污剂提取物中释放蛋白。triton x-100和也被称为np-9的tergitol都是优选的用于提
取的去污剂。去污剂可以添加至约0.1%至约1.0%的最终浓度。例如,浓度可以是约0.1%、约0.2%、约0.3%、约0.5%、约0.7%、约0.8%或约1.0%。在某些实施方案中,该范围可以是约0.1%至约0.3%。优选地,浓度约为0.5%。
119.其他方面,可将不同的第一去污剂用于将蛋白从宿主细胞分离。例如,第一去污剂可以是双(聚乙二醇双[咪唑酰基羰基])、壬苯醇醚-9、双(聚乙二醇双[咪唑酰基羰基])、35、56、72、76、92v、97、58p、el、十乙二醇单十二烷基醚、n-癸基-n-甲基葡糖胺、正癸基α-d-吡喃葡萄糖苷、癸基β-d-吡喃麦芽糖苷、正十二烷酰基-n-甲基葡糖酰胺、正十二烷基α-d-麦芽糖苷、正十二烷基β-d-麦芽糖苷、正十二烷基β-d-麦芽糖苷、七乙二醇单癸醚、七乙二醇单十二烷基醚、七乙二醇单十四烷基醚、正十六烷基β-d-麦芽糖苷、六乙二醇单十二烷基醚、六乙二醇单十六烷基醚、六乙二醇单十八烷基醚、六乙二醇单十四烷基醚、igepa1 ca-630、igepal ca-630、甲基-6-0-(n-甲基氨基甲酰)-α-d-吡喃葡萄糖苷、壬乙二醇单十二烷基醚、n-壬基-n-甲基葡糖胺、n-壬基-n-甲基葡糖胺、八乙二醇单癸基醚、八乙二醇单十二烷基醚、八乙二醇单十六烷基醚、八乙二醇单十八烷基醚、八乙二醇单十四烷基醚、辛基-β-d-吡喃葡萄糖苷、五乙二醇单癸基醚、五乙二醇单十二烷基醚、五乙二醇单十六烷基醚、五乙二醇单己醚、五乙二醇单十八烷基醚、五乙二醇单辛醚、聚乙二醇二缩水甘油醚、聚乙二醇醚w-1、聚氧乙烯10十三烷基醚、聚氧乙烯100硬脂酸酯、聚氧乙烯20异十六烷基醚、聚氧乙烯20油基醚、聚氧乙烯40硬脂酸酯、聚氧乙烯50硬脂酸酯、聚氧乙烯8硬脂酸酯、聚氧乙烯双(咪唑基羰基)、聚氧乙烯25丙二醇硬脂酸酯、来自quillaja树皮的皂苷、20、40、60、65、80、85、tergitol类型15-s-12、tergitol类型15-s-30、tergitol类型15-s-5、tergitol类型15-s-7、tergitol类型15-s-9、tergitol类型np-10、tergitol类型np-4、tergitol类型np-40、tergitol类型np-7、tergitol类型np-9、tergitol类型tmn-10、tergitol类型tmn-6、triton x-100或其组合。
[0120]
然后可以使用离心将纳米颗粒从细胞碎片中分离出来。在一些实施方案中,可以使用梯度离心,例如使用氯化铯、蔗糖和碘克沙醇。可以使用其他技术作为替代或补充,例如标准纯化技术,包括例如离子交换、亲和和凝胶过滤层析。
[0121]
例如,第一柱可以是离子交换层析树脂,如emd tmae(emd millipore),第二柱可以是小扁豆(lens culinaris)凝集素亲和树脂,第三柱可以是阳离子交换柱如emd so3(emd millipore)树脂。在其他方面,阳离子交换柱可以是mmc柱或nuvia c prime柱(bio-rad laboratories,inc)。优选地,本文公开的方法不使用去污剂提取柱;例如疏水性相互作用柱。这种柱常用于在纯化过程中除去去污剂,但可能会对这里公开的方法产生负面影响。
[0122]
去污剂交换
[0123]
为了形成纳米颗粒,用于从宿主细胞中提取蛋白的第一去污剂基本上用第二去污剂代替以实现纳米颗粒结构。np-9是一种优选的提取去污剂。通常,当通过hplc测量时,纳米颗粒不含有可检测的np-9。第二去污剂通常选自由ps20、ps40、ps60、ps65和ps80。优选地,第二去污剂是ps80。为了保持纳米颗粒制剂的稳定性,第二去污剂和蛋白的比率保持在
一定范围内。
[0124]
在具体的方面,使用亲和层析进行去污剂交换以经由其碳水化合物部分结合糖蛋白。例如,亲和层析可以使用豆类凝集素柱。豆类凝集素是最初在植物中鉴定的蛋白,并且发现其与碳水化合物残基特异性地和可逆地相互作用。参见例如sharon and lis,“legume lectins
‑‑
a large family of homologous蛋白s,”faseb j.1990nov;4(14):3198-208;liener,“the lectins:properties,functions,and applications in biology and medicine,”elsevier,2012。合适的凝集素包括伴刀豆球蛋白a(con a)、豌豆凝集素、驴喜豆凝集素和小扁豆凝集素。由于其结合特性,小扁豆凝集素是去污剂交换的优选柱。例如参见实施例10。凝集素柱是市售的;例如capto小扁豆凝集素可从ge healthcare获得。在某些方面,小扁豆凝集素柱可以使用重组凝集素。在分子水平上,认为碳水化合物部分与小扁豆凝集素结合,释放蛋白的氨基酸以在去污剂周围聚结,导致形成提供具有多个抗原拷贝的纳米颗粒的去污剂核心,例如可以是锚定在去污剂中的二聚体、三聚体或四聚体的糖蛋白寡聚体。
[0125]
当去污剂在去污剂交换期间与蛋白一起温育以形成纳米颗粒时,在早期纯化步骤期间可以以高达约0.1%(w/v)存在,并且降低该量以达到具有最佳稳定性的最终纳米颗粒。例如,非离子去污剂(例如ps80)可以为约0.03%至约0.1%。优选地,为了改善稳定性,纳米颗粒含有约0.03%至约0.05%的ps80。在制剂中低于约0.03%ps80的量不表现出良好的稳定性。此外,如果ps80高于约0.05%存在,则形成聚集体。因此,约0.03%至约0.05%的ps80提供结构和稳定性的益处,其允许纳米颗粒的长期稳定性和降低的降解。
[0126]
去污剂交换可以用如上所述纯化的蛋白进行并纯化,冷冻保存,然后解冻以进行去污剂交换。
[0127]
纳米颗粒增强的稳定性和增强的免疫原性
[0128]
不受理论束缚,认为将抗原与非离子去污剂核心结合可提供优异的稳定性和抗原呈递。本文公开的纳米颗粒提供令人惊讶的良好稳定性和免疫原性。有利的稳定性对缺乏适当储存的国家使用的疫苗特别有用;例如,非洲的某些地点可能缺乏冷藏,因此在面临诸如埃博拉病毒和rsv等难以储存条件的地区普遍存在的疾病疫苗,尤其会因稳定性的提高而受益。此外,使用中性ph方法产生的ha流感纳米颗粒展现出优于已知重组流感疫苗的折叠。
[0129]
值得注意的是,现有的使用去污剂生产rsv疫苗的方法包括分裂疫苗,如colau等人在us 2004/0028698中所述,未能产生有效的结构。与本文所公开的具有围绕去污剂核心的蛋白的纳米颗粒不同,colau等人的组合物含有缺乏可识别的病毒结构的无定形材料,可能导致不能将表位有效地呈递给免疫系统。此外,公开的纳米颗粒具有特别增强的稳定性,因为去污剂核心周围的抗原(通常为糖蛋白)的定向在空间上阻碍了引起蛋白降解的酶和其他化学物质的进入。
[0130]
纳米颗粒具有增强的稳定性,如通过其在暴露于不同压力后保持免疫原性的能力所确定。稳定性可以通过多种方式进行测量。在一种方法中,可以通过模拟苛刻的储存条件来制备肽图,以确定各种处理后抗原蛋白的完整性,所述处理旨在对纳米颗粒施加压力。因此,稳定性的测定是与对照样品相比,应激样品中抗原肽的相对丰度。图12显示,即使在对rsv f纳米颗粒组合物施加各种不同的压力之后,也实现了强大的免疫响应。图13说明通过
使用ps80水平高于0.015%的纳米颗粒提供的改进的蛋白酶抗性。值得注意的是,在18个月时,0.03%的ps80相比0.01 5%的ps80显示截短物质形成减少50%。本文公开的纳米颗粒在2-8℃是稳定的。然而,有利的是,它们在25℃下也稳定至少2个月。在一些实施方案中,组合物在25℃稳定至少3个月,至少6个月,至少12个月,至少18个月或至少24个月。对于rsv-f纳米颗粒,稳定性可以通过测量截短的f1蛋白的形成来确定,如图13所示。有利地,相比对照rsv-f蛋白,响应于包括ph(ph3.7)、高ph(ph10),升温(50℃2周)和甚至过氧化物氧化在内的各种压力,本文公开的rsv-f纳米颗粒以90-100%的丰度保留完整的抗原位点ii,如通过肽谱测量,如图12所示。
[0131]
认为锚定在去污剂核心中的糖蛋白的位置通过减少不希望的相互作用而提供增强的稳定性。例如,可以通过屏蔽作用实现针对基于蛋白酶的降解的改进的保护作用,由此以本文公开的摩尔比将糖蛋白锚定在芯中导致阻碍蛋白酶进入的空间位阻。
[0132]
因此,在特定方面中,本文公开rsv-f纳米颗粒和含有它们的组合物,相比未处理的对照,其相应于选自下组的一种或多种处理保留90%至100%的完整位点ii肽:在50℃温育2周、在25℃在ph3.7培养1周、在25℃在ph10培养1周、在25℃搅拌1周、和在25℃与氧化剂如过氧化氢一起温育1周。另外,在这样的处理之后,组合物的功能被保留。参见图12a-12d。例如,与对照相比,中和抗体,抗rsv igg和pca效价被保留。
[0133]
增强的免疫原性通过由流感纳米颗粒实现的交叉中和示例。认为从核心伸出的流感抗原的定向提供了表位对免疫系统更有效的呈递。
[0134]
纳米颗粒抗原
[0135]
在典型的实施方案中,用于产生纳米颗粒的抗原是病毒蛋白。在一些方面,蛋白可被修饰但保留刺激针对天然肽的免疫响应的能力。在一些方面,蛋白固有地含有或适用于含有跨膜结构域以促进蛋白与去污剂核心的结合。蛋白经常是天然糖蛋白。
[0136]
rsv抗原
[0137]
一方面,病毒是呼吸多核体病毒(rsv),病毒抗原是融合(f)糖蛋白。rsvf蛋白的结构和功能已得到很好的表征。有关野生型结构的示例参见图1。用于本文所述组合物的合适的rsv-f蛋白可以源自rsv株,例如a2、long、atcc vr-26、19、6265、e49、e65、b65、rsb89-6256、rsb89-5857、rsb89-6190和rsb89-6614。在某些实施方案中,rsv f蛋白与其天然变体相比是突变的。这些突变赋予所需的特征,例如改善的蛋白表达,增强的免疫原性等。描述rsv-f蛋白结构的其他信息可以在swanson等人中找到。单体未切割的呼吸多核体病毒f抗原保留预灌注特异性中和表位。journal of virology,2014,88,11802-11810.jason s.mclellan等人。structure ofrsv fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody.science,2013,340,1113-1117。
[0138]
主要融合切割位于对应于seq id no:2的残基131至136。主要融合切割位点的失活可以通过突变位点中的残基来实现,其结果是弗林蛋白酶不能再识别共有位点。例如,主要弗林蛋白酶切割位点的失活可以通过在对应于野生型rsv f蛋白(seq id no:2)的精氨酸1 33、精氨酸135和精氨酸136的位置引入至少一个氨基酸取代来实现。在特定方面,精氨酸中的一个、两个或所有三个突变为谷氨酰胺。在其他方面,失活通过将野生型位点突变为以下序列之一来完成:kkqkqq(seq id no:14)、qkqkqq(seq id no:15)、kkqkrq(seq id no:16)和grrqqr(seq id no:17)。
[0139]
在具体方面,可以缺失对应于seq id no:2的酸137至145的1至10个氨基酸,包括下文所示的合适的rsv f蛋白的具体实例。seq id no3-13中的每一个可任选地用活性主要融合切割位点kkrkrr(seq id no:18)制备。seq id no:2中的野生型株具有在seq id no:3-13中校正的测序错误(a至p、v至i和v至m)。在宿主细胞中表达rsv-f蛋白后,n-末端信号肽被切割以提供最终序列。通常,信号肽被宿主细胞蛋白酶切割。然而,在其他方面,可以从宿主细胞中分离全长蛋白并随后切割信号肽。n-末端rsvf信号肽由seq id no:26(mellilkanaittiltavtfcfasg)的氨基酸组成。因此,例如,在表达和纯化期间从seq id no:8切割信号肽后,获得具有seq id no:19的序列的成熟蛋白并用于生产rsv f纳米颗粒疫苗。参见图1b。任选地,一个或多个直至全部rsvf信号肽氨基酸可以缺失、突变,或者整个信号肽可以缺失并用不同的信号肽替换以增强表达。保持初始甲硫氨酸残基以启动表达。
[0140][0141]
在一些方面,本文公开的rsv f蛋白仅通过融合结构域中的缺失从野生型株改变,任选地具有主要切割位点的失活。在其他方面,可以进行对rsv f蛋白的额外改变。通常,突变半胱氨酸残基。通常,n-连接的糖基化位点未突变。见图1b。此外,由于帕利珠单抗抗体与该位点结合的能力被保留,抗原性位点ii在本文中也被称为帕利珠单抗位点。莫维珠单抗(motavizumab)抗体也在位点ii结合。其他合适的rsv-f蛋白可见于美国公开us2011/0305727中(其通过引用并入),特别包括含有其中含有图1c中公开的残基100-150的序列的rsv-f蛋白。
[0142]
在某些其他方面,rsv f1或f2结构域可具有相对于如seq id no:2所示的野生型株的修饰。例如,f1结构域可以具有1、2、3、4、5、6、7、8、9或10个改变,其可以是突变或缺失。类似地,f2结构域可以具有1、2、3、4、5、6、7、8、9或10个改变,其可以是突变或缺失。f1和f2结构域可各自独立地保留与野生型序列至少90%、至少94%、至少95%、至少96%、至少
98%、至少99%或100%同一性。
[0143]
在一个具体实例中,rsv纳米颗粒药物产品可含有约0.025%至约0.03%ps80,其中rsv f范围为约270μg/ml至约300μg/ml,或约60μg/ml至约300μg/ml。在其他方面,纳米颗粒药物产品可以在组合物中含有约0.035%至约0.04%ps80以及300μg/ml至500μg/ml的rsv f。在其他方面,纳米颗粒药物产品可以在组合物中含有约0.035%至约0.04%ps80以及350-500μg/ml的rsv f。
[0144]
因为抗原和去污剂的浓度可以变化,所以各自的量可以称为非离子去污剂:蛋白的摩尔比。例如,通过使用由elisa/a280测量的抗原的ps80浓度和蛋白浓度及其各自的分子量来计算ps80比蛋白的摩尔比。用于计算的ps80的分子量为1310,以rsv f为例,rsv f的分子量为65kd。摩尔比计算如下:(ps80浓度
×
10
×
65000)
÷
(1310
×
rsv f浓度(mg/ml))。因此,例如,如图13所示,由蛋白测得的纳米颗粒浓度为270μg/ml,ps80浓度为0.015%和0.03%。它们的ps80比rsv f蛋白的摩尔比分别为27∶1(即0.015x10x65000/(1310x0.27))和55∶1。
[0145]
在具体的方面,摩尔比在约30∶1至约80∶1、约30∶1至约70∶1、约30∶1至约60∶1、约40∶1至约70∶1或约40∶1至约50∶1的范围内。通常,替代非离子去污剂是ps80并且摩尔比为约30∶1至约50∶1,ps80:蛋白。对于rsv-f糖蛋白,摩尔比为35∶1至约65∶1,特别是约45∶1的比率是特别稳定的。
[0146]
流感抗原
[0147]
纳米颗粒平台特别适用于将流感抗原递呈至受试者的免疫系统。生产流感纳米颗粒疫苗的先前方法已使用疏水性相互作用柱来去除去污剂或仅含有最小量的去污剂以减少产物纯化期间产生的非特异性相互作用。但是,现在已经发现,通过进行去污剂交换步骤可以生产具有非常优异性能的具有非离子去污剂核心的纳米颗粒。纳米颗粒显示出优异的稳定性,这可以通过对环境压力降解的抗性来证明,这允许延长的储存期,这对于疫苗是特别有用的特性。此外,纳米颗粒结构使得它以特别有利的方式递呈抗原。
[0148]
流感纳米颗粒作为疫苗特别有效,这是由于其诱导的抗体包含广泛的中和抗体。因此,一年内由施用的纳米颗粒诱导的抗体可以中和由随后几年“漂移”过程引起的流感病毒株。认为诱导这些广泛中和抗体的这些表位在先前的流感疫苗中完全没有暴露或有效暴露,或者表位在先前的制剂中不够稳定。本文公开的纳米颗粒通过递呈具有增强稳定性的锚定在非离子去污剂核心周围的交叉保护性表位解决了这些问题。
[0149]
最后,本文公开的方法提供了具有良好纯度的特别高产量的流感纳米颗粒,其一般在经济上是有利的,并且对于需要大量快速生产的病毒如流行性流感病毒特别有价值。
[0150]
在某些实施方案中,纳米颗粒可以含有ha或na蛋白。例如,纳米颗粒可以含有选自如下亚型的ha蛋白:h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16。纳米颗粒可含有选自如下亚型的na蛋白:n1、n2、n3、n4、n5、n6、n7、n8和n9。在系统发育上,ha和na蛋白被分成几组。对于ha,组1包含h1、h2、h5、h6、h8、h9、h11、h12、h13和h16,组2包含h3、h4、h7、h10、h14和h15。na也形成两组:组1包含n1、n4、n5和n8,组2包含n2、n3、n6、n7和n9。在某些方面,抗原可以与天然流感ha蛋白或na蛋白具有至少90%的同一性、至少95%的同一性、至少97%的同一性或至少99%。
[0151]
用于纳米颗粒的ha和na蛋白通常是全长序列。在某些方面,c端的部分可被去除。
[0152]
有利地,即使当共同施用本文公开的其他病原体纳米颗粒时,具有流感的组合物也可诱导针对异源流感病毒株的响应。通过诱导针对异源流感毒株的响应,实现更广泛的保护。因此,在特定方面,用基质m佐剂化的组合物诱导的同源hai效价为约800至约2000。在特定方面,异源hai效价为约1300。在具体方面,用基质m-佐剂化的组合物诱导的异源hai效价为约200至约400;例如,异源hai效价可以是约300。
[0153]
在某些方面,流感纳米颗粒是使用中性ph纯化产生的胰蛋白酶抗性纳米颗粒。在纳米颗粒的纯化和配制过程中,通过6.8-8.5之间的中性ph范围在可实现胰蛋白酶抗性。在具体方面,ha纳米颗粒的纯化和配制期间的ph范围为7.0至8.5、7.0至7.5或7.2至7.5。ha纳米颗粒稳定性可以通过差示扫描量热法(dsc)测量。dsc测量溶液中大分子的热力学概貌,特别是通过以受控方式改变温度来测量样品溶液与适当参照物(缓冲液/溶剂)之间的热能吸收差异。dsc提供数据作为转变中点(tm),定义为一半蛋白质变性/未折叠和一半天然/折叠状态的温度。在某些方面,本文中胰蛋白酶抗性ha纳米颗粒具有在约60℃至75℃范围的tm峰值;例如,tm可以是60℃、65℃、70℃或75℃。
[0154]
胰蛋白酶抗性表明ha蛋白适当折叠并因此提供了具有更好的稳定性和免疫原性的疫苗产品。ha蛋白的灵敏度在株与株间不同,并且本文公开的中性ph产生因此提供了用于使所有株尤其是ph敏感株的免疫原性最大化的方法。不受理论束缚,认为去污剂交换和中性ph水平的组合将ha蛋白保留在使其对蛋白酶特别是胰蛋白酶具有抗性的结构中。因此,通过将非离子去污剂核周围结合的ha蛋白与中性ph纯化组合,实现了具有特别好的稳定性和免疫原性的ha蛋白。另外,生产纳米颗粒的方法提供了用于疫苗的出色水平的蛋白。在具体的方面,如由a280所测量的,ha纳米颗粒以约10mg/l的细胞培养物至约30mg/l,或更高以约20mg/l至约30mg/l产生。
[0155]
胰蛋白酶抗性ha纳米颗粒可以如图24所述制备。简而言之,包括去污剂交换在内的多个步骤在高于ph 7.0的缓冲液中进行的;通常在约ph 7.2至约ph 7.4的范围。图25d提供了用胰蛋白酶抗性纳米颗粒获得的更好的热稳定性的实例。使用中性ph获得tff和mmc生产批次,而错误折叠的低ph批次实质上降解和/或错误折叠。
[0156]
埃博拉抗原
[0157]
本公开还提供了用于治疗、改善或预防埃博拉病毒感染和/或疾病的方法和组合物。具体地,组合物是疫苗组合物。有利的是,本文公开的疫苗组合物在动物模型中对致死攻击提供100%的存活率。当使用rt-pcr检测病毒核酸时,组合物还维持大约或低于可检测极限的病毒载量。
[0158]
一方面,本公开提供含有重组埃博拉病毒糖蛋白(gp)纳米颗粒与基于皂苷的佐剂组合的组合物。
[0159]
在具体的方面,本公开提供了免疫原性组合物,其包含纳米颗粒结构中的一种或埃博拉病毒gp蛋白,其中gp蛋白呈三聚体形式,并且每个纳米颗粒含有至少一个附接至非离子去污剂核心的三聚体。
[0160]
埃博拉gp纳米颗粒可用于预防和/或治疗埃博拉病毒感染。另一方面,本公开内容提供了包含埃博拉gp纳米颗粒的药学上可接受的疫苗组合物。在某些方面,来自多于一株的纳米颗粒存在于疫苗中。在另一个实施方案中,公开内容提供了药物包装或试剂盒,其包含填充有疫苗制剂的一种或多种成分的一个或多个容器。
[0161]
埃博拉糖蛋白
[0162]
用于制备纳米颗粒的埃博拉抗原通常是埃博拉糖蛋白(gp)抗原。抗原可以来自多个株。本文公开的组合物可以含有来自1、2、3、4、5或6种不同埃博拉病毒株的纳米颗粒。例如,所述株可能是makona、苏丹、扎伊尔、雷斯顿。在其他方面,埃博拉gp可以与这些株中的一种或多种共享氨基酸或核酸同一性。例如,gp可以与源自makona、苏丹、扎伊尔、雷斯顿病毒的一种或多种gp约80%相同、约85%相同、约90%相同、约95%相同、约97%相同、约98%相同或约99%相同,其中同一性是在蛋白或核酸的全长上测量的。在一些方面,埃博拉gp可包含seq id no:27或28或与其具有同一性的蛋白,或由其组成。
[0163]
genbank登录号aab81004(seq id no:27)提供了代表性的扎伊尔株序列。第一个下划线部分显示了gp1蛋白的n-末端。在纯化和配制成疫苗之前,在细胞中表达之后的处理过程中,先前的信号肽被切割。粗体显示的是弗林蛋白酶切割位点。粗体文字后,显示的是gp2蛋白的n端。图7a显示了蛋白结构的卡通。
[0164][0165][0166]
在genbank登录号ajg44192(seq id no:28)提供了makona分离物序列。如上所述,第一个下划线部分显示了gp1蛋白的n端。在处理过程中前面的信号肽被切割掉。粗体显示的是弗林蛋白酶切割位点。粗体文字后,显示的是gp2蛋白的n端。另见图7b。
[0167][0168]
在三种动物模型中证实了疫苗组合物刺激免疫响应的能力。首先,使用小鼠模型。评估了用基质-m、alpo4或盐水配制的重组ebov/mak全长gp纳米颗粒疫苗。用未佐剂化或alpo4佐剂化的ebov/mak gp免疫小鼠诱导适度的抗体和细胞响应;然而,当用基质-m佐剂化时,纯化的ebov/mak gp纳米颗粒具有高度免疫原性并且在鼠类攻击模型中具有保护性。用基质-m佐剂化的ebov/mak gp免疫小鼠导致抗ebov/mak gp igg和埃博拉病毒中和抗体的显着增加。用基质-m佐剂化的ebov/mak gp免疫可赋予100%的免疫保护免于致死性埃博拉病毒攻击,而未佐剂化的ebov/mak gp只有10%的保护性,并且在用ebov/mak gp和alpo4免疫的小鼠中未观察到保护。因此,在特定方面,本文公开的组合物预防埃博拉感染。
[0169]
ebov/mak gp与基质-m的共施用诱导产生平衡的igg1和igg2a亚类响应。在没有佐剂或具有alpo4的情况下,检测到最小的igg2a抗体。blaney et al.antibody quality and protection from lethal ebola virus challenge in nonhuman primates immunized with rabies virus based bivalent vaccine.plos pathog.2013;9(5):,显示在非人灵长类动物(nhp)的狂犬病/ebov嵌合体疫苗模型中,抗体同种型在病毒中和和抗埃博拉病毒攻击保护中发挥作用。鼠类igg2a抗体相当于能有效结合igg-fc受体(fcεr)和补体(c1q)的人igg1抗体(bruhns,p.properties of mouse and human igg receptors and their contribution to disease models blood.2012;119:5640-5649;vidarsson g,dekkers g,rispens t.igg subclasses and a1lotypes:from structure to effector functions.front.immunol.2014;5:520),并且可以帮助解决病毒感染,例如通过抗体依赖性细胞-介导的细胞毒性。在体内完全保护的所有抗体都是igg2a亚类;即与人igg1相同。因此,本文公开的组合物刺激igg1抗体的产生,作为保护性免疫响应的一部分。
[0170]
使用基质-m佐剂提供了cd4+和cd8+细胞因子分泌t细胞频率的剂量依赖性增加以及产生多于一种细胞因子的多功能t细胞的数量。观察到仅在基质-m佐剂化的ebov/mak gp组中观察到保护免受致命埃博拉病毒攻击,其与多功能t细胞的增强产生相关。
[0171]
基质-m的使用增加了脾脏中的gc b细胞和骨髓中长寿浆细胞的频率。gc是b细胞分化、体细胞超突变、抗体类别转换和记忆b细胞形成的微解剖位置。ebov/mak gp与皂苷佐剂基质-m共同施用也导致促进gc b细胞分化和发育的tfh细胞数量的增加。基质-m佐剂诱导的gc和tfh细胞的增加频率与抗体响应的增强幅度和更多数量的长寿浆细胞的诱导相关,这表明基质-m佐剂化的ebov/mak gp疫苗可诱导特别耐久的抗体响应。
[0172]
每种剂量的埃博拉gp可与佐剂组合。与纯化的ebov/mak gp纳米颗粒施用基质-m佐剂可提供对抗ebov/mak gp免疫响应的强力刺激,从而在小鼠模型中产生100%的保护效力。本文公开的组合物和方法提供抗ebov/makgp igg和埃博拉病毒中和抗体的更快速发作,igg2a浓度增加以及多功能cd4+和cd8+t细胞、tfh细胞、生发中心b细胞的频率增加和ebov/makgp特异性血浆b细胞在骨髓中的持久性。
[0173]
因此小鼠研究的分析证实,本文公开的组合物提供了完全的保护。为了进一步建立保护作用,研究在两个独立的非人灵长类动物模型中进行:狒狒和猕猴。参见perry等人,“the baboon(papio spp.)as a model of human ebola virus infection,”viruses.2012 oct 23;4(10):2400-16;geisbert et al.,“pathogenesis of ebola hemorrhagic fever in cynomolgus macaques:evidence that dendritic cells are early and sustained targets of infection,”am j pathol.2003 dec;163(6):2347-70”。因此,在本公开的一些方面中,保护作用包括在病毒暴露后约7天、约10天、约14天或约21天后rt-pcr检测能力下的病毒载量的减少。
[0174]
非人灵长类动物研究进一步证实,本文公开的组合物是保护性的。埃博拉gp纳米颗粒在没有佐剂和明矾或基质m佐剂的情况下进行评估。参见实施例23。狒狒的免疫响应非常稳定且持续。值得注意的是,包含基质m导致比明矾更高的免疫响应。猕猴模型的结果是特别出乎意料的。参见实施例24和24。所述组合物不仅保护免受活埃博拉疫苗攻击的保护,在用活病毒攻击后第10天埃博拉rna量不可检测。参见图48。值得注意的是,在一个猕猴受试者中,约第7天有一个小信号;但是,到第10天,水平已经回到探测极限以下。相反,未经处理的动物暴露于活埃博拉病毒导致感染和疾病,使得受试者在第9天安乐死。
[0175]
修饰的抗原
[0176]
本文公开的抗原涵盖那些抗原的变体和突变体。在某些方面,抗原可以与公开的抗原共享同一性。通常,并且除非在特定鉴定的抗原背景下具体定义,百分比同一性可以是至少80%、至少90%、至少95%、至少97%或至少98%。可以使用比对程序clustalw2计算百分比同一性,该程序可从www.ebi.ac.uk/tools/msa/clustalw2/获得。以下默认参数可用于成对比对:蛋白质量矩阵=gonnet;缺口开放=10;缺口延伸=0.1。
[0177]
在特定方面,纳米颗粒中含有的蛋白由该蛋白组成。在其他方面,纳米颗粒中包含的蛋白包含该蛋白。对蛋白本身的添加可以用于各种目的。在一些方面,抗原可以在n端、c端或两者延伸。在一些方面,延伸是对功能有用的标签,例如纯化或检测。在一些方面,标签含有表位。例如,标签可以是聚谷氨酸标签、flag标签、ha标签、多his标签(具有约5-10个组氨酸)、myc-标签、谷胱甘肽-s-转移酶标签、绿色荧光蛋白标签、麦芽糖结合蛋白标签、硫氧还蛋白标签或fc标签。在其他方面,延伸可以是与蛋白融合以增强表达的n-末端信号肽。虽然这种信号肽在细胞中表达期间常常被切割,但一些纳米颗粒可能含有具有完整信号肽的抗原。因此,当纳米颗粒包含抗原时,抗原可以含有延伸,因此当掺入纳米颗粒时可以是融
合蛋白。为了计算序列的同一性,不包括延伸。
[0178]
在一些方面,抗原可以被截短。例如,n端可截短约10个氨基酸、约30个氨基酸、约50个氨基酸、约75个氨基酸、约100个氨基酸或约200个氨基酸。取代n-末端,或除n-末端之外c-末端可以被截短或、。例如,c-末端可被截短约10个氨基酸、约30个氨基酸、约50个氨基酸、约75个氨基酸、约100个氨基酸或约200个氨基酸。为了计算具有截短的蛋白的同一性,在蛋白的剩余部分上测量同一性。
[0179]
组合纳米颗粒
[0180]
如本文所用,组合纳米颗粒是指诱导针对两种或更多种不同病原体的免疫响应的纳米颗粒。取决于具体的组合,病原体可以是相同物种的不同株或亚型,或者病原体可以是不同的物种。为了制备组合纳米颗粒,来自多种病原体的糖蛋白可以通过在去污剂交换阶段与它们结合而组合成单个纳米颗粒。糖蛋白与柱的结合然后去污剂交换允许在去污剂核心周围形成多种糖蛋白类型,以提供组合纳米颗粒。
[0181]
本公开还提供了通过组合两种或更多种纳米颗粒来诱导针对两种或更多种不同病原体的免疫响应的疫苗组合物,所述纳米颗粒各自诱导针对不同病原体的响应。任选地,疫苗组合物可以单独包含一种或多种组合纳米颗粒或与另外的纳米颗粒组合,目的是使针对多种病原体的免疫响应最大化,同时减少施用于受试者的疫苗组合物的数量。
[0182]
当某些方面与病原体关联时,这样的组合物是特别理想的。在一个例子中,组合物可以包含针对当局每年确定为形成特定年份的季节性流感的株的纳米颗粒。通常,对于季节性流感疫苗,疫苗组合物含有ha和/或na纳米颗粒,其诱导针对三种、四种或五种流感亚型的株的免疫响应。因此,不同的流感株可以组合在疫苗组合物中。在一些方面,组合纳米颗粒可以含有来自第一株的ha蛋白和来自第二株的na蛋白。在其他方面,纳米颗粒可以含有来自相同或不同亚型的一种或多种ha和一种或多种na蛋白。例如,纳米颗粒可以含有选自如下亚型的一种或多种ha纳米颗粒:h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16和/或选自如下亚型的一种或多种na纳米颗粒:n1、n2、n3、n4、n5、n6、n7、n8和n9。系统发育上,ha和na蛋白被分成几组。对于ha,组1包含h1、h2、h5、h6、h8、h9、h11、h12、h13和h16,组2包含h3、h4、h7、h10、h14和h15。na也形成两组:组1包含n1、n4、n5和n8,组2包含n2、n3、n6、n7和n9。在某些方面,抗原可以与天然流感ha蛋白或na蛋白具有至少90%的同一性、至少95%的同一性、至少97%的同一性或至少99%。
[0183]
在另一个实例中,流感病毒和rsv都引起呼吸系统疾病,并且ha、na和/或rsv f因此可以混合成组合纳米颗粒或多个纳米颗粒组合在疫苗组合物中以诱导针对rsv和一种或多种流感病毒株的响应。
[0184]
疫苗组合物
[0185]
本文公开的组合物可以预防性或治疗性使用,但通常是预防性的。因此,本公开包括用于治疗或预防感染的方法。该方法涉及向受试者施用治疗或预防量的本公开的免疫原性组合物。优选地,药物组合物是提供保护作用的疫苗组合物。在其他方面,保护作用可以包括改善暴露人群百分比中与感染相关的症状。例如,取决于病原体,与未经治疗的受试者相比,组合物可以预防或减少选自以下的一种或多种病毒疾病症状:发热疲劳、肌肉疼痛、头痛、喉咙痛、呕吐、腹泻、皮疹、肾和肝功能受损的症状、内出血和外出血。
[0186]
纳米颗粒可以在各种赋形剂、缓冲液等存在下配制成为疫苗施用。例如,疫苗组合
物可以含有磷酸钠、氯化钠和/或组氨酸。磷酸钠可以以约10mm至约50mm、约15mm至约25mm或约25mm存在;在特定情况下,存在约22mm磷酸钠。组氨酸可以约0.1%(w/v)、约0.5%(w/v)、约0.7%(w/v)、约1%(w/v)、约1.5%(w/v)、约2%(w/v)或约2.5%(w/v)存在。氯化钠当存在时可以是约150mm。在某些组合物中,例如流感疫苗,氯化钠可以以更高的量存在,包括约200mm、约300mm或约350mm。
[0187]
某些纳米颗粒,特别是rsv f纳米颗粒,在微酸性ph水平下具有改善的稳定性。例如,含有纳米颗粒的组合物的ph范围可以是约ph 5.8至约ph 7.0、约ph 5.9至约ph 6.8、约ph 6.0至约ph 6.5、约ph 6.1至约ph 6.4、ph约6.1至约ph 6.3,或约ph 6.2。通常,用于rsv f蛋白纳米颗粒的组合物大约为ph 6.2。在其他纳米颗粒中,组合物可能倾向于中性;例如,纳米颗粒流感可以是约ph 7.0至ph 7.4;经常约ph 7.2。
[0188]
佐剂
[0189]
在某些实施方案中,本文公开的组合物可以与一种或多种佐剂组合以增强免疫响应。在其他实施方案中,组合物在没有佐剂的情况下制备,因此可以作为无佐剂组合物施用。有利地,当以单剂量施用时,本文公开的无佐剂组合物可以提供保护性免疫响应。诱导强免疫响应的的无明矾组合物在大约60岁以上的成年人中特别有用。
[0190]
基于铝的佐剂
[0191]
在一些实施方案中,佐剂可以是明矾(例如alpo4或al(oh)3)。通常,纳米颗粒基本上与明矾结合。例如,纳米颗粒可以与明矾结合至少80%、结合至少85%、结合至少90%或结合至少95%。通常,纳米颗粒与组合物中的明矾结合92%至97%。每个剂量存在的明矾的量通常在约400μg至约1250μg的范围内。例如,明矾可以每剂量约300μg至约900μg、约400μg至约800μg、约500μg至约700μg、约400μg至约600μg或约400μg至约500μg的量存在。通常,对于120μg剂量的蛋白纳米颗粒,明矾以约400μg存在。
[0192]
皂苷佐剂
[0193]
含有皂苷的佐剂也可以与本文公开的免疫原组合。皂苷是从quillaja saponaria molina树的树皮中得到的糖苷。通常,使用多步纯化过程制备皂苷,得到多个级分。如本文所使用的,术语“来自quillaja saponaria molina的皂苷级分”通常用于描述quillaja saponaria的半纯化或限定的皂苷级分或其基本上纯的级分。
[0194]
皂苷级分
[0195]
生产皂苷级分的几种方法是合适的。级分a、级分b和级分c描述于美国专利no.6,352,697中并且可以如下制备。来自quil a的亲脂级分(粗水性quillaja saponaria molina提取物)通过色谱分离并用70%乙腈水溶液洗脱以回收亲脂级分。然后通过半制备性hplc使用在酸性水中的25%至60%乙腈的梯度洗脱来分离该亲脂性部分。本文称为“级分a”或“qh-a”的级分是或对应于在约39%乙腈洗脱的级分。本文称为“级分b”或“qh-b”的级分是或对应于在约47%乙腈洗脱的级分。本文称为“级分c”或“qh-c”的级分是或对应于在约49%乙腈洗脱的级分。关于级分纯化的其他信息见于美国专利号5,057,540。当按照本文所述进行制备时,quillaja saponaria molina的级分a、b和c各代表具有可确定性质的化学密切相关分子的组或族。其获得它们的色谱条件使得在洗脱概貌和生物活性方面的批次间再现性高度一致。
[0196]
其他皂苷级分已被描述。在ep 0436620中描述了级分b3、b4和b4b。级分qa1-qa22
描述为ep03632279b2,q-vac(nor-feed,as丹麦),quillaja saponaria molina spikoside(isconova ab,ultunaall
é
n2b,756 51 uppsala,瑞典)。可使用ep 0 3632 279 b2的级分qa-1、qa-2、qa-3、qa-4、qa-5、qa-6、qa-7、qa-8、qa-9、qa-10、qa-11、qa-12、qa-13、qa-14、qa-15、qa-16、qa-17、qa-18、qa-19、qa-20、qa-21和qa-22,特别是qa-7、qa-17、qa-18和qa-21。其如ep 03632279b2中所述获得,,特别是在第6页和在第8和9页的实施例1中获得。
[0197]
本文所述和用于形成佐剂的皂苷级分通常是基本上纯的级分;也就是说,这些级分基本上不存在来自其他材料的污染。在具体的方面,基本上纯的皂角级分可以含有至多40%重量、至多30%重量、至多25%重量、至多20%重量、至多15%重量、至多10%重量、至多7%重量、至多5%重量、至多2%重量、至多1%重量、至多0.5%重量或至多0.1%重量的其它化合物,例如其他皂苷或其他佐剂物质。
[0198]
iscom结构
[0199]
皂苷级分可以以被称为iscom(免疫刺激complex)的笼状颗粒的形式施用。可以如ep0109942 b1、ep0242380 b1和ep0180546 b1中所述制备iscom。在具体的实施方案中,可以使用运输和/或乘客抗原,如ep 9600647-3(pct/se97/00289)中所述。
[0200]
基质佐剂
[0201]
在某些方面,iscom是iscom基质复合物。iscom基质复合物包含至少一种皂苷级分和脂质。脂质至少是甾醇,如胆固醇。在特定方面,iscom基质复合物还含有磷脂。iscom基质复合物还可以含有一种或多种其他免疫调节(佐剂活性)物质,不一定是糖苷,并且可以如ep0436620b1中所述制备。
[0202]
在其他方面,iscom是iscom复合物。iscom复合物含有至少一种皂苷、至少一种脂质和至少一种抗原或表位。iscom复合物含有通过去污剂处理结合的抗原,使得一部分抗原整合到颗粒中。相比之下,iscom基质被配制为与抗原的混合物,并且iscom基质颗粒与抗原之间的结合通过静电和/或疏水相互作用介导。
[0203]
根据一个实施方案,整合到iscom基质复合物或iscom复合物中的皂苷级分或至少一种另外的佐剂(其也被整合到iscom或iscom基质复合物中或与其混合)选自quillaja saponaria的级分a、级分b或级分c,quillaja saponaria的半纯化制剂、quillaja saponaria的纯化制剂或任何纯化的子级分例如qa 1-21。
[0204]
在具体的方面,每个iscom颗粒可以含有至少两种皂苷级分。可以使用任何%重量的不同皂苷级分的组合。可以使用任何%重量的两个级分的任何组合。例如,颗粒可以分别含有任何%重量的级分a和任何%重量的另一种皂苷级分,例如粗皂苷级分或级分c。因此,在具体的方面,每个iscom基质颗粒或每个iscom复合颗粒可以包含0.1-99.9%重量、5-95%重量、10-90%重量、15-85%重量、20-80%重量、25至75%重量、30至70%重量、35至65%重量、40至60%重量、45至55%重量、40至60%重量或50%重量的一种皂苷级分,例如级分a和其余达100%的每种情况的其他皂苷,例如任何粗级分或任何其他级分例如级分c。重量以皂苷级分的总重量计算。美国公开申请号2013/0129770中公开了iscom基质复合物和iscom复合佐剂的实例。
[0205]
在具体的实施方案中,iscom基质或iscom复合物包含5-99%重量的一个级分,例如级分a和其余高达100%重量的另一级分,例如粗皂苷级分或级分c。重量以皂苷级分的总重量计算。
[0206]
在另一个实施方案中,iscom基质或iscom复合物包含40%99%重量的一个级分,例如,级分a和1%至60%重量的另一级分,例如粗皂苷级分或级分c。重量以皂苷级分的总重量计算。
[0207]
在又一个实施方案中,iscom基质或iscom复合物包含按重量计70%至95%的一种级分例如级分a,和按重量计30%至5%的另一级分例如粗皂苷级分或级分c。重量以皂角级分的总重量计算。在其他实施方案中,来自quillaja saponaria molina的皂苷级分选自qa 1-21中的任一个。
[0208]
除了含有皂苷级分混合物的颗粒之外,iscom基质颗粒和iscom复合颗粒可以分别仅使用一种皂苷级分形成。本文公开的组合物可以含有多个颗粒,其中每个颗粒仅含有一种皂苷级分。也就是说,某些组合物可以含有一种或多种不同类型的iscom-基质复合物颗粒和/或一种或多种不同类型的iscom复合物颗粒,其中每个单独的颗粒含有来自quillaja saponaria molina的一种皂苷级分,其中一种复合物中的皂苷级分与其他复合颗粒中的皂苷级分不同。
[0209]
在具体方面,一种类型的皂苷级分或粗皂苷级分可以被整合到一个iscom基质复合物或颗粒中,并且另一种类型的基本上纯的皂苷级分或粗皂苷级分可以被整合到另一iscom基质复合物或颗粒中。组合物或疫苗可以包含至少两种类型的复合物或颗粒,每种类型的复合物或颗粒具有整合成物理上不同颗粒的一种类型的皂苷。
[0210]
在组合物中,可以使用iscom基质复合物颗粒和/或iscom复合物颗粒的混合物,其中将一种皂苷级分quillaja saponaria molina和另一种皂苷级分quillaja saponaria molina分别并入不同的iscom基质复合物颗粒和/或iscom复合物颗粒中。
[0211]
iscom基质或iscom复合颗粒(其各自具有一种皂苷级份)可以以%重量的任何组合存在于组合物中。在具体的方面,组合物可以含有0.1%重量至99.9%重量、5%重量至95%重量、10%重量至90%重量、15%重量至85%重量、20%重量至80%重量、25%重量至75%重量、30至70%重量、35至65%重量、40至60%重量、45至55%重量、40至60%重量或50%重量的包含第一皂苷级分的iscom基质或复合物,其余部分由含有不同皂苷级分的iscom基质或复合物组成。在一些方面,剩余部分是一种或多种iscom基质或复合物,其中每种基质或复合物颗粒仅含有一种皂苷级份。在其他方面,iscom基质或复合颗粒可以含有多于一种的皂苷部分。
[0212]
在具体的组合物中,第一iscom基质或iscom复合颗粒中的皂苷级分是级分a,第二iscom基质或iscom复合颗粒中的皂苷级分是级分c。
[0213]
优选的组合物包含含有级分a的第一iscom基质和含有级分c的第二iscom基质,其中级分a iscom基质构成总皂角苷佐剂的约70%重量,并且级分c iscom基质构成总皂苷佐剂的约30%重量。在另一种优选的组合物中,级份aiscom基质构成总皂苷佐剂重量的约85%,级份c iscom基质构成总皂苷佐剂重量的约15%。因此,在某些组合物中,组分a iscom基质以组合物中皂苷佐剂总重量的约70%至约85%的范围存在,级份c iscom基质以组合物中皂苷佐剂总重量的约15%至约30%的范围存在。示例性的qs-7和qs-21级分,它们的生产和它们的用途描述于美国专利号5,057,540;6,231,859;6,352,697;6,524,584;6,846,489;7,776,343,and 8,173,141中,通过引用并入这些公开内容。
[0214]
其他佐剂
f蛋白的重组噬菌斑。然后通过感染sf9昆虫细胞扩增重组病毒。以~3moi(感染复数=病毒ffu或pfu/细胞)用杆状病毒感染昆虫细胞的培养物。感染后48-72小时收获培养物和上清液。通过以约800
×
g离心15分钟使粗制细胞收获物约30ml澄清。如下所述纯化获得的含有rsv f蛋白的粗制细胞收获物。
[0227]
非离子表面活性剂np-9(壬基酚乙氧基化物)用于膜蛋白提取方案。通过经过阴离子交换层析、小扁豆凝集素亲和/hic和阳离子交换层析进一步纯化np-9粗提物。洗涤后的细胞通过去污剂处理裂解,然后进行低ph处理,其导致bv和sf9宿主细胞dna和蛋白的沉淀。将中和的低ph处理裂解物澄清并在进行第二次低ph处理之前在阴离子交换和亲和层析上进一步纯化。
[0228]
使用亲和层析去除sf9/bv蛋白、dna和np-9,以及浓缩rsv f蛋白。简言之,小扁豆凝集素是含有钙和锰的金属蛋白,其可逆地结合含有葡萄糖或甘露糖的多糖和糖基化蛋白。将含有rsv f的阴离子交换流过级分装载到小扁豆凝集素亲和层析树脂(capto小扁豆凝集素,ge healthcare)上。糖基化的rsv f蛋白选择性结合树脂,同时去除柱流出液中的非糖基化蛋白和dna。用含有高盐和低摩尔浓度的甲基α-d-吡喃甘露糖苷(mmp)的缓冲液除去弱结合的糖蛋白。
[0229]
此外,柱洗液也可用于去污剂交换np-9去污剂与表面活性剂聚山梨醇酯80(ps80)。为了进行去污剂交换,在将rsv f糖蛋白结合到小扁豆凝集素柱后,将柱与0.1%ps80一起温育。用高浓度的mmp从小扁豆凝集素柱中洗脱rsv f蛋白。洗脱后,将rsv f蛋白三聚体组装成由包含在去污剂核心中的rsv f蛋白三聚体和ps80组成的胶束纳米颗粒。去污剂交换后,进行低ph失活步骤,然后在具有0.1%ps80的缓冲液存在下在硫酸盐柱上温育。
[0230]
将洗脱的材料在含有足够的ps80的溶液中稀释以提供用于大量储存的药物(ds),其中ps80:rsv f蛋白的摩尔比为约50。通过将rsv f纳米颗粒组合在包含22mm磷酸钠、0.03%ps80,ph6.2的磷酸盐缓冲液的溶液中实现充足的ds组合物。在去污剂交换过程中和之后的每个步骤中,组合物中抗原比ps80的比率保持在35-60的摩尔比。使用ps80浓度和rsv f浓度计算摩尔比(如通过elisa/a280所测量),和它们各自的分子量。ps80的分子量为1310,rsv的分子量为65kd。
[0231]
实施例2
[0232]
疫苗组合物的制备
[0233]
为了为施用的疫苗产品提供纳米颗粒,药物稀释在药物产品中,其中ps80:rsv蛋白的摩尔比率为约50。将药物解冻,稀释并填充入玻璃小瓶或预填充的注射器以在施用前储存在2-8℃。纳米颗粒与明矾佐剂结合。添加入明矾佐剂并混合以确保约95%的纳米颗粒与明矾结合,意味着在0.5ml体积中约0.4mg每120μg剂量的rsv f纳米颗粒。
[0234]
实施例3
[0235]
纳米颗粒中rsv f糖蛋白的表征
[0236]
我们通过各种分析技术分析了纳米颗粒中的蛋白结构。图3显示产生的rsv f蛋白的最高峰含有棕榈油酸(峰2a)。第二大峰含有棕榈酸(峰2b)。得到残留缺乏脂肪酸(峰5)和可溶形式(峰1)的峰。分析sds-page凝胶分离另外的变体,包括f1+2蛋白、f1、f1a、f1b和f1c部分以及f2。见图4。肽结构的分析使用肽图进行。见图5。为了评估rsv f糖蛋白上的聚糖结
构,进行hplc-fld。结果证明主要的聚糖结构是岩藻糖基化的。
[0237]
实施例4
[0238]
通过电子显微镜检查rsv f纳米颗粒
[0239]
通过电子显微镜观察如实施例1中制备的纳米颗粒。结果证实含有围绕去污剂核心的rsv f糖蛋白的纳米颗粒的形成。去污剂核心的确切组成仍不清楚。图6说明了所获得的纳米颗粒的种类。即使在去污剂交换之后,rsv f蛋白也保持三聚体结构。得到几种类型的纳米颗粒,其在三聚体/纳米颗粒数量和形态上不同。图6显示在去污剂核心周围可以找到多个三聚体。在突出显示的部分,七个三聚体显示在去污剂周围。图6中的主图显示了产生的去污剂核心周围的三聚体范围。左下图中rsv f蛋白三聚体的卡通结构说明了底部与去污剂核心结合的三聚体的定向,由附接于每种rsv f糖蛋白的脂肪酸促进。
[0240]
实施例5
[0241]
rsv f纳米颗粒的颗粒表征
[0242]
利用动态光散射(dls)通过测量布朗运动中颗粒的光散射模式的变化来确定纳米颗粒的尺寸分布概貌。纳米颗粒尺寸可以作为离子去污剂浓度的比rsv f纳米颗粒的浓度的线性函数来确定(见图7和8)。
[0243]
使用分析超速离心(auc)来测量样品浓度相对于作为施加的离心场的结果的旋转轴的概貌的级数。图8表明,基于存在的纳米颗粒的浓度纳米颗粒主要以两种形状出现。纳米颗粒种类包括单体和二聚体各向异性棒和球形寡聚物。这两种纳米颗粒之间的结构中间体以导致各向异性棒至球形寡聚物的那些之间的浓度形成。图9显示纳米颗粒类型可以通过调节rsv f蛋白的浓度来控制,较高浓度(1mg/ml)导致球形寡聚物的主要群体,而较低浓度(0.22mg/ml)导致在单体/二聚体各向异性棒的主要群体。这些数据说明去污剂的量和rsv f浓度可以控制以实现具有20nm到60nm的特定直径(z-ave)的纳米颗粒。
[0244]
实施例6
[0245]
纳米颗粒增强的稳定性:分子表征
[0246]
所使用的五种压力是在50℃在48小时、1周和2周的时间点的热压力;在48小时、4天和1周的低ph(在25℃下为3.7);在24小时、48小时和一周时间点的高ph值(10℃,25℃);在12小时、48小时和1周的时间点过氧化氢在25℃的氧化;和在4小时、24小时和1周时间点在25℃的物理搅拌。
[0247]
在多种压力处理后,评估主要结构的差异。图10显示了相对于对照,特定区域如何存活压力的比较。数据显示纳米颗粒在整个蛋白中具有优异的稳定性,并且只有使用过氧化氢的特别苛刻的氧化测试才能够将蛋白降解至任何特定程度。然而,即使这种处理也没有减少作为帕利珠单抗靶标的抗原位点ii的结构完整性。事实上,即使在苛刻的氧化条件下,rsv-f蛋白仅在结构上在位置63-82、237-258和360-364处恶化。因此,即使在遭受苛刻的压力之后,纳米颗粒仍基本保持完整。
[0248]
图11进一步量化了关于抗原位点ii的纳米颗粒稳定性。数据显示,响应于热压力、低ph、高ph和搅拌的每一种,在每个样品中的抗原性位点ii保持90%程度的完整。
[0249]
实施例7
[0250]
纳米颗粒增强的稳定性:保持的免疫原性特性
[0251]
评估实施例6中描述的应激疫苗组合物在鼠类模型中的免疫原性。通过在由0.15、
0.45、1.3、4和12μg/ml的rsv f蛋白组成的一系列rsv f剂量下经由两次肌内注射对小鼠施用疫苗。施用在以下条件下应激的rsv f组合物施加压力,并伴有对照(从-70℃贮藏解冻):50℃2周,25℃ph 10一周,25℃0.5%过氧化氢一周。
[0252]
针对抗rsv f igg的存在、pca效价和rsva中和抗体的存在评估免疫响应。物理和化学压力源在体内没有显着影响rsvf蛋白免疫原性。应激的样品诱导相似的抗rsv f igg抗体滴度和相当的功能性pca和rsv a中和滴度至无应激rsv f纳米颗粒疫苗组合物对照的滴度。(见图12a-12d)。总之,这些强制降解研究表明,即使暴露在严重的环境压力下,纳米颗粒也能诱导强免疫响应。
[0253]
实施例8
[0254]
纳米颗粒的蛋白酶抗性
[0255]
具有改进的稳定性的纳米颗粒的形成取决于用于生产纳米颗粒的ps80的量。图13说明相比0.015%ps80(即摩尔比为27),使用0.03%ps80(即摩尔比为55)形成纳米颗粒时稳定性至至多18个月的显著改善。左图显示了时间0两种浓度下产生的纳米颗粒的sds-page。数据显示纳米颗粒制剂获得与参考制剂类似的结果。具体而言,两者都显示f1的强健信号,而f1+2显示实质上没有降解。然后将每种制剂的等分试样在4℃下温育18个月,然后在sds-page上再次运行。右图和表格中的数据说明颗粒中仅含有0.015%的纳米颗粒导致截短的f1。相比之下,在纳米颗粒中使用0.03%制备的纳米颗粒说明对蛋白酶出色的抗性。我们认为,保持去污剂和蛋白的正确比例导致具有糖蛋白定向的纳米颗粒,蛋白酶敏感部分可能经由一些空间位阻机制受到保护。我们进一步观察到ps80浓度等于或高于0.06%会增加聚集物的形成。综合数据显示对于纳米颗粒稳定性的最佳ps80水平为约0.03%至约0.05%。
[0256]
实施例9
[0257]
ha纳米颗粒的纯化
[0258]
tmae柱用缓冲液a1(25mm tris ph7.5,70mm nacl,0.02%np90.5cv,流速:91.7cm 30ml/min)预平衡。样品以20ml/min(25min驻留时间)装载且随后用eq缓冲液a1(25mm tris ph7.5,70mm nacl,0.02%np-9)洗涤。然后使用1.25cv 15%缓冲液b(25mm tris ph8,1m nacl,0.02%np9),随后1.1cv100%b洗脱纯化的样品。图18b中显示代表性色谱图。将来自tmae柱的产物施加到用缓冲液a11(25mm磷酸钠ph6.0,10mm nacl,0.05%ps803cv(流速:147cm/h,13ml/min))预平衡的小扁豆凝集素亲和层析柱。样品以9.4min保留时间-6.5ml/min-73.5cm/h装载。装载后,用3cv缓冲液a12(25mm磷酸钠,ph6,500mm nacl,0.5%np-9)进行高盐洗涤。第一次洗涤后,通过用6cv缓冲液a11(25mm磷酸钠ph6.0,10mm nacl,0.05%ps80)洗涤柱来进行去污剂交换。随后用3cv的100%b洗脱包含ps80的纳米颗粒,b1:缓冲液b:25mm的磷酸钠ph6.0,10mm nacl,0.05%ps80,500mm甲基-α-d-吡喃甘露糖苷。代表性的色谱图如图18c所示。用3cv缓冲液a1(25mm磷酸钠ph6.0,10mm nacl,0.05%ps80)将来自小扁豆凝集素柱的产物应用于硫酸盐柱,用2cv缓冲液a1洗涤,然后用100%缓冲液b1(25mm磷酸钠ph 7.5,500mm nacl,0.05%ps80)洗脱。随后将洗脱的产物与50mm磷酸钠ph9以1∶1组合并无菌过滤。最终产物的ph为7.2。色谱图见图18d。图18e提供了从tmae和ll柱纯化过程中获得的多种产物的凝胶和蛋白印迹。图18f显示了s03-柱的洗脱液。
[0259]
实施例10
[0260]
ha纳米颗粒纯度的分析
[0261]
ha纳米颗粒的制备如图1和2所示。我们使用源自多个株的ha序列(a/新罕布什尔/1/2015,a/瑞士/9715293/2013,a/香港/4801/2014,b/普吉岛/3073/2013和b/布里斯班/60/2008)测量多个ha纳米颗粒制剂的纯度。数据显示在所有情况下获得高纯度制剂。通过凝胶密度测定法分析显示纯度在93%以上,范围从93%到97%。参见图19a至19h。我们还通过rp-hplc分析了三种a亚型株的纯度,发现纯度为83%至85%。见图19i。另外,我们测量了纳米颗粒大小。纳米颗粒显示出在22.0nm和29.9nm之间的直径。参见图19。
[0262]
实施例11
[0263]
ha超微结构分析
[0264]
进行电子显微镜检查以评估ha纳米颗粒的结构。我们发现,与其他糖蛋白一样,ha糖蛋白形成与ps80去污剂核心结合的三聚体。每个去污剂核心都含有多个三聚体。见图20。使用cryo-em 2d类平均法,我们将ha三聚体对接到纳米颗粒上。图21a显示了这些计算机对接实验的结果。上图显示ha三聚体在第一纳米颗粒上的拟合。下面的图显示了在另一纳米颗粒茎上的拟合。
[0265]
为了比较,进行vlp上的对接。vlp含有ha蛋白锚定于其中的脂质双层。参见图21b。中心图显示覆盖在从双层发出的茎上的ha蛋白结构。右上图和下图显示了直接向下注视单独(上图)的ha三聚体和具有相应ha结构覆盖于em图像上(下图)的游离ha em显微图。
[0266]
实施例12
[0267]
与rsv f纳米颗粒共施用的ha纳米颗粒的免疫原性分析
[0268]
对小鼠模型中纳米颗粒在疫苗中的免疫原性进行了评估。施用含有两种抗原的纳米颗粒(来自a/瑞士h3亚型的流感ha蛋白和rsv f蛋白)的组合。每个纳米颗粒也分开施用。疫苗单独施用或与佐剂alpo4或基质m皂苷佐剂一起施用。图22显示施用至组1-10的治疗。第10组,对照,未治疗。治疗在第0天和第21天施用。我们测量了hai针对异源和同源的攻击。参见图23a和23b。图23a显示针对同源攻击基质佐剂化的ha纳米颗粒刺激的特别强烈的响应。图23b显示,当与基质m一起施用时,针对异源流感病毒株a/德克萨斯/50/2012也获得了强hai响应,并且该响应不受与rsv f纳米颗粒共施用影响。
[0269]
我们还测量了rsv f纳米颗粒组分诱导与帕利珠单抗竞争的抗体形成的能力。图23c。数据显示单独施用rsv f纳米颗粒并与alpo4或基质m一起诱导80μg/ml至约700μg/ml的实质抗体滴度。当rsv f和流感纳米颗粒均被诱导时,在不存在佐剂或alpo 4的情况下获得约20μg/ml至40μg/ml的降低的响应。然而,使用基质m时,在单独或与ha纳米颗粒组合施用时rsv f响应是强大的。rsv中和抗体的测量显示出与pca抗体相似的模式。参见图23d。
[0270]
此外,针对抗体响应,我们测量了疫苗诱导的针对rsv和针对a型流感/瑞士/9715293/2013的t细胞响应。图23e和23f。当使用基质m作为佐剂时,数据显示针对两个靶点的ifn γ的强诱导。
[0271]
实施例13
[0272]
胰蛋白酶抗性的纳米颗粒的产生
[0273]
产生流感的某些方式可导致ha蛋白的胰蛋白酶敏感性,其改变折叠,导致疫苗制剂的免疫原性和稳定性降低。为了产生胰蛋白酶抗性的ha纳米颗粒,我们使用采用中性ph缓冲液的去污剂交换方式。参见图24a-c。
[0274]
用ha纳米颗粒bv载体moi=0.1感染sf9细胞;3e6细胞/ml。在第3天收集细胞并用缓冲的0.5%np9;ph 7.5裂解。接下来我们进行了阴离子交换色谱(fractogel tmae;emd)。图24b显示了说明性的色谱图。流出液包含ha。在阴离子交换柱之后,使用capto小扁豆凝集素柱(ge)使用含有0.01%ps80;ph 7.2的高盐/去污剂洗液进行去污剂交换并在0.01%ps80中洗脱。图24c显示去污剂交换过程的说明性色谱图。最后,我们使用切向流过滤(tff):50kd mwco过滤器;ph 7.2产生用于储存产品的原料药物(bds)。在tff阶段和之后,将ps80保持在0.05%,ph7.2的缓冲液中。
[0275]
实施例14
[0276]
胰蛋白酶抗性纳米颗粒分析
[0277]
使用实施例13中描述的方法和来自多种株的ha纳米颗粒进行评估。图25a显示株a/新罕布什尔/1/2015(h1n1)的产量为约20mg/l。b株流感纳米颗粒也具有出色的生产力和纯度。图25b显示作为原料药物评估的b株、b/布里斯班/60/08ha的产量和纯度。产量约为30毫克/升。图25c显示了h3n2株的产量,显示该方法获得约96%的纯度和约20mg/l的产量。
[0278]
热力学稳定性分析
[0279]
图25d提供了使用实施例13中的胰蛋白酶抗性中性ph方式产生的ha纳米颗粒与使用低ph提纯步骤的方式(如图18中所示)之间的热力学概貌比较。使用差示扫描量热法(dsc)来确定溶液中大分子的热力学概貌,具体而言,通过以受控方式改变温度来测量样品溶液与适当参照物(缓冲液/溶剂)之间的热能吸收差异。相对于流感ha样本,dsc允许我们可视化过渡中点(tm
′
s),定义为一半蛋白变性/去折叠,一半呈天然/折叠状态的温度。
[0280]
此外,dsc给了我们有关蛋白构象的信息,并且可以对经历不同处理条件的每种ha株粗略推测估计的稳定性概貌。使用b/布里斯班ha作为实例显示了通过在纯化期间将ha暴露于ph6.0的处理步骤纯化的ha与经由替代步骤纯化的ha(例如mmc树脂或tff膜)纯化的ha之间的差异。数据显示tm值强度较高,显示主峰和尖峰的tm至较高起始的转变,表明当通过替换步骤纯化时ha的正确折叠。然而,暴露于ph6.0的ha的数据显示tm值强度大大降低,显示主峰的tm的较早起始,具有显着加宽的峰,其呈现慢不对称折叠,且/或在较高温度下含有错误折叠的蛋白和聚集峰。其他株(a/cal,a/香港、a/新罕布什尔)也观察到类似的概貌。虽然如上所述低ph值产生纳米颗粒,且尽管其可能具有某种应用,但基于dsc数据中的这三种观察结果,我们得出结论:使用中性ph的替代处理步骤/条件产生ha蛋白,其具有显着更好的热力学和潜在的改善的稳定性概貌。
[0281]
胰蛋白酶抗性
[0282]
图26说明当如实施例13中所述制备纳米颗粒时获得的改进的胰蛋白酶抗性。为了测试胰蛋白酶敏感性,将ha样品稀释至0.24mg/ml,在37℃下用减少的胰蛋白酶温育60分钟,加入胰蛋白酶抑制剂停止消化,然后进行sds-page分析。比较图26的左图和右图说明增强的胰蛋白酶抗性。在sf9昆虫细胞中制备的纯化的ha纳米颗粒是ha0。当暴露于胰蛋白酶时,ha0在h1中的arg aa344处被切割成ha1和ha2。正确折叠的ha三聚体当与增加浓度的胰蛋白酶一起温育时将抵抗进一步的切割。中性ph纯化的b/布里斯班/60/08抵抗胰蛋白酶且正确折叠(左图)。酸性ph纯化的b/布里斯班/60/08ha1是胰蛋白酶敏感和错误折叠的(右图)。图26b和26c说明对于多种株实现了胰蛋白酶抗性。图26b显示菌株a/香港/4801/2014。中性ph纯化a/香港/4801/2014(h3n2)对胰蛋白酶具有抗性,且因此正确折叠(左图)。酸性
infectious diseases,fredrick,md评估第28天的血清样品的抗ebov/mak中和抗体响应。使用弹簧动力喷射注射器递送的汉坦病毒肺综合征(hantavirus pulmonary syndrome,hps)dna疫苗在兔和非人灵长类动物中引发了强中和抗体响应。curr gene ther.2014;14:200-210。对于该测定,去除水疱性口炎病毒g蛋白并用萤光素酶报告基团取代。使用表达扎伊尔埃博拉病毒1976(mayinga)gp的质粒pwrg/ebov-z76(opt)将该vsv萤光素酶表达核心假型化。用于提供假型埃博拉gp的质粒是表达扎伊尔埃博拉病毒1976(mayinga)gp的pwrg/ebov/mak-z76(opt)。在293t细胞中制备psv。将小鼠血清在56℃热失活30分钟,然后制备初始1∶20稀释液,然后在添加了10%(体积/体积)加热失活的fbs、100iu/ml青霉素和100μg/ml链霉素(cemem)的eagle
′
s minimum essential medium(emem)(life technologies)中进行5倍系列稀释。埃博拉病毒gp psv在cemem中稀释。向血清稀释液中加入等体积的含有4x103焦点形成单位和10%豚鼠补体(cedarlane)的psv溶液达到1∶40的最终起始稀释,然后在4℃温育过夜。接种在透明底部黑色96孔板(corning)中的vero细胞单层用50μl各psvs-血清混合物感染,然后在37℃下再温育18-24小时。弃去培养基,裂解细胞,根据renilla荧光素酶测定系统方案(promega#e2820)加入荧光素酶底物。使用tecan m200酶标仪测量闪光萤光素酶信号。将原始数据导出到graphpad prism 6.04版,其中数据基线校正为未处理的psvs信号。使用graphpad prism将数据拟合至四个参数逻辑非线性回归模型,然后从每个样品的曲线内插psvna50%(psvna50)的中和滴度。每个样品一式三份分析。测定阳性对照是来自用pwrg/ebov-z76(opt)(扎伊尔埃博拉病毒1976 mayinga gp dna疫苗)接种3次的兔的血清。
[0298]
通过酶联免疫吸附测定(elisa)定量ebov/mak gp特异性血清抗体。简言之,在2-8℃下用2μg/ml的ebov/mak gp(novavax)包被nunc maxisorp微量滴定板过夜。使用startingblock blocking buffer(pierce)在室温(rt)下将未反应的表面封闭1小时。将板在室温下与从1∶100开始的血清样品的5倍系列稀释液(2小时),偶联至辣根过氧化物酶(hrp)(southern biotech)的山羊抗小鼠igg(或igg1和igg2a)(1小时)、过氧化物酶底物3,3,5,5-四甲基联苯胺(tmb)(sigma)(10分钟)和tmb终止缓冲液(scy tek laboratories)顺序反应。在添加hrp偶联物和tmb试剂之前,将板用pbs/吐温(quality biologicals)洗涤三次。
[0299]
在spectramax plus平板阅读器(molecular devices)中在450nm下读板。使用softmax pro软件(molecular devices)将浓度响应与4参数拟合曲线拟合。抗体效价定义为其中存在50%最大抗体结合(ec 50)响应的最高稀释度的倒数。如果血清igg滴度超出较低的检测范围,则报告<100(起始稀释度)的滴度,并将50的值指定给样品以计算组几何平均滴度(gmt)。来自ibtbioservices(gaithersburg,md)的小鼠抗ebov/mak gp单克隆抗体(mab)(4f3)用作阳性对照。
[0300]
elispot测定,评估ifn-γ和ebov/mak gp特异性igg分泌细胞
[0301]
通过使用注射器的柱塞轻轻研磨组织来从单个脾脏制备单细胞悬液。使用具有21计针头的注射器通过将含有2%fbs的pbs冲洗穿过骨来制备单一骨髓细胞悬液。细胞用含有2%fbs的pbs洗涤两次并计数。根据制造商的程序使用小鼠ifn-γelispot试剂盒(ebioscience,san diego,ca)进行ifn-γelispot测定。简而言之,使用抗ifn-γ抗体(pbs中15μg/ml)以100μl/孔涂布elispot板(millipore,darmstadt,德国),在4℃过夜。将平板
用pbs洗涤四次,并在室温下用rpmi1640培养基加5%fbs封闭1-2小时。用具有覆盖整个ebov gp序列的11个重叠氨基酸(2.5μg/ml)的15-mer ebov gp肽的池刺激200μl体积的总共3x105个脾细胞。十四酰佛波乙酸酯(pma)(50ng/ml)加离子霉素(200ng/ml)用作阳性对照且培养基用作阴性对照。每个刺激条件一式三份进行。将测定板在37℃下在5%co2培养箱中温育过夜,并根据制造商的说明显色信号。使用elispot阅读器和immunospot软件(cellulartechnology,ltd.,shaker heights,oh)对斑点进行计数和分析。通过从gp肽刺激的孔中减去培养基对照中的背景数获得埃博拉-gp特异性斑点数。图中显示的数据是三个重复孔的平均值。为了测量gp特异性igg分泌细胞,将elispot板用ebov/mak gp(pbs中2.5μg/ml)包被并在4℃温育过夜。如上所述将平板洗涤并封闭。将3-5x105个脾细胞或骨髓细胞每孔一式三份铺板,并将平板在37℃温育过夜。第二天洗涤平板,加入山羊抗小鼠igg-hrp并温育1.5小时。如上所述显色并计数斑点。计算并显示来自三份孔的平均点数。
[0302]
细胞表型的表面染色和细胞因子的细胞内染色
[0303]
对于表面染色,首先将细胞与抗cd16/32抗体(克隆2.4g2)一起温育以阻断fc受体。为了表征生发中心细胞,将1x106个新鲜脾细胞在4℃与下列抗体的混合物温育30分钟:b220-percp、cd19-apc、gl7-bv421、cd95-pe-cy7(bd biosciences,ca)和黄色染料(life technologies,ny)。将细胞洗涤两次并悬浮在含有2%fbs的pbs中用于分析。为了染色t滤泡辅助细胞,将1x106个新鲜脾细胞与cxcr5-生物素温育,洗涤两次,然后与抗体包括cd3-bv650、b220-percp、cd4-pe-cy7、链亲和素-bv421、pd-1-apc、cd69-fitc和cd49b-pe(bd biosciences,ca)的混合物和黄色染料(life technologies)温育。将细胞洗涤两次并悬浮在含有2%fbs的pbs中用于分析。
[0304]
为细胞内细胞因子染色,将脾细胞以每孔1x106细胞每孔在96孔u底板中培养。如针对elispot培养物所述进行肽刺激。将平板在bd golgiplug
tm
和bd golgistop
tm
(bd biosciences)的存在下于37℃温育6小时。将细胞洗涤两次,在4℃与包含cd3-bv 650、cd4-percp、cd8-fitc、cd44-apc-cy7和cd62l-pe-cy7(bd pharmingen,ca)的细胞表面标记物的抗体混合物和黄色染料(life technologies,ny)温育。洗涤两次后,细胞用cytoffx/cytoperm(bd biosciences)在4℃固定30分钟,随后用bd perm/wash
tm
(bd biosciences)洗涤两次。将细胞与抗体一起在4℃下与ifn-γ-apc、il-2-bv 421和tnfα-pe(bd biosciences)温育过夜。将细胞洗涤并重悬于1xbd perm/wash缓冲液中用于数据采集。使用lsr-fortessa流式细胞仪(becton dickinson,san jose,ca)获取所有染色样品,并用flowjo软件版本xv10(tree star inc.,ashland,or)分析数据。
[0305]
统计分析使用sas软件版本9.4进行。来自具有tukey调整的配对比较使用组作为独立变量和log转换效价结果作为依赖变量以确定组间的显著性。
[0306]
实施例17
[0307]
ebov/mak gp诱导的抗体响应和保护性效力
[0308]
在小鼠模型中评估了有和没有佐剂的ebov/mak gp纳米颗粒疫苗的免疫原性。小鼠在第0、14和28天通过sc注射接种5μg单独的ebov/mak gp或在基质-m或alpo4佐剂中配制的ebov/mak gp。第28天(第二次免疫后14天)获得的血清分析表明,基质-m佐剂化的ebov/mak gp诱导了高水平的针对mayinga gp的抗原特异性igg抗体,其中几何平均滴度(gmt)为26,991。使用ebov/mak gp和基质-m免疫后获得的响应显着高于由单独ebov/mak gp(gmt=
266,p=0.001)或使用alpo4佐剂化的ebov/mak gp(gmt=436,p=0.0001)诱导的那些(图28a)。与单独的ebov/mak gp相比,alpo4佐剂仅提供抗ebov/mak gp igg的边际增加。
[0309]
使用埃博拉gp假病毒颗粒(psv)分析第28天血清的中和活性(图28b)。在没有佐剂的情况下,用ebov/mak gp单独免疫的小鼠的血清中的中和gmt效价为197,当ebov/mak gp用alpo4佐剂化时,观察到较低的效价(gmt=49,p=0.1)。从使用ebov/mak gp和基质-m免疫的小鼠的血清中观察到的中和效价具有6,463的gmt,比单独使用ebov/mak gp获得的高32倍。在该测定中,使用表达ebov 1976 mayinga株gp的psv,因为表达ebov/mak 2014株gp的psv不可用。因此,该测定是测量针对mayinga gp的抗ebov/mak gp的交叉中和活性。
[0310]
在第42天,在第28天给予第三次接种后两周,通过腹膜内接种1000pfu小鼠适应扎伊尔埃博拉病毒株1976 mayinga来攻击小鼠。对照小鼠在3天后开始死于感染,同时用ebov/mak gp单独接种或用alpo4佐剂化的ebob/mak gp接种的小鼠分别在第5天或第6天死亡。攻击感染后21天,用基质-m佐剂化的ebov/mak gp接种的所有小鼠和仅接种ebov/mak gp的一只小鼠存活并且健康。相比之下,由于埃博拉病毒感染,所有其他小鼠在第8天死亡或已安乐死(图28c)。
[0311]
实施例18
[0312]
埃博拉gp igg、igg1和igg2a响应的动力学
[0313]
为了更详细地进一步表征对基质-m-佐剂化的ebov/mak gp的免疫响应,两组balb/c小鼠(10只/组)用以2.5或5μg的基质-m佐剂化的5μg ebov/mak gp注射。单独注射pbs、ebov/mak gp或ebov/mak gp和alpo4的小鼠组作为对照。在第14、21、28和60天,通过elisa测量ebov/mak gp特异性igg和igg亚类(igg1和igg2a)。
[0314]
在第一次注射后的第14天,用ebov/mak gp和基质-m(2.5或5μg)注射的全部小鼠响应ebov/mak gp特异性igg(gmt分别为755和1,499,数据未显示)。ebov/mak gp组和ebov/mak gp伴随alpo4组中的10只小鼠均未产生ebov/mak gp特异性igg(数据未显示)。到第21天,在基质-m佐剂化的组中,对ebov/mak gp响应的igg进一步增加(图29a)。单独给予ebov/mak gp组或使用ebov/mak gp与alpo4的组中仍然没有响应。所有小鼠在第21天接受第二次注射。在第28天,接受基质-m(2.5或5μg)的小鼠的igg响应强劲增加,其中elisa gmt效价分别为3.0x105和4.9x105(图29a)。在仅ebov/mak gp和伴随alpo4的组的第28和60天,在一些小鼠中检测到特异性igg响应,但显着低于用ebov/mak gp伴随基质-m免疫的小鼠(图29a)。到第60天,与第28天相比,ebov/mak gp与2.5或5μg基质-m诱导的抗gp igg的效价没有显着减少,分别比伴随alpo4的ebov/mak组高67倍和139倍(图29a)。
[0315]
还确定了ebov/mak gp特异性igg1和igg2a响应。与总igg类似,在第28天和第60天,基质-m佐剂化的ebov/mak gp疫苗诱导了高的抗gp igg1和igg2a水平(图29b和29c)。相比之下,给予单独的ebov/mak gp的10只小鼠中只有一只和给予ebov/mak gp和alpo4的10只小鼠中的4只在第28天产生低水平的igg1(图29b)。在第60天,从给予ebov/mak gp伴随alpo4的组中的所有五只剩余小鼠的血清中检测到抗原特异性igg1,但是平均效价比给予ebov/mak gp伴随2.5或5.0μg基质-m的组分别低51和41倍(图29b)。此外,在第28天和第60天,ebov/mak gp单独不诱导可检测的igg2a抗体。
[0316]
实施例19cd4+、cd8+和多功能t细胞响应
[0317]
我们接下来通过在elispot测定中用ebov/mak gp肽离体刺激脾细胞后测量分泌
ifn-γ的t细胞的数量,评估对不同ebov/mak gp制剂的t细胞响应。在第28天,ifn-γ分泌细胞在来自使用ebov/mak gp伴随基质-m免疫的小鼠的脾脏中以基质-m剂量依赖性的方式增加(图30a,30b)。在接受ebov/mak gp伴随5.0和2.5μg基质-m的组中,ifn-γ分泌细胞的平均数分别比仅接受ebov/mak gp高17倍和10倍且比接受伴随alpo4的ebov/mak gp的组分别高8倍和5倍(图30a)。
[0318]
到第60天,来自用伴随5μg基质-m的ebov/mak gp免疫的小鼠的脾脏中ifn-γ分泌细胞的数量仍然比仅用ebov/mak gp免疫的小鼠的脾脏高12倍且比来自用伴随alpo4的ebov/mak gp免疫的小鼠的脾中高3倍(图30b)。在用来自伴随2.5μg基质-m的ebov/mak gp免疫的小鼠的脾中ifn-γ分泌细胞的数量增加也在第60天维持但低于使用5μg基质-m的水平。
[0319]
我们进一步通过细胞因子的细胞内染色结合细胞表面标记物评估了基质-m诱导的cd4+和cd8+t细胞响应。通过第28天的流式细胞术染色分析脾细胞显示来自伴随基质-m的ebov/mak gp组的cd4+和cd8+t细胞分泌ifn-γ、tnfα和il-2(图30c和30d)。来自伴随基质-m的ebov/mak gp组的脾中的细胞因子分泌性cd4+和cd8+t细胞的频率比对照小鼠、仅接受ebov/mak gp或伴随alpo4的ebov/mak gp小鼠中观察到的基线或最小响应高得多(图30c和30d)。还在第28天评估同时产生两种或更多种细胞因子(ifn-γ、tnfα和il-2)的t细胞的频率。产生两种或三种细胞因子的cd4+和cd8+t细胞仅在来自用伴随基质-m的ebov/mak gp免疫的小鼠脾中以显着水平检测。
[0320]
实施例20
[0321]
生发中心和t滤泡辅助细胞响应
[0322]
通过流式细胞术染色分析脾中gc b细胞的频率和绝对数量(图31a)。分析显示在第28天(第二次注射疫苗后第七天),与安慰剂、仅ebov/mak gp或伴随alpo4的ebov/mak gp相比(分别为0.38、0.41和0.44%),使用2.5和5μg的基质-m佐剂化的ebov/mak gp分别具有1.22和2.12%gc频率的响应(图31b)。因此,脾脏中的绝对gc细胞数量在接受基质-m的组中也增加(图31c)。到第60天,频率和绝对数量返回到背景水平(图31d和31e)。
[0323]
在第28天的t
fh
细胞频率分析显示伴随2.5或5μg基质-m的ebov/mak gp比仅ebov/mak gp或伴随alpo4的ebov/mak gp诱导更高的t
fh
细胞频率(图32a和32b)。因此,通过伴随基质-m的ebov/mak gp相比仅ebov/mak gp或伴随alpo4的ebov/mak gp也增强了t
fh
细胞的绝对数量(图32c)。到第60天,t
fh
细胞的频率和绝对数量回缩到接近背景水平(图32d和32e)。
[0324]
实施例21
[0325]
ebov/mak gp-特异性浆细胞
[0326]
为了评估基质-m对ebov/mak gp特异性浆细胞的影响,在免疫后第60天分析脾和骨髓中igg产生细胞的数量。第60天的分析表明在用基质-m佐剂化的ebov/mak gp疫苗免疫的小鼠的脾中只有少数ebov/mak gp特异性igg分泌细胞(<6/106个脾细胞)(图33a)。在仅用ebov/mak gp和伴随alpo4的ebov/mak gp免疫的小鼠的脾脏中未检测到igg分泌细胞(图33a)。相比之下,来自接受基质-m佐剂化的ebov/mak gp(图33b)的小鼠的骨髓中出现大量的ebov/mak gp特异性igg分泌细胞,证明长寿浆b细胞的形成。
[0327]
实施例22
[0328]
抗体与纳米颗粒结合的表征
[0329]
我们测试了数种抗埃博拉抗体与纳米颗粒结合的能力。抗体是13c6、13f6、6d8和kz52。ec50曲线和数值显示在图36中,另外的结合动力学数据显示在图37中。图38显示了使用13c6作为参考的效力数据。四种抗体中的三种对gp表现出出色的结合。
[0330]
实施例23
[0331]
非人类灵长类研究:狒狒
[0332]
为了证实在非人灵长类动物模型中的小鼠中获得的结果,进行了狒狒研究。该研究的设计如图39所示。四个小组成立。第1组是对照组。第2组用接受伴随alpo4的抗原。第2组和第3组分别接受伴随50μg基质-m的60μg和5μg抗原。狒狒在第0天和第21天进行免疫。针对makona gp和mayinga gp都获得了强响应。见图40。额外的分析证实了这种响应是长效的。图41显示了igg在较晚的时间点针对makona的ec50值。数据证实响应是持续的。
[0333]
其他研究证实,免疫后ifn-γ水平显着增加。图42显示基质m与gp组合比使用明矾佐剂增加的更多。有趣的是,较低剂量的5μg gp使ifn-γ水平增加更明显。在图43中显示了t细胞中的tnf-α和ifn-γ响应,其中细胞因子响应如图44所示。同样,gp和基质m在每种情况下的响应都比明矾更明显。这些数据强调了狒狒模型中所公开制剂的强免疫响应。
[0334]
实施例24
[0335]
非人灵长类研究:猕猴研究1
[0336]
为进一步证实纳米颗粒的保护作用,如图45所示进行猕猴研究。在第0天和第21天用所示疫苗肌内免疫猕猴,并在第42天攻击。在第0天和第28天测量抗gp响应。如图46所示,免疫猕猴显示出抗igg抗体的显着诱导。免疫响应的特征如图47所示表征。在第0、3和5周测量响应于多种肽池的ifn-γ分泌细胞。结果证明免疫的猕猴诱导免疫猕猴中的ifn-γ分泌细胞。
[0337]
动物存活是显着的。图48。到第7天,安慰剂治疗的猕猴中埃博拉病毒载量为107。到第9天,安慰剂动物被安乐死。相反,处理的动物100%存活。值得注意的是,在几乎所有时间点的几乎所有动物中,免疫响应能够使病毒载量通过rt-pcr检测不到。动物33362在第7天显示病毒载量比可检测极限高约10%。然而,到第10天,水平下降到检测它们的检测能力之下。
[0338]
实施例25
[0339]
非人灵长类研究:猕猴研究2
[0340]
第二项研究在猕猴中进行。动物在0周时给药5μggp+50μg基质-m,在3周或6周后给予后续加强。然后分别在9周和12周用野生型埃博拉病毒攻击免疫的动物。图49。
[0341]
igg的elisa数据显示在图50中。左图显示在第一次注射后3周,高效价已经发展并持续。右图说明施用间隔6周的动物的结果。这些动物在第二次加强施用后两周显示出显着增加,说明初次-加强方式的有益效果。
[0342]
疫苗组合物在猕猴中充分保护。在用活病毒攻击18天后,盐水对照处理的小鼠全部死亡。相反,用疫苗组合物免疫的100%猕猴在攻击中存活。总的来说,这些数据证实,由组合物刺激的免疫响应无论在3周内或6周内加强施用都是保护性的。
[0343]
更具体地,本技术提供下列各项:
[0344]
1.疫苗组合物,其包含:
[0345]
(i)含有非离子去污剂核心和病毒糖蛋白的纳米颗粒,
[0346]
其中所述病毒糖蛋白与所述核心结合且所述去污剂以约0.03%至约0.05%存在;和
[0347]
(ii)药物上可接受的缓冲剂;且其中所述非离子去污剂选自下组:ps20、ps40、ps60、ps65和ps80。
[0348]
2.项1的疫苗组合物,其中所述病毒糖蛋白选自下组:rsv f蛋白、埃博拉糖蛋白、狂犬病病毒g蛋白、流感ha蛋白、流感na蛋白及其组合。
[0349]
3.项2的疫苗组合物,其中所述病毒糖蛋白是rsv f蛋白且非离子去污剂比病毒糖蛋白的摩尔比率为约30∶1至约60∶1。
[0350]
4.项3的疫苗组合物,其中所述rsv f蛋白包含对应seq id no:2的氨基酸137-146的1-10个氨基酸的缺失和对应seq id no:2的氨基酸131-136的失活的主要弗林蛋白酶切割位点,其中所述主要弗林蛋白酶切割位点由突变失活。
[0351]
5.项4的疫苗组合物,其中所述组合物基本上无任何其他去污剂。
[0352]
6.项4的疫苗组合物,其中所述rsv-f蛋白选自下组:seq id no:1-13和缺乏部分或全部n末端信号肽的seq id no:1-13的变体。
[0353]
7.项6的疫苗组合物,其中所述rsv f蛋白包含seq id no:19。
[0354]
8.项6的疫苗组合物,其中所述rsv f蛋白由seq id no:19构成。
[0355]
9.项8的疫苗组合物,其中所述非离子去污剂是ps80。
[0356]
10.项9的疫苗组合物,其中所述摩尔比率为约50。
[0357]
11.项1的疫苗组合物,其中所述药物上可接受的缓冲剂包含
[0358]
(i)15mm至25mm的磷酸钠;
[0359]
(ii)约150mm的nacl;
[0360]
(iii)0.25%至2%w/v的组氨酸;
[0361]
其中所述组合物ph为5.8至6.4。
[0362]
12.项11的疫苗组合物,其中所述药物上可接受的缓冲剂包含
[0363]
(i)约22mm的磷酸钠;
[0364]
(ii)约150mm的nacl;
[0365]
(iii)约1%的组氨酸;
[0366]
其中所述组合物的ph为约6.2。
[0367]
13.项1-12任一项的疫苗组合物,其中所述rsv f蛋白进一步包含与所述蛋白连接的脂肪酸。
[0368]
14.项1的疫苗组合物,其中所述纳米颗粒具有约20nm至约60nm的z-ave直径。
[0369]
15.项2的疫苗组合物,其中所述疫苗组合物包含约60μg/ml至约290μg/ml浓度的rsv f蛋白。
[0370]
16.项1的疫苗组合物,其中所述纳米颗粒的形状是球形寡聚物或各向异性棒。
[0371]
17.项1-16任一项的疫苗组合物,其中所述疫苗组合物通过分析超速离心确定基本上无任何其他的去污剂。
[0372]
18.项10的疫苗组合物,其中每种纳米颗粒包含4-7个rsv f蛋白三聚体。
[0373]
19.预防病毒感染的方法,其包括施用项1-18任一项的疫苗组合物至受试者。
[0374]
20.项19的方法,其中组合物肌内施用。
[0375]
21.项19的方法,其中每个剂量由约30μg至约150μg的rsv f蛋白组成。
[0376]
22.项19的方法,其中施用单剂量的所述组合物。
[0377]
23.项19的方法,其中所述受试者选自下组:成年人、老年人、怀孕的女性成人、儿童、新生儿和婴儿。
[0378]
24.项19的方法,其中所述组合物包含佐剂。
[0379]
25.项24的方法,其中所述佐剂是明矾佐剂且至少80%的所述佐剂与所述纳米颗粒结合。
[0380]
26.项19的方法,其中所述组合物不包含添加的佐剂。
[0381]
27.项22的方法,其中所述剂量的体积为约0.5ml。
[0382]
28.组合物,其包含至少3种rsv f纳米颗粒类型的异源群体,其中每种纳米颗粒包含围绕包含ps80的含去污剂核心的至少一个rsv f蛋白三聚体;且
[0383]
其中第一rsv f纳米颗粒类型包含各向异性棒,
[0384]
其中第二rsv f纳米颗粒类型包含球形寡聚物,
[0385]
且其中第三rsv f纳米颗粒类型包含各向异性棒和球形寡聚物的中间体。
[0386]
29.项28的组合物,其中每种rsv f三聚体选自具有对应seq id no:2的残基137-146的1-10个氨基酸的缺失的rsv f蛋白及其混合物。
[0387]
30.项28的组合物,其中每种rsv f三聚体包含(i)具有对应seq id no:2的残基137-146的1-10个氨基酸的缺失和(ii)失活的主要融合切割位点的rsv f蛋白及其混合物。
[0388]
31.项29的组合物,其中所述rsv f蛋白选自seq id no:1-13和缺乏部分或全部n末端信号肽的seq id no:1-13的变体。
[0389]
32.项31的组合物,其中所述rsv f蛋白包含seq id no:19。
[0390]
33.项31的组合物,其中所述rsv f蛋白由seq id no:19构成。
[0391]
34.制造rsv f蛋白纳米颗粒的方法,其包括使用第一去污剂从宿主细胞制备rsv f蛋白提取物和将第一去污剂交换成第二去污剂,其中所述第二去污剂为ps80,由此当保持在约0.03%至约0.05%的量的ps80时所述纳米颗粒呈现增强的稳定性。
[0392]
35.项34的方法,其中所述第一去污剂是np-9。
[0393]
36.项34的方法,其中所述增强的稳定性选自下述一项或多项:蛋白酶抗性、氧化压力抗性、热压力抗性和对搅拌的抗性。
[0394]
37.项34的方法,其中所述ps80比rsv f蛋白以约30至约60的摩尔比率存在。
[0395]
38.纳米颗粒,其包含与ps80去污剂核心结合的病毒蛋白三聚体,其中所述ps80:病毒蛋白三聚体的摩尔比率为约30至约60,优选约50。
[0396]
39.项38的纳米颗粒,其中所述病毒蛋白三聚体是rsv f蛋白三聚体。
[0397]
40.项38的纳米颗粒,其中所述纳米颗粒具有通过动态光散射测量约20至约60nm的平均直径(z-ave)。
[0398]
41.项38的纳米颗粒,其中每个rsv f蛋白三聚体包含选自下组的rsvf蛋白:具有对应seq id no:2的残基137-146的1-10个氨基酸缺失的rsvf蛋白。
[0399]
42.项41的纳米颗粒,其进一步包含失活的主要融合切割位点。
[0400]
43.项39的纳米颗粒,其中所述rsv f蛋白具有seq id no:1-13或缺乏部分或全部
n末端信号肽的seq id no:1-13的任一项的序列。
[0401]
44.项39的纳米颗粒,其中所述rsv f蛋白包含对应seq id no:2的残基137-146的10个氨基酸的缺失和通过将位置133、135和136的精氨酸突变为谷氨酰胺的主要弗林蛋白酶切割位点的失活。
[0402]
45.项44的纳米颗粒,其中所述rsv f蛋白包含seq id no:19。
[0403]
46.项44的纳米颗粒,其中所述rsv f蛋白由seq id no:19构成。
[0404]
47.产生包含围绕非离子去污剂核心的蛋白抗原的纳米颗粒的方法,其包括:
[0405]
(i)使包含第一去污剂的蛋白提取物与蛋白纯化柱结合;
[0406]
(ii)通过以第二去污剂基本上替换第一去污剂进行去污剂交换;和
[0407]
(iii)在第二去污剂存在下从所述柱洗脱所述蛋白提取物以提供所述纳米颗粒;
[0408]
其中第二去污剂:蛋白的摩尔比率为约30至约60;且其中第二去污剂选自下组:ps20、ps40、ps60、ps65和ps80。
[0409]
48.项47的方法,其中所述蛋白抗原是病毒糖蛋白。
[0410]
49.项48的方法,其中所述非离子去污剂是ps80。
[0411]
50.项47的方法,其中第一去污剂是np-9。
[0412]
51.项47的方法,其中所述蛋白抗原是rsv-f糖蛋白。
[0413]
52.项47的方法,其中所述摩尔比率为约45至约60。
[0414]
53.项52的方法,其中所述摩尔比率为约45。
[0415]
54.项47的方法,其进一步包括步骤(iv)将所述纳米颗粒与明矾佐剂组合以提供包含纳米颗粒的组合物,其在所述组合物中具有至少80%的所述纳米颗粒与所述明矾结合。
[0416]
55.项54的方法,其中至少90%的所述纳米颗粒与所述明矾结合。
[0417]
56.项47的方法,其中所述蛋白提取物通过包括下述的步骤制备:在sf9宿主细胞中重组表达所述蛋白并以第一去污剂处理所述宿主细胞以提供蛋白提取物,其中所述sf9细胞是组织蛋白酶l或几丁质酶单敲除体,或组织蛋白酶l和几丁质酶二者的双敲除体。
[0418]
57.项47的方法,其中所述蛋白纯化柱是小扁豆凝集素柱。
[0419]
58.组合纳米颗粒,其包含非离子去污剂核心和至少两种病毒蛋白,其中每种病毒蛋白与所述核心结合且其中非离子去污剂:至少一种病毒蛋白的摩尔比为约30至约60。
[0420]
59.项58的组合纳米颗粒,其中所述纳米颗粒包含流感ha蛋白和rsvf蛋白。
[0421]
60.项58的组合纳米颗粒,其中所述纳米颗粒包含流感ha蛋白和流感na蛋白。
[0422]
61.项60的组合纳米颗粒,其中所述ha和na蛋白来自相同的流感亚型。
[0423]
62.项60的组合纳米颗粒,其中所述ha和na蛋白来自不同的流感亚型。
[0424]
63.项60的组合纳米颗粒,其中所述ha和na蛋白的至少一种来自第1组或第2组流感。
[0425]
64.项60的组合纳米颗粒,其中所述ha和na蛋白的至少一种来自b型流感。
[0426]
65.诱导免疫响应的方法,其包括施用项1的组合物至受试者。
[0427]
66.项65的方法,其中所述受试者是人类女性。
[0428]
67.项66的方法,其中所述人类女性是怀孕的。
[0429]
68.一种加强婴儿免疫响应的方法,包括向携带抗rsv f抗体的婴儿施用项1的组
合物。
[0430]
69.一种制备重组胰蛋白酶抗性流感ha纳米颗粒的方法,包括以下步骤:
[0431]
(i)将包含第一去污剂的蛋白提取物与蛋白纯化柱结合;
[0432]
(ii)通过以第二去污剂基本上替换第一去污剂进行去污剂的交换;和
[0433]
(iii)在第二去污剂的存在下从所述柱洗脱所述蛋白提取物以提供所述纳米颗粒;
[0434]
其中所述纳米颗粒的过渡中点(tm)如通过差示扫描量热法测量为至少约60,其中在制备过程中使用的缓冲剂不具有低于7.0的ph。
[0435]
70.根据项69的方法制备的重组胰蛋白酶抗性ha纳米颗粒。
[0436]
71.疫苗组合物,其包含项70的纳米颗粒和药物上可接受的载剂。
[0437]
72.包含项71的纳米颗粒的疫苗组合物,其包含佐剂。
[0438]
73.项35的方法,其中第一去污剂的交换基本上完成,使得通过hplc检测的np-9的量小于约0.1%、小于约0.01%、小于约0.001%或不可检测。
[0439]
74.埃博拉病毒糖蛋白(gp)纳米颗粒,其包含与非离子去污剂核心结合的埃博拉病毒gp三聚体。
[0440]
75.项74的纳米颗粒,其中所述核心中的非离子去污剂包含聚山梨醇酯-80(ps80)。
[0441]
76.项74的纳米颗粒,其中所述纳米颗粒具有约20至约40nm的平均直径。
[0442]
77.项74的纳米颗粒,其中所述纳米颗粒包含多拷贝的埃博拉病毒gp三聚体。
[0443]
78.项77的纳米颗粒,其中所述纳米颗粒包含至多15个三聚体。
[0444]
79.项74的纳米颗粒,其中所述纳米颗粒在sf9细胞中产生。
[0445]
80.项74的纳米颗粒,其中所述埃博拉病毒gp氨基酸序列与seq id no:29为约85%相同、约90%相同、约95%相同、约97%相同或约98%相同。
[0446]
81.项74的纳米颗粒,其中所述埃博拉病毒gp氨基酸序列包含seq id no:29。
[0447]
82.项74的纳米颗粒,其中所述埃博拉病毒gp氨基酸序列由seq id no:29组成。
[0448]
83.疫苗组合物,其包含项74-82任一项的纳米颗粒和皂苷佐剂,其中所述皂苷佐剂由基质a和基质c组成。
[0449]
84.项83的疫苗组合物,其中所述基质a和基质c以85∶15的比率存在。
[0450]
85.在人中诱导针对埃博拉病毒的免疫响应的方法,包括对所述人施用包含埃博拉病毒糖蛋白(gp)纳米颗粒和皂苷佐剂的组合物,
[0451]
其中所述皂苷佐剂由基质a和基质c组成,且
[0452]
其中所述纳米颗粒包含与非离子去污剂核心附接的埃博拉病毒gp三聚体。
[0453]
86.项85的方法,其中所述基质a和基质c皂苷佐剂以85∶15的比率存在。
[0454]
87.项85的方法,其中所述埃博拉病毒gp的氨基酸序列与seq id no:29约85%相同、约90%相同、约95%相同、约97%相同或约98%相同。
[0455]
88.项85的方法,其中所述组合物肌内施用。
[0456]
89.项85的方法,其中所述免疫响应包含下述一项或多项:诱导igg1抗体、诱导igg2a抗体、形成长寿血浆b细胞、滤泡辅助性t细胞(t
fh
)响应、cd4+t细胞响应和cd8+t细胞响应。
[0457]
90.项85的方法,其中所述组合物包含具有每纳米颗粒2-6个三聚体的gp纳米颗粒的非均质群体。
[0458]
91.一种在人类中预防埃博拉病毒感染或疾病的方法,其包括对所述人肌内施用项83的疫苗组合物。
[0459]
92.编码包含seq id no:29或由seq id no:29组成的埃博拉病毒蛋白的核酸。
[0460]
93.包含项92的核酸的sf9宿主细胞。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1