含苯基嘧啶酮盐酸盐的药物组合物,包含其的药物制剂,及其制备方法和用途与流程
1.本发明属于医药技术领域,具体涉及一种含苯基嘧啶酮盐酸盐的药物组合物,包含其的药物制剂,及其制备方法,还涉及该药物组合物或药物制剂在医药方面的用途。
背景技术:
2.勃起功能障碍(erectile dysfunction,ed),俗称“阳痿”,指男子在性刺激下,持续地不能达到或维持足够硬度的阴茎勃起以完成满意性生活,病程在3个月以上方能在临床上诊断为ed。据流行病学数据(j androl,2011,32:496)。
3.ed的药物治疗中,磷酸二酯酶5(phosphodiesterase 5,pde5)抑制剂使用方便、安全、有效、易被多数患者接受,是目前临床的首选用药。目前市场上批准的口服的治疗勃起功能障碍的pde5抑制剂为:西地那非(sildenafil、viagra)、伐地那非(vardenafil、 levitra)、他达拉非(tadalafil、cialis)以及阿伐那非(avanafil、stendra)。其中西地那非由美国辉瑞公司开发,于1998年被美国fda批准上市,是美国fda批准的第一个治疗ed的口服药物。随后在2003年,拜耳与葛兰素史克公司联手推出伐地那非,礼来公司推出他达拉非。2012年,fda批准阿伐那非上市。
4.由于磷酸二酯酶至少有11个酶系及更多的亚型,所以高选择性的pde5抑制剂是开发治疗性功能障碍的关键。目前已经上市的四个pde5抑制剂中,西地那非及伐地那非对pde1及pde6的选择性不好,导致面部潮红、视觉障碍等副作用,并具有潜在的心血管风险,且两个化合物半衰期都较短,不适合长期用药;他达拉非半衰期较长,可以每天用药一次,但对pde11的选择性不好,背痛、肌肉酸痛的副作用影响了病人用药的顺应性;阿伐那非虽然由于高选择性而临床不良反应较低,但是其半衰期较短,不适合长期用药。pde5抑制剂仍存在未满足的临床需求,高选择性、长半衰期的pde5抑制剂是新一代pde抑制剂的研发方向。
5.公开号为cn102216279b的中国授权专利公开了一种苯基嘧啶酮的化合物及其药学上可接受的盐,具有较高磷酸二酯酶5(pde5)抑制活性的化合物。该化合物以天然产物淫羊藿黄酮为先导结构,以计算化学的解析数据为参照,通过结构修饰和拼接合成技术,开展精细的“结构微调”设计与合成工作,最终获得了成药性综合评价比西地那非更好的候选化合物。从临床前毒理学、药效学和药代动力学特性等的研究中可以发现,该苯基嘧啶酮化合物活性(ic
50
=0.62nm)与西地那非(ic
50
=4.31nm)相比提高一个数量级,同时相对于其他同功酶的选择性(包括pde1和pde6)比西地那非显著提高,与西地那非相比具有高活性、高选择性、低毒性、药效明确、结构简单、易于合成等众多优点。
6.基于临床前口服给药的动物实验数据,该化合物可以开发为口服固体制剂,给药方式为口服胃肠道给药,通过抑制pde5酶的活性,提高细胞内cgmp水平,从而增强勃起的功能。
7.然而,苯基嘧啶酮化合物制剂中,因苯基嘧啶酮化合物占比较少,在制备过程中容
易出现混合均匀性的问题,制剂成品易出现溶出偏慢等问题。因此,制备一种含量均匀度好,稳定性好,崩解迅速,可实现快速溶出,处方工艺简单,成本低廉,节能环保的含苯基嘧啶酮的药物组合物或药物制剂,是本发明着力解决的技术问题。
技术实现要素:
8.发明要解决的问题
9.针对上述问题,本发明提供了一种含苯基嘧啶酮盐酸盐的药物组合物,包含其的药物制剂,及其制备方法和用途。
10.用于解决问题的方案
11.第一方面,本发明提供了一种含苯基嘧啶酮盐酸盐的药物组合物,包含式i-a化合物,以及药学上可接受的载体。
[0012][0013]
其中,所述式i-a化合物的粒度d
90
≤30μm。
[0014]
优选地,所述式i-a化合物的粒度d
90
≤20μm。
[0015]
优选地,所述药学上可接受的载体包括填充剂、崩解剂、粘合剂和润滑剂。
[0016]
更优选地,所述药学上可接受的载体由填充剂、崩解剂、粘合剂和润滑剂组成。
[0017]
优选地,按重量百分比计算,所述药物组合物包含如下组分:式i-a化合物1~20%、填充剂35~90%、崩解剂1~20%、粘合剂1~20%和润滑剂0.1~5%。
[0018]
更优选地,按重量百分比计算,所述药物组合物包含如下组分:式i-a化合物1~10%、填充剂72~90%、崩解剂1~8%、粘合剂1~8%和润滑剂0.5~2%。
[0019]
优选地,所述填充剂为乳糖、玉米淀粉、甘露醇、山梨醇和微晶纤维素中的至少一种,所述崩解剂为低取代羟丙纤维素、交联羧甲纤维素钠、羧甲淀粉钠和交联聚维酮中的至少一种,所述粘合剂为羟丙纤维素、羟丙甲纤维素和聚维酮中的至少一种,所述润滑剂为硬脂酸镁、硬脂富马酸钠、滑石粉和胶态二氧化硅中的至少一种。
[0020]
更优选地,所述填充剂为乳糖和微晶纤维素,所述崩解剂为羧甲淀粉钠,所述粘合剂为聚维酮,所述润滑剂为硬脂酸镁。
[0021]
第二方面,本发明提供了上述药物组合物的制备方法,其包括如下步骤:将式i-a化合物和药学上可接受的载体混合。
[0022]
第三方面,本发明提供了一种药物制剂,其由上述药物组合物制成。
[0023]
优选地,所述药物制剂为片剂、胶囊剂、颗粒剂、丸剂、散剂或干混悬剂。
[0024]
更优选地,所述药物制剂为片剂或胶囊剂。
[0025]
第四方面,本发明提供了上述药物制剂的制备方法,可选择直接混合、湿法制粒或干法制粒等工艺,优选选择直接混合工艺。
[0026]
所述制备方法包括如下步骤:
[0027]
(1)将式i-a化合物粉碎至目标粒度,填充剂、崩解剂、粘合剂和润滑剂过筛;
[0028]
(2)将步骤(1)中粉碎后的式i-a化合物以及过筛后的填充剂、崩解剂和粘合剂混合均匀,得到混合物料;或者
[0029]
将步骤(1)中粉碎后的式i-a化合物以及过筛后的填充剂、崩解剂混合均匀,加入步骤(1)中过筛后的粘合剂溶液进行制粒,得到含药颗粒;
[0030]
(3)将步骤(1)中过筛后的润滑剂加入到步骤(2)中的混合物料或含药颗粒中,混合均匀,得到总混粉;
[0031]
(4)将步骤(3)中的总混粉进行压片或灌装胶囊。
[0032]
优选地,步骤(1)中所述填充剂、崩解剂、粘合剂和润滑剂过80目筛。
[0033]
优选地,步骤(4)还包括压片后进行包衣的步骤。
[0034]
第五方面,本发明提供了上述药物组合物或上述药物制剂在制备治疗和/或预防与 pde5酶相关的疾病和/或病症的药物中的用途。
[0035]
优选地,所述与pde5酶相关的疾病和/或病症包含:勃起功能障碍、肺动脉高压、雌性的性功能障碍、早产、痛经、良性前列腺增生、膀胱出口梗阻、失禁、不稳定的和变异型心绞痛、高血压、充血性心衰、肾衰竭、动脉粥样硬化、中风、周围血管疾病、雷诺氏症、炎症性疾病、支气管炎、慢性哮喘、过敏性哮喘、过敏性鼻炎、青光眼和肠蠕动障碍。
[0036]
发明的效果
[0037]
本发明提供了一种含苯基嘧啶酮盐酸盐的药物组合物,包含其的药物制剂,及其制备方法和用途,该组合物具体包含式i-a化合物和药学上可接受的载体。通过对式i-a 化合物的粒度进行限定、辅料组合和用量筛选,以及大量的制备工艺实验研究,解决了混合均匀度、含量均匀度和溶出偏慢的问题。本发明的药物组合物或药物制剂含量均匀度好,稳定性好,崩解迅速,可实现快速溶出,可采用直接混合或湿法制粒两种工艺进行制备,优先使用直接混合的工艺,具有处方工艺简单,成本低廉,节能环保,易于产业化应用等特点。
附图说明
[0038]
图1示出了式i-a化合物(未粉碎处理)的xrpd图谱。
[0039]
图2示出了式i-a化合物(粉碎处理)的xrpd图谱。
[0040]
图3示出了式i-a化合物(模拟湿法制粒)的xrpd图谱。
具体实施方式
[0041]
[术语定义]
[0042]
苯基嘧啶酮盐酸盐
[0043]“苯基嘧啶酮化合物”是一种具有苯基嘧啶酮结构的化合物,公开号为 cn102216279b的中国授权专利公开了一种苯基嘧啶酮的化合物及其药学上可接受的盐,具有较高磷酸二酯酶(pde5)抑制活性,成药性综合评价比西地那非更好。“苯基嘧啶酮盐酸盐”是指苯基嘧啶酮化合物的盐酸盐。
[0044]
式i-a化合物
[0045]“式i-a化合物”是一种苯基嘧啶酮化合物的盐酸盐,结构如下,化学名称为:5,6
‑ꢀ
二乙基-2-[2-正丙氧基-5-(2-(4-甲基哌嗪-1-基)乙酰胺基)苯基]嘧啶-4(3h)-酮盐酸盐。
[0046][0047]
药学上可接受的载体
[0048]“药学上可接受的载体”是指与药物活性成分相容并且对受试者无害的药用辅料,包括(但不限于)填充剂、粘合剂、崩解剂、润滑剂、润湿剂、增稠剂、助流剂、矫味剂、矫嗅剂、防腐剂、抗氧化剂、ph调节剂、溶剂、助溶剂、表面活性剂等。
[0049]
[药物组合物]
[0050]
本发明提供了一种含苯基嘧啶酮盐酸盐的药物组合物,所述药物组合物包含式i-a 化合物以及药学上可接受的载体。
[0051]
在一项实施方案中,所述式i-a化合物的粒度d
90
≤30μm。
[0052]
在一项优选实施方案中,所述式i-a化合物的粒度d
90
≤20μm。
[0053]
在一项实施方案中,所述药学上可接受的载体包括填充剂、崩解剂、粘合剂和润滑剂。
[0054]
在一项优选实施方案中,所述药学上可接受的载体由填充剂、崩解剂、粘合剂和润滑剂组成。
[0055]
在一项实施方案中,按重量百分比计算,所述药物组合物包含如下组分:式i-a化合物1~20%、填充剂35~90%、崩解剂1~20%、粘合剂1~20%和润滑剂0.1~5%。
[0056]
在一项优选实施方案中,按重量百分比计算,所述药物组合物包含如下组分:式i-a 化合物1~10%、填充剂72~90%、崩解剂1~8%、粘合剂1~8%和润滑剂0.5~2%。
[0057]
在一项实施方案中,所述填充剂为乳糖、玉米淀粉、甘露醇、山梨醇和微晶纤维素中的至少一种,所述崩解剂为低取代羟丙纤维素、交联羧甲纤维素钠、羧甲淀粉钠和交联聚维酮中的至少一种,所述粘合剂为羟丙纤维素、羟丙甲纤维素和聚维酮中的至少一种,所述润滑剂为硬脂酸镁、硬脂富马酸钠、滑石粉和胶态二氧化硅中的至少一种。
[0058]
在一项优选实施方案中,所述填充剂为乳糖和微晶纤维素,所述崩解剂为羧甲淀粉钠,所述粘合剂为聚维酮,所述润滑剂为硬脂酸镁。
[0059]
[药物组合物的制备方法]
[0060]
本发明提供了上述药物组合物的制备方法,其包括如下步骤:将式i-a化合物和药学上可接受的载体混合。
[0061]
[药物制剂]
[0062]
本发明提供了一种药物制剂,其由上述药物组合物制成。
[0063]
在一项实施方案中,所述药物制剂为片剂、胶囊剂、颗粒剂、丸剂、散剂或干混悬剂。
[0064]
在一项优选实施方案中,所述药物制剂为片剂或胶囊剂。
[0065]
[药物制剂的制备方法]
[0066]
本发明提供了上述药物制剂的制备方法,可选择直接混合、湿法制粒或干法制粒的制备方法,优选直接混合的制备方法。
[0067]
所述制备方法包括如下步骤:
[0068]
(1)将式i-a化合物粉碎至目标粒度,填充剂、崩解剂、粘合剂和润滑剂过筛;
[0069]
(2)将步骤(1)中粉碎后的式i-a化合物以及过筛后的填充剂、崩解剂和粘合剂混合均匀,得到混合物料;或者
[0070]
将步骤(1)中粉碎后的式i-a化合物以及过筛后的填充剂、崩解剂混合均匀,加入步骤(1)中过筛后的粘合剂溶液进行制粒,得到含药颗粒;
[0071]
(3)将步骤(1)中过筛后的润滑剂加入到步骤(2)中的混合物料或含药颗粒中,混合均匀,得到总混粉;
[0072]
(4)将步骤(3)中的总混粉进行压片或灌装胶囊。
[0073]
在一项实施方案中,步骤(1)中填充剂、崩解剂、粘合剂和润滑剂过80目筛。
[0074]
在一项实施方案中,步骤(4)还包括压片后进行包衣的步骤。
[0075]
[医药用途]
[0076]
本发明提供了上述药物组合物或上述药物制剂在制备治疗和/或预防与pde5酶相关的疾病和/或病症的药物中的用途。
[0077]
在一项实施方案中,所述与pde5酶相关的疾病和/或病症包含:勃起功能障碍、肺动脉高压、雌性的性功能障碍、早产、痛经、良性前列腺增生、膀胱出口梗阻、失禁、不稳定的和变异型心绞痛、高血压、充血性心衰、肾衰竭、动脉粥样硬化、中风、周围血管疾病、雷诺氏症、炎症性疾病、支气管炎、慢性哮喘、过敏性哮喘、过敏性鼻炎、青光眼和肠蠕动障碍。
[0078]
以下通过实施例进一步详细的说明本发明。但不应将此理解为本发明上述主题的范围仅限于以下的实施例。在不脱离本发明上述技术思想的情况下,根据本领域普通技术知识和惯用手段做出的各种替换或变更,均应包括在本发明的范围内。
[0079]
本发明的实施方案或具体实施例中对崩解时限、脆碎度、混合均匀度、含量均匀度、溶出曲线、外观、粉末流动性等评价指标的检测方法如下:
[0080]
崩解时限:采用《中国药典》2020版,0921崩解时限检查法,在37℃
±
1℃,900ml 水中,药片应在30分钟内全部崩解并通过筛网,如有少量轻质上漂或粘附于不锈钢管或筛网,但无硬心者,可作为符合规定论。重复测定6片,均应符合规定,如有一片不符合规定,应另取6片复试,均应符合规定。
[0081]
脆碎度:采用《中国药典》2020版,0923片剂脆碎度检查法,使用片剂脆碎度测定仪,取若干片,使其总重约为6.5g,用吹风机吹去片剂脱落的粉末,精密称重,置于圆筒中,转动100次,取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂,龟裂及粉碎的片,本实验一般仅作一次。如减失重量超过1%时,应该复测2次, 3次的平均减失重量不得过1%,并不得检出断裂,龟裂及粉碎的片。
[0082]
混合均匀度:采用含量检测方法,取混合后的10个不同位置的药粉,检测含量,根据含量结果计算rsd值,一般认为rsd值<5%,符合混合均匀度的要求。
[0083]
含量均匀度:采用含量检测方法,分别取单个计量单位物料量(不少于10个取样点) 检测含量,根据含量结果计算a+2.2s值,一般认为a+2.2《15,符合含量均匀度的要求。
[0084]
溶出:采用《中国药典》2020版,0931溶出度与释放度测定法第二法测定,采用 0.1mol/l盐酸溶液为溶出介质,取样时间:5、10、15、30、45min,介质体积900ml,转速:50rpm测定溶出,限度要求:45分钟的溶出量应不低于标示量的80%。
[0085]
素片外观:采用《中国药典》2020版,0101片剂制剂通则项下内容,素片外观完整光洁,色泽均匀,无粘冲和揭盖,有适宜的硬度和耐磨性,以免包装、运输过程中发生磨损和破碎。
[0086]
粉末流动性:常用休止角表示,休止角是指粉体堆积层的自由斜面与水平所形成的最大角,休止角越小,摩擦力越小,流动性越好,一般认为休止角《30
°
时流动性较好,《40
°
时可以满足生产过程中的流动性要求。》40
°
时,一般认为不满足生产过程中的流动性要求。
[0087]
为了解决小剂量药物混合均匀度、含量均匀度等技术问题,本发明进行了填充剂、崩解剂、粘合剂等辅料用量筛选和大量的制备工艺实验研究,考察了一种含苯基嘧啶酮盐酸盐的药物组合物的混合均匀度、含量均匀度、崩解时限、脆碎度、药粉流动性和素片外观等指标。
[0088]
下述实施例中未作特殊说明,所有原料和试剂均来自于商购或通过本领域的常规方法制备而得。其中式i-a化合物购买自山东特珐曼药业有限公司,乳糖(牌号:g200、 f100)购自德国美剂乐沃斯堡牛奶房两合公司,微晶纤维素(牌号:ph101、ph102)购自旭化成株式会社,羧甲淀粉钠(牌号:zw-ssg-d)购自湖州展望药业有限公司,聚维酮(别名:聚乙烯吡咯烷酮,牌号:k30)购自美国巴斯夫公司,淀粉、硬脂酸镁(牌号:sh-ym-m)购自安徽山河药用辅料股份有限公司,薄膜包衣预混剂(牌号:欧巴代 ys-1-7027cn)购自上海卡乐康包衣技术有限公司,明胶空心胶囊壳(牌号:1#、2#) 购自苏州胶囊有限公司。
[0089]
实施例1:片剂处方(直接压片)
[0090][0091]
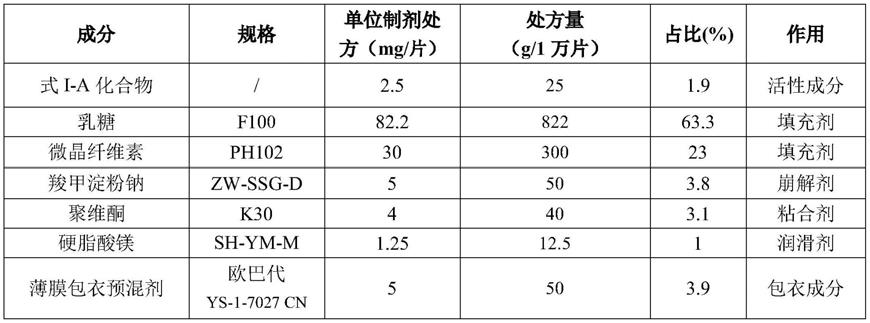
制备工艺:
[0092]
(1)物料预处理:将式i-a化合物进行粉碎,测定粒度d
90
=18.8μm;辅料过80目筛备用。
[0093]
(2)称量:按处方量称量式i-a化合物、乳糖、微晶纤维素、羧甲淀粉钠、聚维酮、硬脂酸镁。
[0094]
(3)混合:在料斗混合机中加入除硬脂酸镁以外的其他成分,转速10rpm/min,混合10分钟。
[0095]
(4)润滑:加入硬脂酸镁,设置转速10rpm/min,混合5分钟,得总混粉;在混合机的不同位置共取样10个点,测定混合均匀度。测定颗粒含量,计算片重。
[0096]
(5)压片:采用旋转压片机压片,压片模具:6.5mm圆形浅凹冲模,控制硬度范围 40~80n,片重约125mg,重量差异限度
±
5.0%,取样,测定脆碎度、含量等。
[0097]
(6)包衣:采用薄膜包衣预混剂(欧巴代ys-1-7027cn),将片芯单锅装量的4.0%的量称取包衣粉加入纯化水中,搅拌分散均匀,配制成15%(w/w)包衣溶液;将片芯置于包衣锅内,设定进风温度55~65℃、控制物料温度40~60℃,设定锅体转速 1~10rpm/min,按包衣程序进行包衣操作,控制包衣增重1~3%。
[0098]
实施例2:片剂处方(湿法制粒)
[0099][0100]
制备工艺:
[0101]
(1)物料预处理:将式i-a化合物进行粉碎,测定粒度d
90
=18.8μm;辅料过80目筛备用。
[0102]
(2)称量:按处方量称量式i-a化合物、乳糖、微晶纤维素、羧甲淀粉钠、聚维酮、硬脂酸镁。
[0103]
(3)粘合剂溶液配制:将处方量的聚维酮k30加入至50%乙醇溶液中,不断搅拌,配制成澄清的5%(w/w)聚维酮乙醇溶液,备用。
[0104]
(3)预混合:在高速湿法制粒机中加入除硬脂酸镁以外的其他成分,搅拌转速 180rpm/min,混合10min。
[0105]
(4)制粒:设定搅拌转速180rpm/min、剪切转速1200rpm/min,加入粘合剂溶液进行制粒,加浆时间控制在5min以内,加浆结束后设定搅拌转速180rpm/min、剪切转速 2000pm/min,搅拌5min。
[0106]
(5)湿整粒:将制粒后的物料用摇摆颗粒机(20目筛网)进行湿整粒。
[0107]
(6)干燥:将湿物料加入沸腾干燥机中,控制进风温度60℃,干燥至水分3.0%以下(卤素快速水分测定仪测定,105℃/5min测定)。
[0108]
(7)干整粒:将干燥好的物料经粉碎整粒机干整粒(整粒转速1000rpm/min,v型筛网2.0mm)。
[0109]
(8)润滑:加入硬脂酸镁,设置转速10rpm/min,混合5分钟,得总混粉;在混合机的不同位置共取样10个点,测定混合均匀度。测定颗粒含量,计算片重。
[0110]
(9)压片:采用旋转压片机压片,压片模具:6.5mm圆形浅凹冲模,控制硬度区间 40~80n,片重约125mg,重量差异限度
±
5.0%,取样,测定脆碎度、含量等。
[0111]
(10)包衣:采用薄膜包衣预混剂(欧巴代ys-1-7027cn),将片芯单锅装量的4.0%的量称取包衣粉加入纯化水中,搅拌分散均匀,配制成15%(w/w)包衣溶液;将片芯置于包
衣锅内,设定进风温度55~65℃、控制物料温度40~60℃,设定锅体转速 1~10rpm/min,按包衣程序进行包衣操作,控制包衣增重1~3%。
[0112]
实施例3:片剂处方(直接压片)
[0113][0114]
制备工艺同实施例1。
[0115]
实施例4:胶囊剂处方(直接混合)
[0116][0117]
胶囊充填前工艺同实施例1,胶囊充填步骤如下:采用胶囊充填板采用2号胶囊进行充填,充填重量平均值约为125mg;灌装过程对产品性状、重量差异进行监控。胶囊性状:除去胶囊壳后为白色或类白色粉末;重量差异限度:
±
5.0%。
[0118]
实施例5:胶囊剂处方(湿法制粒)
[0119][0120]
胶囊充填前工艺同实施例2,胶囊充填:采用胶囊充填板采用2号胶囊进行充填,充填重量平均值约为125mg;灌装过程对产品性状、重量差异进行监控。胶囊性状:除去胶囊壳后为白色或类白色粉末;重量差异限度:
±
5.0%。
[0121]
实施例6:胶囊剂处方(湿法制粒)
[0122][0123]
该实施例处方及工艺设计参考授权专利(授权公告号:cn102216279b)说明书第973-977段“实施例222胶囊剂”,制备工艺如下:将式i-a化合物进行粉碎,测定粒度 d
90
=18.8μm;将含有式i-a化合物及辅料淀粉、乳糖和微晶纤维素过80目筛,按处方量称取,以10%聚乙烯吡咯烷酮乙醇溶液为粘合剂,用16目筛制成适宜的颗粒,65℃干燥, 14目筛整粒,加入硬脂酸镁混合均匀,测颗粒含量,计算装量,装入胶囊,即得(采用 1号胶囊进行充填,充填重量平均值为198mg)。
[0124]
实施例7:片剂处方(湿法制粒)
[0125][0126]
该实施例处方及工艺设计参考授权专利(授权公告号:cn102216279b)说明书第 978-980段“实施例223片剂(湿制粒法)”,制备工艺如下:将式i-a化合物进行粉碎,测定粒度d
90
=18.8μm;将含有式i-a化合物及辅料乳糖、微晶纤维素和羧甲淀粉钠过80 目筛,按处方量称取,以8%淀粉浆制软材,16目制粒,干燥、整粒后,加入硬脂酸镁混合均匀,测定颗粒含量,计算片重,压片即得(压片采用8.0mm圆形浅凹冲模,控制硬度区间60~100n,片重平均值约为200mg)。
[0127]
实施例8:片剂处方(直接压片)
[0128][0129]
制备工艺与实施例1类似,区别在于实施例8的崩解剂和粘合剂为交联聚维酮和羟
丙纤维素。
[0130]
对比例1:片剂处方(直接压片)
[0131][0132]
制备工艺同实施例1,区别:对比例1采用未粉碎处理的式i-a化合物(实测值: d
90
=88μm)进行处方制备。
[0133]
对比例2:胶囊剂处方(湿法制粒)
[0134][0135]
制备工艺同实施例6,区别:对比例2采用未粉碎处理的式i-a化合物(实测值: d
90
=88μm)进行处方制备。
[0136]
晶型检测:
[0137]
采用x射线粉末衍射法测定式i-a化合物(未粉碎处理)、式i-a化合物(粉碎处理)、式i-a化合物(模拟湿法制粒,加入少量溶剂润湿后干燥)的晶型,其xrpd图谱分别见图1、图2、图3。从xrpd晶型图谱可以看出,式i-a化合物经粉碎或模拟湿法制粒处理过程中晶型稳定,未发生晶型转变,推测其在后续制剂过程中也具有较为理想的稳定性。
[0138]
评价结果表1:
[0139][0140]
评价结果表2:
[0141][0142]
评价结果表3:
[0143][0144]
注:以上3个评价结果表格中,cr指累积溶出量(cumulated release rate)。
[0145]
结果分析:
[0146]
实施例1-8采用了特定的辅料组合,其制得的片剂或胶囊剂均取得了好的崩解效果, 30min内均能够实现崩解完全。其中实施例1-5的辅料组合相对于实施例6-8崩解效果更好,在10min内就能实现崩解完全,且实施例1-5可以实现快速溶出,实施例6-8溶出偏慢。
[0147]
实施例1-8使用的原料药均经机械粉碎,控制物料粒度d
90
≤30μm(实测值为 d
90
=18.8μm),制备的物料总混粉混合均匀性、成品含量均匀度均较好;对比例1-2采用未粉碎的原料药(实测值为d
90
=88μm)进行直接混合或湿法制粒,物料粉末流动性、混合均匀度、成品含量均匀度相对较差。
[0148]
实施例1-5中的直接混合、湿法制粒两种工艺的中间体粉末流动性、可压性均符合要求,各个工艺的崩解效果、溶出行为几乎相同,差异性小,重量差异/装量差异、含量和含量均匀度均符合要求,且工艺步骤简单,无需特殊生产条件和生产设备,成本低廉,适合工业化生产。两种工艺中优选直接混合工艺,减少了湿法制粒、湿整粒、干燥、干整粒等步骤,操作更为简便,利于环保和节能减排,更加适宜工业化生产。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1