miR-32-5p在制备提高肿瘤细胞对双氢青蒿素敏感性的药物中的应用
mir-32-5p在制备提高肿瘤细胞对双氢青蒿素敏感性的药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体地,涉及mir-32-5p在制备提高肿瘤细胞对双氢青蒿素敏感性的药物中的应用。
背景技术:
2.神经母细胞瘤(neuroblastoma,nb)是一种婴幼儿时期最常见的颅外实体性恶性肿瘤,由外周交感神经组织的前体细胞发展而来,超过50%的神经母细胞瘤发生于2岁以内的婴幼儿,占儿童癌症死亡率的15%(park, j. r., eggert, a. & caron, h. neuroblastoma: biology, prognosis, and treatment. hematology/oncology clinics of north america. 2008 24, 65-86.;irwin ms, park jr. neuroblastoma: paradigm for precision medicine. pediatric clinics of north america. 2015 feb;62(1):225-256.),神经母细胞瘤具有异质性高、生物学行为复杂、分子特征多样等特点,疾病转移风险高,原发部位相对隐匿,早期诊断和检出难度高。目前,针对神经母细胞瘤的治疗手段多样,国内外普遍采用手术、化疗、放疗、免疫治疗等治疗手段,但是由于神经母细胞瘤的早期诊断困难,对其治疗效果一直并不理想,化疗作为神经母细胞瘤的一种重要的治疗方式,药物耐药性是一直以来导致化疗失败的重要原因。
3.双氢青蒿素(dihydroartemisinin,dha)由青蒿素经四氢硼钠还原所得,也是青蒿素类药物在生物体内的活性代谢产物。由于其吸收好、代谢和排泄迅速、安全低毒等性能,成为众多医学领域研究的热点。双氢青蒿素对肿瘤细胞具有直接细胞毒作用,并能诱导肿瘤细胞发生凋亡(kuwano k. involvement of epithelial cell apoptosis in interstitial lung diseases[j]. intern med, 2008, 47 (5) :345
–
353.)。与正常细胞的细胞质相比,肿瘤细胞中具有更多的游离铁离子,这也是双氢青蒿素能够选择性杀伤肿瘤细胞的关键因素,双氢青蒿素内部含有过氧桥结构,在遇到亚铁离子时桥结构断裂产生大量以碳为中心的自由基,而且活性氧自由基水平也会大幅度提高,两种自由基含量的持续增加会对dna造成不可修复的损伤,使得dna双链破碎化,导致肿瘤细胞死亡,双氢青蒿素诱导肿瘤细胞发生凋亡包括参与内质网应激(endoplasmic reticulum stress)、线粒体凋亡以及死亡受体(death receptor)途径,且每一条通路都不是单独的,而是共同对肿瘤细胞凋亡发挥作用,但是,双氢青蒿素单独使用时效果不佳。
[0004]
鉴于此,本发明经实验研究发现,mir-32-5p能够提高神经母细胞瘤细胞对双氢青蒿素的敏感性,进而增强治疗效果,并且基于mir-32-5p的上述功能,可筛选能够提高双氢青蒿素敏感性的潜在物质。目前,尚未有文献报道mir-32-5p在用作双氢青蒿素药物增敏剂中的应用。
技术实现要素:
[0005]
针对现有技术存在的不足,本发明的目的在于提供mir-32-5p在制备提高肿瘤细
胞对双氢青蒿素敏感性的药物中的应用,所述mir-32-5p能够显著增加神经母细胞瘤细胞对双氢青蒿素的敏感性,此外,所述mir-32-5p通过靶向vps4b提高双氢青蒿素在体内的敏感性,且mir-32-5p和双氢青蒿素联合应用对神经母细胞瘤细胞的迁移和侵袭具有协同抑制的效果,进一步的体内实验研究证明了mir-32-5p和双氢青蒿素联合具有联合抑制神经母细胞瘤转移的作用。
[0006]
本发明的上述目的通过以下技术方案得以实现:本发明的第一方面提供了mir-32-5p和/或其靶基因在制备提高肿瘤细胞对双氢青蒿素敏感性的药物中的应用;优选地,所述靶基因为vps4b;优选地,所述mir-32-5p的核苷酸序列如seq id no:1所示;优选地,所述mir-32-5p高表达或过表达;优选地,所述靶基因低表达或不表达。
[0007]
进一步,所述seq id no:1为uauugcacauuacuaaguugca (seq id no:1)。
[0008]
进一步,所述肿瘤细胞包括神经母细胞瘤细胞、黑色素瘤细胞、肾癌细胞、肺癌细胞、胰腺癌细胞、前列腺癌细胞、宫颈癌细胞、乳腺癌细胞、卵巢癌细胞、肝癌细胞、胶质瘤细胞、胃癌细胞、膀胱癌细胞、结肠癌细胞;优选地,所述肿瘤细胞为神经母细胞瘤细胞。
[0009]
进一步,所述mir-32-5p包括mir-32-5p和/或促进mir-32-5p表达的试剂。
[0010]
进一步,所述促进mir-32-5p表达的试剂包括(但不限于):针对mir-32-5p或mir-32-5p的上游或下游基因设计的促进mir-32-5p表达的试剂、结合分子、小分子化合物等。
[0011]
进一步,所述靶基因包括抑制vps4b表达的试剂。
[0012]
进一步,所述抑制vps4b表达的试剂选自:以vps4b或其转录本为靶序列、且能够抑制vps4b基因表达或基因转录的干扰分子,包括:shrna(小发夹rna)、小干扰rna(sirna)、dsrna、微小rna、反义核酸,或能表达或形成所述shrna、小干扰rna、dsrna、微小rna、反义核酸的构建物。
[0013]
进一步,所述提高肿瘤细胞对双氢青蒿素敏感性还包括抑制肿瘤细胞对双氢青蒿素的抵抗。
[0014]
进一步,所述mir-32-5p通过靶向vps4b提高肿瘤细胞对双氢青蒿素的敏感性。
[0015]
本发明的第二方面提供了mir-32-5p和/或其靶基因在制备用于预防和/或治疗神经母细胞瘤的药物中的应用;优选地,所述靶基因为vps4b;优选地,所述mir-32-5p的核苷酸序列如seq id no:1所示;优选地,所述mir-32-5p高表达或过表达;优选地,所述靶基因低表达或不表达;优选地,所述预防和/或治疗神经母细胞瘤包括抑制神经母细胞瘤的转移;更优选地,所述抑制神经母细胞瘤的转移为抑制神经母细胞瘤的迁移和侵袭。
[0016]
本发明的第三方面提供了一种提高肿瘤细胞对双氢青蒿素敏感性的药物组合物。
[0017]
进一步,所述药物组合物包括有效量的促进mir-32-5p表达的试剂和/或抑制其靶基因vps4b表达的试剂;
优选地,所述药物组合物还包括药学上可接受的载体和/或辅料;优选地,所述肿瘤细胞包括神经母细胞瘤细胞、黑色素瘤细胞、肾癌细胞、肺癌细胞、胰腺癌细胞、前列腺癌细胞、宫颈癌细胞、乳腺癌细胞、卵巢癌细胞、肝癌细胞、胶质瘤细胞、胃癌细胞、膀胱癌细胞、结肠癌细胞;更优选地,所述肿瘤细胞为神经母细胞瘤细胞。
[0018]
进一步,所述药学上可接受的载体和/或辅料在remington's pharmaceutical sciences中有详细的记载。
[0019]
进一步,所述药物组合物施用于有需要的受试者以提高其对双氢青蒿素的敏感性。
[0020]
进一步,所述施用方式包括(但不限于):口服、腹膜内注射、皮下注射、肌肉注射、经皮注射、直肠给药、阴道给药、舌下给药、静脉注射、含服、吸入。
[0021]
进一步,所述施用方式中不经胃肠道(药物成分不会经过胃肠道)的药物组合物剂型包括(但不限于):可以直接注射的溶液、可以溶解或者悬浮在于药物成分兼容的载体中的干粉产品、可以直接注射的悬液、乳液、不经胃肠道的控释剂型。
[0022]
进一步,所述施用方式中通过直肠和阴道给药的药物组合物剂型包括(但不限于):栓剂。可将本发明所述促进mir-32-5p表达的试剂与不具有刺激性的合适的载体和/或辅料混合来制备栓剂,例如可可油、聚乙二醇、或者栓剂蜡。
[0023]
进一步,所述施用方式中通过口服或者舌下给药的药物组合物的剂型包括(但不限于):片剂、锭剂、胶囊、粉末、颗粒、酏剂、悬液、糖浆、薄片剂、口香糖、或者按照行业当前惯例制备的其他剂型。
[0024]
进一步,所述药物组合物是采用本领域公知的常规制备方法制备得到的。
[0025]
进一步,所述药物组合物在实际应用之前,可通过诸如细胞培养和动物实验等制药行业的标准惯例,测定药物活性成分的有效剂量、毒性和疗效,例如测定ld50(半数致死剂量)和ed50(半数有效剂量)。具体的剂量应该根据采用的剂型和给药途径确定。中毒剂量和疗效剂量之间的比例称为治疗指数,可以使用ld50/ed50的比值表达。在一开始可以通过细胞培养分析的方法来预估有效剂量。另外,还可以通过动物模型来确定药物活性成分在血浆中的循环浓度范围,其中包括通过细胞培养分析或者动物模型确定ic50(即本发明中所述药物成分的半数抑制剂量)。血浆中的活性成分浓度水平可以进行检测,例如通过高效液相色谱法检测。任何特定剂量的疗效都可以通过合适的生物分析进行监控。医生可以根据实际观察到的疗效来确定或者调整实际采用的剂量。
[0026]
进一步,所述促进mir-32-5p表达的试剂通过靶向vps4b提高肿瘤细胞对双氢青蒿素的敏感性。
[0027]
本发明的第四方面提供了一种用于预防和/或治疗神经母细胞瘤的药物组合物。
[0028]
进一步,所述药物组合物包括有效量的促进mir-32-5p表达的试剂和/或抑制其靶基因vps4b表达的试剂;优选地,所述药物组合物还包括药学上可接受的载体和/或辅料;优选地,所述预防和/或治疗神经母细胞瘤包括抑制神经母细胞瘤的转移;更优选地,所述抑制神经母细胞瘤的转移为抑制神经母细胞瘤的迁移和侵袭。
[0029]
本发明的第五方面提供了一种抗肿瘤的联合用药物。
[0030]
进一步,所述联合用药物包括有效量的促进mir-32-5p表达的试剂和/或抑制其靶基因vps4b表达的试剂、双氢青蒿素;优选地,所述联合用药物还包括药学上可接受的载体和/或辅料;优选地,所述联合用药物还包括其他抗肿瘤药物;更优选地,所述其他抗肿瘤药物包括分子靶向药物、化疗药物、免疫治疗药物;最优选地,所述分子靶向药物包括间变性淋巴瘤激酶抑制剂、原肌球蛋白受体激酶抑制剂;最优选地,所述化疗药物包括铂类抗肿瘤药物、紫杉烷类抗肿瘤药物;最优选地,所述免疫治疗药物包括靶向pd-1/pd-l1的单克隆抗体、靶向神经节苷脂gd2的单克隆抗体、靶向b7-h3的单克隆抗体;最优选地,所述间变性淋巴瘤激酶抑制剂包括克唑替尼、艾乐替尼、色瑞替尼、布格替尼、劳拉替尼、恩曲替尼,所述原肌球蛋白受体激酶抑制剂包括恩曲替尼、拉罗替尼、卡波替尼、梅瑞替尼;最优选地,所述铂类抗肿瘤药物包括顺铂、卡铂或环铂,所述紫杉烷类抗肿瘤药物包括紫杉醇、多西他赛或卡巴他赛;最优选地,所述靶向pd-1/pd-l1的单克隆抗体包括keytruda、opdivo、libtayo、tecentriq、bavencio、imfinzi,所述靶向神经节苷脂gd2的单克隆抗体包括danyelza、qarziba、naxitamab、dinutuximab beta,所述靶向b7-h3的单克隆抗体包括omburtamab、enoblituzumab、mirzotamab clezutoclax。
[0031]
进一步,所述促进mir-32-5p表达的试剂通过靶向vps4b提高肿瘤细胞对双氢青蒿素的敏感性。
[0032]
进一步,所述药学上可接受的载体和/或辅料在remington's pharmaceutical sciences中有详细的记载。
[0033]
进一步,所述联合用药物施用于有需要的受试者。
[0034]
本发明中所述成分的剂量由医生根据实际观察到的疗效来确定或者调整。在治疗持续时间和频率方面,通常需要由专业的临床医生来监控患者,以便确定相关治疗方法是否有疗效,是否需要增加或者减少剂量,是否需要提高或者降低给药频率,是否需要中断治疗或者恢复治疗,或者对治疗方案做出其他修改。可以根据多种临床因素,例如患者对于本发明所述成分的敏感程度,每周或者每天对给药计划/方案进行修改。
[0035]
本发明的第六方面提供了一种体外非诊断或非治疗目的地提高肿瘤细胞对双氢青蒿素敏感性的方法。
[0036]
进一步,所述方法包括向肿瘤细胞递送本发明第三方面所述的药物组合物。
[0037]
本发明的第七方面提供了一种筛选提高肿瘤细胞对双氢青蒿素敏感性的潜在物质的方法。
[0038]
进一步,所述方法包括如下步骤:(1) 将待测物质和表达mir-32-5p和/或其靶基因vps4b的体系接触;(2) 检测待测物质对mir-32-5p和/或其靶基因vps4b的影响;(3) 若所述待测物质可提高mir-32-5p的表达、活性,和/或抑制其靶基因vps4b的表达、活性,则表明该待测物质为用于提高肿瘤细胞对双氢青蒿素敏感性的潜在物质。
[0039]
进一步,步骤(1)包括:在测试组中,将待测物质加入到表达mir-32-5p和/或其靶基因vps4b的体系中,在对照组中,所述体系为不添加所述待测物质的表达mir-32-5p和/或其靶基因vps4b的体系;和/或步骤(2)包括:检测测试组的体系中mir-32-5p和/或其靶基因vps4b的表达或活性,并与对照组的体系中mir-32-5p和/或其靶基因vps4b的表达或活性比较;如果测试组中mir-32-5p的表达、活性在统计学上高于对照组,和/或其靶基因vps4b的表达、活性在统计学上低于对照组,则表明该测试物质是用于提高肿瘤细胞对双氢青蒿素敏感性的潜在物质;优选地,所述肿瘤细胞为神经母细胞瘤细胞。
[0040]
进一步,所述待测物质包括(但不限于):针对mir-32-5p或mir-32-5p的上游或下游基因设计的促进mir-32-5p表达的试剂、结合分子、小分子化合物等;以vps4b或其转录本为靶序列、且能够抑制vps4b基因表达或基因转录的干扰分子,包括:shrna(小发夹rna)、小干扰rna(sirna)、dsrna、微小rna、反义核酸,或能表达或形成所述shrna、小干扰rna、dsrna、微小rna、反义核酸的构建物等。
[0041]
进一步,所述体系包括(但不限于):细胞体系、亚细胞体系、细胞培养物体系、亚细胞培养物体系、溶液体系、组织体系、器官体系、动物体系。
[0042]
进一步,若所述测试组中mir-32-5p的表达、活性在统计学上高于对照组,优选显著高于,如高于对照组20%以上,较佳的高于对照组50%以上,更佳的高于对照组80%以上,和/或其靶基因vps4b的表达、活性在统计学上低于对照组,优选显著低于,如低于对照组20%以上,较佳的低于对照组50%以上,更佳的低于对照组80%以上,就表明该测试物质是用于提高肿瘤细胞对双氢青蒿素敏感性的潜在物质。
[0043]
进一步,所述方法还包括如下步骤:对筛选得到的潜在物质进行进一步的验证试验,所述验证实验包括(但不限于):细胞实验、动物实验,以从潜在物质中进一步选择和确定对提高肿瘤细胞对双氢青蒿素敏感性有效的组合物。
[0044]
本发明的第六方面提供了如下任一方面的应用,所述应用包括如下方面:(1) mir-32-5p和/或其靶基因在制备本发明第三方面所述的药物组合物中的应用;(2) mir-32-5p和/或其靶基因在制备本发明第四方面所述的联合用药物中的应用;(3) mir-32-5p和/或其靶基因在筛选提高肿瘤细胞对双氢青蒿素敏感性的潜在物质中的应用;优选地,所述肿瘤细胞为神经母细胞瘤细胞;(4) mir-32-5p和/或其靶基因、和双氢青蒿素联合在制备抗肿瘤药物中的应用;(5) mir-32-5p和/或其靶基因、双氢青蒿素在抑制肿瘤转移中的应用;优选地,所述肿瘤为神经母细胞瘤。
[0045]
除非另有定义,本发明上下文中的所有科技术语具有本领域普通技术人员所理解的相同含义。此外,对部分术语解释如下。
[0046]
本文中使用的术语“活性成分”,是指用于药物或药物组合物中的任何一种物质或物质的混合物,此种物质在疾病的诊断、治疗、症状缓解、处理或疾病的预防中有药理活性
或其他直接作用或者能影响机体的功能或结构。在本发明的实施例中,所述活性成分包括(但不限于):促进mir-32-5p表达的试剂和/或抑制其靶基因vps4b的试剂、双氢青蒿素,所述促进mir-32-5p表达的试剂和/或抑制其靶基因vps4b的试剂包括(但不限于):针对mir-32-5p或mir-32-5p的上游或下游基因设计的促进mir-32-5p表达的试剂、结合分子、小分子化合物等;以vps4b或其转录本为靶序列、且能够抑制vps4b基因表达或基因转录的干扰分子,包括:shrna(小发夹rna)、小干扰rna(sirna)、dsrna、微小rna、反义核酸,或能表达或形成所述shrna、小干扰rna、dsrna、微小rna、反义核酸的构建物等。
[0047]
本文中使用的术语“治疗”,通常涉及治疗人类或动物(例如,被兽医所应用),其中可达到某些预期的治疗效果,例如,抑制病症的发展(包括降低发展速度、使发展停止)、改善病症和治愈病症。还包括作为预防措施(例如预防)的治疗。对还没有发展为病症但有发展为该病症危险的患者的用途,也包括在术语“治疗”中。
[0048]
本文中使用的术语“有效量”,是指具有治疗效果的量或在治疗对象中产生治疗效果所需要的量。例如,药物治疗上或药学上有效量是指产生需要的治疗效果所需要的药物的量,治疗效果可以通过临床试验结果、模型动物研究和/或体外研究的结果来反映。药学上有效量取决于几个因素,包括但不限于治疗对象的特征因素(如身高、体重、性别、年龄和用药史)、罹患疾病的严重程度。
[0049]
与现有技术相比,本发明具有以下有益效果:本发明首次将mir-32-5p应用于提高肿瘤细胞对双氢青蒿素敏感性的药物中,所述mir-32-5p能够显著提高神经母细胞瘤细胞对双氢青蒿素的敏感性,此外,所述mir-32-5p通过靶向vps4b提高双氢青蒿素在体内的敏感性,且mir-32-5p和双氢青蒿素联合应用对神经母细胞瘤细胞的迁移和侵袭具有协同抑制的效果。
[0050]
附图说明
[0051]
以下,结合附图来详细说明本发明的实施方案,其中:图1是mir-32-5p在神经母细胞瘤组织和细胞中的表达情况结果图,其中,a图:gse128004,b图:gse121513,c图:四种神经母细胞瘤细胞系和一种人胚肾293t细胞系;图2是qrt-pcr检测分别转染mir-32-5p mimics和mir-32-5p inhibitor的sk-n-sh和imr-32细胞中mir-32-5p的表达水平的结果图,其中,a图:sk-n-sh,b图:imr-32;图3是细胞划痕实验检测mir-32-5p对神经母细胞瘤细胞迁移和侵袭影响的结果图,其中,a图:mir-32-5p mimics,b图:mir-32-5p inhibitor,c图:sk-n-sh,d图:imr-32;图4是transwell实验分析mir-32-5p对神经母细胞瘤细胞迁移和侵袭影响的结果图,其中,a图:mir-32-5p mimics,b图:sk-n-sh,c图:mir-32-5p inhibitor,d图:imr-32,e图:mir-32-5p mimics,f图:sk-n-sh,g图:mir-32-5p inhibitor,h图:imr-32;图5是western blot检测各种蛋白表达情况的结果图,其中,a图:mir-32-5p mimics,b图:mir-32-5p inhibitor;图6是细胞中vps4b在mrna和蛋白水平上的表达量,其中,a图:mrna水平上vps4b的表达量的统计图,b图:蛋白水平上vps4b的表达量的统计图,c图:蛋白水平上vps4b的表达结果图;
图7是mir-32-5p对vps4b表达水平影响的结果图,其中,a图:mir-32-5p mimics对vps4b mrna表达水平影响的结果图,b图:mir-32-5p mimics对vps4b蛋白表达水平影响的结果图,c图:mir-32-5p inhibitor对vps4b mrna表达水平影响的结果图,d图:mir-32-5p inhibitor对vps4b蛋白表达水平影响的结果图;图8是双荧光素酶报告基因检测的结果图,其中,a图:野生型vps4b mrna的3
’‑
utr上和mir-32-5p的结合位点、突变型vps4b mrna的3
’‑
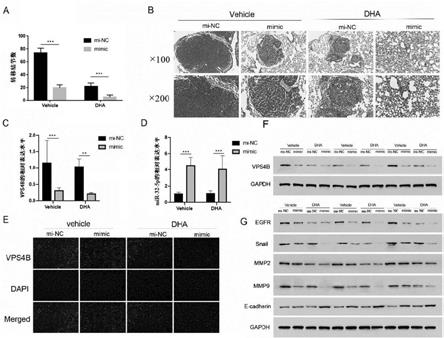
utr上的突变位点示意图,b图:相对荧光素酶活性的统计图;图9是qrt-pcr和western blot检测vps4b在sk-n-sh细胞中过表达效率的结果图,其中,a图:qrt-pcr,b图:western blot;图10是细胞划痕实验、transwell实验检测vps4b、mir-32-5p对神经母细胞瘤细胞的影响结果图,其中,a图:mi-nc,b图:mimic,c图:划痕面积统计图,d图:迁移结果图,e图:迁移细胞数统计图,f图:侵袭结果图,g图:侵袭细胞数统计图;图11是western blot检测各种蛋白表达情况的结果图,其中,a图:vps4b,b图:emt蛋白;图12是mir-32-5p和dha对神经母细胞瘤细胞迁移影响的结果图,其中,a图:mimic,b图:inhibitor,c图:mimic划痕面积统计图,d图:inhibitor划痕面积统计图;图13是mir-32-5p和dha对神经母细胞瘤细胞迁移和侵袭影响的结果图,其中,a图:迁移结果图,b图:迁移细胞数统计图,c图:侵袭结果图,d图:侵袭细胞数统计图,e图:迁移结果图,f图:迁移细胞数统计图,g图:侵袭结果图,h图:侵袭细胞数统计图;图14是western blot检测各种蛋白表达情况的结果图,其中,a图:mimic,b图:inhibitor;图15是western blot检测各种蛋白表达情况的结果图,其中,a图:mimic,b图:inhibitor,c图:vps4b,d图:emt蛋白;图16是vps4b对mir-32-5p和dha协同治疗作用的影响的结果图,其中,a图:dha-vector,b图:dha-oevps4b,c图:划痕面积的统计图;图17是vps4b对mir-32-5p和dha协同治疗作用的影响的结果图,其中,a图:迁移结果图,b图:迁移细胞数统计图,c图:侵袭结果图,d图:侵袭细胞数统计图;图18是dha和mir-32-5p在裸鼠异种移植模型中抑制神经母细胞瘤转移的结果图,其中,a图:转移结节数统计图,b图:he染色的结果图,c图:vps4b相对表达水平统计图,d图:mir-32-5p相对表达水平统计图,e图:免疫荧光检测结果图,f图:vps4b,g图:emt蛋白。
[0052]
具体实施方式
[0053]
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
[0054]
实施例1 筛选在神经母细胞瘤患者中差异表达的基因
1、实验方法(1) 本实施例从geo数据库中鉴定差异表达的基因,选择的数据集包括gse128004和gse121513,gse128004数据集是神经母细胞瘤患者的外泌体数据,包括15例患者和3例正常对照,gse121513数据集中包含8个胚胎干细胞系、7个正常胎儿肾上腺神经母细胞样本、7个正常胎儿肾上腺皮质样本和95个神经母细胞瘤样本。使用r语言包(deseq2包)筛选组织样本中的差异表达基因,以调整后的p《0.01和|log2fc|》2作为阈值;(2) 为了研究mir-32-5p对神经母细胞瘤细胞迁移的影响,本实施例首选分析了mir-32-5p在四种人神经母细胞瘤细胞系(imr-32、sh-sy5y、sk-n-sh和sk-n-be)一种人胚肾293t细胞系中的表达水平,其中rna的分离和qrt-pcr分析方法如下:使用trizol试剂(invitrogen,carlsbad,california,usa)从细胞中提取总rna,使用逆转录试剂盒(fermentas,ma,usa)从每个2 μg rna样品中合成互补dna(cdna),qrt-pcr在abi 7300仪器上使用sybr预混pcr试剂盒(thermo)进行,扩增程序为:95℃ 10 min,(95℃ 15 s,60℃ 45 s,72℃ 30 s)
×
40个循环,比较阈值循环(ct)值用于定义mirna的表达水平,并使用2-δδct
方法计算相对变化,将靶基因归一化为u6表达,mir-32-5p的正向引物:cgcgcgtattgcacattactaa (seq id no:4),反向引物:aggtgcagggtccgaggtatt (seq id no:5);u6的正向引物:ctcgcttcggcagcaca (seq id no:6),反向引物aacgctttcacgaatttgcgt (seq id no:7)。
[0055]
2、实验结果结果显示,神经母细胞瘤患者样本中的mir-32-5p的表达水平显著低于正常样本(见图1a和图1b,p《0.05和p《0.01),与293t细胞相比,神经母细胞瘤肿瘤细胞(imr-32、sh-sy5y、sk-n-sh和sk-n-be)中mir-32-5p的表达水平显著下调(见图1c)。
[0056]
实施例2 mir-32-5p对神经母细胞瘤细胞迁移和侵袭的影响1、实验材料人神经母细胞瘤细胞(imr-32,sh-sy5y,sk-n-sh和sk-n-be)购自于美国典型培养物保藏中心(atcc,manassas,va,usa),在含有10%胎牛血清(bi,kibbutz,israel)、青霉素g(100 u/ml,beyotime,china)、链霉素(100 g/ml,hyclone,china)的dmem培养基(life sciences,shanghai,china)中37℃、5% co2的条件下孵育培养。
[0057]
2、实验方法本实施例分别将mir-32-5p mimics和mir-32-5p inhibitor转染到神经母细胞瘤细胞sk-n-sh和imr-32中,并检测转染效率,研究mir-32-5p对神经母细胞瘤细胞迁移和侵袭的影响,其中,mir-32-5p mimics、阴性对照(mi-nc)、mir-32-5p inhibitor和阴性对照(in-nc)购自于上海吉安制药有限公司(中国,上海),转染前24 h将细胞接种于6孔板中。当细胞生长至约70-80%融合度时,用mir-32-5p mimics (100 pmol)和mimics nc (100 pmol)分别转染神经母细胞瘤细胞sk-n-sh,并用mir-32-5p inhibitor (100 pmol)和inhibitor nc (100 pmol)转染神经母细胞瘤细胞imr-32,根据制造商的说明使用lipofectamine
®
2000试剂(invitrogen,赛默飞世尔科技有限公司)进行转染。
[0058]
(1) 细胞划痕实验将1
×
105个/500 μl/孔的细胞移入12孔板中,并培养成完全融合的单层细胞。用10 μl无菌移液器的枪头刮去贴壁细胞,洗涤,并在含2% fbs的dmem培养基中培养。分别在
blot检测了vps4b mrna的表达水平和蛋白表达水平;进一步采用双荧光素酶报告基因检测方法对vps4b野生型(luc-vps4b-wt)和vps4b突变型(luc-vps4b-mut)的神经母细胞瘤细胞进行了验证。通过ncbi预测vps4b的3
’‑
utr上与mir-32-5p互补的序列,通过双荧光素酶3
’‑
utr报告基因检测vps4b是mir-32-5p的直接作用靶标。为了构建荧光素酶质粒,将3
’‑
utr序列片段插入到pgl3载体(promega,madison,wi,usa)中,构建vps4b 3
’‑
utr wt质粒和vps4b 3
’‑
utr突变体。vps4b的wt序列为5
’‑
actgatacctttcactgtgcaatc-3
’ꢀ
(seq id no:2),vps4b 3
’‑
utr突变体的序列为5
’‑
ctgatacctttcactacatgcactc-3
’ꢀ
(seq id no:3)。将sk-n-sh细胞(5
×
105/孔)接种于6孔板中,培养24 h,并使用lipofectamine 2000将荧光素酶报告载体vps4b 3
’‑
utr wt、vps4b 3
’‑
utr mut、荧光素酶对照载体mirna-32-5p模拟物共转染到上述细胞中,5 pmol mirnas(100 pmol)。转染48 h后,收集细胞并裂解,根据制造商的说明(promega),测量萤火虫荧光素酶和海肾荧光素酶的活性,从细胞裂解液中检测荧光素酶报告基因,将相对萤火虫荧光素酶的活性相对于海肾荧光素酶的活性进行归一化,计算报告基因的倍数变化如下:rlu萤火虫荧光素酶/rlu海肾荧光素酶
×
100%。
[0063]
2、实验结果结果显示,与293t细胞相比,神经母细胞瘤细胞中的vps4b的表达上调(见图6);在mir-32-5p mimics转染的sk-n-sh细胞中,vps4b mrna和蛋白水平下调(p《0.05),而抑制mir-32-5p的imr-32细胞中vps4b的mrna和蛋白水平上调(p《0.05)(见图7),表明了在神经母细胞瘤细胞中vps4b和mir-32-5p之间存在负调控相关性;双荧光素酶报告基因检测的结果显示,当mir-32-5p和vps4b野生型3
’‑
utr荧光素酶报告基因共转染时,荧光素酶信号被抑制,而突变型utr不受抑制(见图8a和图8b),表明了mir-32-5p通过直接结合3
’‑
utr调节vps4b的表达,以上结果均证明了vps4b是mir-32-5p的直接作用靶点。
[0064]
实施例4 vps4b是mir-32-5p对神经母细胞瘤细胞转移的调控作用所必需的1、实验方法(1) 为了进一步评估vps4b是否有助于mir-32-5p的生物学效应,本实施例通过转染vps4b表达载体到sk-n-sh细胞中,vps4b表达载体构建如下,通过pcr扩增了编码vps4b的全长cdna,引物序列如下:正向引物为cccaagcttatgtcatccacttcgcccaac (seq id no:8),反向引物为cggaattcttagccttcttgaccaaaatcttc (seq id no:9),vps4b连接到载体pcdna3.1的适当位点,重组载体pcdna3.1-vps4b在大肠杆菌dh5α中增殖并通过dna序列分析证实含有vps4b cdna序列,将鉴定的pcdna3.1-vps4b转染到sk-n-sh细胞中,上述转染过程采用lipofectamine
®ꢀ
2000转染试剂(invitrogen,thermo fisher scientific,inc.)按照制造商的使用说明书进行;进行细胞划痕实验、transwell实验,具体实验方法同实施例2中的实验方法。
[0065]
(2) western blot实验本实施例中检测了细胞中的上皮细胞-间充质转化(emt)生物标志物e-cadherin、snail、egfr、mmp2、mmp9的表达水平,具体实验方法同实施例2中western blot的实验方法。
[0066]
2、实验结果结果显示,转染vps4b表达载体的sk-n-sh细胞中vps4b的表达水平显著增加(见图9a和图9b),与oevps4b-nc和vector-nc组相比,过表达vps4b促进sk-n-sh细胞的迁移和侵
袭(见图10),表明了vps4b在sk-n-sh细胞中是一种转移调控因子;oevps4b质粒和mir-32-5p mimic共转染可以一定程度降低过表达mir-32-5p对癌细胞转移(迁移和侵袭)的作用(p《0.05) (见图10),表明了mir-32-5p靶向vps4b并影响nb癌细胞的转移;western blot分析的结果显示,与oevps4b质粒共转染可恢复sk-n-sh细胞中mir-32-5p mimic引起的vps4b、egfr、snail、mmp2和mmp9蛋白的下调和e-cadherin的上调(p《0.05)(见图11a和图11b)。
[0067]
实施例5 mir-32-5p增加了神经母细胞瘤细胞对双氢青蒿素的敏感性1、实验方法本实施例研究了mir-32-5p是否能增加神经母细胞瘤细胞对dha的敏感性,采用mir-32-5p mimics(实验组)、nc mimics(阴性对照组)、mir-32-5p inhibitor(实验组)、nc inhibitor(阴性对照组)分别转染神经母细胞瘤细胞,然后用不同浓度的dha分别处理12 h和24 h,进行细胞划痕实验、transwell实验和western blot实验。具体实验方法同实施例2中的实验方法。
[0068]
2、实验结果细胞划痕实验的结果显示,与nc对照组相比,dha处理组在12 h和24 h的划痕宽度和划痕面积更大(见图12),表明了dha能够显著抑制肿瘤细胞的迁移能力;与vehicle对照组相比,上调mir-32-5p的表达可促进dha在12 h和24 h时对肿瘤细胞迁移的抑制作用(见图12),表明了mir-32-5p miminc能够增强dha对肿瘤细胞的抑制作用,mir-32-5p抑制剂能够缓解dha对肿瘤细胞的抑制作用,证明了mir-32-5p促进了dha对肿瘤细胞的抑制作用;transwell实验的结果显示,与nc对照组相比,dha显著降低了细胞迁移和侵袭的能力,mir-32-5p miminc和dha的共处理协同抑制细胞迁移和侵袭的能力,而抑制mir-32-5p的表达可显著增加肿瘤细胞的迁移和侵袭,且mir-32-5p抑制剂能够缓解dha对肿瘤细胞的抑制作用(见图13),表明了dha和mir-32-5p在肿瘤细胞的迁移和侵袭中具有协同抑制的作用,证明了mir-32-5p促进了dha对肿瘤细胞的抑制作用;western blot实验的结果显示,dha显著降低了egfr、mmp2、mmp9和snail的表达并增加了e-cadherin的表达,dha和mir-32-5p mimics联合应用时,显著增加了上述效果,且mir-32-5p抑制剂缓解了dha处理诱导的上述emt蛋白的表达变化(见图14a和图14b),进一步证明了mir-32-5p促进了dha在神经母细胞瘤细胞的迁移和侵袭中的抑制作用。
[0069]
实施例6 vps4b参与mir-32-5p和双氢青蒿素对神经母细胞瘤细胞转移的协同治疗作用1、实验方法本实施例进一步研究了vps4b对mir-32-5p和dha生物学效应的影响,首先检测了vps4b在神经母细胞瘤细胞sk-n-sh中的表达情况,并分析了vps4b的过表达是否能够缓解mir-32-5p mimics和dha对sk-n-sh细胞转移的抑制作用,具体实验方法同实施例2中的实验方法。
[0070]
2、实验结果结果显示,mir-32-5p mimic和dha显著下调vps4b的表达,而mir-32-5p inhibitor和dha显著上调vps4b的表达(见图15a和图15b);在mir-32-5p mimic和dha共处理的细胞中过表达vps4b能够缓解vps4b和emt蛋白的表达水平(见图15c和图15d);划痕实验的结果显示,dha-oevps4b-mimic组的划痕面积显著大于dha-oevps4b-nc组(见图16);
transwell实验的结果显示,过表达vps4b可以逆转dha和mir-32-5p mimic对细胞的迁移和侵袭的抑制作用(见图17);以上结果表明了vps4b过表达显著减弱了mir-32-5p和dha对细胞转移的抑制作用,进一步证实了vps4b是mir-32-5p和dha发挥对nb细胞转移抑制作用的靶点。
[0071]
实施例7 双氢青蒿素和mir-32-5p在裸鼠异种移植模型中抑制神经母细胞瘤的转移1、实验材料4-6周龄balb/c雌性裸鼠购自于北京维通利华实验动物技术有限公司,在标准室温、标准湿度的条件下进行饲养。
[0072]
2、实验方法本实施例在小鼠模型体内中进一步证实了上述结论,通过向裸鼠尾静脉注射imr-32细胞建立了神经母细胞瘤裸鼠异种移植模型,对其分别进行dha、mir-32-5p、dha+mir-32-5p治疗,之后处死小鼠,并收集肺组织和肿瘤组织,进行he染色和免疫荧光染色分析,对dha和mir-32-5p在体内肿瘤转移中的作用进行了分析。
[0073]
(1) 神经母细胞瘤裸鼠异种移植模型的构建所有动物的操作均按照中国中医科学院实验动物保护和使用管理委员会(iacuc)批准的《实验动物护理与使用指南》进行。4-6周龄balb/c雌性裸鼠尾静脉注射imr-32细胞(100 μl,2
×
106)以产生神经母细胞瘤转移瘤,注射1周后,随机将荷瘤裸鼠分为对照组(生理盐水,n=5)、dha治疗组(dha 100 mg/kg,n=5)和联合治疗组(dha 100 mg/kg+inhibitor,n=5),每隔一天用标准卡尺测量肿瘤的大小,按照公式v=(w2×
l)/2计算肿瘤的体积,小鼠每天腹腔注射dha和mir-32-5p inhibitor,持续3周。注射3周后,所有小鼠均用水合氯醛麻醉后实施安乐死,计数并拍摄肺结节数,每3-4天测量一次肿瘤的直径和大小,监测肿瘤形成情况。
[0074]
(2) 组织he染色和免疫荧光染色将小鼠进行安乐死后,检查每个肿瘤的湿重,切除移植肿瘤,并用4%多聚甲醛将其固定,固定后放置于液氮中冷冻。将肿瘤组织和肺组织进行苏木精伊红(h&e)/免疫组化染色,同时收集肿瘤组织进行蛋白表达检测。组织标本固定后,用石蜡包埋,或快速冷冻,液氮中保存备用。固定和包埋的组织切片用二甲苯脱蜡,再水合,在柠檬酸缓冲液(ph 6.0)微波加热的载玻片上进行抗原提取,组织切片与山葵过氧化物酶结合的山羊抗小鼠二抗共孵育。使用3,3
’‑
二氨基联苯胺(dab)(phoenix biotechnologies)对载玻片进行染色,meyer’s苏木精进行复染,并按照制造商的说明在乙醇中脱水,使用荧光显微镜(放大率,
×
200)观察结果,使用image pro plus软件估算集成光密度水平,以均数
±
标准差表示。
[0075]
3、实验结果结果显示,与nc组相比,mir-32-5p mimic的肺转移结节数量显著减少,dha与mir-32-5p mimic共处理组比mir-32-5p mimic组抑制细胞转移的作用更强(见图18a);与dha、mir-32-5p单独治疗相比,dha+mir-32-5p mimic联合治疗对肿瘤的抑制作用增强,he染色分析的结果显示,dha+mir-32-5p组的小鼠癌细胞明显小于dha组和mir-32-5p组(见图18b);在mir-32-5p mimic的小鼠肿瘤组织中,vps4b mrna的表达水平受到抑制(见图18c和图18d);western blot实验的分析结果显示,dha组、mir-32-5p组、dha+mir-32-5p组均使小
鼠体内的vps4b、egfr、snail、mmp2、mmp9下调,e-cadherin上调,与dha组和mir-32-5p组相比,dha+mir-32-5p组对蛋白质的调控作用更显著(见图18f和图18g);肺组织的免疫荧光检测分析结果显示,dha组、mir-32-5p组、dha+mir-32-5p组均使小鼠体内的vps4b蛋白下调(见图18e),以上结果表明,mir-32-5p通过靶向vps4b提高dha在体内的敏感性。
[0076]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1