cdk7抑制剂thz1在鼻咽癌放疗抵抗治疗中的应用
技术领域
1.本发明涉及生物技术领域,尤其涉及cdk7抑制剂thz1在鼻咽癌放疗抵抗治疗中的应用。
背景技术:2.肿瘤是我国的主要死亡原因,在过去的半个世纪,我国肿瘤的发生率和死亡率均保持上升趋势。2018年,肿瘤的新发病例约430万例,死亡病例约290万例。如何有效治疗肿瘤是亟待解决的公共卫生问题。
3.得益于鼻咽癌治疗策略的研究,鼻咽癌的治疗效果得到了很大的提升,但是仍然有20-30%的鼻咽癌病人因为放疗抵抗而发生复发和转移,放疗抵抗被认为是临床肿瘤治疗的主要障碍。目前以铂类为基础的双重化疗方案作为复发和转移性鼻咽癌的一线治疗。有关鼻咽癌放疗抵抗的机制研究,主要涉及了dna损伤修复增强,细胞周期改变,免疫逃逸等等。而对于放疗引起了基因组dna的各种损伤,这些损伤导致的转录改变是如何影响放射治疗的有效性目前还不清楚。
技术实现要素:4.(一)要解决的技术问题
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种cdk7抑制剂thz1在鼻咽癌放疗抵抗治疗中的应用,为鼻咽癌的治疗提供强有力的手段。
6.(二)技术方案
7.为了达到上述目的,本发明采用的主要技术方案包括:cdk7抑制剂thz1在制备治疗鼻咽癌药物中的应用。
8.较佳地,所述的抑制剂thz1的化学式为
[0009][0010]
较佳地,抑制剂thz1的体外浓度为150nm,体外作用时间为5天。
[0011]
较佳地,抑制剂thz1的小鼠每日给药剂量为10mg/kg,抑制剂thz1的小鼠给药时长为26天。
[0012]
另一方面,本发明提出一种cdk7抑制剂thz1在增加鼻咽癌放疗敏感性中的应用。
[0013]
此外,本发明还提出一种肿瘤药物的设计方法,以tfiih的亚基cdk7作为靶点,将其抑制剂thz1开发药物治疗放疗抵抗肿瘤。
[0014]
较佳地,所述的肿瘤为鼻咽癌。
[0015]
(三)有益效果
[0016]
本发明的有益效果是:本发明中的cdk7抑制剂thz1,在体外水平的细胞实验和体内水平的裸鼠皮下成瘤实验中,均能有效抑制鼻咽癌放疗抵抗肿瘤的生长。从细胞水平以及动物水平,证实了thz1与放疗联合使用时,可以增加放疗敏感性,说明thz1用于鼻咽癌放疗抵抗的治疗是可行的。
附图说明
[0017]
图1为rna聚合酶ii ctd在转录中的磷酸化示意图。
[0018]
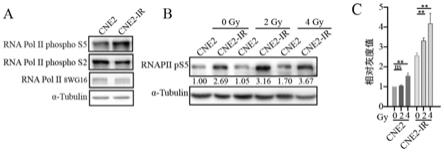
图2a为western blot检测cne2和cne2-ir细胞中rna聚合酶ii的s5和s2磷酸化的水平,α-微管蛋白作为对照。
[0019]
图2b为western blot检测cne2和cne2-ir细胞在接受指定剂量照射后rna聚合酶ii的s5磷酸化水平。
[0020]
图2c为细胞在放射后rna聚合酶ii的s5磷酸化水平的量化。用t检验比较差异,**表示p《0.01。
[0021]
图3为鼻咽癌cne2-ir放疗抵抗细胞对cdk7抑制剂thz1更为敏感。
[0022]
图4为thz1可以有效降低cne2-ir细胞对放疗产生的抵抗。
[0023]
图5为thz1可以降低放疗照射后以及放疗抵抗细胞中rna聚合酶ii的s5磷酸化的增加。
[0024]
图6为异种移植瘤模型中检测放疗抵抗的实验过程示意图。
[0025]
图7为不同实验组放疗后肿瘤体积的变化。用t检验比较差异,*表示p《0.05,**表示p《0.01。
[0026]
图8为小鼠皮下肿瘤冷冻切片免疫荧光染色图。
[0027]
图8a为thz1可以有效降低小鼠体内因放疗引起的rna聚合酶ii s5磷酸化水平的增加。rnapii ps5为绿色,dapi为蓝色。比例尺:1000μm,右下角插图比例尺:10μm。
[0028]
图8b为rna聚合酶ii s5磷酸化荧光强度的比较。用t检验比较差异,***表示p《0.001。
具体实施方式
[0029]
为了更好的解释本发明,以便于理解,下面通过具体实施方式,对本发明作详细描述。
[0030]
下面通过实施例对本技术的发明予以进一步说明,但并不因此而限制本技术的范围。
[0031]
除非另有说明,本发明中所公开的试验方法、检测方法、制备方法均采用本技术领域的分子生物学、生物化学、分析化学、细胞培养、重组dna技术等相关领域的常规技术。
[0032]
下述实施例中所用的材料、试剂等,如无具体实施例描述部分:特殊说明,均可从商业途径得到。
[0033]
基因转录主要分为四个阶段:转录起始,启动子近端暂停,转录延伸以及转录终止。rna聚合酶ii在启动子近端发生暂停时,c端结构域(ctd)的ser5被tfiih的亚基激酶cdk7磷酸化,而当rna聚合酶ii暂停被释放,进入转录延伸时,ser2被p-tefb的亚基cdk9磷
酸化,如图1所示。
[0034]
通过靶向周期蛋白依赖激酶等酶辅助因子,可以间接抑制肿瘤致癌转录因子。thz1,一种苯胺嘧啶,通过共价修饰抑制cdk7的活性,如下列化合式所示。thz1能够有效抵抗t-all细胞和其他的血液恶性肿瘤的增殖活性。在jurkat细胞中,低剂量thz1能够影响一小部分基因如关键调控因子runx1,导致基因表达失调和细胞死亡。
[0035][0036]
本发明的实施例的实验对象
[0037]
从下表所示的来源收集了鼻咽癌细胞;从江苏集萃药康生物科技股份有限公司购买了24只4周龄的balb/c-nu裸鼠。
[0038]
细胞名称组织或疾病类别来源cne2鼻咽癌中南大学湘雅医院肖志强老师馈赠cne2-ir鼻咽癌中南大学湘雅医院肖志强老师馈赠
[0039]
实施例1
[0040]
鼻咽癌放疗敏感和抵抗细胞中,rnapii ctd磷酸化水平有差异。
[0041]
通过本实施例可知:鼻咽癌放疗敏感细胞和放疗抵抗细胞中,rna聚合酶ii ser5磷酸化上的差异。
[0042]
(1)材料和试剂:
[0043]
购置如下表所示的基础培养基和血清,按照10%fbs比例配制,用于培养cne2和cne2-ir等细胞。用细胞裂解液收集蛋白,进行蛋白质免疫印迹实验。
[0044][0045]
(2)实验步骤
[0046]
1)收集蛋白
[0047]
将4
×
105个细胞铺至6孔板中,在37℃和5%co2环境中培养24小时。去掉培养基,用缓冲液dpbs漂洗细胞3遍,加入200μl细胞裂解液(2%sds,10%甘油,62.5mm tris-hcl ph 6.8;加入1
×
蛋白酶抑制剂cocktail,10mm氟化钠,1mm正钒酸钠),用细胞刮铲将细胞刮下来,在干热仪上95-100℃处理5分钟,点离后去掉沉淀。
[0048]
2)电离辐照
[0049]
将4
×
105个细胞铺至6孔板中,在37℃和5%co2环境中培养24小时后,使用线性加速器(x-rad 225,precision),在室温和200cgy/min的条件下进行不同剂量的辐照,继续培养48小时后收集蛋白,步骤同上。
[0050]
3)测定蛋白浓度
[0051]
取1块96孔板,将蛋白标准品按2,1.5,1,0.75,0.5,0.25,0.125,0.05mg/ml的浓度梯度稀释,每孔加入6μl。加入4微升细胞蛋白样品以及2微升灭菌去离子水。标准品和样品均设置两个复孔。将bca试剂a和bca试剂b按50:1配制成bca工作液,每孔加入120μl,37℃避光孵育20-30分钟。用酶标仪测定a562,根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
[0052]
4)蛋白质免疫印迹实验
[0053]
第1步:清洗玻璃板,配制8%分离胶,混匀后迅速加至玻璃板中,缓慢加入ddh2o将胶界面压平。
[0054]
试剂或材料体积ddh2o4.6ml30%丙烯酰胺2.6ml1.5m tris-hcl ph 8.82.6ml10%sds100μl10%aps100μltemed10μl
[0055]
第2步:待分离胶凝固后,配制4%浓缩胶,插入适应玻璃板规格的梳子。
[0056][0057][0058]
第3步:待胶凝固后,缓慢垂直拔出梳子。将玻璃板放置进跑胶电泳盒,配制10
×
电泳液,在电泳盒中加入1
×
电泳液。
[0059]
试剂或材料体积或重量glysin144gtris30gsds10gddh2oto 1l
[0060]
第4步:按每孔上样量20μg计算出样品的上样体积,按10:1在样品中加入10
×
loading buffer(1%溴酚蓝+β-巯基乙醇=1:4),在干热仪上95-100℃处理5分钟,点离,混匀。
[0061]
第5步:上样。按蛋白marker和样品逐个点样,其余孔用1
×
loading buffer补齐。
[0062]
第6步:跑胶。先用80v电压跑30分钟,待样品跑齐至一条线后,继续用120v电压跑1小时。
[0063]
第7步:转膜。配制1
×
转膜液,在盛有转膜液的容器中,按照转膜底板、海绵、滤纸、分离胶、pvdf膜、滤纸、海绵、透明顶板的顺序夹好。在低温环境下,用290ma恒流转90分钟。
[0064]
试剂或材料体积或重量glysin9gtris1.93g甲醇200mlddh2oto 1l
[0065]
第8步:封闭。取出pvdf膜,用pbst漂洗后,放入pbst(0.1%tritonx-100)配制5%脱脂牛奶,检测蛋白质的磷酸化则需要用5%bsa封闭。在摇床上进行,膜正面朝上,室温孵育1小时。
[0066]
第9步:一抗孵育。将牛奶封闭后的膜用pbst清洗3次,用5%bsa配制的rnapii抗体(鼠抗,1:3000),rnapii s5磷酸化抗体(鼠抗,1:3000),和rnapii s2磷酸化抗体(兔抗,1:5000),α-tubulin(鼠抗,1:5000)在摇床上4℃孵育过夜。
[0067]
第10步:二抗孵育。pbst清洗3次,用5%bsa配制的二抗(1:5000),在摇床上室温孵育1小时。
[0068]
第11步:显影。pbst洗3次后,ecl显影。
[0069]
(3)测试结果和结论:
[0070]
在鼻咽癌放疗敏感和抵抗细胞中,相对于总rnapii的蛋白水平来说,rnapii ctd ser5磷酸化水平在抵抗细胞中较高,ser2磷酸化水平在抵抗细胞中较低,如图2a所示。在给予一定剂量的辐照后,cne2和cne2-ir的rnapii ser5磷酸化水平均增加,并且cne2-ir的rnapii ser5磷酸化水平高于cne2,如图2b所示,图2c为三次重复实验的灰度统计图。
[0071]
实施例2
[0072]
cne2和cne2-ir对cdk7抑制剂thz1的敏感性不同。
[0073]
(1)材料和试剂:
[0074]
购置以下试剂。
[0075][0076]
(2)实验步骤
[0077]
1)药物处理
[0078]
第1步:以10cm培养皿为例,用1ml胰酶消化对数期细胞,终止消化后离心收集,使用无酚红dmem培养基重悬成细胞悬液,计数后,按照每孔1000个cne2细胞和每孔1200个cne2-ir细胞,计算后取适量细胞铺板于96孔板中(边缘孔用无菌pbs填充),每一个加药浓度均设置三个以上复孔。保留三个复孔只加等量培养基作为本底,在37℃和5%co2环境中培养至细胞单层铺满孔底。
[0079]
第2步:将药物溶于10%dmso的dpbs缓冲液中,等细胞贴壁后,按照0、0.01、0.03、0.1、0.3、1、3、10μm的浓度梯度来加药,设置0μm的对照为只加入等体积的溶剂,每个孔的dmso终浓度均小于0.2%。细胞在37℃和5%co2环境中继续培养3天。
[0080]
2)mtt实验检测细胞活力
[0081]
第1步:每个孔加入20μl mtt溶液(5mg/ml,即0.5%mtt),继续培养4h后终止培养。
[0082]
第2步:每个孔加入50μl三联溶解液(10%sds,5%异丁醇,0.012mol/l浓盐酸),放入培养箱孵育过夜。
[0083]
第3步:用酶标仪检测,药物处理3天后,对照组(溶剂)和实验组(药物)细胞,在
490nm波长各个孔的吸光度值,记录结果。
[0084]
第4步:将各孔的吸光度值减去本底值,再将实验组每个浓度的吸光度值取平均数,除以对照组平均吸光度值,得到不同药物浓度作用下的平均细胞存活率(%),并计算不同药物浓度下的标准差。以药物浓度的log值为横坐标,平均细胞存活率(%)作为纵坐标绘制细胞生长曲线,见图3,并用graphpad进行dose-response-inhibition参数分析计算ic50。
[0085]
(3)测试结果和结论:
[0086]
cne2-ir放疗抵抗细胞对cdk7抑制剂thz1更为敏感,ic50为209nm。cne2细胞的ic50为1027nm。
[0087]
实施例3
[0088]
放疗照射和thz1共同作用,对cne2和cne2-ir生长增值的影响。
[0089]
(1)试剂和材料:
[0090]
参考实施例2。
[0091]
(2)实验步骤:
[0092]
1)药物处理
[0093]
以cne2为例,将每孔4
×
105个细胞铺至6孔板中的2个孔,铺2块,放至37℃和5%co2环境中培养待细胞贴壁。将药物溶于10%dmso的dpbs缓冲液中,每块板中各加入终浓度为150nm的thz1,以及0μm不含thz1的溶剂,每个孔的dmso终浓度均小于0.2%,放至37℃和5%co2环境中培养12小时。
[0094]
2)电离辐照
[0095]
取其中1块6孔板,使用线性加速器(x-rad 225,precision),在室温和200cgy/min的条件下进行2gy剂量的辐照。将对照组(溶剂,0gy)和实验组(药物,0gy;溶剂,2gy;药物,2gy)的cne2细胞消化下来,离心并重悬于无酚红培养基,计数后按每孔1000个铺于96孔板,每组至少3个复孔,保留三个复孔只加等量培养基作为本底,放至37℃和5%co2环境中培养5天。cne2-ir的处理同cne2,每孔1200个铺于96孔板。
[0096]
3)mtt实验检测细胞活力
[0097]
参考实验2的第1-2步。用酶标仪检测,放疗和药物共同处理5天后,对照组(溶剂,0gy)和实验组(药物,0gy;溶剂,2gy;药物,2gy)细胞,在490nm波长各个孔的吸光度值,记录结果。将各个孔的吸光度值减去本底值,再分别计算实验组与对照组的吸光度值的比值,得到实验组不同条件下的细胞细胞存活率(%),绘制图4的柱状图。
[0098]
(3)结果和结论:
[0099]
如图4所示,在接受2gy放疗处理后,加用抑制剂thz1的cne2-ir细胞,与不加thz1的cne2-ir相比,可以有效降低cne2-ir细胞对放疗产生的抵抗,具有增加放疗敏感性的效果。
[0100]
实施例4
[0101]
放疗照射和thz1共同作用下,cne2和cne2-ir细胞的rnapii ser5磷酸化的变化。
[0102]
(1)材料和试剂:
[0103]
参考实验1和实验2。
[0104]
(2)实验步骤:
[0105]
1)加药处理
[0106]
以cne2为例,将每孔4
×
105个细胞铺至6孔板中的2个孔,铺2块,放至37℃和5%co2环境中培养待细胞贴壁。将药物溶于10%dmso的dpbs缓冲液中,每块板中各加入终浓度为250nm的thz1,以及0μm不含thz1的溶剂,每个孔的dmso终浓度均小于0.2%,放至37℃和5%co2环境中培养12小时。
[0107]
2)电离辐照
[0108]
取其中1块6孔板,使用线性加速器(x-rad 225,precision),在室温和200cgy/min的条件下进行6gy剂量的辐照,放至37℃和5%co2环境中培养48小时。cne2-ir的处理同cne2。
[0109]
收集蛋白
[0110]
将对照组(溶剂,0gy)和实验组(溶剂,6gy;药物,0gy;药物,6gy)按实验1的实验步骤收集蛋白。
[0111]
4)蛋白质免疫印迹实验
[0112]
参考实验1的实验步骤。
[0113]
结果和结论:
[0114]
如图5所示,与cne2相比,thz1可以降低cne2-ir的rnapii ser5磷酸化水平。并且thz1可以降低cne2和cne2-ir中因为放疗照射产生的rnapii ser5磷酸化增加。
[0115]
实施例5
[0116]
加用thz1抑制剂,可有效抑制鼻咽癌放疗抵抗细胞异种移植瘤的生长。
[0117]
(1)材料和试剂:
[0118]
从湖南斯莱克景达实验动物有限公司购买了24只4周龄的balb/c-nu裸鼠,饲养两周后进行实验。
[0119]
[0120]
(2)实验步骤:
[0121]
第1步:消化收集cne2-ir细胞,细胞计数后,用dpbs重悬细胞,并调整细胞浓度为5
×
107/ml。随后用胰岛素针吸取100μl 5
×
106个细胞接种于裸鼠皮下。
[0122]
第2步:待肿瘤平均体积到达200mm3时,进行分组。如图6,分为:对照组、溶质注射及4gy放疗组、thz1注射和4gy放疗组。
[0123]
第3步:将5%医用葡萄糖注射液配制的10%dmso溶液作为溶质,将thz1配制成2mg/ml的母液。thz1注射组每只均使用1ml注射器按10mg/kg/day腹腔注射thz1,溶质注射组同等条件注射10mg/kg/day的溶质,药物注射维持至实验终止。
[0124]
第4步:配制麻醉药。加10mg三溴乙醇至10ml叔戊醇中完全溶解,配制成母液,可用锡箔纸包好4℃避光保存。按1:40将母液溶于生理盐水,使用0.22μm的滤膜进行过滤,4℃避光保存,麻醉药有效期为1个月。
[0125]
第5步:thz1组和溶质组小鼠,在初次注射thz1和溶质24小时后,按照麻醉药注射量为10-20μl/g进行腹腔注射,5-10分钟后小鼠被麻醉,用铅块遮盖小鼠身体,只暴露肿块部分,在室温和200cgy/min的条件下进行4gy剂量的辐照。待小鼠恢复后,每隔一天测量肿瘤体积并绘制生长曲线,如图6所示。
[0126]
(3)结果和结论:
[0127]
如图7所示,通过定期测量肿瘤体积的变化,发现与对照组相比,给与4gy放疗处理后,cne2-ir抵抗肿瘤在短暂几天生长受抑制后,可以恢复肿瘤增殖。而加用thz1药物后,可以有效抑制抵抗肿瘤在4gy放疗处理后的增殖。说明thz1在小鼠体内也能够有效抑制放疗抵抗肿瘤的生长。
[0128]
实施例6
[0129]
thz1在体内可以有效抑制因放疗引起的rnapii ser5磷酸化水平的增加。(1)材料和试剂:购置以下试剂。
[0130][0131][0132]
(2)实验步骤:
[0133]
1)肿瘤组织剥离和脱水
[0134]
第1步:断颈法处死小鼠,在超净台上使用无菌刀片将肿瘤剥离,并按动物房规定处理小鼠尸体。
[0135]
第2步:将肿块迅速放入稀释的4%甲醛溶液中,4℃冰箱固定过夜。
[0136]
第3步:用pbs在摇床上清洗肿块三次,每次10分钟。
[0137]
第4步:将肿块加入15%蔗糖溶液中,置于4℃冰箱,2-3小时后,肿块下沉至底部。
[0138]
第5步:将肿块加入30%蔗糖溶液中,4℃冰箱过夜。
[0139]
2)oct包埋
[0140]
第1步:准备约5cm
×
5cm的方形锡箔纸,折叠出来一个立方形的容器。并用marker笔在侧面标记肿块的信息。
[0141]
第2步:在底部加入一层oct试剂,将肿块加入标记好的锡箔纸容器中,迅速在上面再加一层oct,直至将肿块组织全部覆盖。并迅速使用镊子将组织置于液氮中速冻。
[0142]
第3步:待oct全部变白后,取出锡箔纸并包好,立即放入-80℃保存。
[0143]
3)冰冻切片及免疫荧光染色
[0144]
第1步:将德国徕卡1950型快速冰冻切片机预冷至-20℃,取出组织支取器,将组织用oct固定在支取器上。
[0145]
第2步:将支取器固定于持承器上,启动进退键,旋动旋钮,将组织修平。
[0146]
第3步:调到欲切的厚度至12um左右,调好防卷板,使切出的切片能在第一时间顺利地通过刀和防卷板之间,平整地铺在持刀器的挡板上,这时可掀起防卷板,取出一块预冷的载玻片,将其贴上并标记。切片置于-80℃冰箱储存。
[0147]
第4步:用丙酮室温固定5分钟,pbs清洗2次,每次5分钟。
[0148]
第5步:用5%bsa室温封闭30分钟。
[0149]
第6步:吸走bsa,用rnapii s5磷酸化抗体(鼠抗,1:1000)4℃冰箱孵育过夜。
[0150]
第7步:pbst洗3次,每次10分钟,室温避光孵育二抗alexa fluor 488dye(1:500)1小时。
[0151]
第8步:pbst洗3次,用dapi染色1分钟。pbst洗3次后封片。
[0152]
第9步:使用zesis lsm 880confocal进行显微镜下成像。
[0153]
(3)结果和结论:对照组、溶质注射及4gy放疗组、thz1注射和4gy放疗组的小鼠,将其肿瘤组织冰冻切片,进行rnapii ser5磷酸化的免疫荧光染色,发现与对照组相比,给与4gy放疗处理的肿瘤rnapii ser5磷酸化增加,而加用thz1药物后,可以有效降低肿瘤在4gy放疗处理后出现的rnapii ser5磷酸化增加。说明thz1在小鼠体内也可以有效降低因放疗引起的rnapii ser5磷酸化水平的增加,见图8。
[0154]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
