一种用于介入手术的载药油剂制备方法及其应用与流程
本发明涉及药剂制造领域,尤其涉及一种用于介入手术的载药油剂制备方法,及其制备的载药油剂的应用。
背景技术:
1、超液化碘油常规用于原发性肝细胞肝癌介入术中,在原发性肝癌的介入治疗中碘油又称做碘化油,乙碘油,其组分为植物油与碘结合的一种有机碘化合物,活性成分为碘化植物油脂肪酸乙酯。在原发性肝细胞肝癌的介入治疗中一般是将碘油与一到两种化疗药物做成临时乳剂,通过导管注射到供血肿瘤的肝动脉内,即经导管肝动脉化疗栓塞术。在这种介入手术中,碘油被看作一种液体栓塞剂,用于栓塞肿瘤小动脉,往往在手术中先将水溶性化疗药物与碘油充分混合,医生希望通过注射器反复抽吸充分混合碘油和水溶性化疗药物的混合物制备成乳剂,目的是让碘油载带药物。这种碘油-化疗药物混合乳剂经过导管,注入到肝肿瘤中。医生希望随着碘油进入肿瘤血管中,化疗药物也被携带进入肿瘤中,化疗药物缓释起到治疗作用。但这种临时乳剂很不稳定,极短的时间内就破乳分层,碘油重新析出,与药物分离。结果是药物并未随着碘油滞留肿瘤内部,而是流向全身,类似静脉化疗的作用。化疗药物基本没有起到作用。
2、小分子靶向药物已经广泛用于恶性肿瘤的治疗,很多恶性肿瘤患者已从中获益。大部分的靶向药物都难溶于水,多为口服制剂,生物利用度低,但目前使用的靶向药物其实并不是理想的靶向,这些口服的靶向药物不仅仅是靶向肿瘤细胞的相关基因,它也同样靶向全身各器官、组织中的正常细胞的相关基因。所以这些口服靶向药物的全身副作用非常明显;由于靶向药物不溶于水,所以目前还没有靶向药物的水溶液剂型;即使是强行溶解了,通过静脉注入到血液循环中,药物会马上析出导致致命并发症。我们有小鼠实验的结果可以证实;
3、我们实验发现注射到肿瘤组织中植物油或脂肪酸可以长期存留,不容易被清除或者吞噬。利用这种特性可以将植物油及脂肪酸用做药物载体,药物会随着载体被截留在肿瘤局部并长期存留,不流向全身。
4、如果能将这些难溶性药物均匀加载在油性载体中并稳定存在,就可以制备成药物油性溶液,使药物直接到达病灶用于局部治疗,提高了药物生物利用度,一方面扩展了药物的使用范围,另一方面减少药物剂量的同时也减轻了药物的副作用。
技术实现思路
1、为了克服现有技术的上述缺点,本发明的目的是提供一种提高了药物生物利用度也减轻了药物副作用的载药油剂制备方法。
2、本发明解决其技术问题所采用的技术方案是:
3、一种用于介入手术的载药油剂制备方法,将药物与脂质偶联后均匀分散在油性载体中,得到载药油制剂。
4、作为一种改进方案,所述药物与脂质的偶联,是药物与脂质在反应介质中通过氢键、分子间作用力或共价键进行偶联,产物经过纯化获得药物-脂质偶联物,所述偶联物可以均匀分散在油性载体中并稳定存在;
5、其中药物与脂质通过共价键偶联包括药物与脂质直接偶联或者通过连接桥进行偶联。
6、作为一种改进方案,所述药物与脂质偶联的方法包括
7、(1)通过氢键或分子间作用力偶联;
8、(2)通过共价键偶联,包括缩合剂法、混合酸酐法、酰卤法。
9、作为一种改进方案,所述通过氢键或分子间作用力偶联法,是指在反应介质中,脂质分子与药物通过氢键或分子间作用力结合形成脂质药物偶联物,产物经纯化后再均匀分散在油载体中。
10、作为一种改进方案,所述缩合剂法,脂质分子中羧基或磷酸基在缩合剂和催化剂作用下与药物分子中的胺基或羟基反应生成药物-脂质偶联物;
11、所述缩合剂法包括碳二亚胺类缩合剂法、碳鎓盐类缩合剂法、鏻鎓盐类缩合剂法、有机磷类缩合剂法;
12、所述碳二亚胺类缩合剂法所用缩合剂包括二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)中任意一种;
13、所用催化剂包括4-二甲氨基吡啶(dmap)、4-吡咯烷基吡啶(4-ppy)、1-羟基苯并三唑(hobt)、1-羟基-7-氮杂苯并三氮唑(hoat)、n-羟基琥珀酰亚胺(nhs)、n-羟基邻苯二甲酰亚胺(nhpi)、n-羟基-1,8-萘二甲酰亚胺(nhni)、五氟苯酚(pfpoh)中任意一种;
14、所述碳鎓盐类缩合剂法所用缩合剂包括o-(7-氮杂苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(hatu)、o-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(hbtu)、o-(5-氯苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(hctu)、o-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓四氟硼酸盐(tbtu)、o-(n-丁二酰亚胺基)-二(二甲胺基)碳鎓四氟硼酸盐(tstu)、o-(n-endo-5-降莰烯-2,3-二碳二酰亚胺)-二(二甲胺基)碳鎓四氟硼酸盐(tntu)中任意一种;
15、所述鏻鎓盐缩合剂法所用缩合剂包括苯并三氮唑-1-基氧基-三(二甲胺基)鏻鎓六氟磷酸盐(bop)、7-氮杂苯并三氮唑-1-基氧基-三(二甲胺基)鏻鎓六氟磷酸盐(aop)、苯并三氮唑-1-基氧基-三(1-吡咯烷基)鏻鎓六氟磷酸盐(pybop)、7-氮杂苯并三氮唑-1-基氧基-三(1-吡咯烷基)鏻鎓六氟磷酸盐(pyaop)中任意一种;
16、所述有机磷类缩合剂法所用缩合剂包括二苯基磷酰氯(dpp-cl)、氰代磷酸二乙酯(decp)、叠氮化磷酸二苯酯(dppa)、硫代二甲基磷酰基叠氮(mpta)、二(2-氧-3-唑烷基)磷酰氯(bop-cl)中任意一种。
17、作为一种改进方案,所述混合酸酐法,首先脂质分子中羧基或磷酸基与酰化试剂生成混合酸酐,再进一步与药物分子中胺基或羟基反应,生成药物-脂质偶联物;
18、所述混合酸酐法包括氯甲酸酯法、羰基二咪唑法、磺酰氯法、boc酸酐法;
19、所述氯甲酸酯法所用酰化试剂为氯甲酸乙酯或氯甲酸异丁酯;
20、所述羰基二咪唑法所用酰化试剂为n,n'-羰基二咪唑(cdi);
21、所述磺酰氯法所用酰化试剂为甲烷磺酰氯(mscl),对甲苯磺酰氯(tscl)和对硝基苯磺酰氯(nscl);
22、所述boc酸酐法所用酰化试剂为二叔丁基二碳酸酯((boc)2o)。
23、作为一种改进方案,酰卤法是将脂质分子中的羧基或磷酸基与卤化试剂形成酰卤,再与药物分子中的胺基或羟基反应,生成-药物脂质偶联物;在卤化反应步骤中常需要加入有机碱或无机碱来中和生成的卤化氢来促进反应进行。
24、所述卤化试剂包括二氯亚砜、三氯氧磷、草酰氯、三氯均三嗪、三氟均三嗪;
25、所述有机碱包括三乙胺、吡啶;
26、所述无机碱包括碳酸钠、碳酸氢钠、碳酸钾、氢氧化钠、氢氧化钾。
27、作为一种改进方案,所述药物与脂质偶联的反应介质包括可以溶解药物和脂质的有机溶剂,如二氯甲烷、氯仿、乙酸乙酯、苯、甲苯、二甲苯、四氢呋喃、乙腈、二氧六环、石油醚、乙醚、二氯亚砜、二甲基甲酰胺;
28、当反应介质为上述有机溶剂时,纯化后的偶联物溶液需要先通过旋蒸浓缩,继而进行真空干燥法去除溶剂,然后将药物-脂质偶联物再重新溶解到油性载体中。
29、作为一种改进方案,所述药物与脂质偶联中反应介质优选为液态的植物油、液态的脂肪酸、液态的脂肪酸一元醇酯、液态的脂肪酸甘油酯以及上述植物油、脂肪酸、脂肪酸酯的衍生物;反应产物经过纯化可获得载有药物-脂质偶联物的油性制剂。
30、作为一种改进方案,所述脂质包括脂肪酸类、脂肪醇类、甘油脂类、甘油磷脂类、鞘脂类、固醇脂类、孕烯酮醇脂类,及上述脂质的衍生物一种或多种。
31、再进一步的,所述脂肪酸类脂质包括短链脂肪酸、中链脂肪酸、长链脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸及其衍生物中的至少一种;
32、所述短链脂肪酸包括:乙酸、丙酸、乳酸、丁酸、异丁酸、戊酸、异戊酸、丁二酸、丁烯酸、丁烯二酸、戊二酸、戊烯酸、戊烯二酸;
33、所述中链脂肪酸包括己酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、十一烯酸、月桂酸;
34、所述长链脂肪酸包括十三烷酸、肉豆蔻酸、肉豆蔻烯酸、十五烷酸、十五碳烯酸、棕榈酸、棕榈油酸、十七烷酸、十七烯酸、硬脂酸、油酸、亚油酸、亚麻油酸、花生酸、二十碳烯酸、二十碳二烯酸、二十碳三烯酸、花生四烯酸、二十碳五烯酸、二十一碳酸、山嵛酸、芥酸、二十二碳二烯酸、二十二碳五烯酸、二十二碳六烯酸、二十三碳酸、二十四碳酸、二十四碳烯酸;
35、以及上述脂肪酸衍生物如臭氧化脂肪酸中的至少一种。作为一种改进方案,所述共价键包括结构稳定的酰胺键、酯键;以及
36、对酸敏感的腙键、亚胺键、肟键、硅醚键、马来酸二酯键;
37、对氧化还原敏感的二硫键、二硒键、硫醚键、硒醚键;
38、对酶敏感的肽键、半乳糖糖苷键、葡糖苷酸键、硫酸酯键、焦磷酸二酯键。
39、作为一种改进方案,所述药物与脂质的共价偶联可以是药物分子与脂质分子之间直接以共价键结合,也可以是药物分子与脂质分子通过一个连接桥连接;
40、所述连接桥是一个分子,或是两个分子以上的聚合物,包括聚氨基酸、短肽、聚糖、糖胺聚糖、聚乙二醇、聚丙烯酸、聚乳酸、聚己内酯。
41、作为一种改进方案,所述纯化方法包括过滤、萃取、重结晶、柱层析、透析中的一种或多种。
42、作为一种改进方案,所述反应介质及油载体优选为碘油,所述偶联方法优选为氢键或分子间作用力偶联法;
43、具体方法如下:
44、将药物和脂质加入到碘油中,加热并搅拌,反应温度30-60℃,反应时间15min-4h,过滤或离心除去不溶物,即得载有药物的碘油;
45、其中所述药物与脂质的摩尔比为1:1-1:10;
46、所述脂质在碘油中的浓度为1%-20%。
47、作为一种改进方案,所述反应介质及油载体优选为碘油,所述偶联方法优选为碳二亚胺类缩合法,所述缩合剂优选为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci),所述催化剂优选为n-羟基琥珀酰亚胺(nhs);
48、具体方法如下:
49、将药物、脂质、缩合剂和催化剂加入到碘油中,加热并搅拌,反应温度30-60℃,反应时间15min-4h,过滤或离心除去不溶物,即得载有药物的碘油;
50、其中所述药物与脂质的摩尔比为1:1-1:10;
51、所述药物与缩合剂的摩尔比为1:1-1:5;
52、所述药物与催化剂的摩尔比为1:1-1:10;
53、所述脂质在碘油中的浓度为1%-20%。
54、作为一种改进方案,所述油载体包括液态的植物油、液态的脂肪酸、液态的脂肪酸一元醇酯、液态的脂肪酸甘油酯以及上述植物油、脂肪酸、脂肪酸酯的衍生物。
55、作为一种改进方案,所述药物包括系统化疗药物、小分子靶向药物、镇痛药物、放射性核素以及用于示踪的显影剂。
56、所述系统化疗药物包括:
57、干扰核酸代谢,抑制核酸合成的药物:去氧氟尿苷、氟尿嘧啶、巯嘌呤、硫鸟嘌呤、阿糖胞苷、氟鸟苷、替加氟、吉西他滨、卡莫氟、羟基脲、甲氨蝶呤、安西他滨、培美曲赛、雷替曲赛;
58、破坏dna结构,阻断dna复制的药物:尼莫司汀、卡莫司汀、洛莫司汀、司莫司汀、环磷酰胺、异环磷酰胺、甘磷酰芥、达卡巴嗪、丙卡巴肼、卡铂、顺铂、奥沙利铂、奈达铂、丝裂霉素、培洛霉素、平阳霉素、博来霉素;
59、拓扑异构酶抑制剂:伊立替康、三尖杉酯碱、羟基喜树碱、拓扑替康、替尼泊苷、依托泊苷;
60、干扰rna转录的药物:放线菌素d、多柔比星、柔红霉素、表柔比星、吡柔比星、米托蒽醌;
61、抑制微管蛋白合成,阻滞细胞分裂的药物:长春瑞滨、紫杉醇、多西紫杉醇、长春新碱、长春地辛、长春碱;
62、抑制蛋白质合成的药物:门冬酰胺酶;
63、抗激素类药物:阿他美坦、氨鲁米特、来曲唑、福美坦、甲他孕酮、他莫昔芬。
64、再进一步的,所述小分子靶向药包括:
65、akt抑制剂:卡帕塞替尼(capivasertib);
66、alk抑制剂:克唑替尼(crizotinib)、色瑞替尼(ceritinib)、艾乐替尼(alectinib)、布加替尼(brigatinib)、劳拉替尼(lorlatinib);
67、bcl-2抑制剂:维奈妥拉(venetoclax);
68、bcr-abl抑制剂:伊马替尼(imatinib)、达沙替尼(dasatinib)、尼洛替尼(nilotinib)、普纳替尼(ponatinib);
69、braf v600e抑制剂:维莫非尼(vemurafenib)、达拉非尼(dabrafenib)、康奈非尼(encorafenib);
70、btk抑制剂:伊鲁替尼(ibrutinib)、阿卡替尼(acalabrutinib)、泽布替尼(zanubrutinib)、奥布替尼(orelabrutinib);
71、cdk4/6抑制剂:帕博西林(palbociclib)、瑞博西林(ribociclib)、玻玛西林(abemaciclib);
72、egfr抑制剂:吉非替尼(gefitinib)、厄洛替尼(erlotinib)、埃克替尼(icotinib)、阿法替尼(afatinib)、达克替尼(dacomitinib)、奥希替尼(osimertinib)、阿美替尼(almonertinib);
73、fgfr抑制剂:厄达替尼(erdafitinib)、培米替尼(pemigatinib)、英非格拉替尼(infigratinib);
74、ezh2抑制剂:他泽司他(tazemetostat);
75、heg2抑制剂:拉帕替尼(lapatinib)、来那替尼(neratinib)、吡咯替尼(pyrotinib)、图卡替尼(tucatinib);
76、hdac抑制剂:伏立诺他(vorinostat)、罗米地辛(romidepsin)、贝利司他(belinostat)、帕比司他(panobinostat)、西达本胺(chidamide)、mocetinostat;
77、mek抑制剂:曲美替尼(trametinib)、考比替尼(cobimetinib)、比美替尼(binimetinib)、司美替尼(selumetinib);
78、met抑制剂:卡马替尼(capmatinib)、特泊替尼(tepotinib)、沃利替尼(savolitinib);
79、mtor抑制剂:西罗莫司(sirolimus)、替西罗莫司(temsirolimus)、依维莫司(everolimus)、佐他莫司(zotarolimus);
80、ntrk抑制剂:恩曲替尼(entrectinib)、拉罗替尼(larotrectinib)、艾乐替尼(alectinib);
81、parp抑制剂:奥拉帕利(olaparib)、尼拉帕利(niraparib)、他拉唑帕利(talazoparib)、鲁卡帕利(rucaparib);
82、pdgfr抑制剂:阿伐普替尼(avapritinib)、米哚妥林(midostaurin)、尼达尼布(nintedanib)、拉多替尼(radotinib)、瑞普替尼(ripretinib);
83、pi3k抑制剂:阿培利司(alpelisib)、艾代拉利司(idelalisib)、厄布利塞(umbralisib);
84、蛋白酶体(proteasome)抑制剂:硼替佐米(bortezomib)、卡非佐米(carfilzomib)、伊沙佐米(ixazomib);
85、ret抑制剂:普雷西替尼(pralsetinib)、塞尔帕替尼(selpercatinib);
86、ros1抑制剂:恩曲替尼(entrectinib);
87、smo抑制剂:维莫德吉(vismodegib)、索尼德吉(sonidegib)、格拉吉布(glasdegib);
88、src/ab1双重抑制剂:博舒替尼(bosutinib);
89、vegfr抑制剂:索拉非尼(sorafenib)、舒尼替尼(sunitinib)、帕唑帕尼(pazopanib)、瑞戈非尼(regorafenib)、凡德他尼(vandetanib)、乐伐替尼(lenvatinib)、卡博替尼(cabozantinib)、阿昔替尼(axitinib)、特拉替尼(telatinib)、阿帕替尼(apatinib)、安罗替尼(anlotinib)、呋喹替尼(fruquintinib);
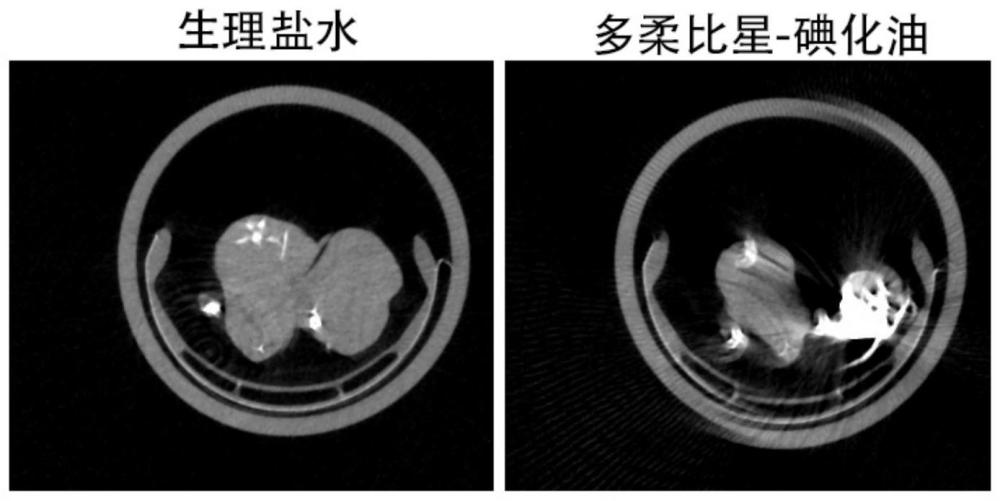
90、其他:泊马度胺(pomalidomide)。
91、再进一步的,镇痛药包括非甾体抗炎镇痛药物、高乌甲素和草乌甲素,及上述镇痛药的衍生物中的至少一种;
92、所述非甾体抗炎镇痛药物包括:阿司匹林、对乙酰氨基酚、安乃近、保泰松、羟基保泰松、吲哚美辛、吲哚美辛钠、双氯芬酸、双氯芬酸钠、丁苯羟酸、萘普生、萘普生钠、萘普酮、布洛芬、酮基布洛芬、洛索洛芬、洛索洛芬钠、舒林酸、氯诺昔康、吡罗昔康、美洛昔康、尼美舒利、氟比洛芬、氟比洛芬钠、氟比洛芬酯、塞来昔布、依托考昔、帕瑞昔布、艾瑞昔布、酮洛酸、酮洛酸氨丁三醇以及上述药物的衍生物。
93、再进一步的,所述放射性核素包括77br,45ca,57co,58co,51cr,131cs,137cs,67cu,59fe,67ga,195hg,197hg,203hg,123i,125i,131i,111in,177lu,99mo,185os,191os,32p,33p,203pb,35s,113sn,85sr,89sr,99tc,132te,201th,48v,133xe,87y,90y,91y,169yb,65zn。
94、再进一步的所述用于示踪的显影剂包括
95、x线下显影剂:碘他拉酸、碘他拉葡胺、碘佛醇、碘苯酯、碘帕醇、碘海醇、碘克沙醇、碘美普尔中的至少一种;
96、以及核磁共振显影剂:含铁、钆、锰化合物中的至少一种。
97、使用如上述任意一项方法制备的用于介入手术的载药油剂在介入手术用于肿瘤局部治疗的应用。
98、与现有技术相比,本发明的有益效果是:
99、本发明中药物与脂质的偶联,增加了药物的脂溶性,使水溶性或难溶性药物也能加载到油载体中,与油载体一起靶向并滞留在肿瘤组织,使药物直接到达病灶,提高了药物的生物利用度,一方面扩展了药物的使用范围,另一方面减少药物剂量的同时也减轻了药物的副作用。
100、本发明中油载体赋予了药物趋向细胞膜的特性,使药物更容易进入肿瘤细胞发挥作用。
101、本发明优选的以油载体为反应介质的方法,避免了有机溶剂残留的风险,使药剂更安全。
- 还没有人留言评论。精彩留言会获得点赞!