一种用于防治呼吸道疾病的雾化吸入制剂及其应用的制作方法
1.本发明属于雾化吸入制剂技术领域,尤其涉及一种用于防治呼吸道疾病的雾化吸入制剂及其应用。
背景技术:
2.目前,对于呼吸道疾病治疗的常用给药方式有吸入、口服、静脉、透皮等,其中吸入给药的作用部位在肺部,由于肺部的生理结构,使得吸入给药更能与呼吸系统的生理、组织学特点巧妙结合,具备明显优势,目前吸入治疗已被多国推荐为防治哮喘、慢阻肺等呼吸道疾病的首选给药方式。吸入制剂系原料药溶解或分散于合适介质中,以气溶胶或蒸汽形式递送至肺部,发挥局部或全身作用的液体或固体制剂。
3.吸入制剂剂型种类丰富,各国药典对于其分类的描述各不相同。《中国药典》(2020年版,第四部),将吸入制剂分类为:吸入气雾剂、吸入粉雾剂、吸入喷雾剂、吸入液体制剂、可转变为蒸汽的制剂。吸入制剂基本由主药和辅料配制而成(如气雾剂需要加入抛射剂、粉雾剂需要加入载体),主药与相应辅料的配比要求很高,轻微的差异都会显著影响吸入制剂的稳定性与递送药物均一性。药物粒径严控:药物颗粒粒径的大小会显著影响其肺部沉积率。中国药典指出,吸入制剂中原料药物的粒度大小通常应控制在10μm以下,其中大多数应在5μm以下。一般认为,理想的药物粒径介于1-5μm之间。
4.在国内对于治疗病毒引起的呼吸道疾病的雾化吸入已经非常广泛。我国批准上市的ifn主要有ifn-α2b、ifn-α2a和ifn-α1b,剂型有注射液、喷雾剂、乳膏、栓剂、阴道泡腾片及滴眼液,然而却没有雾化剂型。雾化治疗需要使用专用制剂,使用非雾化用制剂有时非但不能达到有效治疗目的,而且可能增加不良反应。比如,喷雾剂的雾粒粒径较大,通常被嵌顿在口咽部或吞咽入消化道,因此不适用于肺部吸入治疗。乳膏、栓剂等剂型也不适用于雾化。临床上常见将ifn注射液超说明书予以雾化给药。然而部分上市的ifn注射液含有苯甲醇等防腐剂,而防腐剂雾化吸入后可以引起气道痉挛、黏膜损害及诱发哮喘等不良反应。国内已有较多超说明书雾化使用ifn注射液的临床经验,尤其是在儿科领域。新冠病毒疫情暴发以来,专家推荐可试用ifn雾化。但是我国无雾化专用剂型,超说明书使用应遵循“超说明书用药”原则,也更应关注药物产生的不良反应,选择适宜的药物及雾化装置确保药物的有效性及安全性并进行药学监护。当然,期望药企能研发出ifn的雾化剂型以满足临床需求,保障患者用药安全、有效是临床迫切需求之一。关于雾化吸入ifn用于病毒性肺炎的尝试主要源于我国的儿童病例,但经查阅国外文献,并未发现雾化吸入ifns治疗呼吸道病毒感染的报道,仅有少数的研究显示雾化吸入ifn-γ可能有助于耐药肺结核的控制和ipf(特发性肺纤维化)的治疗,说明雾化吸入ifns可能在呼吸系统疾病的治疗中具有一定应用前景。但目前缺乏关于ifn雾化吸入治疗covid-19的临床研究结果,其有效性和安全性尚需进一步研究。雾化吸入ifn治疗冠状病毒肺炎的不良反应总体来说,雾化吸入ifn具有作用迅速、用药剂量小、全身不良反应轻等优点,但仍不能忽视其不良反应。目前国内生产的ifn均为注射制剂,虽然有文献支持其空气动力学符合雾化制剂的要求,但其用药说明中没有提到其
可用于雾化吸入,属于“超说明书用药”范畴。
5.生物大分子具有复杂的结构,在吸入情况下会有一些造成其降解的因素。如何保证结构的完整性和生物活性是成功开发吸入制剂的关键因素。而且,尽管吸入制剂有延长肺部暴露的优点,但其吸入制剂的安全性,尤其是所用的赋形剂都是药物在研发中和临床使用中所关注的重要方面。目前,被批准用于吸入制剂的赋形剂数量有限,主要是一些糖、氨基酸、脂类、盐类、磷脂和小分子的pegs。在一些新的吸入制剂中使用未批准的赋形剂将会费时、费力,并且有被监管机构拒绝的风险。这也部分解释了吸入制剂在市场上数量少的原因。被fda批准的有限的赋形剂,对吸入制剂的创新是极大的考验。另外,处方的设计、辅料的选择、加工技术、雾化设备选择这些都应该系统考虑。其次,生物大分子药物的组织穿透性、系统性吸附都被其亲水性质所限制。所以研发一种效果显著且稳定性好的干扰素生物大分子雾化吸入制剂以满足临床需求,保障患者用药安全、有效是本领域亟待解决的技术问题之一。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种防治呼吸道疾病效果显著、稳定性好的干扰素生物大分子雾化吸入制剂,具有活性保持好、粒径均匀的优势。
7.为了实现上述发明目的,本发明提供了以下技术方案:
8.本发明提供了一种防治呼吸道疾病的雾化吸入制剂,包括抗病毒活性因子、甘露醇、增溶剂和缓冲液。
9.优选的,所述抗病毒活性因子包括干扰素,所述干扰素包括氨基酸序列如seq id no.1所示的干扰素。
10.优选的,所述增溶剂包括氯化钠,所述缓冲液包括磷酸氢二钠水合物和磷酸二氢钠水合物。
11.优选的,所述甘露醇的浓度为1-80mg/ml,抗病毒活性因子的浓度为0.001-200μg/ml,
12.优选的,所述增溶剂和缓冲液的浓度如下:磷酸氢二钠水合物15.5-31mg/ml,磷酸二氢钠水合物4.95-9.9mg/ml,氯化钠8.7-17.4mg/ml。
13.优选的,所述雾化吸入制剂的ph值为5.5-7.6。
14.优选的,所述雾化吸入制剂的储存温度为-30℃~27℃。
15.优选的,所述雾化吸入制剂优先选用便携式网状雾化器。
16.本发明还提供了一种上述雾化吸入制剂在制备防治呼吸道疾病的产品中的应用。
17.优选的,所述呼吸道疾病包括病毒感染所致的呼吸道疾病。
18.优选的,所述病毒包括呼吸道合胞病毒、流感病毒和新冠病毒。
19.本发明的有益效果:
20.本发明提供的雾化吸入制剂在雾化前、后活性没有显著差异,雾化使用时产生的颗粒粒径均匀且小,在0.5-10μm之间,可用于呼吸道疾病的预防和治疗,尤其是对病毒感染引起的呼吸道疾病防治效果显著,没有副作用,特别适合婴幼儿、儿童和老人使用,同时也适合于其他年龄段的人群使用。
21.另外,本发明雾化吸入制剂具有广谱抗病毒活性,对于多种由病毒感染引起的呼
吸道疾病均具有显著的防治效果。
附图说明
22.图1为不同配方样品生物学活性,*表示与配方4相比,有显著变化(p《0.05);
23.图2为不同配方样品粒径体积分布,其中粒径《3μm时,a-e分别表示与配方1、配方2、配方3、配方4、配方5相比,有显著变化(p《0.05);3μm《粒径《5μm时,a-e分别表示与配方1、配方2、配方3、配方4、配方5相比,有显著变化(p《0.05);粒径》5μm时,*、#、&、¥、@分别表示与配方1、配方2、配方3、配方4、配方5相比,有显著变化(p《0.05);
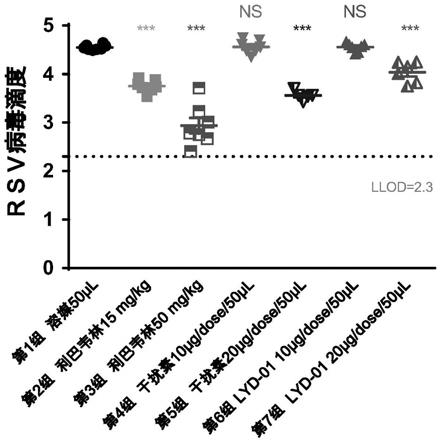
24.图3为不同配方样品粒径体积数量分布,图3中的各字母注释同图2;
25.图4为不同抗病毒活性因子浓度配方雾化粒径结果;
26.图5为实施例3制剂在不同试验温度和不同ph值下的生物学活性,其中a、c、e分别表示ph为6.5、7.0、7.5时,与37℃保存条件相比,有显著变化(p《0.05),b、d、f分别表示ph为6.5、7.0、7.5时,与室温保存条件相比,有显著变化(p《0.05);g、h、i、j分别表示37℃、常温、2~8℃、-20℃保存时,与ph值为7.0相比,有显著变化(p《0.05);
27.图6为实施例2制剂在不同试验温度和不同ph值下的生物学活性,图6中的各字母注释同图5;
28.图7为实验小鼠体重变化情况;
29.图8为小鼠肺组织病毒滴度变化,与第1组相比,ns表示p》0.05无统计学差异,***表示p《0.001差异极显著。
具体实施方式
30.本发明提供了一种防治呼吸道疾病的雾化吸入制剂,包括抗病毒活性因子、甘露醇、增溶剂和缓冲液。
31.本发明对于甘露醇、增溶剂和缓冲液的具体来源没有特殊限定,采用本领域符合医药原料的市售产品均可。在本发明中,所述增溶剂优选的为氯化钠,所述缓冲液优选的为由磷酸氢二钠水合物和磷酸二氢钠水合物组成的pb缓冲液。在本发明中,甘露醇既有稳定剂的作用,又有增溶剂的作用,另外在呼吸道中还能够增加分泌物的水合作用,更有利于药物的扩散。
32.在本发明中,所述抗病毒活性因子优选的包括干扰素,所述干扰素优选的包括氨基酸序列如seq id no.1所示的干扰素。在本发明雾化吸入制剂中,氨基酸序列如seq id no.1所示的干扰素的浓度优选为0.001-200μg/ml,更优选为0.005-100μg/ml。本发明氨基酸序列如seq id no.1所示的干扰素的分子量为18.3kd,等电点为5.5~6.5之间。本发明对于氨基酸序列如seq id no.1所示的干扰素的制备方法没有特殊限定,在本发明具体实施例中,氨基酸序列如seq id no.1所示的干扰素的制备方法优选的经基因工程制备获得,具体包括合成核苷酸序列,选择载体、构建工程菌、规模化发酵、分离纯化等步骤。
33.在本发明中,当稳定剂、增溶剂和缓冲液分别为甘露醇、氯化钠、磷酸氢二钠水合物和磷酸二氢钠水合物时,所述甘露醇的浓度优选为1-80mg/ml,更优选为5-60mg/ml,所述氯化钠的浓度优选为8.7-17.4mg/ml,更优选为9.5-16.5mg/ml,所述磷酸氢二钠水合物的浓度优选为15.5-31mg/ml,更优选为17.5-28mg/ml,所述磷酸二氢钠水合物的浓度优选为
4.95-9.9mg/ml,更优选为5.5-8.5mg/ml。
34.本发明雾化吸入制剂的ph值优选为5.5-7.6,更优选为6.0-7.5。应用本发明提供的雾化吸入制剂防治呼吸道疾病时,本发明对于雾化器的种类没有特殊限定,超声雾化、射流雾化、振网雾化给药装置均可,在本发明具体实施例中,优选的采用振网式雾化器。本发明雾化吸入制剂配合雾化器使用,产生均匀的0.5-10μm之间的微小颗粒,药物通过呼吸吸入的方式进入呼吸道和肺部沉积,从而达到无痛、迅速有效治疗的目的。本发明经药用辅料种类以及用量选择,确保本发明雾化吸入制剂具有显著的生物稳定性,药用活性在雾化前、后没有显著变化,对病毒感染引起的呼吸道疾病防治效果显著,没有副作用,特别适合婴幼儿、儿童和老人使用,同时也适合于其他年龄段的人群使用。本发明所述雾化吸入制剂的储存温度优选为-30℃~27℃,更优选为2-8℃。
35.本发明对于雾化吸入制剂的制备方法没有特殊限定,只要确保按照本发明所记载原辅物料以及用量进行配制、除菌后包装并按说明书使用即可。
36.本发明还提供了一种上述雾化吸入制剂在制备防治呼吸道疾病的产品中的应用。
37.在本发明中,所述呼吸道疾病优选包括病毒感染所致的呼吸道疾病。本发明对于病毒的种类没有特殊限定,在本发明具体实施例中,所述病毒优选的包括呼吸道合胞病毒、流感病毒和新冠病毒,所述新冠病毒优选的包括covid-19、sars-cov-2。本发明对于产品的种类没有特殊限定,包括药品。
38.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
39.实施例1
40.氨基酸序列如seq id no.1所示的干扰素的制备
41.根据如seq id no.1所示的氨基酸序列合成对应的核酸模板,通过pcr的方法扩增出足够量的核酸。
42.扩增反应体系引物为:
43.f:catatgtgcgacctgccaca
44.r:ctcgagttagttggtgctcaggc
45.扩增反应体系包含:dntp 1μl、10x pfu缓冲液5μl、上下游引物各2μl、模板1μl、pfu酶0.4μl(5u/μl)、ddh2o 38.6μl。
46.扩增反应条件为:95℃,3分钟、95℃,22秒、68℃,20秒、72℃,60秒、72℃,5分钟。共24个循环。反应完成后用琼脂糖凝胶电泳进行分离,用nde i/xho i双酶切,电泳回收500bp左右的目的dna片段。
47.将pet30a质粒载体用nde i/xho i双酶切,经琼脂糖电泳回收并和上述回收的目的dna片段连接。连接反应条件为:无缝克隆混合液,8.5μl、酶切载体pet30a,4μl、已纯化好的pcr产物,7.5μl,上述连接混合液放在37℃条件下在pcr仪1h即可。
48.制备大肠杆菌bld21感受态细胞,转化上述连接产物,涂布卡那霉素平板,37℃过夜培养。
49.挑取单菌落作为模板,用上述设计的引物f、r进行扩增,产物经琼脂糖电泳检测,阳性克隆在500bp左右出现特异条带;取阳性克隆小量培养,提取质粒用nde i/xho i双酶切。分别在3kb左右和500bp左右出现特异性的条带,与预计情况相符,初步说明重组质粒构
建成功。为进一步确认其序列,以t7通用引物对abi377测序仪进行全自动序列测定。
50.氨基酸序列如seq id no.1所示的干扰素的发酵、纯化与检测
51.将构建得到的新型干扰素的表达工程菌经涂平板活化后挑选单菌落接种于含有终浓度为30μg/ml的卡那霉素的lb培养基中(每升用蛋白胨10g、酵母粉5g、氯化钠10g配制,调节ph为7.0),37℃、235转/分摇床摇瓶培养至od600nm为0.6-0.8。然后以5%的体积接种量接种于50l的lb培养基中在80l发酵罐中进行发酵培养(含30μg/ml的卡那霉素),培养温度为37℃,培养过程中用氨水调节ph在6.5-7.5之间,用转速控制溶氧值在3-5%之间。在od600nm达到1.0后按质量体积比1:5000的比例加入iptg 10g继续诱导培养4.5小时,诱导培养温度为37℃,并在此过程中向发酵罐中适当的补加lb培养基。诱导培养时间到后,放罐室温5000转/分离心20分钟收集菌体,所得菌体用te缓冲液(50mmol/l tris-hcl,5mmol/l edta,ph8.0)洗涤离心两次以除去发酵液中的主要杂质。
52.取上述处理得到的菌体40g以1:15的质量体积比加入600ml te缓冲液置超声波破碎仪上进行超声破碎,条件为打5秒,歇5秒,共60分钟,所得破碎液室温12000转/分离心20分钟弃上清,沉淀以1:10的质量体积比加入te缓冲液洗涤离心两次得分离包涵体。
53.所得10g包涵体以1:10的质量体积比加入包涵体溶解液(8mol/l尿素,50mmol/ltris-hcl,300mmol/l氯化钠,ph8.0)溶解后在适度搅拌条件下变性处理2小时,待包涵体完全溶解后室温12000转/分离心20分钟弃沉淀,上清以稀释复性法进行复性处理,复性液组成为:0.15mol/l硼酸钠缓冲液,3mmol/l氧化型谷胱甘肽,1mmol/l还原型谷胱甘肽,调节ph为9.5。复性过程在2-8℃低温冷库中进行,首先用复性液将上清稀释6倍,放置8小时后再用复性液稀释5倍继续复性6小时。
54.透析后的复性液经4℃12000转/分离心30分钟后用25mmol/l tris-hcl ph8.0溶液平衡的deae sepharose ff色谱柱。上样完成后先用平衡缓冲液继续冲洗色谱柱2-3个柱体积,然后以含有0.35mol/l氯化钠的25mmol/l tris-hcl ph8.0溶液进行洗脱收集洗脱峰。
55.上述上样、冲洗与洗脱过程中的线性流速应控制在50-200cm/h之间。
56.deae sepharose ff洗脱峰用50mmol/l醋酸-醋酸钠ph4.5缓冲液以1:10的体积比稀释后上用同样缓冲液平衡的cm sepharose ff色谱柱。上样完成后先用平衡缓冲液继续冲洗色谱柱2-3个柱体积,然后在用含有0.1-0.15mol/l氯化钠的25mmol/l醋酸-醋酸钠ph4.5缓冲液洗脱除去主要杂质峰后用含有0.5mol/l氯化钠的25mmol/l醋酸-醋酸钠ph4.5缓冲液洗脱收集目标峰。上述上样、冲洗与洗脱过程中的线性流速应控制在50-200cm/h之间。
57.用sds-page电泳加考马斯亮蓝染色法和分子排阻hplc法分别检测上述cm sepharose ff色谱柱分离得到的新型干扰素α的纯度,结果均在97%以上。用《中华人民共和国药典2020年版(三部)》规定的“干扰素活性测定法”和“蛋白质含量测定法”确定其比活性为不小于3.0
×
108iu/mg。
58.实施例2
59.将实施例1制备所得的氨基酸序列如seq id no.1所示的干扰素配制成防治呼吸道疾病的雾化吸入制剂,其中甘露醇45mg/ml,氨基酸序列如seq id no.1所示干扰素30μg/ml,磷酸氢二钠水合物15.5mg/ml,磷酸二氢钠水合物4.95mg/ml,氯化钠8.7mg/ml。(配方1)
(制剂a)
60.实施例3
61.将实施例1制备所得的氨基酸序列如seq id no.1所示干扰素配制成防治呼吸道疾病的雾化吸入制剂,其中甘露醇45mg/ml,氨基酸序列如seq id no.1所示干扰素50μg/ml,磷酸氢二钠水合物15.5mg/ml,磷酸二氢钠水合物4.95mg/ml,氯化钠8.7mg/ml。(制剂b)
62.实施例4
63.将实施例1制备所得的氨基酸序列如seq id no.1所示干扰素配制成防治呼吸道疾病的雾化吸入制剂,其中甘露醇1mg/ml,氨基酸序列如seq id no.1所示干扰素0.001μg/ml,磷酸氢二钠水合物31mg/ml,磷酸二氢钠水合物9.9mg/ml,氯化钠17.4mg/ml。
64.实施例5
65.将实施例1制备所得的氨基酸序列如seq id no.1所示干扰素配制成防治呼吸道疾病的雾化吸入制剂,其中甘露醇80mg/ml,氨基酸序列如seq id no.1所示干扰素200μg/ml,磷酸氢二钠水合物20mg/ml,磷酸二氢钠水合物6.5mg/ml,氯化钠9.2mg/ml。
66.实施例6
67.与实施例2的不同之处在于氨基酸序列如seq id no.1所示干扰素的浓度为80μg/ml,其余均同实施例2。
68.实施例7
69.与实施例2的不同之处在于氨基酸序列如seq id no.1所示干扰素的浓度为100μg/ml,其余均同实施例2。
70.对比例1
71.与实施例2的不同之处在于用peg600替换甘露醇,其余均同实施例2。(配方2)
72.对比例2
73.与实施例2的不同之处在于用白蛋白替换甘露醇,其余均同实施例2。(配方3)
74.对比例3
75.与实施例2的不同之处在于用壳聚糖替换甘露醇,其余均同实施例2。(配方4)
76.对比例4
77.与实施例2的不同之处在于用中分子量透明质酸替换甘露醇,其余均同实施例2。(配方5)
78.实施例8
79.分别测定实施例2和对比例1-4的生物学活性和样品粒径,其中生物学活性检测方法为:用《中华人民共和国药典2020年版(三、四部)》规定的“干扰素活性测定法”进行测定,样品粒径的检测方法为:利用激光粒径测试仪(型号winner311xp,测量里程0.1-100μm),在环境温湿度:25℃,69%rh的条件下,对上述组方进行雾化后(雾化器为振网式雾化器)的粒径大小进行测试。结果如图1-3所示。
80.由图1-3可以看出,与不含有甘露醇的其他雾化吸入制剂相比,本发明的雾化吸入制剂具有较高的生物学活性和更均匀、更适合、更有利于雾化吸入的粒径,且《3μm的粒径体积分布和数量分布占比大。
81.实施例9
82.分别测定实施例2和实施例3的样品粒径,样品粒径的检测方法同实施例8。各组别
进行三次重复,最终取平均值作图。以制剂缓冲液为对照(即对照组不添加氨基酸序列如seq id no.1所示干扰素),对制剂缓冲液测试中位粒径为:3.201μm。实施例2雾化吸入制剂测试后中位粒径xv50=3.188μm,数量分布数据:<3μm占比96.548%,<5μm占比99.417%,满足医用雾化使用的要求。结果如图4所示,由图4可以看出,本发明雾化吸入制剂在使用时具有更均一、更符合呼吸道雾化吸入的粒径。
83.实施例10
84.分别在2-8℃、-20℃、37℃以及在ph6.5、ph7.0、ph7.5的条件下,对实施例2和实施例3的雾化吸入制剂的活性稳定性进行检测,结果如图5和图6所示。
85.由图5和图6的结果可以看出,本发明雾化吸入制剂在ph7.0时活性最好,在2-8℃和-20℃条件下可长期保存,生物学活性稳定性最好。
86.实施例11
87.采用振网式雾化器与实施例3的雾化吸入制剂联合使用,经过细胞病变法测定实施例3雾化吸入制剂雾化前、后的生物学活性,结果如表1所示,表明本发明雾化吸入制剂在雾化前和雾化后的生物学活性改变不大,没有统计学上的差别。
88.表1雾化前、后生物学活性变化
89.类别生物学活性(
×
106iu/ml)雾化前5.49
±
0.16雾化后5.45
±
0.34
90.实施例12
91.2020年1月10-18日期间,35只balb/c小鼠,分为5组,每组7只,雌雄随机分布,上述动物组别分别用呼吸道合胞病毒(rsv)a2毒株滴鼻进行感染造模。给药实验样品分别为:溶媒(空白对照):20mm磷酸缓冲液(溶媒,ph7.0);利巴韦林,溶解于普通生理盐水,配置成浓度为1.5、5.0mg/ml母液;市售干扰素,稀释于溶媒,配置成母液;实施例3制剂(lyd-01)。上述试验样品分别以肌肉注射及雾化的方式进行抗病毒效果测试,具体实验设计如表2所示。分别考察肺组织病毒载量,动物体重变化等指标。结果如图7和图8所示。
92.表2抗rsva2毒株感染小鼠体内效果试验设计
[0093][0094]
由图7和图8可以看出,市售干扰素及本发明雾化吸入制剂肌肉注射未见明显的病毒抑制效果,但市售干扰素及本发明雾化吸入制剂雾化给药可抑制病毒,体现出良好的体内药效。其中市售干扰素雾化给药在设定剂量下可引起动物体重下降,考虑为不良副作用。
而本发明雾化吸入制剂未见小鼠体重下降,表明本发明雾化吸入制剂在雾化使用时不仅能够达到显著抑制rsv病毒效果,而且没有不良副作用。
[0095]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1