德拉马尼作为CXCL10抑制剂的用途的制作方法
德拉马尼作为cxcl10抑制剂的用途
技术领域
1.本发明涉及医药技术领域,具体涉及德拉马尼作为cxcl10抑制剂的用途。
背景技术:
2.结核病(tuberculosis,tb)是全球重要的死亡原因之一,目前依然是重大的公共卫生挑战。2021年世界卫生组织报告表明,2020年全球新发结核病患者约有1000万,约149万结核病患者死亡。耐多药结核病(multidrug-resistant tb,mdr-tb)患者的治疗纷繁复杂且治疗周期长,仅约59%的患者能获得良好的治疗效果。自2019年末开始,随着新冠肺炎在全球范围内大面积流行,抗结核病的斗争进一步陷入窘境。因此,亟需更高效的抗结核药物。
3.有研究表明,抗结核药物可以通过调节免疫细胞的功能来影响免疫系统。利福平通过与芳基碳氢化合物受体结合损害巨噬细胞的功能。然而,贝达喹啉通过增加溶酶体活性及激活自噬增强机体杀灭结核分支杆菌的能力。
4.德拉马尼(delamanid,dlm)是一种硝基双氢咪唑噁唑类药物,通过抑制结核分枝杆菌细胞壁的合成来发挥作用。dlm可以有效提高痰涂片阳性mdr-tb患者治疗2个月时的痰涂片阴转率,目前已被who纳入治疗mdr-tb的c组药物。巨噬细胞在抵御结核分枝杆菌中发挥重要作用,dlm除了可以高效的杀灭结核分枝杆菌外,对机体免疫系统是否有影响尚不清楚。
5.dlm对巨噬细胞的作用机制及探索对结核病患者产生新的作用效果具有重要现实意义。
技术实现要素:
6.本发明提供了德拉马尼对治疗mdr-tb患者的新用途,可以减轻机体炎症反应,减轻肺组织局部损伤。
7.为实现上述目的,本发明采用的技术方案为:
8.德拉马尼在制备cxcl10抑制剂中的用途。
9.本发明还提供了德拉马尼和其他cxcl10抑制剂的用途。
10.德拉马尼和其他cxcl10抑制剂在制备治疗耐多药结核病的用途。
11.进一步的,其中cxcl10抑制剂是cxcl10表达抑制剂。
12.进一步的,其中cxcl10表达抑制剂是鲁索利替尼。
13.本发明提供了德拉马尼对治疗mdr-tb患者的新用途,德拉马尼可以减少耐多药结核病患者c反应蛋白的水平,减轻机体的炎症反应。德拉马尼可以抑制耐多药结核病患者cxcl10的表达,进而减少淋巴细胞在病灶中的聚集,减轻肺部炎症反应。
14.根据本发明提供的新用途,德拉马尼能够减轻mdr-tb患者的炎症反应,德拉马尼为cxcl10高表达的患者带来更大的获益。
附图说明
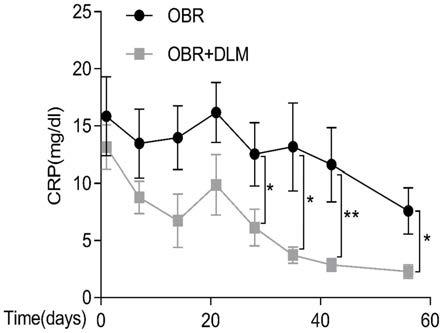
15.图1是两组人群c反应蛋白水平比较。
16.图2是两组人群细胞因子水平(a)热图;(b)表达水平。
17.图3是rt-qpcr及elisa结果。
18.图4是迁移实验结果。
19.图5是western blot结果。
具体实施方式
20.为使本领域的技术人员更好地理解本发明的技术方案,以下实施例对本发明的作进一步详细描述,以下实施例仅用于说明发明,但不用来限制本发明的范围。
21.德拉马尼在制备cxcl10抑制剂中的用途。
22.本发明还提供了德拉马尼和其他cxcl10抑制剂的用途。
23.德拉马尼和其他cxcl10抑制剂在制备治疗耐多药结核病的用途。
24.进一步的,其中cxcl10抑制剂是cxcl10表达抑制剂。
25.进一步的,其中cxcl10表达抑制剂是能够抑制cxcl10的sirna。
26.进一步的另一种cxcl10抑制剂是鲁索利替尼。
27.德拉马尼作为jak2/stat1信号通路抑制剂的用途。
28.德拉马尼在制备治疗感染性疾病的药物中的用途。
29.根据纳入标准和排除标准,筛选仅使用最佳基础治疗方案(optimized background therapeutic regimen,obr)的mdr-tb患者及使用obr联合德拉马尼(orr+dlm)的mdr-tb患者。分别于治疗第1天,14天,28天,56天留取这些患者的血浆,用免疫比浊法检测c反应蛋白的水平,用流式细胞术检测cxcl10的表达水平。结果表明orb+dlm组c反应蛋白较obr组明显下降,且差异具有统计学意义。orb+dlm组cxcl10表达水平较obr组明显下降,且差异具有统计学意义。由此可见,dlm可以抑制耐多药结核病患者crp及cxcl10的表达,并可以减轻炎症损伤。
30.在细胞实验中,dlm作用于巨噬细胞24小时后,cxcl10水平较对照组明显降低。说明在体外实验中,dlm可以抑制巨噬细胞表达cxcl10。
31.在迁移实验中,dlm对人外周血单个核细胞(peripheral blood mononuclear cells,pbmc)的趋化作用较对照组弱,说明dlm抑制cxcl10表达后进而抑制淋巴细胞的迁移,减轻病灶局部的炎症反应。
32.在western blot实验中,dlm通过抑制jak/stat信号通路来抑制cxcl10的表达。
33.实施例1
34.根据纳入标准和排除标准收集mdr-tb患者
35.(1)纳入标准:
①
年龄在18-64周岁;
②
痰培养或痰涂片结核分枝杆菌阳性;
③
对异烟肼和利福平耐药的结核分枝杆菌感染引起的tb患者,或是痰涂片阳性并且利福平耐药快速检验阳性的患者;
④
胸部ct检查结果证实为肺结核。
36.(2)排除标准:
①
有硝基-咪唑类及其衍生物药物过敏史;
②
有严重的合并症或肝肾功能受损者;
③
有临床上显著的心电图变化,;
④
有临床显著的心血管病史或正患有此类疾病,如心力衰竭、冠心病、高血压、心律失常等;
⑤
患有禁忌使用硝基咪唑及其衍生物类的
疾病;
⑥
患有临床上显著的代谢、胃肠道、神经、精神或内分泌性疾病、恶性肿瘤或其他异常;
⑦
据研究者判断,受试者有不适合参加试验的或者可能使患者不能可靠地参加本试验全过程的任何疾病。
37.分别于治疗后第1天,14天,28天及56天时,收集这两组患者晨起空腹静脉血5ml于含edta抗凝的采血管中,低温保存的条件下尽快送回实验室,3000rpm离心10min,将血浆分装后储存于-80℃冰箱备用。
38.实施例2
39.用免疫比浊法测血浆中c反应蛋白的水平
40.(1)将两组患者血浆样本分别加入至beckman coulter全自动生化分析仪中。
41.(2)读取各个血浆样本的crp值。
42.应用graphpad prism 8软件绘制折线图,结果参见图1,其中横坐标表示时间,纵坐标表示crp的蛋白表达量。结果表明,crp在dlm处理组表达水平显著低于在对照组中的表达水平。在图1中,横线为平均值
±
标准误,*号代表p<0.05。**号代表p《0.01。
43.用流式细胞术检测血浆中细胞因子的水平
44.(1)将cxcl10和ccl2的冻干标准球放入同一个15ml离心管中,用移液器向其中加入4ml assay diluent吹打混匀,在室温下平衡15min,标记为top standard 1,此时浓度为2500pg/ml。将il-6、il-8、il-1β、tnf-α及ifn-γ的冻干标准球放入另一个15ml离心管中,用移液器向其中加入4ml assay diluent吹打混匀,在室温下平衡15min,此时浓度为200,000fg/ml。
45.(2)取8个流式管,用移液器分别向其中各加入500μl assay diluent,并分别标记为1:2,1:4,1:8,1:16,1:32,1:64,1:128和1:256。用移液器从已平衡好的top standard 1中吸取500μl加入至标记有1:2的流式管中,吹打混匀后,再用移液器从标记有1:2的流式管中吸取500μl加入至标记有1:4的流式管中,按照相同的方式进行浓度梯度稀释,直至标记有1:256的流式管,另外准备1个仅有500μl assay diluent的流式管作为0pg/ml的阴性对照管。
46.(3)另取7个流式管分别标记为top standard 2,1:3,1:9,1:27,1:81,1:243和1:729。在标记有top standard 2的流式管中加入460μl assay diluent,向其余6个流式管中分别加入400μl assay diluent。用移液器从已平衡好的15ml离心管中吸取40μl标准品加入至标记有top standard 2的流式管中,吹打混匀。再用移液器从标记有top standard 2的流式管中吸取200μl加入至标记有1:3的流式管中,吹打混匀后,再用移液器从标记有1:3的流式管中吸取200μl加入至标记有1:9的流式管中,按照相同的方式进行浓度梯度稀释,直至标记有1:729的流式管。另外准备1个仅有500μl assay diluent的流式管作为0fg/ml的阴性对照管。
47.(4)将cxcl10和ccl2这两种细胞因子的capture bead用微型旋涡混合仪充分混匀备用,根据样本总数配置所需capture bead。考虑到实验过程中有所损耗,可酌情多配制2-3个样本的使用量。按表1.1配置好后,用微型旋涡混合仪充分混匀,室温孵育15min后使用。
48.表1.1 cxcl10和ccl2的capture bead配置方法
49.组分使用量capture bead diluent48μl
b吸取500μl加入至上诉15ml离心管中混匀备用。
60.(9)为cxcl10及ccl2这两种细胞因子的标准品及所有样本各准备一个流式管,做好标记,每个流式管内分别加入50μl已梯度稀释好的各个浓度的标准品或各样本。将配置好的capture beads涡旋5s后,在各个流式管中分别加入50μl,轻轻混匀,室温孵育1h。
61.(10)为il-6、il-8、il-1β、tnf-α及ifn-γ这5种细胞因子的标准品及所有样本各准备一个流式管,做好标记,每个流式管内分别加入50μl已梯度稀释好的各个浓度的标准品或各样本。将配置好的capture beads涡旋5s后,在各个流式管中分别加入20μl,轻轻混匀,室温避光孵育2h。
62.(11)向检测cxcl10和ccl2的各个流式管中各加入50μl pe detection reagent,轻轻混匀,室温孵育2h。
63.(12)向检测il-6、il-8、il-1β、tnf-α及ifn-γ这5种细胞因子的各个流式管中各加入20μl part a,轻轻混匀,室温避光孵育2h。
64.(13)向检测cxcl10和ccl2的各个流式管中各加入1ml wash buffer,室温下,200g,离心5min,弃去上清。
65.(14)向检测il-6、il-8、il-1β、tnf-α及ifn-γ这5种细胞因子的各个流式管中加入1ml wash buffer,室温下,200g,离心5min,弃去上清。
66.(15)向检测cxcl10和ccl2的各个流式管中各加入100μl wash buffer,涡旋混匀后用流式细胞仪检测。
67.(16)向检测il-6、il-8、il-1β、tnf-α及ifn-γ这5种细胞因子的各流式管中加入100μl part b,轻轻混匀,室温避光孵育1h。在各流式管中加入1ml wash buffer,室温下,200g,离心5min,弃去上清。在各流式管中加入100μl wash buffer,涡旋混匀后流式细胞仪检测。
68.用r软件绘制细胞因子表达水平热图,结果参见图2(a),其中每一个小格代表一个患者,纵坐标表示各种细胞因子在各个时间点的表达水平。用graphpad prism 8对细胞因子表达量进行统计分析并绘图,结果参见图2(b),其中横坐标表示时间,纵坐标表示各种细胞因子的蛋白表达量。结果表明,dlm治疗组mdr-tb患者cxcl10水平显著低于对照组。在图2中,横线为平均值
±
标准误,*号代表p《0.05,**号代表p《0.01。
69.实施例3
70.1、细胞培养
71.(1)用75%酒精擦拭紫外线照射30min的超净工作台台面。
72.(2)在超净工作台中按次序摆放无菌离心管、吸管、细胞培养瓶。
73.(3)取出细胞培养瓶,打开瓶盖,将细胞培养液倒入离心管中。
74.(4)1000rpm,离心5min。
75.(5)吸弃上层培养基,用1ml新鲜培养基将细胞沉淀重悬,混匀后,依稀释比例转移至新的细胞培养瓶中。
76.(6)将细胞培养瓶放入37℃含5%co2的培养箱内培养,换液的时间由细胞生长速度而定。
77.(7)以1
×
106/ml的密度将u937细胞种植于12孔板中,每孔加1ml含有浓度为10ng/ml的pma的完全培养基,置于37℃含5%co2培养箱中培养过夜,诱导为贴壁的巨噬细胞。
78.(8)用pbs清洗细胞2次,dlm(0.3μg/ml)加入完全培养基中,以相同体积的dmso为空白对照。
79.(9)dlm或dmso作用0-24h后,留取上清用于elisa检测,加入1ml pbs,用细胞刮将细胞轻轻刮下置于1.5ml ep管中,3000rpm离心5min,吸弃上清,细胞沉淀冻存于-80℃冰箱备用。
80.3、应用rt-qpcr方法检测cxcl10基因的表达
81.(1)rna的提取
82.1.1在溶液rd中加入β-巯基乙醇至终浓度为1%,在溶液rw中按1:4加入无水乙醇。
83.1.2将上述步骤中得到的细胞沉淀,在冰上化开,每管加入540μl rd溶液,涡旋震荡混匀,若出现不溶性沉淀,12000rpm离心2min,将上清转移至另一离心管中。
84.1.3加入700μl溶液rb,混匀,此时可能会出现沉淀。将得到的溶液和沉淀一起转入纯化柱(纯化柱+收集管)中,12000rpm离心60s,倒掉废液,将纯化柱放回收集管中。
85.1.4向纯化柱中加入350μl溶液rp,12000rpm离心1min,弃废液,将纯化柱放回收集管中。
86.1.5向纯化柱中加入500μl已加入无水乙醇的溶液rw,室温静置2min,12000rpm离心30s,弃废液,将纯化柱放回收集管中。
87.1.6重复上诉步骤。
88.1.7将纯化柱放回收集管中,12000rpm继续空离2min,去除残余液体,将纯化柱置于室温放置数分钟,彻底晾干吸附材料中残余的漂洗液。
89.1.8将纯化柱转入一个新的无rna酶1.5ml离心管中,加入30μl无rna酶水,室温静置2min,12000rpm离心2min即得到rna溶液,立即反转录成cdna。
90.(2)反转录
91.采用yeasen biotech公司的hifairⅱ1st strand cdna synthesis supermix进行反转录,总体系为20μl。反应体系配制均在冰上进行,体系如下:
92.组分使用量2*hifair r ii supermix10μl模板rna2ngrnase free dd h2o加至20μl
93.配制好的反应体系,在pcr仪上进行以下反应:25℃,5min;45℃,30min,85℃,5min。反应完毕后,保存在-20℃。
94.(3)实时荧光定量pcr
95.3.1引物序列
96.97.3.2实时荧光定量pcr检测cxcl10
98.以上述步骤(2)中得到的cdna为模板,采用yeasen biotech公司的试剂盒qpcr sybr green master mix(low rox)检测cxcl10基因的表达水平,选用β-actin为内参基因。使用applied biosystems公司的abi 7500实时荧光定量pcr仪进行检测。反应体系如下:
[0099][0100]
反应条件为:95℃预变性5min;95℃变性10s,60℃退火35s,40个循环。
[0101]
3.3数据处理及统计分析
[0102]
根据实时荧光定量pcr的结果,用abi 7500v2.3软件对结果进行分析,以β-actin基因为内参基因,通过2
‑△△
ct
的方法计算出dlm组和dmso组cxcl10基因的相对表达量。采用双因素方差分析方法,以p<0.05为差异具有统计学意义。应用graphpad prism 8软件绘制柱状图,结果参见图3(a),其中横坐标表示时间,纵坐标表示相对表达量。结果表明,cxcl10基因在dlm处理组表达水平显著低于在对照组中的表达水平。在图3(a)中,横线为平均值
±
标准差,*号代表p<0.05。**号代表p《0.01。
[0103]
4、应用elisa方法检测cxcl10的表达变化
[0104]
(1)从已平衡至室温的密封袋中取出实验所需板条;
[0105]
(2)吸取1ml标准品&标本通用稀释液至冻干标准品中,静置15min,待其充分溶解。此时浓度为500pg/ml。
[0106]
(3)准备8个1.5ml ep管,标记好。每管加入500μl标准品&标本通用稀释液;
[0107]
(4)用ddh2o将20*浓缩洗涤液稀释成1*;
[0108]
(5)将溶解好的标准品倍比稀释。从标准品中吸取500μl加入至第1个ep管中,充分混匀后,吸取500μl至第2个ep管。直至第7个ep管。浓度梯度分别为250pg/ml,125pg/ml,62.5pg/ml,31.25pg/ml,15.62pg/ml,7.8pg/ml,3.9pg/ml,0pg/ml。
[0109]
(6)空白孔加标准品&标本通用稀释液,其余相应孔中加标本或不同浓度标准品(100μl/孔),用封板胶纸封住反应孔,37℃温箱避光孵育90min;
[0110]
(7)洗板5次;
[0111]
(8)空白孔加生物素化抗体稀释液,其余孔各加入100μl生物素化抗体工作液,用新封板胶纸封住反应孔,37℃温箱避光孵育60min;
[0112]
(9)洗板5次;
[0113]
(10)空白孔加酶结合物稀释液,其余孔各加入100μl酶结合物工作液,用新封板胶纸封住反应孔,37℃温箱避光孵育30min;
[0114]
(11)洗板5次;
[0115]
(12)每孔加入100μl显色底物(tmb),37℃温箱避光孵育15min;
[0116]
(13)每孔加入100μl反应终止液,混匀后于3min内测量od
450
值。
[0117]
应用graphpad prism 8软件绘制柱状图,结果参见图3(b),其中横坐标表示时间,纵坐标表示cxcl10的蛋白表达量。结果表明,cxcl10蛋白在dlm处理组表达水平显著低于在对照组中的表达水平。在图3(b)中,横线为平均值
±
标准差,*号代表p<0.05。**号代表p《0.01。
[0118]
5、通过transwell实验探究dlm抑制cxcl10的表达后对pbmc迁移的影响
[0119]
(1)提前24小时用不含血清的培养基饥饿pbmc置于小室上层;
[0120]
(2)将巨噬细胞置于小室下层,用dlm,dmso,cxcl10及amg487(cxcl10与cxcr3作用的拮抗剂)分别处理巨噬细胞24h后,与上层小室共培育12h;
[0121]
(3)使用细胞成像微孔板检测系统观察穿透小室膜的细胞数,并计算迁移率。
[0122]
应用细胞成像微孔板检测系统拍摄照片,如图4(a)。使用graphpad prism8软件绘制柱状图,结果参见图4(b),其中横坐标表示不同的处理方式,纵坐标表示迁移率。结果表明,dlm处理组表达水平显著低于在对照组中的表达水平。在图4(b)中,横线为平均值
±
标准差,*号代表p<0.05。**号代表p《0.01。****号代表p《0.0001。
[0123]
6、通过western blot实验探索dlm抑制巨噬细胞cxcl10的机制
[0124]
将巨噬细胞分别用dlm和dmso刺激0h,4h,8h,12h,24h后,收集细胞沉淀,提取蛋白,定量后进行western blot检测。
[0125]
巨噬细胞总蛋白的提取及bca法测蛋白浓度
[0126]
(1)按如下表所示配置每个样本所需的细胞裂解液,考虑到损耗,可酌情多配制一些,充分混匀后置于冰上备用。
[0127]
组分使用量np-40100μlpmsf1μl蛋白磷酸酶抑制剂1μlcocktail1μl
[0128]
(2)向各个装有样本的1.5ml ep管中各加入100μl配置好的细胞裂解液,用移液器充分混匀,置于冰上,使蛋白裂解10min。
[0129]
(3)充分裂解后,4℃,12000rpm,离心10min,将上清转移至新的无菌1.5ml ep管中,并各取5μl用pbs稀释20倍。
[0130]
(4)配置工作液:根据标准品和样本数量,按50体积bca试剂加1体积cu试剂(50:1)配置成bca工作液,充分混匀。
[0131]
(5)稀释标准品:将bsa标准液(5mg/ml)稀释10倍至0.5mg/ml。将标准品按0μl,2μl,4μl,6μl,8μl,12μl,16μl,20μl加到96孔板的蛋白标准品孔中,加pbs补足至20μl,每个浓度设置2个重复。
[0132]
(6)将各个样本各取20μl到96孔板的样品孔中,每个样本各设置2个重复。
[0133]
(7)每孔分别加入200μl bca工作液,37℃反应15-30min。
[0134]
(8)用多功能酶标仪测定各孔的a562nm,以标准组各浓度a562平均值为纵坐标,对应的标准品浓度为横坐标,绘制标准曲线。
[0135]
(9)根据标准曲线公式,计算出各个稀释后样品的浓度,再计算出原样品的蛋白质浓度。
[0136]
(10)找到浓度最低的样本,用pbs将剩余样本的浓度调整到与浓度最低的样本一致。
[0137]
(11)在各样本中加入5
×
蛋白上样缓冲液,使其终浓度为1
×
。
[0138]
(12)将所有样本用金属浴95℃加热10min。
[0139]
(13)加热结束后,2000rpm,离心2min,冻存于-80℃备用。
[0140]
western blot检测蛋白水平的变化
[0141]
(1)用洗洁精及超纯水仔细清洗玻璃板、15孔梳子及支架,自然晾干后备用。
[0142]
(2)取一无菌50ml离心管,先配置分离胶,10%sds-page分离胶配制方法如下:
[0143]
h2o5.9ml30%制胶液(29:1)5.0ml1.5m tris-hcl(ph8.8)3.8ml10%sds0.15ml10%过硫酸铵0.15mltemed0.006ml总体积15ml
[0144]
(3)按上述配方配置好后充分混匀,用移液器吸取分离胶沿玻璃板间隙缓慢加入至合适高度,加入1ml异丙醇压平胶面,室温静置30min。待胶凝固后,倒去异丙醇,并用滤纸吸干胶面。
[0145]
(4)配制sds-page浓缩胶(5%acrylamide),配制方法如下:
[0146]
h2o4.1ml30%制胶液(29:1)1.0ml1.0m tris-hcl(ph6.8)0.75ml10%sds0.06ml10%过硫酸铵0.06mltemed0.006ml总体积6ml
[0147]
(5)用移液器将混匀的浓缩胶沿玻璃缝隙加入,直至溢出,把梳子垂直插入浓缩胶中,室温静置30min,待其凝固后,将梳子垂直向上轻轻拔出。
[0148]
(6)将灌好胶的玻璃板安装在电泳装置上,放入电泳槽内,加入1
×
sds电泳缓冲液,电泳液至少要漫过电泳槽底部的导丝。
[0149]
(7)上样:用移液器吸取18μl彩虹180广谱蛋白marker及各个样本,分别加入对应的泳道中,空余的泳道用1
×
蛋白上样缓冲液补足。
[0150]
(8)电泳:80v电泳30min后,将电压调为120v再电泳约1h。根据marker分离情况适时终止电泳。
[0151]
(9)电泳结束后,将玻璃板从支架取下,将两层玻璃板撬开,切除上面的浓缩胶,之后浸泡于1
×
转膜缓冲液中。
[0152]
(10)将pvdf膜置于甲醇中活化1min。
[0153]
(11)将转膜用的夹子、海绵垫、滤纸用1
×
转膜缓冲液充分浸泡后按负极到正极方向依次放置海绵垫、滤纸、凝胶、pvdf膜、滤纸、海绵垫。放置过程中避免气泡形成。
[0154]
(12)确认放置方向正确后,将夹子合拢扣紧,将夹子放入电转槽中,向其中加入1
×
转膜缓冲液直至完全没过pvdf膜。连接正负极,将整个电转装置置于冰水浴中,80v电转1.5h。
[0155]
(13)电转结束后,根据目的蛋白的大小将pvdf膜裁开,做好标记,并用封闭液室温封闭2h。
[0156]
(14)将一抗用封闭液稀释至适当浓度(p-jak2 1:500,jak2 1:1000,p-stat11:2000,stat1 1:1000,p-65 1:1000,p-p65 1:1000,p-38 1:1000,p-p38 1:500,β-actin 1:5000),将pvdf膜放于可热封的杂交袋中,加入适量稀释后的一抗溶液,排尽气泡后封口,4℃过夜孵育。
[0157]
(15)将pvdf膜用镊子取出,用1
×
tbst缓冲液清洗3次,每次10min。
[0158]
(16)用封闭液稀释二抗(1:10000),将pvdf膜放于可热封的杂交袋中,加入适量稀释后的二抗溶液,排尽气泡后封口,室温孵育2h。
[0159]
(17)将pvdf膜用镊子取出,用1
×
tbst缓冲液清洗3次,每次10min。
[0160]
(18)将pvdf膜置于ax-ii x射线摄影暗匣中,根据pvdf膜的数量,将ecl超敏发光液a和ecl超敏发光液b按1:1混合,用移液器均匀滴加在pvdf膜表面。
[0161]
(19)在暗室中将显影液和定影液分别倒入两个搪瓷盘中备用,将胶片放入ax-ii x射线摄影暗匣中并扣紧,根据不同的蛋白表达量拍摄不同的时间,将胶片放入显影液中,待胶片呈现清晰的条带后,放入定影液中。最后将胶片置于阴凉通风处自然晾干。
[0162]
结果参见图5(a),结果表明,dlm通过抑制jak2/stat1信号通路抑制巨噬细胞cxcl10的表达。
[0163]
jak/stat通路抑制实验
[0164]
将巨噬细胞分别用dlm,dmso及jak/stat通路抑制剂磷酸鲁索利替尼(ruxolitinib phosphate)处理4h,8h,24h后收集细胞上清,用elisa检测cxcl10的表达水平。
[0165]
使用graphpad prism 8软件绘制柱状图,结果参见图5(b),其中横坐标表示时间,纵坐标表示cxcl10蛋白表达水平。结果表明,磷酸鲁索利替尼也可以通过jak/stat信号通路抑制cxcl10的表达,且其抑制作用较dlm更强。在图5(b)中,横线为平均值
±
标准差,*号代表p<0.05。***号代表p《0.001。****号代表p《0.0001。
[0166]
实施例4
[0167]
1、两组人群一般情况分析
[0168]
共纳入23例mdr-tb患者,其中obr组10人,obr+dlm组13人,对两组患者的一般情况进行分析发现(表1):dlm+obr组与dlm组在年龄、性别、体质指数无统计学差异。
[0169]
表1obr及obr+dlm两组的人口统计学和基线临床特征
[0170][0171]
2、两组人群c反应蛋白表达水平
[0172]
两组患者crp表达水平如图1所示,dlm+obr组c反应蛋白水平在第4,5,6,8周时均较obr组低(第4周:6.15
±
6.07mg/dl,第5周:3.72
±
2.70mg/dl,第6周:2.81
±
2.16mg/dl,第8周:2.22
±
2.30mg/dl)。表明dlm可以降低mdr-tb患者crp的表达水平,从而减轻局部炎症反应。
[0173]
3、两组人群细胞因子表达水平
[0174]
治疗第14天,28天,56天后,obr+dlm组患者cxcl10表达水平均明显低于obr组。两组患者血浆中ccl2,il-6,il-8和il-1β的水平无统计学差异,tnf-α和ifn-γ在检测低限以下。表明dlm可以抑制mdr-tb患者cxcl10的表达水平。dlm可能对cxcl10高表达的mdr-tb患者治疗效果更好。
[0175]
4、体外实验中dlm对巨噬细胞分泌cxcl10的影响
[0176]
巨噬细胞经dlm和dmso分别处理24h时,dlm组cxcl10的基因表达水平及蛋白表达水平均较对照组低。说明dlm对巨噬细胞有免疫调节作用,具体表现在可以降低cxcl10的表达水平。
[0177]
5、dlm抑制cxcl10表达后的功能验证
[0178]
dlm组处理巨噬细胞后对pbmc的迁移能力明显弱于对照组,表明dlm抑制cxcl10表达后可以抑制pbmc在局部病灶中的聚集,减轻局部炎症反应。
[0179]
6、dlm抑制cxcl10表达的机制
[0180]
dlm以时间依赖方式抑制p-jak2和p-stat1,dlm不影响p-65及p-38的表达,说明dlm是通过jak2/stat1信号通路来抑制cxcl10表达的。
[0181]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种变换,这些简单变型均属于本发明的保护范围。
[0182]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征和步骤,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对
各种可能的组合方式不再另行说明。
[0183]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1