包含靶向PD-L1和TGF-β的融合蛋白的药物组合物的制作方法
包含靶向pd-l1和tgf-β
的融合蛋白的药物组合物
1.本技术引用或参考的所有文献(包括但不限于文献、专利、专利申请)和本技术引用的文献中引用或参考的所有文献,以及本技术或通过引用并入本技术的任何文献提及的任何产品的任何制造商的说明、描述、产品规格和产品页,均通过引用的方式并入,并可以用于本发明的实践。更具体地,本技术引用的所有参考文献都以相同程度通过引用的方式并入,就如同各文献被具体地和单独地指出通过引用的方式并入本技术一样。而且,在任何国家,在本技术中对这些出版物的任何引用并不构成该出版物成为本领域公知常识的认可。
技术领域
2.本发明属于药物制剂领域,具体而言,本发明涉及包含靶向pd-l1和tgf-β的融合蛋白的药物组合物及其用途。
背景技术:
3.程序性死亡配体1(programmed death-ligand 1,pd-l1)是程序性死亡受体1(programmed death 1,pd-1)的配体之一,pd-l1与pd-1结合形成受体配体复合物后发出抑制性信号,包括诱导il-10(炎症与免疫抑制因子)产生,下调抗凋亡基因bcl-2来促进抗原特异性t细胞的凋亡,抑制淋巴结中cd8+t细胞的增殖等。pd-l1除了能与pd-1以较强的亲和力结合外,还能与cd80以较弱的亲和力结合,抑制t细胞活性。研究发现乳腺癌、肺癌、胃癌、肠癌、肾癌、黑色素瘤等多种人类肿瘤组织中pd-l1蛋白高表达,使得肿瘤细胞能够逃避免疫系统的杀伤。同时,pd-l1的表达水平和受试者的临床及预后紧密相关。这表明pd-l1是肿瘤免疫治疗中极具潜力的靶点。
4.转化生长因子β(transforming growth factorβ,tgf-β)为多功能细胞因子,在细胞增殖及分化、迁移及黏附、胞外基质产生、血管生成及结缔组织生成和免疫功能等过程中发挥重要调节作用。tgf-β同时具有肿瘤抑制和肿瘤促进的作用,但随着肿瘤的发展,其通过上皮间质转化过程,促进肿瘤转移、免疫逃逸以及诱导肿瘤血管生成,最终导致疾病进展。tgf-β通过识别转化生长因子β受体ii(tgf-βreceptor,tgfβrii)形成复合物,随后tgfβri以二聚体形式加入,形成异源四聚体受体复合物进行信号传递。研究发现,利用tgfβ受体抑制tgf-β信号传导能减少肿瘤的转移,使其成为目前肿瘤药物开发的重要方向之一。
5.pd-l1以及其他免疫检查点蛋白质的抑制剂作用效率较低,仅对部分受试者长期发挥作用,且可能导致致命的自身免疫不良事件,如何提高其治疗效果和减少毒性仍然是免疫治疗领域研究的重点。有研究发现,tgf-β是导致免疫检查点抑制剂失效的重要原因。因此,制备一种既能抑制pd-l1/pd-1通路亦能抑制tgf-β信号通路的药物,可有效地提高抗肿瘤效果,例如靶向pd-l1和tgf-β的融合蛋白。但融合蛋白药物的分子量大,结构复杂,容易降解、聚合和/或发生不希望发生的化学修饰等而变得不稳定。为了使融合蛋白适合于生产和施用于患者,并且在储存和随后使用过程中保持生物学活性和稳定性,因此,本领域仍然需要开发稳定的包含靶向pd-l1和tgf-β的融合蛋白的药物组合物。
技术实现要素:
6.本发明提供了包含靶向pd-l1和tgf-β的融合蛋白的药物组合物,所述药物组合物能够实现稳定的效果,适合在受试者中施用。
7.本发明提供的药物组合物,其包含:(a)靶向pd-l1和tgf-β的融合蛋白,(b)包含一种或多种缓冲液的缓冲系统,(c)表面活性剂,和(d)稳定剂。
8.在一些实施方案中,前述药物组合物中所述缓冲系统包括磷酸盐缓冲液、组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液中的一种或两种。
9.在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液,所述第一缓冲液是磷酸盐缓冲液或组氨酸缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液磷酸盐缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液组氨酸缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是磷酸盐缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包括第一缓冲液磷酸盐缓冲液和第二缓冲液组氨酸缓冲液。
10.在一些具体实施方案中,所述磷酸盐缓冲液包括磷酸钠缓冲液或磷酸钾缓冲液,所述枸橼酸盐缓冲液包括枸橼酸钠缓冲液、枸橼酸钾缓冲液或枸橼酸钙缓冲液。
11.在一些实施方案中,前述药物组合物中所述缓冲系统包括磷酸钠缓冲液、组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液中的一种或两种。
12.在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液,所述第一缓冲液是磷酸钠缓冲液或组氨酸缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液磷酸钠缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包含第一缓冲液组氨酸缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是磷酸钠缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液。在一些实施方案中,前述药物组合物中所述缓冲系统包括第一缓冲液磷酸钠缓冲液和第二缓冲液组氨酸缓冲液。
13.在一些具体实施方案中,所磷酸钠缓冲液由磷酸氢二钠和磷酸二氢钠组成,所述枸橼酸钠缓冲液由枸橼酸与枸橼酸钠组成,所述tris-hcl缓冲液由tris和盐酸组成,所述组氨酸缓冲液由组氨酸组成,或由组氨酸和盐酸组氨酸组成。
14.在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度为1mm至100mm,优选为2mm至80mm,优选为5mm至60mm,更优选为10mm至40mm。在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度为约10mm。在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度为约18mm。在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度为约20mm。在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度为约22mm。在一些实施方案中,前述药物组合物中所述第一缓冲液的浓度包括但不限于:约10mm,约11mm,约12mm,约13mm,约14mm,约15mm,约16mm,约17mm,约18mm,约19mm,约20mm,约21mm,约22mm,约23mm,约24mm,约25mm,约26mm,约27mm,约28mm,约30mm,约32mm,约34mm,约36mm,约38mm,或约40mm。
15.在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度为1mm至100mm,优选为2mm至80mm,优选为5mm至60mm,更优选为10mm至40mm。在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度为约10mm。在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度为约18mm。在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度为约20mm。在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度为约22mm。在一些实施方案中,前述药物组合物中所述第二缓冲液的浓度包括但不限于:约10mm,约11mm,约12mm,约13mm,约14mm,约15mm,约16mm,约17mm,约18mm,约19mm,约20mm,约21mm,约22mm,约23mm,约24mm,约25mm,约26mm,约27mm,约28mm,约30mm,约32mm,约34mm,约36mm,约38mm,或约40mm。
16.在一些实施方案中,前述药物组合物中所述缓冲系统的ph为5至9,6至9,优选为6.5至8.5,更优选为6.5至8。在一些实施方案中,前述药物组合物中所述缓冲系统的ph为约6.5。在一些实施方案中,前述药物组合物中所述缓冲系统的ph为约7。在一些实施方案中,前述药物组合物中所述缓冲系统的ph为约7.5。在一些实施方案中,前述药物组合物中所述缓冲系统的ph为约8。在一些实施方案中,前述药物组合物中所述缓冲系统的ph包括但不限于:约5、约5.1、约5.2、约5.3、约5.4、约5.5、约5.6、约5.7、约5.8、约5.9、约6、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8、约8.2、约8.4、或约8.5。
17.在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度为1mg/ml至200mg/ml,优选为2mg/ml至150mg/ml,优选为5mg/ml至100mg/ml,更优选为10mg/ml至约60mg/ml。在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度为约20mg/ml。在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度为约25mg/ml。在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度为约40mg/ml。在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度为约50mg/ml。在一些实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白的浓度包括但不限于:约10mg/ml,约15mg/ml,约20mg/ml,约25mg/ml,约30mg/ml,约35mg/ml,约40mg/ml,约45mg/ml,约50mg/ml,约55mg/ml,约60mg/ml,约80mg/ml,或约100mg/ml。
18.在一些实施方案中,前述药物组合物中所述表面活性剂选自聚山梨酯(如聚山梨酯20、聚山梨酯40、聚山梨酯60、聚山梨酯65、聚山梨酯80、聚山梨酯81、聚山梨酯85),泊洛沙姆(如泊洛沙姆181、泊洛沙姆188、泊洛沙姆407),聚乙二醇或聚羟体等。在一些实施方案中,前述药物组合物中所述表面活性剂是聚山梨酯80。在一些实施方案中,前述药物组合物中所述表面活性剂是聚山梨酯20。
19.在一些实施方案中,前述药物组合物中所述表面活性剂的浓度为0.01mg/ml至1mg/ml,优选为0.04mg/ml至0.8mg/ml,优选为0.06mg/ml至0.6mg/ml,更优选为0.08mg/ml至0.4mg/ml。在一些实施方案中,前述药物组合物中所述表面活性剂的浓度为约0.1mg/ml。在一些实施方案中,前述药物组合物中所述表面活性剂的浓度为约0.2mg/ml。在一些实施方案中,前述药物组合物中所述表面活性剂的浓度为约0.4mg/ml。在一些实施方案中,前述药物组合物中所述表面活性剂的浓度包括但不限于:约0.08mg/ml,约0.09mg/ml,约0.1mg/ml,约0.2mg/ml,约0.3mg/ml,约0.4mg/ml,约0.5mg/ml,或约0.6mg/ml。
l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液,和/或约1mm至约100mm的第二缓冲液,(c)约0.01mg/ml至约1mg/ml的表面活性剂,和(d)约10mg/ml至约200mg/ml的糖,和/或选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
26.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液,和/或约2mm至约80mm的第二缓冲液,(c)约0.04mg/ml至约0.8mg/ml的表面活性剂,和(d)约20mg/ml至约150mg/ml的糖,和/或选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
27.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液,和/或约5mm至约60mm的第二缓冲液,(c)约0.06mg/ml至约0.6mg/ml的表面活性剂,和(d)约40mg/ml至约120mg/ml的糖,和/或选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
28.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液,和/或约10mm至约40mm的第二缓冲液,(c)约0.08mg/ml至约0.4mg/ml的表面活性剂,和(d)约50mg/ml至约100mg/ml的糖,和/或选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
29.在一些实施方案中,前述药物组合物包含:(a)约1mg/ml至约200mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液磷酸盐缓冲液,和/或约1mm至约100mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.01mg/ml至约1mg/ml的聚山梨酯20或聚山梨酯80,和(d)约10mg/ml至约200mg/ml的海藻糖、甘露醇或蔗糖,和/或约20mm至约800mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
30.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液磷酸盐缓冲液,和/或约2mm至约80mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.04mg/ml至约0.8mg/ml的聚山梨酯20或聚山梨酯80,和(d)约20mg/ml至约150mg/ml的海藻糖、甘露醇或蔗糖,和/或约40mm至约600mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
31.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液磷酸盐缓冲液,和/或约5mm至约60mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.06mg/ml至约0.6mg/ml的聚山梨酯20或聚山梨酯80,和(d)约40mg/ml至约120mg/ml的海藻糖、甘露醇或蔗糖,和/或约60mm至约500mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选
为约6.5至约8.5,更优选为约6.5至约8。
32.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液磷酸盐缓冲液,和/或约10mm至约40mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.08mg/ml至约0.4mg/ml的聚山梨酯20或聚山梨酯80,和(d)约50mg/ml至约100mg/ml的海藻糖、甘露醇或蔗糖,和/或约80mm至约400mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
33.在一些实施方案中,前述药物组合物包含:(a)约1mg/ml至约200mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液组氨酸缓冲液,和/或约1mm至约100mm选自磷酸盐缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.01mg/ml至约1mg/ml的聚山梨酯20或聚山梨酯80,和(d)约10mg/ml至约200mg/ml的海藻糖、甘露醇或蔗糖,和/或约20mm至约800mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
34.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液组氨酸缓冲液,和/或约2mm至约80mm选自磷酸盐缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.04mg/ml至约0.8mg/ml的聚山梨酯20或聚山梨酯80,和(d)约20mg/ml至约150mg/ml的海藻糖、甘露醇或蔗糖,和/或约40mm至约600mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
35.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液组氨酸缓冲液,和/或约5mm至约60mm选自磷酸盐缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.06mg/ml至约0.6mg/ml的聚山梨酯20或聚山梨酯80,和(d)约40mg/ml至约120mg/ml的海藻糖、甘露醇或蔗糖,和/或约60mm至约500mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
36.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液组氨酸缓冲液,和/或约10mm至约40mm选自磷酸盐缓冲液、tris-hcl缓冲液或枸橼酸盐缓冲液的第二缓冲液,(c)约0.08mg/ml至约0.4mg/ml的聚山梨酯20或聚山梨酯80,和(d)约50mg/ml至约100mg/ml的海藻糖、甘露醇或蔗糖,和/或约80mm至约400mm的选自氯化钠、精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
37.在一些实施方案中,前述药物组合物包含:(a)约1mg/ml至约200mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液磷酸钠缓冲液,和/或约1mm至约100mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约
0.01mg/ml至约1mg/ml的聚山梨酯20或聚山梨酯80,和(d)约10mg/ml至约200mg/ml的海藻糖、甘露醇或蔗糖,和/或约20mm至约800mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
38.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液磷酸钠缓冲液,和/或约2mm至约80mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.04mg/ml至约0.8mg/ml的聚山梨酯20或聚山梨酯80,和(d)约20mg/ml至约150mg/ml的海藻糖、甘露醇或蔗糖,和/或约40mm至约600mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
39.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液磷酸钠缓冲液,和/或约5mm至约60mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.06mg/ml至约0.6mg/ml的聚山梨酯20或聚山梨酯80,和(d)约40mg/ml至约120mg/ml的海藻糖、甘露醇或蔗糖,和/或约60mm至约500mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
40.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液磷酸钠缓冲液,和/或约10mm至约40mm的选自组氨酸缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.08mg/ml至约0.4mg/ml的聚山梨酯20或聚山梨酯80,和(d)约50mg/ml至约100mg/ml的海藻糖、甘露醇或蔗糖,和/或约80mm至约400mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
41.在一些实施方案中,前述药物组合物包含:(a)约1mg/ml至约200mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液组氨酸缓冲液,和/或约1mm至约100mm选自磷酸钠缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.01mg/ml至约1mg/ml的聚山梨酯20或聚山梨酯80,和(d)约10mg/ml至约200mg/ml的海藻糖、甘露醇或蔗糖,和/或约20mm至约800mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
42.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液组氨酸缓冲液,和/或约2mm至约80mm选自磷酸钠缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.04mg/ml至约0.8mg/ml的聚山梨酯20或聚山梨酯80,和(d)约20mg/ml至约150mg/ml的海藻糖、甘露醇或蔗糖,和/或约40mm至约600mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
43.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液组氨酸缓冲液,和/或约5mm至约60mm选自磷酸钠缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.06mg/ml至约0.6mg/ml的聚山梨酯20或聚山梨酯80,和(d)约40mg/ml至约120mg/ml的海藻糖、甘露醇或蔗糖,和/或约60mm至约500mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
44.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液组氨酸缓冲液,和/或约10mm至约40mm选自磷酸钠缓冲液、tris-hcl缓冲液或枸橼酸钠缓冲液的第二缓冲液,(c)约0.08mg/ml至约0.4mg/ml的聚山梨酯20或聚山梨酯80,和(d)约50mg/ml至约100mg/ml的海藻糖、甘露醇或蔗糖,和/或约80mm至约400mm的选自精氨酸或其药学上可接受的盐、甘氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约5至约9,约6至约9,优选为约6.5至约8.5,更优选为约6.5至约8。
45.在一些实施方案中,前述药物组合物包含:(a)约1mg/ml至约200mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约1mm至约100mm的第一缓冲液磷酸钠缓冲液,和/或约1mm至约100mm的第二缓冲液组氨酸缓冲液,(c)约0.01mg/ml至约1mg/ml的聚山梨酯80,和(d)约10mg/ml至约200mg/ml的蔗糖,和约20mm至约800mm的选自精氨酸或其药学上可接受的盐或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
46.在一些实施方案中,前述药物组合物包含:(a)约2mg/ml至约150mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约2mm至约80mm的第一缓冲液磷酸钠缓冲液,和/或约2mm至约80mm的第二缓冲液组氨酸缓冲液,(c)约0.04mg/ml至约0.8mg/ml的聚山梨酯80,和(d)约20mg/ml至约150mg/ml的蔗糖,和约40mm至约600mm的选自精氨酸或其药学上可接受的盐或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
47.在一些实施方案中,前述药物组合物包含:(a)约5mg/ml至约100mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约5mm至约60mm的第一缓冲液磷酸钠缓冲液,和/或约5mm至约60mm的第二缓冲液组氨酸缓冲液,(c)约0.06mg/ml至约0.6mg/ml的聚山梨酯80,和(d)约40mg/ml至约120mg/ml的蔗糖,和约60mm至约500mm的选自精氨酸或其药学上可接受的盐或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
48.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液磷酸钠缓冲液,和/或约10mm至约40mm的第二缓冲液组氨酸缓冲液,(c)约0.08mg/ml至约0.4mg/ml的聚山梨酯80,和(d)约50mg/ml至约100mg/ml的蔗糖,和约80mm至约400mm的选自精氨酸或其药学上可接受的盐或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
49.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液磷酸钠缓冲液,和/或约10mm至约40mm的第二缓冲液组氨酸缓冲液,(c)约0.1mg/ml至约0.4mg/ml的聚山梨酯20或聚山梨酯80,和(d)约50mg/ml至约100mg/ml的海藻糖、甘露醇或蔗糖,和约80mm至约400mm的选自精氨酸或其药学上可接受的盐或脯氨酸的其他稳定剂;其中所述药物组合物的ph为6.5至
8.5,优选为6.5至8,例如,约6.5、约6.6、约6.7、约6.8、约6.9、约7、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8、约8.2、约8.4、或约8.5。
50.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约10mm至约40mm的第一缓冲液磷酸钠缓冲液,和/或约10mm至约40mm的第二缓冲液组氨酸缓冲液,(c)约0.1mg/ml至约0.4mg/ml的聚山梨酯80,和(d)约50mg/ml至约100mg/ml的蔗糖;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
51.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约50mg/ml至约100mg/ml的蔗糖,和约80mm至约400mm的选自精氨酸、盐酸精氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
52.在一些实施方案中,前述药物组合物包含:(a)约10mg/ml至约60mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约50mg/ml至约100mg/ml的蔗糖;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
53.在一些实施方案中,前述药物组合物包含:(a)约20mg/ml至约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约40mg/ml至约120mg/ml或约50mg/ml至约100mg/ml的蔗糖,和约80mm至约400mm的选自精氨酸、盐酸精氨酸或脯氨酸的其他稳定剂;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
54.在一些实施方案中,前述药物组合物包含:(a)约20mg/ml至约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约50mg/ml至约100mg/ml的蔗糖;其中所述药物组合物的ph为约6.5至约8.5,优选为约6.5至约8。
55.在一些实施方案中,前述药物组合物包含:(a)约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约80mg/ml的蔗糖,和约100mm的盐酸精氨酸;其中所述药物组合物的ph为约7.5。
56.在一些实施方案中,前述药物组合物包含:(a)约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约80mg/ml的蔗糖,和约100mm的盐酸精氨酸;其中所述药物组合物的ph为约6.5。
57.在一些实施方案中,前述药物组合物包含:(a)约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约80mg/ml的蔗糖,和约200mm的脯氨酸;其中所述药物组合物的ph为约7.5。在一些实施方案中,前述药物组合物包含:(a)约50mg/ml的靶向pd-l1和tgf-β的融合蛋白,(b)约20mm的第一缓冲液磷酸钠缓冲液,和/或约20mm的第二缓冲液组氨酸缓冲液,(c)约0.2mg/ml的聚山梨酯80,和(d)约80mg/ml的蔗糖;其中所述药物
组合物的ph为约7.5。
58.在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白,其包括:
59.(a)结合人程序性死亡配体1(pd-l1)的抗体或其抗原结合片段(例如至少一个重链可变结构域和至少一个轻链可变结构域);和
60.(b)人tgfβ结合结构域。
61.在一些实施方案中,所述人tgfβ结合结构域是人tgfβrii或其tgfβ结合片段,例如是与seq id no:36所示氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的多肽或肽段,或任何文本所述的片段。
62.在一些实施方案中,所述抗体或其抗原结合片段的重链cdr1包含seq id no:1或seq id no:15示出的氨基酸序列,重链cdr2包含seq id no:2或seq id no:16示出的氨基酸序列,重链cdr3包含seq id no:3或seq id no:17示出的氨基酸序列,所述抗体或其抗原结合片段的轻链cdr1包含seq id no:4或seq id no:18示出的氨基酸序列,轻链cdr2包含seq id no:5或seq id no:19示出的氨基酸序列,轻链cdr3包含seq id no:6或seq id no:20示出的氨基酸序列。
63.在一些实施方案中,所述抗体或其抗原结合片段包含:seq id no:1所示的hcdr1,seq id no:2所示的hcdr2,seq id no:3所示的hcdr3,seq id no:4所示的lcdr1,seq id no:5所示的lcdr2,和seq id no:6所示的lcdr3;或seq id no:15所示的hcdr1,seq id no:16所示的hcdr2,seq id no:17所示的hcdr3,seq id no:18所示的lcdr1,seq id no:19所示的lcdr2,和seq id no:20所示的lcdr3。
64.在一些实施方案中,所述抗体或其抗原结合片段的重链可变结构域与seq id no:7或seq id no:21示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,所述抗体或其抗原结合片段的轻链可变结构域与seq id no:8或seq id no:22示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在一些的实施方案中,所述抗体或其抗原结合片段的重链可变结构域包含seq id no:7或seq id no:21示出的氨基酸序列,所述抗体或其抗原结合片段的轻链可变结构域包含seq id no:8或seq id no:22示出的氨基酸序列。在一些实施方案中,所述抗体或其抗原结合片段包含seq id no:7所示的重链可变结构域,和seq id no:8所示的轻链可变结构域。在一些实施方案中,所述抗体或其抗原结合片段包含seq id no:21所示的重链可变结构域,和seq id no:22所示的轻链可变结构域。
[0065][0066]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白还可包括将抗体或其抗原结合片段与人tgfβ结合结构域相连接的连接肽,例如将抗体或其抗原结合片段的c末端与人tgfβ结合结构域的n末端相连接的连接肽。所述的连接肽可以采用柔性连接肽或刚性连接肽,可选地,是由甘氨酸和丝氨酸组合而成,例如,(g4s)
x
g所示的连接肽,其中x可选地为3-6的整数,优选为4-5,最优选为4。也可以采用不含连接肽的连接方式。
[0067]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包括抗体的至少一个轻链可变结构域与至少一个重链可变结构域,所述的轻链可变结构域与所述重链可变结构域组合时,形成与人pd-l1结合的抗原结合位点。
[0068]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白还可包含免疫球蛋白的恒定区,或所述恒定区的片段、类似物、变体或衍生物。在一些实施方案中,所述恒定区来自人免疫球蛋白重链,例如igg1、igg2、igg3和igg4或其他类别免疫球蛋白的重链,优选为来自igg1的重链。在一些实施方案中,所述恒定区可包含任何本文所述的修饰,例如氨基酸的插入、缺失、取代或化学修饰。在一些实施方案中,所述恒定区包含改变效应功能的突变,例如,将抗体恒定区c末端的赖氨酸残基突变为疏水性氨基酸,如丙氨酸或亮氨酸,减少蛋白酶的水解切割,增加血清半衰期。在一些实施方案中,所述恒定区的任意氨基酸残基可用igg1任意同种异型(allotype)的氨基酸残基取代,优选地,用g1m(3)和/或ng1m(1)的氨基酸残基取代。
[0069]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含结合人pd-l1的抗体或其抗原结合片段,和人tgfβ结合结构域。所述抗体或其抗原结合片段可任选地包含经修饰的恒定区,例如任何本文所述的修饰,包含恒定区c末端的k突变为a,或同种异型(allotype)氨基酸取代;所述人tgfβ结合结构域包含人tgfβrii或其能够结合tgfβ的片段或变体、或人tgfβrii的胞外结构域。
[0070]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含(a)与seq id no:7所示重链可变结构域氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:8所示轻链可变结构域氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,或者与seq id no:21所示重链可变结构域氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、
92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:22所示轻链可变结构域氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,和(b)人tgfβ结合结构域。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含(a)seq id no:7所示重链可变结构域和seq id no:8所示轻链可变结构域,或者seq id no:21所示重链可变结构域和seq id no:22所示轻链可变结构域,和(b)人tgfβ结合结构域。在一些具体实施方式中,所述人tgfβ结合结构域是人tgfβrii或其tgfβ结合片段或变体,或与seq id no:36所示氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的多肽或肽段:
[0071]
evqlvesggglvkpggslrlscaasgfifrsygmswvrqapgkglewvasissggstyypdsvkgrftisrdnaknslylqmnslraedtavydcargydsgfaywgqgtlvtvss(seq id no:7);
[0072]
divltqspaslavspgqratitcrasqsvstssssfmhwyqqkpgqppkllikyasnlesgvparfsgsgsgtdftltinpveandtanyycqhsweipytfgqgtkleik(seq id no:8);
[0073]
qitlkesgptlvkptqtltltctvsgfslstygvhwirqppgkalewlgviwrgvttdynaafmsrltitkdnsknqvvltmnnmdpvdtatyycarlgfyamdywgqgtlvtvss(seq id no:21);
[0074]
diqmtqspsslsasvgdrvtitckasqsvsndvawyqqkpgkapklliyyaanrytgvpdrfsgsgygtdftftisslqpediatyfcqqdytspytfgqgtkleik(seq id no:22);
[0075]
ipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd(seq id no:36)。
[0076]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(a)与seq id no:9所示重链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:10所示轻链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,或者与seq id no:23所示重链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:24所示轻链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,和(b)人tgfβ结合结构域。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(a)与seq id no:29所示重链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:10所示轻链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,或者与seq id no:32所示重链氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列和与seq id no:24所示轻链氨基酸序列具有至少80%、81%、82%、
83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的序列,和(b)人tgfβ结合结构域。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(a)seq id no:9所示重链和seq id no:10所示轻链,或者seq id no:23所示重链和seq id no:24所示轻链,和(b)人tgfβ结合结构域。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(a)seq id no:29所示重链和seq id no:10所示轻链,或者seq id no:32所示重链和seq id no:24所示轻链,和(b)人tgfβ结合结构域。在一些具体实施方式中,所述人tgfβ结合结构域是人tgfβrii或其tgfβ结合片段或变体,或与seq id no:36所示氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的多肽或肽段。
[0077]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)第一多肽,其氨基酸序列与seq id no:11、seq id no:25、seq id no:30或seq id no:33示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;和(2)第二多肽,其氨基酸序列与seq id no:13或seq id no:27示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)第一多肽,其具有seq id no:11或seq id no:30示出的氨基酸序列;和(2)第二多肽,其具有seq id no:13示出的氨基酸序列。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)第一多肽,其具有seq id no:25或seq id no:33示出的氨基酸序列;和(2)第二多肽,其具有seq id no:27示出的氨基酸序列。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)两个完全相同的第一多肽,其氨基酸序列与seq id no:11或seq id no:25示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性,或其氨基酸序列与seq id no:30或seq id no:33示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性;和(2)两个完全相同的第二多肽,其氨基酸序列与seq id no:13或seq id no:27示出的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)两个完全相同的第一多肽,其具有seq id no:11或seq id no:30示出的氨基酸序列;和(2)两个完全相同的第二多肽,其具有seq id no:13示出的氨基酸序列。在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白包含:(1)两个完全相同的第一多肽,其具有seq id no:25或seq id no:33示出的氨基酸序列;和(2)两个完全相同的第二多肽,其具有seq id no:27示出的氨基酸序列。
[0078]
其中所述第一多肽的氨基酸序列从n端到c端依次为:识别pd-l1抗原表位或抗原的抗体重链可变结构域、抗体恒定区、连接肽、人tgfβrii的tgfβ结合片段的序列。
[0079]
在可选的实施方案中,前述药物组合物中所述靶向pd-l1和tgf-β的融合蛋白为
pct/cn2020/111983中的靶向pd-l1和tgf-β的融合蛋白。
[0080]
本发明还提供一种制备前述药物组合物的方法,其包括使上述靶向pd-l1和tgf-β的融合蛋白与缓冲系统接触的步骤,例如,将靶向pd-l1和tgf-β的融合蛋白置换到缓冲系统中。在一个实施方案中,所述缓冲系统包括第一缓冲液磷酸盐缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是组氨酸缓冲液、枸橼酸盐缓冲液或tris-hcl缓冲液。在一个实施方案中,所述缓冲系统包括第一缓冲液组氨酸缓冲液,并且,所述缓冲系统还包含第二缓冲液,所述第二缓冲液是磷酸盐缓冲液、枸橼酸盐缓冲液或tris-hcl缓冲液。所述第一缓冲液的浓度为1mm至100mm,优选为2mm至80mm,优选为5mm至60mm,更优选为10mm至40mm。所述第二缓冲液的浓度为1mm至100mm,优选为2mm至80mm,优选为5mm至60mm,更优选为10mm至40mm。所述缓冲系统的ph为5至9,6至9,优选为6.5至8.5,更优选为6.5至8。所述制备前述药物组合物的方法,进一步地还包括加入稳定剂,以及表面活性剂,不区分先后顺序,其中所述稳定剂包含海藻糖、甘露醇、蔗糖、氯化钠、精氨酸或其药学上可接受的盐、甘氨酸和/或脯氨酸等,所述表面活性剂包括聚山梨酯20或聚山梨酯80等。
[0081]
本发明还提供了一种制备包含靶向pd-l1和tgf-β的融合蛋白的冻干制剂的方法,其中包括将前述药物组合物经冷冻干燥的步骤。在一些实施方案中,所述冷冻干燥按照本领域公知的方法进行,包括但不限于包括预冻、一次干燥和二次干燥的步骤。技术人员理解,任何将水从本发明的药物组合物中移除的方法均适用于本发明。
[0082]
本发明还提供一种包含靶向pd-l1和tgf-β的融合蛋白的冻干制剂,其是经前述制备冻干制剂的方法制备所得。
[0083]
本发明还提供一种包含靶向pd-l1和tgf-β的融合蛋白的冻干制剂,所述冻干制剂经复溶后可形成前述药物组合物。
[0084]
本发明还提供一种制品,其包括容器,该容器中装有前述药物组合物或前述冻干制剂。
[0085]
本发明的药物组合物或冻干制剂可根据已知的方法施用,例如以合适的方式在一段时间内输注或注射,例如,通过皮下的、静脉的、腹膜内的、肌肉内的、动脉内的、病灶内的或关节内的途径,局部施用,吸入或通过持续释放或延时释放。
[0086]
本发明还提供本发明所述的药物组合物、冻干制剂或制品在制备治疗癌症、抑制肿瘤生长或增强抗肿瘤应答的药物中的用途。在一些实施方案中,所述癌症或肿瘤包括但不限于:肺鳞癌、肺腺癌、粘液性腺瘤、脑低级神经胶质瘤、多形性成胶质细胞瘤、间皮瘤、黑色素瘤、肉瘤、软组织肉瘤、骨肉瘤、甲状腺癌、肾癌、肝癌、急性骨髓性白血病、食管腺癌、食管鳞癌、淋巴瘤、非小细胞肺癌、乳腺癌、胰腺导管癌、胰腺癌、前列腺癌、结肠直肠癌、大肠癌、胃腺癌、胃癌、胃肠道间质瘤、胆道癌、胆管癌、胆囊癌、阴茎癌、肛门癌、阴道癌、子宫颈癌、子宫体子宫内膜样癌、子宫内膜癌、膀胱癌、人乳头瘤病毒感染、头颈部癌、皮肤癌、下咽癌、喉癌、口腔癌、鼻咽癌、口咽癌、咽喉癌、鼻旁窦和鼻腔癌、和/或唾液腺癌。
[0087]
本技术还提供一种治疗癌症、抑制肿瘤生长或增强抗肿瘤应答的方法,其包括施用本发明的药物组合物、冻干制剂或制品。在一些实施方案中,所述的肿瘤或癌症包括但不限于:肺鳞癌、肺腺癌、粘液性腺瘤、脑低级神经胶质瘤、多形性成胶质细胞瘤、间皮瘤、黑色素瘤、肉瘤、软组织肉瘤、骨肉瘤、甲状腺癌、肾癌、肝癌、急性骨髓性白血病、食管腺癌、食管鳞癌、淋巴瘤、非小细胞肺癌、乳腺癌、胰腺导管癌、胰腺癌、前列腺癌、结肠直肠癌、大肠癌、
胃腺癌、胃癌、胃肠道间质瘤、胆道癌、胆管癌、胆囊癌、阴茎癌、肛门癌、阴道癌、子宫颈癌、子宫体子宫内膜样癌、子宫内膜癌、膀胱癌、人乳头瘤病毒感染、头颈部癌、皮肤癌、下咽癌、喉癌、口腔癌、鼻咽癌、口咽癌、咽喉癌、鼻旁窦和鼻腔癌、和/或唾液腺癌。
附图说明
[0088]
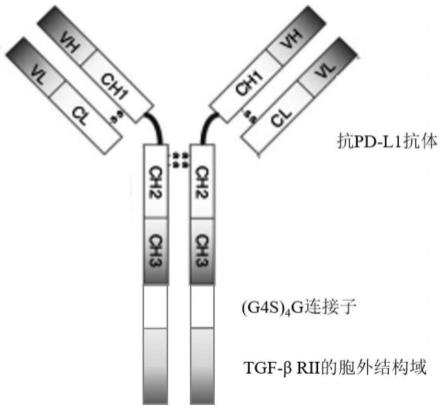
图1.抗pd-l1抗体-tgfβrii融合蛋白结构示意图,通过(g4s)4g连接肽将抗pd-l1抗体重链的c端与tgfβ受体ii胞外结构域的n末端相连。
[0089]
图2a.报告基因法检测hu5g11-higg1-tgfβrii的pd-l1端生物学活性;图2b.报告基因法检测m7824的pd-l1端生物学活性。
[0090]
图3.elisa法检测hu5g11-higg1-tgfβrii与pd-l1的体外结合活性。
[0091]
图4.elisa法检测hu5g11-higg1-tgfβrii与tgf-β1的体外结合活性。
具体实施方式
[0092]
本发明的以下描述只为说明本发明的多种实施方式。除非另行指明,本技术所用的技术和科学术语的含义等同于本领域普通技术人员的普遍理解。对于本技术一个术语存在多个定义的情况,除非另行指明,应采用本节所用定义。
[0093]“磷酸盐缓冲液”是包含磷酸根离子的缓冲液。磷酸盐缓冲液的示例包括磷酸钠缓冲液、磷酸钾缓冲液等,优选的磷酸盐缓冲液是磷酸钠缓冲液。例如,磷酸钠缓冲液是由磷酸氢二钠和磷酸二氢钠配制而成。
[0094]“枸橼酸盐缓冲液”是包括枸橼酸根离子的缓冲液。枸橼酸盐缓冲液的示例包括枸橼酸钠缓冲液、枸橼酸钾缓冲液、枸橼酸钙缓冲液等,优选的枸橼酸盐缓冲液是枸橼酸钠缓冲液。例如,枸橼酸钠缓冲液是枸橼酸与枸橼酸钠配制而成。
[0095]“tris-hcl缓冲液”是由tris(氨丁三醇)和盐酸配制而成的。
[0096]“组氨酸缓冲液”是包括组氨酸根离子的缓冲液。组氨酸缓冲液的实例包括组氨酸缓冲液、组氨酸-醋酸缓冲液、组氨酸-盐酸缓冲液、组氨酸-盐酸组氨酸等,例如,适用于本发明的组氨酸缓冲液由组氨酸(l-histidine)配制而成,不包含醋酸或盐酸,适用于本发明的组氨酸缓冲液还可以由组氨酸和盐酸组氨酸组成。
[0097]“缓冲液”或“缓冲系统”是指在药学上可接受的、用于维持药物组合物的ph值至期望的ph范围。适用于本发明使用的缓冲系统包括至少一种缓冲液,例如磷酸盐缓冲液、枸橼酸盐缓冲液、tris-hcl缓冲液、组氨酸缓冲液中的一种或多种组合。在一些实施方案中,适用于本发明使用的缓冲系统包含磷酸盐缓冲液和组氨酸缓冲液两种。
[0098]“药物组合物”意在涵盖以任选地特定的量包含特定活性成分(例如融合蛋白)的产物,以及任何通过以任选地特定的量组合特定活性成分直接或间接产生的任何产物。药物组合物的目的是使融合蛋白适于生产和施用于患者,并且在储存和随后的使用过程中保持生物学活性和/或稳定性。在一些方案中,所述药物组合物为水溶性注射液,所述水溶性注射液包括但不限于未经冻干的水溶性制剂或冻干粉重构的水溶性制剂。在另一些方案中,所述药物组合物为冻干制剂。在本发明中,“药物组合物”和“制剂”不相互排斥。
[0099]“稳定的”或“稳定化的”药物组合物是指活性成分(例如融合蛋白)保存在其中时基本保持其物理稳定性和/或化学稳定性和/或生物学活性的药物组合物。本领域已有多种
用于测量活性成分稳定性的分析技术,例如在peptide and protein drug delivery,247-301,vincent lee ed.,marcel dekker,inc.,new york,n.y.,pubs.(1991)jones,a.adv.drug delivery rev.10:29-90(1993)中进行了综述。稳定性可以在所选温度和其他保存条件下在所选时间段进行测量。举例来说,如果在目检颜色和/或澄清度后,或者通过uv光散射、分子排阻色谱法(sec)和差示扫描量热法(dsc)测得,活性成分没有显示出显著的聚集增加、沉淀和/或变性,那么所述活性成分在药物组合物中“保留它的物理稳定性”。优选地,当使用本发明的药物组合物时,如通过sec-uplc或任何其他合适的用于测量聚集形成的方法时,5%或更少,4%或更少,优选地3%或更少的活性成分形成聚集物(也称为高分子杂质)。如果活性成分(例如融合蛋白)没有显示出显著的化学改变,那么所述活性成分在药物组合物中“保留它的化学稳定性”。通过检测和定量化学上改变的形式,可以评估化学稳定性。经常改变蛋白化学结构的过程包括水解或截短(通过诸如分子排阻色谱法和sds-page等方法来评价)、氧化(通过诸如与质谱法或maldi/tof/ms结合的肽谱法等方法来评价)、脱酰胺作用(通过诸如离子交换色谱法、毛细管等电聚焦电泳、肽谱法、异天冬氨酸测量等方法来评价)和异构化(通过测量异天冬氨酸含量、肽谱法等来评价)。如果活性成分(例如融合蛋白)在给定时间内的生物学活性在制备药物组合物时所表现出的生物活性的预定范围内,则活性成分在药物组合物中于给定时间内“保持其生物学活性”,例如通过抗原结合测定来确定。
[0100]“高分子杂质”或“聚集物”是指分子量大于目标活性成分(例如融合蛋白)的杂质的总称。
[0101]
冠词“一种”、“一个”和“所述”在此用于指代该冠词的语法对象的一个/种或多于一个/种(即至少一个/种)。举例来说,“一种/个药物组合物”指一种/个药物组合物或多于一种/个药物组合物。
[0102]“约”或“大约”是指数值在本领域一般技术人员所测定的具体值的可接受误差范围内,所述数值部分取决于怎样测量或测定(即测量体系的限度)。例如,在本领域中“约”或“大约”可意味着在1内或超过1的标准差。或者“约”或“大约”表示所述值加上或减去15%、10%、5%或1%的范围。此外,特别对于生物学系统或过程而言,该术语可意味着至多一个数量级或数值的至多5倍。本发明中除另外说明,否则“约xx”或“大约xx”或“基本上包含“xx”的含义是该具体值“xx”的可接受误差范围内的数值(包括数值“xx”本身,以及本领域一般技术人员测定该数值的可接受误差范围内的数值)。
[0103]
如本文中所述,任何百分比范围、比率范围或整数范围应当理解为包括在列举的范围内的任意整数的值,且适当时,包括其分数(诸如整数的十分之一和百分之一),除非另外指出。
[0104]
在本技术全文中,除非上下文另有规定,词语“包含”、“包括”和“含有”将被理解为表示包括所述的步骤或要素或一组步骤或要素,但不排除任何其他步骤或要素或一组步骤或要素。“由
……
组成”所表示的是包括并且限于短语“由
……
组成”之后的内容。因此,短语“由
……
组成”表示所列出的要素是需要的或必需的,并且没有其他要素可存在。“基本由
……
组成”所表示的是包括列于此短语之后的任意要素,并且限于不妨碍或有助于所列的要素的如在本技术中详述的活性或作用的其他要素。因此,短语“基本由
……
组成”表示所列出的要素是需要的或必需的,但其他要素是可选的并可取决于其是否影响所列出的要
素的活性或作用而存在或不存在。
[0105]“tgfβrii”或“tgfβ受体ii”是指具有野生型人tgfβ受体2同种型b序列的多肽或蛋白,例如seq id no:35所示的多肽,或具有与seq id no:35所示氨基酸序列基本相同的序列的多肽。
[0106]
tgfβrii的“结合tgfβ的片段”或“tgfβ结合片段”是指tgfβrii中具有tgfβ结合活性的片段,约占tgfβrii序列的至少0.1%、0.5%、1%、5%、10%、25%、35%、50%、75%、90%、95%、99%、或100%。该片段通常是可溶片段,例如人tgfβrii的胞外结构域或其变体。
[0107]
如本文所用,术语“抗体”是指具有至少一个抗原结合结构域的结合蛋白。本技术的抗体和其片段可以是整个抗体或其任何片段。因此,本技术的抗体和片段包括单克隆抗体或其片段和抗体变体或其片段,以及免疫缀合物。抗体片段的实例包括fab片段、fab'片段、f(ab)'2片段、fv片段、fd片段、fd’片段、分离的cdr区、单链fv分子(scfv)和本领域已知的其他抗体片段,以及经过任何本领域已知修饰的抗体(例如糖基化修饰、化学修饰等)。抗体和其片段还可以包括重组多肽、融合蛋白和双特异性抗体。本文公开的抗pd-l1抗体和其片段可以是igg1、igg2、igg3或igg4同种型。术语“同种型”是指由重链恒定区基因编码的抗体种类。
[0108]“抗原结合片段”是指保留全长抗体的抗原结合功能的片段,包括fab、fab’、f(ab’)2、scfv、fv、fd、fd’、分离的cdr区和单一结构域vhh片段和本领域已知的其他抗体片段,或将上述片段进行任何本领域已知修饰的片段。
[0109]
如本文所用,术语“ec50”是指有效浓度,抗体的50%最大应答。如本文所用,术语“ic50”是指抑制浓度,抗体的50%最大应答。ec50和ic50两者均可以通过elisa或facs分析或本领域已知的任何其他方法进行测量。
[0110]“同一性”是指两个参考序列之间的相似性,同一性百分比是指通过本领域技术人员熟知的序列比较算法,将序列或序列指定区域进行比较所得出的百分数,例如可以通过national center for biotechnology institute网站上可得的blastn/blastp算法的默认设置来进行。
[0111]“基本相同”是指序列之间具有至少约80%及以上(例如81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的同一性。
[0112]“受试者”是指哺乳动物,包括人和非人动物,优选的受试者是人。
[0113]“治疗”包括治疗性治疗以及防范性治疗或预防性措施,通过给予受试者治疗剂来减少所述疾病、紊乱,或病症(例如,癌症或肿瘤)的至少一种症状或缓解症状的发展。
[0114]“癌症”是指以异常方式增殖的细胞的集合。
[0115]
实施例
[0116]
为清楚起见,进一步用实施例来阐述本技术,但是实施例并非限制本技术的范围。实施例中的融合蛋白hu5g11-higg1-tgfβrii为pct/cn2020/111983中的hu5g11-higg1-tgfβrii。
[0117]
实施例1融合蛋白瞬转表达质粒的构建和表达
[0118]
构建靶向pd-l1和tgf-β的融合蛋白hu5g11-higg1-tgfβrii,如图1所示。该分子的
轻链具有seq id no:27的氨基酸序列;该分子的重链(seq id no:33)是融合蛋白,其包含抗人pd-l1抗体(seq id no:32)的重链、人tgfβrii的胞外结构域氨基酸序列(seq id no:36)以及将前两者相连的(g4s)4g连接肽(seq id no:37)。
[0119]
hu5g11-higg1-tgfβrii轻链的氨基酸序列(seq id no:27):
[0120]
diqmtqspsslsasvgdrvtitckasqsvsndvawyqqkpgkapklliyyaanrytgvpdrfsgsgygtdftftisslqpediatyfcqqdytspytfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0121]
hu5g11-higg1-tgfβrii重链的氨基酸序列(seq id no:33):
[0122]
qitlkesgptlvkptqtltltctvsgfslstygvhwirqppgkalewlgviwrgvttdynaafmsrltitkdnsknqvvltmnnmdpvdtatyycarlgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvavshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgaggggsggggsggggsggggsgipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd
[0123]
pd-l1抗体重链的氨基酸序列(seq id no:32):
[0124]
qitlkesgptlvkptqtltltctvsgfslstygvhwirqppgkalewlgviwrgvttdynaafmsrltitkdnsknqvvltmnnmdpvdtatyycarlgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvavshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspga
[0125]
人tgfβrii胞外结构域的氨基酸序列(seq id no:36):
[0126]
ipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd
[0127]
连接肽的氨基酸序列(seq id no:37):
[0128]
ggggsggggsggggsggggsg
[0129]
采用全基因合成hu5g11-higg1-tgfβrii的重链核酸序列(seq id no:34)和轻链核酸序列(seq id no:28),连接到真核表达载体中,优选pcdna3.1(+)表达载体,构建目的表达质粒。采用expifectamine
tm cho转染技术将重链和轻链的表达质粒导入expicho-s
tm
细胞内,进行目的蛋白的瞬时表达,获得的细胞培养上清进行蛋白的纯化。
[0130]
实施例2融合蛋白的分离纯化与鉴定
[0131]
将实施例1得到的细胞培养上清样品加载到蛋白a亲和层析柱上,如ge公司的mabselect,用含磷酸盐的平衡缓冲液(如10mm磷酸盐缓冲液,ph=6.0)平衡层析柱后,再用含氯化钠的淋洗缓冲液(如含0.5m氯化钠的25mm磷酸盐缓冲液,ph=7.0~7.4)淋洗部分结合的杂质,最后用洗脱缓冲液洗脱结合在层析柱上的目的蛋白产物,得到hu5g11-higg1-tgfβrii。所述的洗脱可以使用常规的方法:例如高盐缓冲液、改变ph等方法实现,如采用1m盐酸精氨酸(ph=3~4),或50mm柠檬酸盐缓冲液(ph=3~4)进行洗脱。其中磷酸盐缓冲液
采用磷酸氢二钠和磷酸二氢钠配制而成,柠檬酸盐缓冲液采用柠檬酸和柠檬酸三钠配制而成。洗脱液采用紫外分析法进行定量。
[0132]
实施例3融合蛋白的体外结合亲和力检测
[0133]
采用biacore t200分析hu5g11-higg1-tgfβrii、m7824与pd-l1和tgfβ的亲和力。其中,m7824为cn106103488中的抗pd-l1/tgfβ阱,重链和轻链序列分别如本技术的seq id nos:42和43所示。编码重链和轻链的dna序列合成后克隆到表达载体中,将轻链和重链表达载体共转染到expicho-s
tm
中,细胞在8%co2、37℃培养箱中孵育,然后使用proteina填料根据实施例2所述方法纯化培养上清,得到m7824。
[0134]
1)检测融合蛋白与pd-l1亲和力:将anti-higg1(fc)antibody通过氨基偶联的方法连接到cm5芯片表面,偶联量约8000~9000ru。使用cm5芯片分别捕获hu5g11-higg1-tgfβrii和m7824,然后使用运行缓冲液将pd-l1蛋白(sinobiological,10084-h08h)稀释至20nm、10nm、5nm、2.5nm、1.25nm,测定不同浓度pd-l1蛋白及空白对照(运行缓冲液)与hu5g11-higg1-tgfβrii和m7824相互作用的信号,从而获得结合和解离曲线。之后用3mol/l mgcl2缓冲液再生至基线平稳。
[0135]
2)检测融合蛋白与tgfβ的亲和力:将anti-higg1(fc)antibody通过氨基偶联的方法连接到cm5芯片表面,偶联量约8000~9000ru。使用cm5芯片分别捕获hu5g11-higg1-tgfβrii和m7824,然后使用运行缓冲液将tgfβ蛋白(sinobiological,10804-h08h)稀释至1000nm、500nm、250nm、125nm、62.5nm,测定不同浓度tgfβ蛋白及空白对照(运行缓冲液)与hu5g11-higg1-tgfβrii和m7824相互作用的信号,从而获得结合和解离曲线。之后用3mol/l mgcl2缓冲液再生至基线平稳。
[0136]
biacontrol software 2.0实时采集数据信号,biaevaluation software 2.0进行数据分析,数据经扣减后(即每一个循环中样品信号扣减掉空白对照信号)用langmuir 1:1模型拟合,计算结合速率常数ka、解离速率常数kd、平衡常数kd值。
[0137]
表1各测试样品与pd-l1和tgfβ的亲和力
[0138][0139]
由上表可以看出,与作为对照的m7824相比,hu5g11-higg1-tgfβrii表现出更小的kd和kd值,即hu5g11-higg1-tgfβrii与pd-l1和tgfβ均具有更高的亲和力。
[0140]
实施例4报告基因法检测hu5g11-higg1-tgfβrii的pd-l1端生物学活性
[0141]
取cho-pdl1-cd3l细胞(中国食品药品检定研究院),用cho-pdl1-cd3l完全培养基调整活细胞密度至4~5
×
105cells/ml,以每孔100μl加入到96孔全白细胞板中,37℃、5%co2细胞培养箱中孵育。孵育16~20h后,取对数生长期jurkat-pd-1-nfat细胞(中国食品药品检定研究院),用分析培养基调整活细胞密度至1.25-2
×
106cells/ml。取出上述96孔全白细胞板,吸弃上清,加入50μl/孔的jurkat-pd-1-nfat细胞悬液。将hu5g11-higg1-tgfβ
rii预稀释至浓度为56nmol/l,2倍梯度稀释,共10个稀释梯度(即稀释至约56nmol/l、约28nmol/l、约14nmol/l、约7nmol/l、约3.5nmol/l、约1.75nmol/l、约0.875nmol/l、约0.4375nmol/l、约0.21875nmol/l、约0.109375nmol/l);将pd-l1抗体预稀释至浓度为68nmol/l,2倍稀释,共10个稀释梯度;将m7824预稀释至浓度为56nmol/l,2倍稀释,共10个稀释梯度。按照每孔50μl分别加入梯度稀释的hu5g11-higg1-tgfβrii、pd-l1抗体和m7824到上述细胞培养板中,37℃、5%co2细胞培养箱中孵育6h。将bio-glo luciferase试剂(promega,g7940)以每孔100μl加入到上述细胞板中,室温避光孵育2~3min。用多功能酶标仪(thermo,varioskan flash)读取相对光单位(rlu)值。hu5g11-higg1-tgfβrii的pd-l1端生物学活性结果如图2a和表2所示。表2的结果表明hu5g11-higg1-tgfβrii具有更高的pd-l1端生物学活性。
[0142]
测试样品生物学活性(%)=(参比样品ec50值/测试样品ec50值)
×
100%
[0143]
表2报告基因法检测各测试样品的pd-l1端生物学活性
[0144]
样品生物学活性ec50(nmol/l)pd-l1抗体100%4.603hu5g11-higg1-tgfβrii75.4%6.106样品生物学活性ec50(nmol/l)pd-l1抗体100%4.151m782472.5%5.724
[0145]
注:pd-l1抗体(参比样品)为cn107001463中的人源化5g11-igg1抗体,重链和轻链序列分别如本技术的seq id nos:23和24所示;m7824为cn106103488中的抗pd-l1/tgfβ阱,重链和轻链序列分别如本技术的seq id nos:42和43所示,制备方法参见实施例3。
[0146]
实施例5酶联免疫吸附方法(elisa)检测hu5g11-higg1-tgfβrii与pd-l1和tgf-β的体外结合活性融合蛋白与pd-l1的体外结合试验
[0147]
1)包被:将pd-l1重组蛋白(sinobiological,10084-h08h)用pbs稀释至2μg/ml,100μl/孔包被在96孔板中,4℃孵育过夜;2)含0.05%tween 20的pbs溶液洗涤96孔板1次,每孔加入250μl封闭液(含3%bsa的pbs溶液),封闭1~2小时;3)用稀释液(含1%bsa和0.05%tween 20的pbs溶液)将hu5g11-higg1-tgfβrii预稀释至约4000ng/ml,4倍梯度稀释,共7个稀释梯度(即稀释至约4000ng/ml、约1000ng/ml、约250ng/ml、约62.5ng/ml、约15.625ng/ml、约3.90625ng/ml和约0.9765625ng/ml);含0.05%tween 20的pbs溶液洗涤96孔板3次后,分别加入梯度稀释的hu5g11-higg1-tgfβrii和空白对照品,100μl/孔,25℃孵育1~2小时;4)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔100μl加入1:3500稀释的hrp标记的羊抗人二抗(pe,nef802001ea),25℃孵育1小时;5)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔100μl加入3,3',5,5'-四甲基联苯胺(tmb),25℃避光孵育5分钟;最后加入1m h2so4终止反应;6)酶标仪(thermo scientific,varioskan flash)于450nm检测吸收值,以平均吸光度值为纵坐标,以hu5g11-higg1-tgfβrii浓度的对数为横坐标,计算hu5g11-higg1-tgfβrii的ec50值。
[0148]
融合蛋白与tgf-β的体外结合试验
[0149]
1)包被:将tgf-β1重组蛋白(sinobiological,10804-h08h)用pbs稀释至2μg/ml,100μl/孔包被在96孔板中,4℃孵育过夜;其他步骤如上所示。
[0150]
hu5g11-higg1-tgfβrii体外结合pd-l1的结果如图3和表3所示,体外结合tgf-β1的结果如图4和表3所示,elisa结果显示其保留了与pd-l1和tgf-β的结合活性。
[0151]
表3 hu5g11-higg1-tgfβrii在elisa试验中与pd-l1和tgfβ的结合的ec50值
[0152] pd-l1端tgf-β端样品ec
50
(ng/ml)ec
50
(ng/ml)pd-l1/tgfβrii34.3167.03
[0153]
实施例6药代动力学分析
[0154]
1)单次给药药代动力学研究:本试验采用食蟹猴作为动物模型,将其随机分为3组,每组6只,雌雄各半,每组分别单次静脉输注1、10、60mg/kg的hu5g11-higg1-tgfβrii,于给药前0h,给药开始后1min、3h、8h、24h、48h、72h、120h、168h、216h、264h、336h、504h、672h通过静脉采集全血,分离并收集上清,elisa法检测上清中血药浓度等指标,结果见表4。
[0155]
2)重复给药药代动力学研究:本试验采用食蟹猴作为动物模型,分为3组,每组10只,雌雄各半,每周1次,连续4周(共5次)静脉滴注20、60、200mg/kg的hu5g11-higg1-tgfβrii,于首次给药前0h及给药开始后1min、3h、8h、24h、48h、72h、120h、168h,第3次和第4次给药前0h及给药开始后1min,第5次给药前0h及给药开始后1min、3h、8h、24h、48h、72h、120h、168h、216h、264h、336h、504h、672h通过静脉采血,分离并收集上清,elisa法检测上清中血药浓度等指标。结果见表5,表5结果表明血清中未见hu5g11-higg1-tgfβrii明显蓄积。
[0156]
elisa操作步骤如下:
[0157]
1)包被:将human pd-l1/b7-h1/cd274 protein,fc ta(sinobiological,lc11no2402)用pbs稀释至1μg/ml,100μl/孔包被在96孔板中,4℃孵育过夜;2)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔300μl加入封闭液(含0.05%tween 20和1%bsa的的pbs溶液),25℃封闭2~3小时;3)含0.05%tween20的pbs溶液洗涤96孔板3次后,以每孔100μl分别加入空白对照样本、标准曲线样本、待测样本,25℃孵育1~1.5小时;4)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔100μl加入用封闭液稀释至终浓度为0.05μg/ml的human tgf-βrii biotinylated antibody(r&d,xl0519051),25℃孵育1~1.5小时;5)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔100μl加入用封闭液1:200稀释的streptavidin-hrp,25℃孵育30分钟;6)含0.05%tween 20的pbs溶液洗涤96孔板3次,以每孔100μl加入tmb底物显色液,25℃避光孵育5~10分钟;最后以每孔100μl加入0.5m h2so4,终止反应;7)酶标仪于450nm检测吸收值。
[0158]
表4 hu5g11-higg1-tgfβrii单次给药的药代力动学参数
[0159][0160]
表5 hu5g11-higg1-tgfβrii重复给药的药代动力学参数
[0161][0162]
实施例7融合蛋白对小鼠mc38移植瘤的抑制作用
[0163]
igg1的dna序列合成后克隆到的pcdna3.1表达载体中。使用expicho转染试剂盒(thermo fisher,a29133)将轻链和重链表达载体共转染到expicho-s
tm
中。将细胞在8%co2、37℃培养箱中培养,使用proteina填料根据实施例2所述方法纯化培养上清,得到igg1。igg1的重链和轻链氨基酸序列如本技术seq id no:38和seq id no:39所示。
[0164]
igg1-tgfβrii的dna序列合成后克隆到pcdna3.1表达载体中。使用expicho转染试剂盒(thermo fisher,a29133)将轻链和重链表达载体共转染到expicho-s
tm
中。将细胞在8%co2、37℃培养箱中培养,使用proteina填料根据实施例2所述方法纯化培养上清,得到igg1-tgfβrii。igg1-tgfβrii重链和轻链氨基酸序列如本技术seq id no:40和seq id no:41所示。
[0165]
采用pd-l1人源化小鼠皮下接种3
×
105mc38/hpd-l1细胞/只,构建小鼠结肠癌模型,待肿瘤长到50~70mm3,根据肿瘤体积分组,10只/组,静脉注射(iv)hu5g11-higg1-tgfβrii、igg1和igg1-tgfβrii,每2天1次,共6次,注射体积0.1ml/10g体重。每周两次用游标卡尺测量肿瘤直径,通过下列公式计算所得的t/c%或抑瘤率tgi(%)考察药物对肿瘤生长的影响。实验结束、达到实验终点、或肿瘤体积达到1500mm3,co2麻醉处死动物,随后解剖取瘤并拍照。肿瘤体积(v)计算公式为:v=1/2
×a×
b2,其中a、b分别表示长、宽;t/c(%)=(t-t0)/(c-c0)
×
100,其中t、c为实验结束时的治疗组、同型对照组肿瘤体积;t0、c0为实验开始时的治疗组、同型对照组肿瘤体积;抑瘤率(tgi)(%)=100-t/c。
[0166]
结果如表6所示,hu5g11-higg1-tgfβrii(3.7、12.3mg/kg)对mc38/hpd-l1皮下移植瘤生长有明显抑制作用,抑瘤率分别为56%和69%,呈现剂量依赖性;igg1-tgfβrii(2.3mg/kg)对mc38/hpd-l1皮下移植瘤的抑瘤率为4%,没有明显疗效;其中,igg1-tgfβrii(2.3mg/kg)与hu5g11-higg1-tgfβrii(3.7mg/kg)的给药剂量处于同一量级、不存在实质性差别,这证实了相对于具有其他组成的融合蛋白(即,包含igg1和tgfβrii的融合蛋白),hu5g11-higg1-tgfβrii表现出显著更高的抑瘤率。荷瘤小鼠对以上药物均能够较好耐受,没有明显体重下降等症状发生。
[0167]
表6各测试样品对结肠癌细胞mc38/hpd-l1皮下移植瘤的疗效
[0168][0169]
注:随机分组,第一次给药时间为d0;给药频率和次数为每2天1次,共6次,给药途径为静脉注射(iv)。p《0.05、p《0.01、p《0.001通过t检验与igg1组(同型对照组)对比。
[0170]
实施例8电化学发光方法检测hu5g11-higg1-tgfβrii刺激细胞因子分泌
[0171]
1)液相法:用rpmi1640完全培养基调整pbmc细胞浓度至约1~2
×
106细胞/ml,按100μl/孔加入到96孔细胞培养板中。用rpmi1640完全培养基稀释igg1(seq id no:38和seq id no:39,制备方法见实施例7)、lps(sigma,l4391-1mg)、hu5g11-higg1-tgfβrii,配制成1000μg/ml的igg1;10μg/ml的lps;100μg/ml、300μg/ml、1000μg/ml的hu5g11-higg1-tgfβrii。将rpmi1640完全培养基作为阴性对照。将上述配制好的溶液分别取100μl加入到96孔细胞培养板中,充分混匀,于37℃、5%co2细胞培养箱内培养。24小时和48小时分别取96孔板中的细胞上清,采用v-plex proinflammatory panel 1(human)试剂盒(msd,k15049d-2)检测细胞因子il-2、il-4、il-6、tnf-α、ifn-γ含量,结果如表7所示。
[0172]
2)固相法:用pbs稀释igg1(seq id no:38和seq id no:39,制备方法见实施例7)、lps(sigma,l4391-1mg)、hu5g11-higg1-tgfβrii,配制成500μg/ml的igg1、5μg/ml的lps;50
μg/ml、150μg/ml、500μg/ml的hu5g11-higg1-tgfβrii;pbs作为阴性对照。将上述配制好的溶液以200μl/孔分别加入至96孔高吸附板对应孔中,37℃包被2h,然后取出细胞培养板,吸弃溶液,用pbs溶液清洗细胞培养板3次。用rpmi1640完全培养基调整pbmc细胞浓度至约1~2
×
106cells/ml,按200μl/孔加入到96孔细胞培养板中,于37℃、5%co2细胞培养箱内培养。24小时和48小时分别取96孔板中的细胞上清,采用v-plex proinflammatory panel 1(human)试剂盒(msd,k15049d-2)检测细胞因子il-2、il-4、il-6、tnf-α、ifn-γ含量,结果如表8所示。
[0173]
表7液相法检测各测试样品刺激细胞因子分泌的结果
[0174][0175]
表8固相法检测各测试样品刺激细胞因子分泌的结果
[0176][0177]
由上表结果可以看出,hu5g11-higg1-tgfβrii表现出引起细胞因子风暴的低可能性,因此,当向受试者给予时基本上不会存在过度激活免疫系统而引发全身性炎症的风险。
[0178]
实施例9融合蛋白对食蟹猴的毒性试验
[0179]
采用temp-14热敏电阻温度计检测肛温;采用大动物无创生理信号遥测系统检测呼吸频率及ii导联心电图;采用无创血压计测量血压(收缩压、舒张压、平均动脉压)。定性分析心电图波形,并以ecgauto软件分析每个时间点处30秒时段内稳定连续的心电图,指标
包括心率、r-r间期、p波时间、p-r间期、qrs波时间、q-t间期、校正q-t间期。
[0180]
单次给药毒性:本试验共6只食蟹猴,每组3只,雌雄兼有,设2个组,分别单次静脉注射300、1000mg/kg hu5g11-higg1-tgfβrii,观察14天。试验期间对一般观察和体重、摄食量、体温、ii导联心电图及血压、血液学、血液生化、尿液等指标进行检测,试验结束时进行大体解剖观察。试验期间动物未出现死亡或濒死现象,各项指标未见异常。
[0181]
重复给药毒性:本试验共使用40只食蟹猴,分为4组,每组10只,雌雄各半,分别为空白对照组和hu5g11-higg1-tgfβrii 20、60、200mg/kg组。每周1次、连续给药4周(共5次),停药恢复观察6周。重复静脉注射给药毒性试验毒代动力学参数参见实施例6的表5。
[0182]
给药结束时,60、200mg/kg组可见轻度以rbc、hgb、hct降低为主的贫血样改变以及ret、ret%升高,200mg/kg组还可见骨髓涂片轻度红细胞系、晚幼红细胞比例升高。组织病理学检查骨髓及脾脏未见相关改变。至恢复期结束,200mg/kg组1只雌猴hgb、hct仍未见明显恢复,红细胞形态学见血红蛋白含量降低,其余食蟹猴的上述指标均可见不同程度恢复。
[0183]
给药结束时,20、60、200mg/kg组甲状腺轻微单核细胞浸润,60、200mg/kg组肾脏轻微~轻度单核细胞浸润,20mg/kg及200mg/kg组脑膜轻微单核细胞浸润。恢复期结束,除200mg/kg组脑膜病变未见明显恢复外,其余食蟹猴的脏器病变均可见一定程度恢复。
[0184]
此外,各组食蟹猴一般观察、体重、摄食量、体温、ii导联心电图、呼吸频率及血压、血液生化、尿液、眼科检查、骨髓涂片、免疫球蛋白、补体、循环免疫复合物、淋巴细胞亚群及细胞因子均未见明显异常改变。
[0185]
由此可见,hu5g11-higg1-tgfβrii表现出低的急性毒性和长期毒性,因此可以预期所述融合蛋白能够在临床上表现出良好的安全性。
[0186]
药物组合物的实施例
[0187]
分子排阻色谱法(sec-uplc):用于测定样品中抗体的纯度,采用thermo vanquish f高效液相色谱,acquity uplc protein beh sec column(1.7μm,4.6mm
×
300mm)色谱柱,acquity uplc protein beh sec guard column(1.7μm,4.6mm
×
30mm)为预柱,以50mmol/l磷酸盐缓冲液-200mmol/l氯化钠溶液(ph 7.0)为流动相进行洗脱,检测波长为280nm。按面积归一化法计算高分子杂质和免疫球蛋白单体的百分含量。
[0188]
dls粒径的检测方法:使用纳米粒度仪(malvern,zen3600)检测样品的粒径,程序如下:温度25℃,平衡时间120s。
[0189]
tonset、tm的检测方法:采用蛋白质稳定分析仪(nanotemper,prometheus nt.48)分析样品的拐点温度(tonset)、熔解温度(tm),取10μl样品放入样品室进行检测,程序如下:扫描开始温度为25℃,扫描结束温度为95℃,升温速率为0.3℃/min。
[0190]
使用多孔板直读动静态光散射仪(wyatt,dynaproplate readerⅲ)检测样品的聚集温度(tagg),样品离心后取30μl上清加入到384孔样品盘中,封板膜封板,再将384孔样品盘离心去除气泡,然后进行检测,程序如下:升温程序从25℃到85℃,扫描时间为5秒。
[0191]
使用多孔板直读动静态光散射仪(wyatt,dynaproplate readerⅲ)检测样品的扩散系数(kd),样品预稀释至10mg/ml,然后梯度稀释至8mg/ml、6mg/ml、4mg/ml、2mg/ml,过滤离心后取30μl上清样品加入到384孔样品盘中,封板膜封板,再将384孔样品盘离心去除气泡,然后进行检测,程序如下:温度设置25℃,样品采集5次数据,采集时间5秒。
[0192]
使用多孔板直读动静态光散射仪(wyatt,dynaproplate readerⅲ)检测样品的第
二维利系数(a2),样品预稀释至10mg/ml,然后梯度稀释至8mg/ml、6mg/ml、4mg/ml、2mg/ml,过滤离心后取30μl上清样品加入到384孔样品盘中,封板膜封板,再将384孔样品盘离心去除气泡,然后进行检测,程序如下:温度设置25℃,样品采集5次数据,采集时间5秒。
[0193]
生物学活性检测方法:参见实施例5。
[0194]
ce-sds还原电泳方法:采用beckman coulter pa 800plus生物制药分析系统,内径50μm、总长31cm、有效长度21cm的非涂层-熔融石英毛细管,pda检测器,在检测波长220nm下进行检测。按面积归一化法计算降解物的校正峰面积百分比。
[0195]
缓冲系统的配制:缓冲系统可采用本领域常规的方法进行配制,如f1中的缓冲系统:20mm磷酸钠缓冲液(ph 7.5)由约5.5441g/l na2hpo4
·
12h2o和约0.6237g/l nah2po4
·
h2o配制而成;f4中的缓冲系统:20mm磷酸钠缓冲液+20mm组氨酸缓冲液(ph 7.5)由约5g/l na2hpo4
·
12h2o、约0.833g/l nah2po4
·
h2o和约3.1g/l组氨酸配制而成;f12中的缓冲系统:20mm磷酸钠缓冲液+20mm组氨酸缓冲液(ph 6.5)由2.11g/l na2hpo4
·
12h2o、1.95g/l nah2po4
·
h2o和2.03g/l组氨酸、1.44g/l盐酸组氨酸一水合物配制而成。
[0196]
实施例9缓冲系统的筛选
[0197]
通过超滤离心的方式,将hu5g11-higg1-tgfβrii置换到表9筛选的缓冲系统中,置换完成后进行浓缩,按照表9筛选的药物组合物分别添加辅料,混合均匀后过滤除菌。不同药物组合物的sec-uplc、dls粒径和生物学活性的检测结果见表10。
[0198]
表9筛选的药物组合物
[0199][0200]
注:“/”表示未添加。
[0201]
表10筛选的药物组合物的sec-uplc、dls粒径和生物学活性的检测结果
[0202][0203]
注:“/”表示未测,d表示天。
[0204]
实施例10稳定剂和ph的筛选
[0205]
通过超滤离心的方式,将hu5g11-higg1-tgfβrii置换到表11筛选的缓冲系统中,置换完成后进行浓缩,按照表11筛选的药物组合物分别添加辅料,混合均匀后过滤除菌。不同药物组合物的tonset、tm、tagg、kd和a2的检测结果见表12,不同药物组合物在40℃和2~8℃条件下的稳定性考察结果见表13。
[0206]
表11筛选的药物组合物
[0207][0208]
注:“/”表示未添加。
[0209]
表12筛选的药物组合物的tm、tagg、kd和a2检测结果
[0210][0211]
注:“/”表示未测。
[0212]
表13筛选的药物组合物在40℃和2~8℃条件下的稳定性考察结果
[0213][0214]
注:d表示天,w表示周,m表示月。
[0215]
实施例11稳定剂和ph的筛选
[0216]
通过超滤离心的方式,将hu5g11-higg1-tgfβrii置换到表14筛选的缓冲系统中,置换完成后进行浓缩,按照表14筛选的药物组合物分别添加辅料,混合均匀后过滤除菌。不同药物组合物在40℃和2~8℃条件下的稳定性考察结果见表15。
[0217]
表14筛选的药物组合物
[0218][0219]
注:“/”表示未添加。
[0220]
表15筛选的药物组合物在40℃和2~8℃条件下的稳定性考察结果
[0221][0222]
注:d表示天,m表示月,“/”表示未测。
[0223]
本领域技术人员应该进一步理解,本发明可以在不背离其精神和核心属性的前提下以其他具体形式实施。在前述说明书中,本发明仅公开了示例性的实施方案,应该理解其他的变化也被包括在本发明的范围之内。因此,本发明不限于本文详细描述的具体实施方案。相反,关于本发明的范围和内容,应该参考后附的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1