用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物及其制备方法和应用与流程
1.本发明涉及中成药制剂及药理毒理学技术领域,具体涉及一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物及其制备方法和应用。
背景技术:
2.中医认为反复发作的呼吸道感染乃因正气亏虚,表卫虚弱,外邪肝内所致。小儿肝常有余,脾常不足,脏腑娇嫩,肌肤薄弱,加之寒温不知自调,家长常有护养不周,因而六淫邪气每易由口鼻、皮毛而入,侵袭肺系,肺气虚则肺卫不固,宣肃失常,脾气虚则清阳不升,运化无力。童康颗粒中防风、黄芪、白术益肺固表,陈皮醒牌运湿,山药健脾养胃,牡蛎化痰散结,诸药共奏益肺健脾,固卫化湿之效。
3.小儿感冒、咳喘等肺系病证最为常见,所以儿童反复呼吸道感染是儿科常见病、多发病。咳嗽是儿童反复呼吸道感染疾病最常见的主诉,气虚俨然与儿童身体素质薄弱、反复发病息息相关,儿童气虚通常见于肺气不足,或脾气虚弱。脾虚则运化不健,水谷精微不能上荣于肺,肺气日虚。肺气亏损,肃降失司则咳嗽。剖析儿童气虚咳嗽的发病病机,本发明提供了一种能治疗儿童反复呼吸道感染的作用的药物及其制备方法。
技术实现要素:
4.为克服现有的技术缺陷,本发明目的在于提供一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物及其制备方法和应用,本发明采用的制备方法能将混合物整合成均匀颗粒,提高颗粒的流动性和可压性,使得本发明制备下的颗粒型药物成分更加均匀,生物利用度高,安全性好。便于儿童充分吸收、服用方便。
5.为了解决上述技术问题,本发明提供了以下技术方案:
6.第一方面,提供了一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物的制备方法,所述制备方法包括以下步骤:
7.(1)取山药、陈皮干燥后分别粉碎成超微细粉;所述干燥条件为:干燥时间18~20h,干燥温度80~85℃;
8.(2)取防风、白术分别粉碎,将粉碎后的防风、白术先蒸馏提取,收集挥发油;蒸馏后的药液滤过另器存放,药渣加水煎煮,煎液滤过;所述蒸馏的条件为:蒸馏时间≥5h,加水量为药材的5~8倍,蒸馏温度95~100℃;
9.(3)取黄芪、牡蛎分别粉碎,将粉碎后的黄芪、牡蛎煎煮提取两次,煎液滤过,合并步骤(2)的煎液,浓缩后煮沸得到浸膏;所述浓缩条件为:温度50~60℃,真空度-0.06~-0.1mpa,相对密度1.25~1.35(50℃测);
10.(4)将山药细粉、陈皮细粉、挥发油以及辅料加入浸膏中,依次经过制粒干燥、整粒和总混后得到药物组合物;
11.其中,上述原料的含量如下:黄芪322g、白术214g、防风108g、牡蛎322g、陈皮26g、
山药322g、辅料260~290g;
12.具体地,通过上述原料药组合制成2000g颗粒。
13.进一步地,所述辅料包括蔗糖、乳糖、枸橼酸、桔子香精和香兰素;具体地,上述辅料中个原料的含量为蔗糖240g、乳糖40g、枸橼酸6.0g、桔子香精 1.6ml和香兰素800mg;
14.进一步地,步骤(1)中,将粉碎后的山药和陈皮过筛后得到细粉,过筛的网筛目数≥200目。
15.具体地,干燥后的陈皮和山药细粉的水分≤8.5%。
16.进一步地,步骤(2)中,所述防风的细度≤10cm,所述白术的细度≤2cm。
17.进一步地,步骤(2)中,所述蒸馏条件还包括:浸润时间1.5h;所述煎煮条件为:煎煮次数1次,时间1.5h,加水量为原料的10倍,温度95~100℃,搅拌速度30~60转/min。
18.进一步地,步骤(3)中,所述黄芪的细度≤10cm;第一次煎煮的条件为:时间2h,加水量为原料的10倍,温度95~100℃,搅拌速度30~60转/min;
19.第二次煎煮的条件为:时间1.5h,加水量为原料的8倍,温度95~100℃,搅拌速度30~60转/min。
20.进一步地,步骤(4)中,制粒干燥步骤条件为:进风温度80~90℃、物料温度35~50℃、出风温度45~75℃、加浆温度60~85℃、风机频率30~50hz、喷液转速8-30rpm、干燥时间≤30min,水分≤4%。
21.进一步地,步骤(4)中,整粒步骤条件为:螺旋送料转速30~50rpm、压棍转速8~15rpm、压棍间隙0.4~0.6mm、油压160~200bar、粉碎转速80~120rpm、整粒转速80~120rpm、孔径1.2mm、水冷≤20℃、粒度大于20目小于40目。
22.进一步地,步骤(4)中,总混步骤条件为:转速10转/min,混合时间15min,粒度大于20目,小于60目。
23.第二方面,提供了一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物,所述药物组合物由第一方面所述的制备方法制备而成。
24.优选地,在本发明中,将上述药物组合物制备成每袋含生药量1.314克的袋装颗粒。
25.具体地,针对不同年龄的儿童,其服用的药量也有所不同;其中,1-3岁儿童,一次1/2袋,一日2次,相当于生药量1.314克;4岁-7岁儿童,一次 3/4袋,一日3次,相当于生药量2.9565克;8-12岁儿童,一次1袋,一日3 次,相当于生药量3.942克。
26.第三方面,提供了第二方面所述的药物组合物在制备用于治疗儿童反复呼吸道感染引起的气虚咳嗽药物中的应用。
27.与现有技术相比,本发明具有以下有益效果:
28.1、本发明的制备方法中,将山药和陈皮研磨成超微细粉后直接使用,能避免其有效成分的流失;同时,防风、白术采用蒸馏法提取挥发油,并与山药和陈皮细粉一起加入到浸膏中,减少了挥发油在煎煮过程中的损失,提高其利用率从而增加药效;本发明还进一步限定了制粒干燥、整粒和总混操作的具体条件,有利于混合物整合成均匀颗粒,提高颗粒的流动性和可压性,使得本发明制备下的颗粒型药物成分更加均匀,生物利用度高、安全性好,便于儿童吸收、食用方便。
29.2、本发明针对儿童气虚咳嗽的发病病机,采用黄芪内补肺脾之气,外可固表止汗;
白术益气健脾,燥湿利水,可助黄芪加强益气固表之功,使气旺表实,汗不外泄;防风,走表而祛风邪,使本方补中寓散,具有固表而不留邪,驱邪而不伤正的意义;陈皮,理气健脾,燥湿助运;山药,补益脾肺;牡蛎,化痰散结,敛汗除烦,镇静安神。全方共奏益气健脾,固表止汗,利水化湿,驱风化痰之效。使得本发明的药物组合物具有治疗儿童反复呼吸道感染的作用。
30.本发明附加的方面和优点将在下面的描述中部分给出,这些将从下面的描述中变得明显,或通过本发明的实践了解到。
具体实施方式
31.为了更充分的理解本发明的技术内容,下面将结合具体实施例对本发明作进一步介绍和说明;显然,以下所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
32.对于本领域的技术人员来说,通过阅读本说明书公开的内容,本发明的特征、有益效果和优点将变得显而易见。
33.除非另外指明,所有百分比、分数和比率都是按本发明组合物的总重量计算的。
34.本文中“包括”、“包含”、“含”、“含有”、“具有”或其它变体意在涵盖非封闭式包括,这些术语之间不作区分。术语“包含”是指可加入不影响最终结果的其它步骤和成分。术语“包含”还包括术语“由...组成”和“基本上由...组成”。本发明的组合物和方法/工艺可包含、由其组成和基本上由本文描述的必要元素和限制项以及本文描述的任一的附加的或任选的成分、组分、步骤或限制项组成。
35.术语“药物颗粒”即为本发明提供的药物组合物。
36.以下实施例中,所用原料组分均可通过市售购买得到的常规原料。
37.实施例1-3
38.实施例1
39.实施例1提供一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物,该药物组合物包括以下原料:黄芪322g、白术214g、防风108g、牡蛎 322g、陈皮26g、山药322g、蔗糖240g、乳糖40g、枸橼酸6.0g、桔子香精1.6ml 和香兰素800mg;
40.该药物组合物的制备方法包括以下步骤:
41.(1)取山药、陈皮干燥后分别粉碎,过筛后得到超微细粉,过筛的网筛目数≥200目;所述干燥条件为:干燥时间18h,干燥温度80℃;干燥后的陈皮和山药细粉的水分≤8.5%。
42.(2)取防风、白术分别粉碎,防风的细度≤10cm,白术的细度≤2cm;将粉碎后的防风、白术先蒸馏提取,收集挥发油;蒸馏后的药液滤过另器存放,药渣加水煎煮,煎液滤过;蒸馏的条件为:浸润时间1.5h,蒸馏时间≥5h,加水量为药材的5倍,蒸馏温度95℃;
43.煎煮条件为:煎煮次数1次,时间1.5h,加水量为原料的10倍,温度95℃,搅拌速度30~60转/min。
44.(3)取黄芪、牡蛎分别粉碎,黄芪的细度≤10cm;将粉碎后的黄芪、牡蛎煎煮提取两次,第一次煎煮的条件为:时间2h,加水量为原料的10倍,温度95℃,搅拌速度40转/min;第
二次煎煮的条件为:时间1.5h,加水量为原料的8倍,温度95℃,搅拌速度40转/min;煎液滤过,合并步骤(2)的煎液,浓缩后煮沸得到浸膏;所述浓缩条件为:温度50℃,真空度-0.06mpa,相对密度1.25(50℃测);
45.(4)将山药细粉、陈皮细粉、挥发油以及辅料加入浸膏中,依次经过制粒干燥、整粒和总混后得到药物组合物;
46.其中,制粒干燥步骤条件为:进风温度80℃、物料温度35℃、出风温度 45℃、加浆温度60℃、风机频率30hz、喷液转速10rpm、干燥时间≤30min,水分≤4%;
47.整粒步骤条件为:螺旋送料转速30rpm、压棍转速8rpm、压棍间隙0.4mm、油压160bar、粉碎转速80rpm、整粒转速80rpm、孔径1mm、水冷≤20℃、粒度30目;
48.总混步骤条件为:转速10转/min,混合时间15min,粒度30目。
49.实施例2
50.实施例2提供一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物,该药物组合物包括以下原料:黄芪322g、白术214g、防风108g、牡蛎 322g、陈皮26g、山药322g、蔗糖240g、乳糖40g、枸橼酸6.0g、桔子香精1.6ml 和香兰素800mg;
51.该药物组合物的制备方法包括以下步骤:
52.(1)取山药、陈皮干燥后分别粉碎,过筛后得到超微细粉,过筛的网筛目数≥200目;所述干燥条件为:干燥时间20h,干燥温度85℃;干燥后的陈皮和山药细粉的水分≤8.5%。
53.(2)取防风、白术分别粉碎,防风的细度≤10cm,白术的细度≤2cm;将粉碎后的防风、白术先蒸馏提取,收集挥发油;蒸馏后的药液滤过另器存放,药渣加水煎煮,煎液滤过;蒸馏的条件为:浸润时间1.5h,蒸馏时间≥5h,加水量为药材的8倍,蒸馏温度100℃;
54.煎煮条件为:煎煮次数1次,时间1.5h,加水量为原料的10倍,温度100℃,搅拌速度30~60转/min。
55.(3)取黄芪、牡蛎分别粉碎,黄芪的细度≤10cm;将粉碎后的黄芪、牡蛎煎煮提取两次,第一次煎煮的条件为:时间2h,加水量为原料的10倍,温度100℃,搅拌速度45转/min;第二次煎煮的条件为:时间1.5h,加水量为原料的8倍,温度100℃,搅拌速度45转/min;煎液滤过,合并步骤(2)的煎液,浓缩后煮沸得到浸膏;所述浓缩条件为:温度60℃,真空度-0.1mpa,相对密度1.35(50℃测);
56.(4)将山药细粉、陈皮细粉、挥发油以及辅料加入浸膏中,依次经过制粒干燥、整粒和总混后得到药物组合物;
57.其中,制粒干燥步骤条件为:进风温度90℃、物料温度50℃、出风温度 75℃、加浆温度85℃、风机频率50hz、喷液转速30rpm、干燥时间≤30min,水分≤4%;
58.整粒步骤条件为:螺旋送料转速50rpm、压棍转15rpm、压棍间隙0.6mm、油压200bar、粉碎转速120rpm、整粒转速120rpm、孔径1.2mm、水冷≤20℃、粒度35目;
59.总混步骤条件为:转速10转/min,混合时间15min,粒度35目。
60.实施例3
61.实施例3提供一种用于治疗儿童反复呼吸道感染引起的气虚咳嗽的药物组合物,该药物组合物包括以下原料:黄芪322g、白术214g、防风108g、牡蛎 322g、陈皮26g、山药322g、蔗糖240g、乳糖40g、枸橼酸6.0g、桔子香精1.6ml 和香兰素800mg;
62.该药物组合物的制备方法包括以下步骤:
63.(1)取山药、陈皮干燥后分别粉碎,过筛后得到超微细粉,过筛的网筛目数≥200目;所述干燥条件为:干燥时间19h,干燥温度83℃;干燥后的陈皮和山药细粉的水分≤8.5%。
64.(2)取防风、白术分别粉碎,防风的细度≤10cm,白术的细度≤2cm;将粉碎后的防风、白术先蒸馏提取,收集挥发油;蒸馏后的药液滤过另器存放,药渣加水煎煮,煎液滤过;蒸馏的条件为:浸润时间1.5h,蒸馏时间≥5h,加水量为药材的6倍,蒸馏温度98℃;
65.煎煮条件为:煎煮次数1次,时间1.5h,加水量为原料的10倍,温度98℃,搅拌速度30~60转/min。
66.(3)取黄芪、牡蛎分别粉碎,黄芪的细度≤10cm;将粉碎后的黄芪、牡蛎煎煮提取两次,第一次煎煮的条件为:时间2h,加水量为原料的10倍,温度96℃,搅拌速度50转/min;第二次煎煮的条件为:时间1.5h,加水量为原料的8倍,温度96℃,搅拌速度50转/min;煎液滤过,合并步骤(2)的煎液,浓缩后煮沸得到浸膏;所述浓缩条件为:温度55℃,真空度-0.08mpa,相对密度1.30(50℃测);
67.(4)将山药细粉、陈皮细粉、挥发油以及辅料加入浸膏中,依次经过制粒干燥、整粒和总混后得到药物组合物;
68.其中,制粒干燥步骤条件为:进风温度85℃、物料温度45℃、出风温度 60℃、加浆温度75℃、风机频率40hz、喷液转速25rpm、干燥时间≤30min,水分≤4%;
69.整粒步骤条件为:螺旋送料转速40rpm、压棍转速12rpm、压棍间隙0.5mm、油压180bar、粉碎转速100rpm、整粒转速100rpm、孔径1.2mm、水冷≤20℃、粒度35;
70.总混步骤条件为:转速10转/min,混合时间15min,粒度35目。
71.具体地,实施例1-3制得的药物组合物的剂型均为颗粒剂。
72.实施例4
73.本实施例的目的是评价实施例3的药物颗粒重复灌胃给予幼年sd大鼠26 周后可能出现的毒性反应(包括发育毒性)、靶器官以及停药后4周毒性反应的恢复情况,为供试品的临床研究提供动物试验资料。
74.具体试验操作如下:
75.试验选用幼年sd大鼠240只,雌雄各半,1~4组为主研究组,每组20只 /性别,分别为溶媒对照组(灭菌注射用水)、低剂量组(2g生药/kg/天)、中剂量组(6g生药/kg/天)和高剂量组(18g生药/kg/天);5~8组为卫星组,用于行为学功能和动情周期的检查,组别和剂量同主研究组,每组10只/性别。灌胃给药,动物于pnd14/15开始给药,每天给药1次,连续给药26周,共给药182次。给药容量为15ml/kg。试验期间,对动物进行临床观察、体重、摄食量、身体发育、身长、尾长、胫骨长度、反射发育、行为学发育、体温、血细胞计数、凝血功能、血液生化、尿液、t淋巴细胞亚群、眼科检查以及雄鼠精子计数和活力、精子形态学和雌鼠动情周期等指标的检查。给药13周结束 (d92)、末次药后次日(d183)和恢复期4周结束(d211),分别对1~4组前5只/性别/组、中间10只/性别/组和后5只/性别/组的动物实施安乐死,进行大体解剖观察,主要脏器称重,计算脏体比和脏脑比,并对40多种组织脏器进行组织病理学检查。
76.结果讨论:
77.一般毒性讨论
78.本药物以2、6、18g生药/kg/天的剂量重复灌胃给予幼年sd大鼠,每天给药1次,连续给药26周,恢复4周。给药后,2g生药/kg/天剂量下雌雄动物给药期间个别时间点食量减少;6g生药/kg/天剂量下雌雄动物给药期间唾液分泌过多、肛周污秽,体重一过性增长缓慢(第1周),大部分时间点食量减少,尿酮体增加;18g生药/kg/天剂量下雌雄动物给药期间唾液分泌过多、肛周污秽,部分时间点食量减少,尿酮体增加;上述改变在恢复期可恢复。
79.上述改变中,动物唾液分泌过多在灌胃给药试验中比较常见,尤其在中药制剂给药中常见,与供试品气味和浓度等有关,多次给药后动物可能存在一定的应激性反应,但停药后可恢复。肛周污秽发生在6和15 18g生药/kg/天剂量,仅在d2~d3可见,为给药后动物产生的一过性改变,可能与给予的药物浓度较大有关。各剂量组动物食量改变由大到小为6g生药/kg/天剂量组、18g生药 /kg/天剂量组、2g生药/kg/天剂量组,以6g生药/kg/天剂量组最明显,同时各剂量组动物各时间点体重未见明显异常改变,认为食量改变与给予的药物制剂和清膏混合物的给药浓度、给药容量相对较大以及辅料成分有关。
80.尿酮体阳性,常见于糖代谢发生障碍、脂肪分解增加或糖尿病酸中毒的情况,还见于碳水化合物摄入不足或丢失,如饥饿、频繁呕吐、肾脏重吸收功能障碍、消化系统疾病等情况;本试验中,6和18g生药/kg/天剂量组动物的尿糖、血糖、血甘油三酯和胆固醇等糖和脂肪代谢指标、以及血尿素氮和肌酐、血清钠、钾和氯离子等与肾脏相关的指标均未见明显异常改变,组织病理镜下肾脏、胰腺以及胃肠等组织也未见明显异常改变,但动物给药期间可见唾液分泌过多、一过性肛周污秽、食量减少,综合分析认为尿酮体改变可能主要与给予供试品后动物食物摄入量减少有关。同时也提示临床上注意监测尿酮体改变。
81.发育毒性讨论
82.本药物以2、6、18g生药/kg/天的剂量重复灌胃给予幼年sd大鼠,每天给药1次,连续给药26周,恢复4周。给药后,所有剂量下动物生长发育指标包括身体发育指标、反射发育指标、身长、尾长和胫骨长度、行为发育指标 (自发活动试验中动物的总路程和活动次数、y迷宫试验中动物的自发交替率) 以及生殖相关指标(雄鼠精子计数和活力、精子形态学、雌鼠动情周期不规律率)均未见明显与供试品相关的异常改变。
83.给药后,6g生药/kg/天剂量下雌雄动物体重一过性增长缓慢(第1周)、单位时间生长速度一过性降低(d3)。以上单位时间生长速度和体重改变为给药后的短暂性、一过性改变,未见给药的时间相关性,认为对动物整体生长发育无明显影响。
84.综合本药物重复给予幼年大鼠的一般毒性和发育毒性,认为对幼年大鼠的生长发育没有影响,6和/或18g生药/kg/天剂量下可见唾液分泌过多、肛周污秽、尿酮体增加、部分或大部分时间点食量减少、但体重未见异常尿酮体增加, 2g生药/kg/天剂量下个别时间点食量减少、但体重未见异常,上述改变恢复期可恢复,因此,本试验条件下不良反应剂量(noael)为2g生药/kg/天。
85.结论:
86.在本试验条件下,本药物以2、6、18g生药/kg/天的剂量重复灌胃给予幼年sd大鼠,每天给药1次,连续给药26周,恢复4周。给药后,所有剂量下动物均未见明显与供试品相关的整体生长发育毒性;2g生药/kg/天剂量下个别时间点食量减少、但体重未见异常;6、18g生药/kg/天剂量下可见唾液分泌过多、肛周污秽、食量减少、尿酮体增加,食量减少、但体重
未见异常,上述改变恢复期可恢复。因此,认为本药物给予幼年sd大鼠的未见不良反应剂量 (noael)为2g生药/kg/天。
87.实施例5
88.本实施例的目的是评价实施例3的药物颗粒重复灌胃给予幼年sd大鼠 26周后可能出现的毒性反应(包括发育毒性)、靶器官以及停药后4周毒性反应的恢复情况,为供试品的临床研究提供动物试验资料。
89.方法:选用幼年sd大鼠(出生后14/15日龄,pnd14/15)240只,雌雄各半,按照窝别母鼠号采用excel软件随机分组,然后将每窝幼鼠分配至不同的试验终点。1~4组为主研究组,每组20只/性别,分别为溶媒对照组(灭菌注射用水)、低剂量组(2g生药/kg/天)、中剂量组(6g生药/kg/天)和高剂量组(18g生药/kg/天);5~8组为卫星组,用于行为学功能和动情周期的检查,组别和剂量同主研究组,每组10只/性别。灌胃给药,动物于pnd14/15 开始给药,每天给药1次,连续给药26周,共给药182次。给药容量为15ml/kg。试验期间,对动物进行临床观察、体重、摄食量、身体发育、身长、尾长、胫骨长度、反射发育、行为学发育、体温、血细胞计数、凝血功能、血液生化、尿液、t淋巴细胞亚群、眼科检查以及雄鼠精子计数和活力、精子形态学和雌鼠动情周期等指标的检查。给药13周结束(d92)、末次药后次日(d183) 和恢复期4周结束(d211),分别对1~4组前5只/性别/组、中间10只/性别/ 组和后5只/性别/组的动物实施安乐死,进行大体解剖观察,主要脏器称重,计算脏体比和脏脑比,并对40多种组织脏器进行组织病理学检查。
90.结果:浓度分别为0.133g生药/ml、0.4g生药/ml和1.2g生药/ml的药物颗粒混悬液在首次、第91次以及末次供试品配制完成后进行浓度分析和均一性分析。结果显示各浓度混悬液的实测浓度在理论浓度的88.42%~114.27%之间,上、中、下三层的变异系数(cv)为0.37%~9.47%,结果均在可接受范围内。溶媒对照品中未检测到供试品。
91.试验期间,2g生药/kg/天剂量组1只雌性动物于给药第52天发现死亡,此前临床观察和体重未见明显异常,由于大部分组织均被啃食,故不能通过病理组织学检查明确死亡原因。由于该只动物死亡发生在低剂量组,发生率较低 (1/60),其他各组均未见明显异常,病理组织学未见异常,也未见濒死或死亡情况,因此认为该动物死亡可能是偶发,与供试品不相关。
92.试验期间,各剂量组动物的体温、眼科检查、血细胞计数、凝血功能、血液生化、t淋巴细胞亚群、脏器重量、脏体比和脏脑比,以及给药13周结束 (d92)、给药26周后结束(d183)及4周恢复期结束(d211)大体观察和病理镜下均未见明显与供试品相关的异常改变。各剂量组动物生长发育指标包括身体发育指标、反射发育指标、身长、尾长和胫骨长度、行为发育指标(自发活动试验中动物的总路程和活动次数、y迷宫试验中动物的自发交替率)以及生殖相关指标(雄鼠精子计数和活力、精子形态学、雌鼠动情周期不规律率) 均未见明显与供试品相关的异常改变。
93.临床观察:2g生药/kg/天剂量组动物未见异常;6g生药/kg/天剂量组18/40 动物(8
♂
10
♀
)d9~d73期间唾液分泌过多、10/40动物(6
♂4♀
)d2~d3肛周污秽;18g生药/kg/天剂量组39/40动物(19
♂
20
♀
)d9~d166期间唾液分泌过多、2/40动物(1
♂1♀
)d2~d3肛周污秽。
94.体重和体重增长、单位时间生长速度、食量:2、18g生药/kg/天剂量组动物体重和
食量未见明显异常改变;6g生药/kg/天剂量组动物给药期间体重可见一过性增长缓慢(第1周),大部分时间点食量减少,分别减少10.2%-20.9% (雄性)和11.9%-25.7%(雌性),恢复期可恢复,食量改变可能与辅料有关。
95.尿液分析:第91天药前3天内(d90)和末次给药前3天内(d180),6、 18g生药/kg/天剂量组部分动物尿酮体和尿白细胞增加,恢复期尿酮体可恢复、尿白细胞可见恢复趋势。
96.结论:在本试验条件下,药物颗粒以2、6、18g生药/kg/天的剂量重复灌胃给予幼年sd大鼠,每天给药1次,连续给药26周,恢复28天。所有剂量下动物均未见明显与供试品相关的整体生长发育毒性;6g生药/kg/天剂量下动物食量减少,6、18g生药/kg/天剂量下尿酮体和尿白细胞增加,恢复期可恢复或见恢复趋势。因此,认为药物颗粒给予幼年sd大鼠的未见明显不良反应剂量(noael)为2g生药/kg/天。
97.实施例6
98.1.实验目的
99.评价实施例3的颗粒剂的药效作用。
100.2.实验原理
101.2,4-二硝基氟苯(dnfb)可与腹壁皮肤蛋白结合成完全抗原,由此刺激 t淋巴细胞增殖成致敏淋巴细胞。4~7天后再将其涂抹于耳部进行抗原攻击,使局部肿胀,一般在抗原攻击后24~48h达高峰,其肿胀程度可以反应映迟发型变态反应程度。
102.3.实验动物及饲养条件
103.3.1.实验动物
104.3.1.1.等级、种系:spf级balb/c小鼠。
105.3.1.2.动物管理:动物由取得实验动物管理资格认可的人员饲养管理。
106.3.1.3.购入时体重、数量、性别:体重16~18g,雄性,共24只,雄性。
107.3.1.4.繁育单位:广东省实验动物中心。
108.3.1.5.检疫过程:动物检疫观察5天。在此期间,观察动物的外观体征、行为活动、粪便性状、体重及饮食等指标。
109.3.1.6.动物标识方法:用饱和苦味酸溶液,在动物体表不同部位的被毛涂染斑点,以示不同号码。
110.3.2.饲养条件
111.3.2.1.饲养房间:中山大学肿瘤防治中心(实验动物中心)。
112.3.2.2.温、湿度:20~25℃;湿度:40%~70%
113.3.2.3.换气次数:大于10次/小时
114.3.2.4.饲养密度:6只/笼
115.3.2.5.照明时间:12小时(上午7:00开灯~下午7:00关灯)
116.3.3.饲料
117.3.3.1.种类:spf级大小鼠饲料
118.3.3.2.给料方法:自由摄取
119.3.3.3.饲料常规营养成分指标:经广东省实验动物监测所(参照中华人民共和国国家标准gb14924.3-2010)检测,检测频度:每年两次。
120.3.3.4.饲料的保存:保存在专门的饲料间里,保持通风、清洁、干燥
121.3.4.饮用水
122.3.4.1.饮用水种类:经121℃(1.0kg/cm2)、30min灭菌高质水,符合《饮用净水水质标准》(cj94-2005)。
123.3.4.2.给水方法:经动物饮用瓶自由摄取
124.3.5.动物尸体处理
125.动物尸体暂存于动物暂存间内的-20℃专用冰箱内,集中交给广东生活环境无害化处理中心进行无害化处理。
126.4.主要仪器及试剂
127.4.1.主要仪器
128.4.1.1.457a电子天平,深圳市安普特公司;
129.4.1.2.tle 104电子天平,梅特勒-托利多公司;
130.4.1.3.bc-5000vet全自动五分类血液细胞分析仪,深圳迈瑞公司;
131.4.1.4.mikro 200r低温高速离心机,德国hettich公司;
132.4.1.5.eclipse ti-s荧光倒置显微镜,日本nikon公司;
133.4.1.6.heracell 150i二氧化碳培养箱,美国thermo fisher公司;
134.4.1.7.epoch2微孔板分光光度计,美国biotek公司。
135.4.2.主要试剂
136.4.2.1.2,4-二硝基氟苯(dnfb),thermo fisher scientific公司。
137.5.实验方法
138.5.1.药物颗粒剂量及给药途径
139.药物颗粒规格为2g/袋,人日服用量按8g计,人体重按60kg计,经体表面积折算得小鼠口服剂量为1.6g/kg。为使实验结果显著,药物颗粒分别选择2 倍剂量和4倍剂量,即3.2g/kg和6.4g/kg进行实验。药物颗粒配制成混悬液灌胃给药,每天1次,给药体积为10.7ml/kg。
140.5.2.胸腺法新剂量及给药途径
141.胸腺法新人日用量为1.6mg,人体重按60kg计,经体表面积折算得小鼠剂量为0.32mg/kg。胸腺法新配制成注射液皮下注射给药,每天1次,给药体积为5ml/kg。
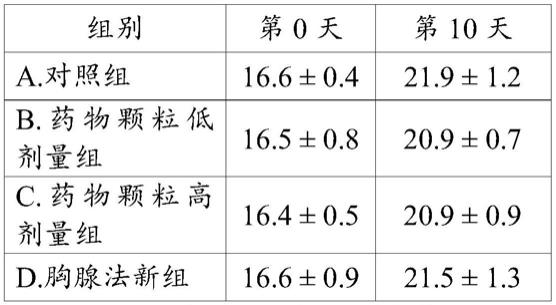
142.5.3.药物颗粒低剂量混悬液的配制
143.取药物颗粒(2g/袋)3袋,加入蒸馏水搅拌溶解,配制成20ml混悬液。
144.5.4.药物颗粒高剂量混悬液的配制
145.取药物颗粒(2g/袋)6袋,加入蒸馏水搅拌溶解,配制成20ml混悬液。
146.5.5.胸腺法新注射液的配制
147.往注射用胸腺法新瓶中加入1ml注射用水,混匀,得1.6mg/ml的母液,按100μl/管分装,-80℃保存。取100μl母液加入2.4ml生理盐水,混匀,得0.064mg/ml的胸腺法新注射液。
148.5.6.dnfb溶液的配制
149.称取2,4-二硝基氟苯(dnfb)50mg至10ml ep管中,再加入2.5ml 橄榄油和2.5ml丙酮,混匀。dnfb溶液每次使用前配制。
150.5.7.动物分组与给药
151.5天检疫期后将24只spf级balb/c小鼠按体重随机分为a.对照组,b. 药物颗粒低剂量组(3.2g/kg),c.药物颗粒高剂量组(6.4g/kg),d.胸腺法新组(0.32mg/kg),共4组,每组6只。各组每天按设计剂量给药1次,连续9d,对照组灌胃蒸馏水10.7ml/kg作对照。
152.5.8.一般状态观察及体重称量
153.每天观察小鼠饮食、大便、毛发、呼吸、精神状态等一般状态及行为表现。每10天称量体重1次。
154.5.9.dnfb诱发小鼠耳肿胀实验
155.给药第5d,剃去各组小鼠腹部范围约3cm
×
3cm的毛发,用dnfb溶液 50μl均匀涂抹致敏。第10d,用dnfb溶液均匀涂抹于小鼠右耳两面进行攻击,每面各涂抹10μl。攻击24h后,按10ml/kg腹腔注射4%水合氯醛溶液进行镇静,摘眼球取血1ml置于ep管中备用。颈椎脱臼处死小鼠,剪下左右耳。用打孔器取下耳朵中央直径6mm的耳片,称重。计算左右耳片重量之差。
156.5.10.胸腺指数和脾脏指数测定
157.第11d称量小鼠体重,进行5.9.项取材后分别取出胸腺及脾脏称重,计算脏器指数。脏器指数=脏器重量(g)/体重(100g)。
158.6.数据处理
159.实验数据由graphpad prism 8.0生物统计学软件进行统计学处理:实验数据以mean
±
sd表示,采用单因素方差分析结合dunnett’s多重比较法进行分析。
160.7.实验结果
161.7.1.一般状态观察及体重结果
162.dnfb致敏前各组动物的精神状态均良好、毛色光洁、活动自如、呼吸均匀、摄食、粪便未见明显异常、口鼻内无异常分泌物。第5d,dnfb致敏后各组动物活动减少。第6~10d多数动物腹部出现皮肤硬化和小面积的皮肤脱落。第10~11d,dnfb攻击后各组动物的右耳均逐渐变得红肿。如表1所示,实验期间各组间体重比较无显著差异(p》0.05)。
163.表1:受试样品对小鼠体重的影响(g,mean
±
sd,n=6)
[0164][0165]
注:各组间比较无显著差异。
[0166]
7.2.dnfb诱发小鼠耳肿胀实验结果
[0167]
如表2所示,各组别的左耳重量无显著差异(p》0.05);与对照组比较,药物颗粒高剂量组右耳片重量显著增加(p《0.05),药物颗粒低剂量组、高剂量组的左右耳片重量差均显著增加(p《0.05或p《0.01)。此结果提示,本发明的药物组合物具有增强免疫力的作用。
[0168]
表2:受试样品对小鼠胸腺指数和脾脏指数的影响(mean
±
sd,n=6)
[0169][0170]
注:与对照组比较,*:p《0.05,**:p《0.01。
[0171]
7.3.胸腺指数和脾脏指数结果
[0172]
如表3所示,各组间比较,胸腺系数无显著差异。与对照组比较,本发明的药物组合物高剂量组脾脏系数显著降低(p《0.05)。
[0173]
表3:受试样品对小鼠胸腺指数和脾脏指数的影响(mean
±
sd,n=6)
[0174]
组别胸腺指数脾脏指数a.对照组0.338
±
0.0440.578
±
0.070b.药物颗粒低剂量组0.354
±
0.0680.585
±
0.075c.药物颗粒高剂量组0.304
±
0.0550.478
±
0.026*d.胸腺法新组0.349
±
0.0250.538
±
0.071
[0175]
注:与对照组比较,*:p《0.05。
[0176]
实验讨论与结论分析
[0177]
dnfb诱发小鼠耳肿胀实验是最常用的免疫功能评价实验之一。2,4-二硝基氟苯(dnfb)可与腹壁皮肤蛋白结合成完全抗原,由此刺激t淋巴细胞增殖成致敏淋巴细胞。4~7天后再将其涂抹于耳部进行抗原攻击,使局部肿胀,一般在抗原攻击后24~48h达高峰,其肿胀程度可以反应映迟发型变态反应程度。脾脏是机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。胸腺也是与机体免疫力密切相关的重要淋巴器官,是t淋巴细胞分化、发育、成熟的场所,可分泌胸腺激素诱导造血干细胞发育为t淋巴细胞,具有增强细胞免疫功能和调节免疫平衡等作用。
[0178]
通过上述实验结果显示,本发明提供的药物组合物可增强dnfb诱导的小鼠迟发型变态反应,提示其具有增强免疫力的作用。
[0179]
以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1