BAG3抑制剂在制备治疗瘢痕产品中的用途
bag3抑制剂在制备治疗瘢痕产品中的用途
技术领域
1.本发明涉及医药领域,特别是涉及bag3抑制剂在制备治疗瘢痕产品中的用途。
背景技术:
2.增生性瘢痕是创伤/烧伤愈合后常见并发症,不仅影响患者容貌,且产生的挛缩可导致不同程度的功能障碍,如肌腱挛缩、关节脱位、运动功能障碍等,严重降低患者的生活质量,为后期治疗带来沉重经济和心理负担。据统计,烧伤后增生性瘢痕的发生率为91.4%,烧伤创面愈合时间若超过2周,增生性瘢痕发生率高达74.67%。瘢痕的防治研究是一个既古老又新颖的课题。研究发现瘢痕增生是人体对创伤的一种过度的愈合反应导致以成纤维细胞增殖失控和胶原等大量细胞外基质过度产生和沉积为特征的皮肤真皮层的纤维代谢性疾病,但其发病机制尚未完全阐明,因此目前其治疗仍是临床上颇为棘手的难题。
3.临床大量证据显示,增生性瘢痕常出现在身体皮肤张力较大的部位,如前胸,肩部,上臂外侧等。而头皮和小腿前部很少出现严重的瘢痕,这两个部位的特点是骨骼直接位于皮肤下,皮肤不容易受到张力的直接影响。有研究表明,张力可直接激活成纤维细胞中yap/taz信号通路,促进成纤维细胞活化。另有研究表明,力学刺激可通过活化离子通道piezo1诱导成纤维细胞活化,促进病理性瘢痕形成。同时,张力刺激亦可直接激活成纤维细胞中fak-erk-elk1信号通路促进促血管生成因子lrg-1表达,从而促进瘢痕增生。因此,局部皮肤张力是病理性瘢痕形成的重要因素,通过针对张力调控瘢痕形成的具体靶点对病理性瘢痕的防治具有重要价值。
4.bag3是一种抗凋亡和前自噬因子,可参与包括细胞自噬、泛素化降解、凋亡、细胞骨架重构等一系列细胞活动。作为一种力学敏感蛋白,bag3在张力对增生性瘢痕的调控中起着重要作用。在张力刺激下,bag3可与yap/taz结合,诱导分子伴侣介导的选择性自噬,从而促进成纤维细胞在高张力环境下的迁移和增殖能力。近期有研究发现,抑制bag3表达可以使细胞无法感受张力刺激,表明bag3在张力传导中起到重要作用。同时研究发现,bag3在囊性纤维化组织中表达增高,并通过促进自噬促进囊性纤维化进展。
5.目前病理性瘢痕的治疗和预防方法有多种,主要集中在上皮覆盖创面后,在瘢痕形成前和尚未成熟的阶段尽量去除各种造成瘢痕增生的因素,防止瘢痕对机体造成各种畸形和功能障碍。现有的预防和治疗病理性瘢痕方法的局限性主要有:1.手术治疗:治疗过程痛苦、复发率高且不适用于大面积瘢痕患者;2.压力治疗:对大面积烧伤患者效果较好,但患者需长期佩戴弹力加压装置,生活严重不便;3.放疗:治疗效果有限,且对患者全身和局部往往造成永久性放射性损伤;4.冷冻疗法:仅适用于面积较小的瘢痕,且治疗可引起皮肤色素加深、皮肤萎缩等并发症;5.糖皮质激素治疗:可产生皮肤萎缩、毛细血管扩张、骨质疏松、女性月经失调、注射部位溃烂或钙化等并发症;6.激光疗法:有效率较低,易诱发新的瘢痕;7.抗肿瘤药物治疗(5-fu等):对正常细胞同样具有较大毒性,且临床价值尚不确切;8.他克莫司、他汀类药物、他莫昔芬等药物:临床疗效有限,治疗靶点尚不确切。
技术实现要素:
6.鉴于以上所述现有技术的缺点,本发明的目的在于提供bag3抑制剂在制备治疗瘢痕产品中的用途,用于解决现有技术中的问题。
7.为实现上述目的及其他相关目的,本发明提供bag3基因作为靶标在制备瘢痕治疗或诊断药物中的用途。
8.本发明还提供bag3抑制剂在制备至少具备以下功效之一的产品中的用途:
9.预防或治疗瘢痕;
10.抑制皮肤成纤维细胞的增殖速率;
11.促进皮肤成纤维细胞凋亡。
12.本发明还提供一种用于预防或治疗瘢痕的药物组合物,其有效物质含有前述的bag3抑制剂以及药学上可接受的载体、稀释剂或赋形剂。
13.如上所述,本发明的bag3抑制剂在制备治疗瘢痕产品中的用途,具有以下有益效果:
14.(1)本发明涉及的药物相对于他克莫司、他汀类药物、他莫昔芬等药物而言,治疗靶点明确,规避了治疗机制不明、效率低、易引起副作用等缺点;相对于糖皮质激素类药物,规避了激素可能带来的一系列副作用;相对于抗肿瘤类药物和放射疗法,规避了损伤人体正常细胞的可能;相对于激光治疗,规避了治疗深度浅的缺点以及诱发新瘢痕形成的可能性;相对于手术治疗和冷冻疗法,可治疗大面积的病理性瘢痕,规避了治疗范围小这一缺陷;
15.(2)本发明涉及的药物相对于目前现行药物具有成本上的显著优势,合成成本较低。
附图说明
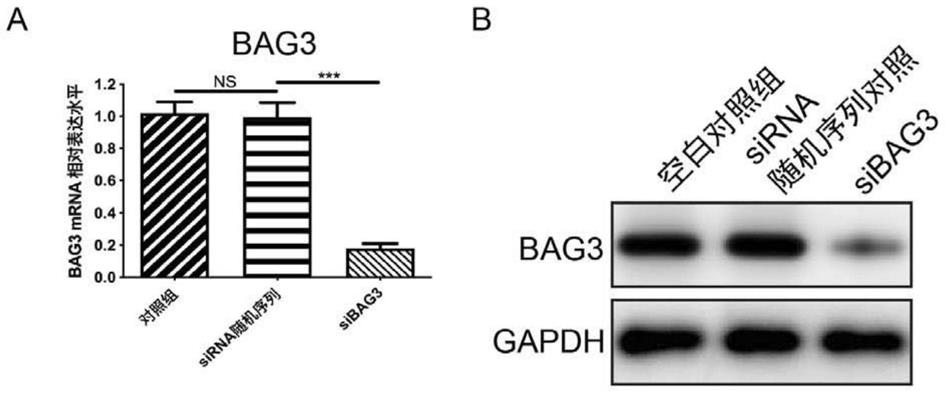
16.图1显示为人增生性瘢痕成纤维细胞中的bag3敲减后bag3 mrna的相对表达水平图(a)以及蛋白表达水平图(b)。
17.图2显示为敲减bag3后人增生性瘢痕成纤维细胞中瘢痕相关标记物col1a1、fibronectin与α-sma mrna的相对表达水平图(a)以及蛋白表达水平图(b)。
18.图3显示为敲减bag3后的人增生性瘢痕成纤维细胞的增殖能力图。
19.图4显示为小鼠增生性瘢痕模型的病理学改变。
20.图5显示为敲减bag3后小鼠体内瘢痕相关标记物col1a1、fibronectin与α-sma mrna的相对表达水平图(a)以及蛋白表达水平图(b)。
具体实施方式
21.本技术的发明人研究发现bag3基因在增生性瘢痕中的表达明显高于正常皮肤。基于此,本发明提供bag3基因作为靶标在制备瘢痕治疗或诊断药物中的用途。
22.本发明中,所述瘢痕选自表浅性瘢痕、挛缩性瘢痕、蹼状瘢痕、凹陷性瘢痕、萎缩性瘢痕、桥状瘢痕和赘状瘢痕、增生性瘢痕或瘢痕疙瘩中的任一种或多种。
23.优选的,所述瘢痕为增生性瘢痕。
24.增生性瘢痕是一种皮肤纤维化疾病,是以成纤维细胞增殖失控和胶原等大量细胞
外基质过度产生和沉积为特征的皮肤真皮层的纤维代谢性疾病。
25.所述人bag3基因作为靶标在制备瘢痕治疗药物具体是指:将bag3基因作为作用对象,对药物或制剂进行筛选,以找到可以抑制人bag3基因表达的药物作为瘢痕治疗备选药物。如本发明所述的bag3基因小分子干扰rna(sirna)即是以人bag3基因为作用对象筛选获得的,可用作具有抑制皮肤成纤维细胞增殖作用的药物。除此之外,诸如抗体药物,小分子药物等也可将bag3基因作为作用对象。
26.所述将人bag3基因作为靶标用于制备瘢痕诊断药物具体是指:将bag3基因表达产物作为一项瘢痕诊断指标应用于瘢痕诊断药物的制备。
27.所述瘢痕治疗药物为能够特异性抑制bag3基因的转录或翻译,或能够特异性抑制bag3蛋白的表达或活性的分子,从而降低皮肤成纤维细胞中bag3基因的表达水平,达到抑制皮肤成纤维细胞的增殖、生长、分化和/或存活的目的,最终抑制瘢痕形成。
28.所述通过bag3基因制备获得的瘢痕治疗药物或者瘢痕诊断药物包括但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或干扰慢病毒。
29.所述核酸包括但不限于:反义寡核苷酸、双链rna(dsrna)、核酶、核糖核酸内切酶iii制备的小干扰rna或者短发夹rna(shrna)。
30.所述瘢痕治疗药物的施用量为足够降低人bag3基因的转录或翻译,或者足够降低人bag3蛋白的表达或活性的剂量。以使人bag3基因的表达至少被降低50%、80%、90%、95%或99%。
31.采用前述瘢痕治疗药物治疗瘢痕的方法,主要是通过降低人bag3基因的表达水平抑制皮肤成纤维细胞的增殖来达到治疗的目的。具体的,治疗时,将能有效降低人bag3基因表达水平的物质给药于患者。
32.本发明还提供bag3抑制剂在制备至少具备以下功效之一的产品中的用途:
33.预防或治疗瘢痕;
34.抑制皮肤成纤维细胞的增殖速率;
35.促进皮肤成纤维细胞凋亡。
36.所述产品必然包括bag3抑制剂,并以bag3抑制剂作为前述功效的有效成分。
37.所述产品中,发挥前述功用的有效成分可仅为bag3抑制剂,亦可包含其他可起到前述功用的分子。
38.亦即,bag3抑制剂为所述产品的唯一有效成分或有效成分之一。
39.所述产品可以为单成分物质,亦可为多成分物质。
40.所述产品的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
41.所述产品主要针对的对象为哺乳动物。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。
42.所述产品包括但不限于药物、保健品等。
43.所述bag3抑制剂可以为核酸分子、抗体、小分子化合物。
44.如本发明实施例列举的,所述bag3抑制剂可以为降低皮肤成纤维细胞中bag3基因表达的核酸分子。具体的,可以是双链rna或shrna。
45.本发明还提供一种降低皮肤成纤维细胞中bag3基因表达的核酸分子,所述核酸分
子选自双链rna或shrna。
46.其中,所述双链rna中含有能够与bag3基因杂交的核苷酸序列;
47.所述shrna中含有能够与bag3基因杂交的核苷酸序列。
48.进一步的,所述双链rna包含第一链和第二链,所述第一链和所述第二链互补共同形成rna二聚体,并且所述第一链的序列与bag3基因中的靶序列基本相同。
49.所述bag3基因中的靶序列即为核酸分子用于特异性沉默bag3基因表达时,被所述核酸分子识别并沉默的mrna片段所对应的bag3基因中的片段。
50.进一步的,所述双链rna为小干扰rna(sirna)。
51.在一种实施方式中,针对人bag3的sirna序列为:
52.正义链:5
’‑
aac-agg-ugc-agu-uuc-ucg-aug-ggu-c-3’(seq id no.1)
53.反义链:5
’‑
gac-cca-ucg-aga-aac-ugc-acc-ugu-u-3’(seq id no.2)
54.在一种实施方式中,针对小鼠bag3的sirna序列为:
55.正义链:5
’‑
uga-agg-caa-gaa-gac-uga-uaa-3’(seq id no.3)
56.反义链:5
’‑
uua-uca-guc-uuc-uug-ccu-uca-3’(seq id no.4)
57.该sirna可以起到特异性沉默皮肤成纤维细胞中内源bag3基因表达的作用。
58.所述shrna包括正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述正义链片段的序列与bag3基因中的靶序列基本相同。
59.所述shrna经酶切加工后可成为小干扰rna(sirna)进而起到特异性沉默皮肤成纤维细胞中内源bag3基因表达的作用。
60.进一步的,所述shrna的茎环结构的序列可选自以下任一:uucaagaga、aug、ccc、uucg、ccacc、ctcgag、aagcuu和ccacacc。
61.进一步的,所述bag3基因来源于人或鼠。
62.所述shrna还可以制备为核酸构建体使用。所述核酸构建体例如为慢病毒载体、腺相关病毒载体。所述核酸构建体还可以进一步制备成慢病毒或腺相关病毒。
63.本发明还提供一种用于预防或治疗瘢痕的组合物,其有效物质含有前述的核酸分子以及药学上可接受的载体或辅料。
64.所述组合物可以为药物组合物。
[0065]“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
[0066]“药学上可接受的载体或辅料”应当与所述有效成分相容,即能与其共混而不会在通常情况下大幅度降低药物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
[0067]
在一些实施例中,所述载体选自组氨酸多肽、赖氨酸多肽、分支状的组氨酸-赖氨酸共聚物、硅纳米颗粒、脂质载体或病毒载体。
[0068]
在一较佳实施例中,所述载体为组氨酸-赖氨酸聚合物。
[0069]
当所述组合物用于预防或治疗瘢痕时,需要将有效剂量的所述的组合物施用于对象中。在一些实施例中,所述组合物的给药方式为局部注射或涂抹。采用该方法,所述皮肤成纤维细胞的生长、增殖、复发和/或转移被抑制,或消退已形成的瘢痕或减小已形成的瘢痕的体积。进一步的,所述皮肤成纤维细胞的生长、增殖、复发和/或转移的至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%的部分被抑制。
[0070]
所述组合物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
[0071]
所述组合物主要针对的对象为哺乳动物。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。
[0072]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0073]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0074]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0075]
以下实施例中用到的实验材料如下:
[0076]
1.sirna分子的序列如下:
[0077]
针对人bag3的sirna序列为:
[0078]
正义链:5
’‑
aac-agg-ugc-agu-uuc-ucg-aug-ggu-c-3’(seq id no.1)
[0079]
反义链:5
’‑
gac-cca-ucg-aga-aac-ugc-acc-ugu-u-3’(seq id no.2)
[0080]
针对小鼠bag3的sirna序列为:
[0081]
正义链:5
’‑
uga-agg-caa-gaa-gac-uga-uaa-3’(seq id no.3)
[0082]
反义链:5
’‑
uua-uca-guc-uuc-uug-ccu-uca-3’(seq id no.4)
[0083]
2.小核苷酸/组氨酸-赖氨酸聚合物(hkp)纳米颗粒溶液配制方法
[0084]
已用作sirna转染载体的组氨酸-赖氨酸聚合物(hkp)具有赖氨酸骨架,该赖氨酸骨架包括含有多重组氨酸、赖氨酸或天冬氨酸的支链。将hkp(购自苏州圣诺生物有限公司)溶于depc水制成depc水溶液,然后以质量比为4:1、体积比为1:1与sirna(购自苏州圣诺生物有限公司)水溶液混合,形成平均直径为150-200nm的纳米颗粒。hkp-sirna水溶液为半透
明状,没有明显的沉淀物聚集,可以在4℃下储存至少三个月。
[0085]
3.小核苷酸针剂配制方法
[0086]
体内实验小核苷酸针剂的配制:用depc-5%葡萄糖溶液溶解经过sirna(锐博生物科技有限公司合成)和hkp,分别制成sirna水溶液和hkp水溶液,然后以质量比为4:1、体积比为1:1与sirna水溶液混合,形成平均直径为150-200nm的纳米颗粒。hkp-sirna水溶液为半透明状,没有明显的沉淀物聚集,可以在4℃下储存至少三个月。
[0087]
实验方法
[0088]
1.人瘢痕来源成纤维细胞的提取和培养
[0089]
取人增生性瘢痕临床标本(病人已签署知情同意书),用dispase ii(2mg/ml,lifetechnologies,thermofisher)4℃浸泡过夜。无菌环境中切碎组织,浸泡于4mg/ml ii型胶原蛋白水解酶(sigma-aldrich,burlington,ma,usa)中,37℃摇床消化2-4小时。70μm细胞滤网(falcon,corning,new york,usa)过滤,1000rpm离心5min,去上清,含10%胎牛血清的高糖dmem培养基(gibco,thermo,rockford,il,usa)重悬细胞沉淀,接种至培养皿中,每2天换液一次。
[0090]
2.小鼠增生性瘢痕模型建立
[0091]
小鼠增生性瘢痕模型参考geoffrey c gurtner,faseb j,2007(doi:10.1096):将12周龄的c57/bl6小鼠麻醉,背部备皮,后正中线做一长约2cm的皮肤全层切口,并用无菌丝线缝合。伤口愈合后,将机械拉伸装置缝合于切口两侧,通过调整螺丝旋钮,对切口的瘢痕产生机械负荷,隔天维持4mm的拉力并保持伸展。2周后处死小鼠取材。
[0092]
3.小核苷酸针剂注射
[0093]
小鼠造模当天,即开始小核苷酸针剂皮内注射。小鼠随机分为对照组(溶剂对照)、sinc空载组和sibag3给药组。每只小鼠8个注射点,每点50μl,每3天注射一次,直至处死取材。sibag3给药组注射针剂中sibag3终浓度为200μg/ml。
[0094]
4.体外培养细胞的sirna转染
[0095]
待细胞密度至约70%时换液,加入hkp-sirna水溶液。分为对照组(溶剂对照)、sinc空载组和sibag3给药组。培养液中sirna终浓度为50nm,培养24h后进行后续检测。
[0096]
5.实时荧光定量pcr
[0097]
用trizol(invitrogen,grand island,ny,usa)分离和纯化rna,nanodrop 2000超微量分光光度计(thermo,rockford,il,usa)对rna浓度和纯度进行测量。用rt-pcr试剂盒(takara,shiga,japan)及abi ht7900 pcr仪(applied biosystems,foster city,ca,usa)对提取的总rna进行逆转录反应。以上述逆转录产物为模板,使用light cycler 480ii实时荧光定量pcr仪(roche,basel,switzerland)进行实时荧光定量pcr反应。
[0098]
6.edu细胞增殖能力检测
[0099]
对于体外培养的细胞,使用click-it edu(5-ethynyl-2
′‑
deoxyuridine)alexa fluor 488imaging试剂盒(invitrogen,carlsbad,ca,u.s.a.)对细胞的增殖活性进行检测。荧光分析使用蔡司510激光扫描显微镜(zeiss,thornwood,ny,u.s.a.)。
[0100]
7.组织切片及masson染色
[0101]
取材后4%多聚甲醛固定,乙醇脱水,二甲苯透明,浸蜡,包埋,5μm切片,烘片。
[0102]
masson染色:
[0103]
(1)切片用masson酸性复红染液染色5-10min;
[0104]
(2)以0.2%醋酸水溶液浸洗片刻;
[0105]
(3)1%磷钼酸溶液分化3-5min;
[0106]
(4)不经水洗,直接用苯胺蓝染液染色8min;
[0107]
(5)以0.2%醋酸水溶液浸洗片刻,自来水涮洗。
[0108]
染色结果:胶原纤维呈蓝色,胞浆、肌肉、纤维素、神经胶质呈红色,胞核黑蓝色。
[0109]
8.细胞总蛋白提取及定量:
[0110]
使用ripa(thermo,rockford,il,usa)裂解缓冲液(加入pmsf蛋白酶抑制剂,thermo,rockford,il,usa)提取细胞总蛋白,12000rpm 4℃离心20min,取上清。取10μl蛋白溶液,pierce
tm bca蛋白定量试剂盒(thermo,rockford,il,usa)及200pro酶标仪(tecan,switzerland)测定562nm吸光度,计算蛋白浓度。
[0111]
9.western blot
[0112]
往蛋白溶液中加入5x sds-page样品上样缓冲液(thermo,rockford,il,usa),650rpm 98℃金属浴15min。配制10%聚丙烯酰胺凝胶,浸泡于迁移缓冲液中。根据蛋白浓度,加入含20μg总蛋白的蛋白溶液及5μl分子量标志物(thermo,rockford,il,usa)。使用bio-raid powerpac
tm
电泳仪电源及电泳槽(bio-raid,wuhan,china)80v电泳45min,120v电泳60min。裁取整块分离胶,相应大小的nc膜(ge healthcare,buckinghamshire,hp79na,uk),300ma湿转120min。5%脱脂牛奶(0.1%tbst配制)室温封闭1h;0.1%tbst清洗3次,每次5min;一抗(abcam,cambridge,uk)4℃摇床孵育过夜;0.1%tbst清洗3次,每次5min;二抗(abcam,cambridge,uk)室温孵育1h;0.1%tbst清洗3次,每次5min。高敏型ecl化学发光检测试剂盒(vazyme,nanjing,china)和tanon全自动化学发光/荧光图像分析系统(tanon,shanghai,china)显影。
[0113]
实验结果
[0114]
1.采用小核苷酸干扰技术敲减bag3可抑制人增生性瘢痕成纤维细胞中瘢痕相关标记物的表达
[0115]
分离并培养人增生性瘢痕成纤维细胞。采用rnai技术对人增生性瘢痕成纤维细胞中的bag3进行敲减(参见图1所示),并采用实时定量pcr(q-pcr)对瘢痕相关标记物col1a1、fibronectin与α-sma的基因表达水平(mrna)进行检测;采用western blot对瘢痕相关标记物col1a1、fibronectin与α-sma的蛋白水平进行检测;结果显示,敲减bag3可显著降低瘢痕相关标记物col1a1、fibronectin与α-sma的表达(参见图2所示)。
[0116]
2.针对人bag3的小核苷酸干扰可抑制人增生性瘢痕成纤维细胞的增殖能力
[0117]
分离并培养人增生性瘢痕成纤维细胞,用小核苷酸对bag3的表达进行干扰,采用edu法对人增生性瘢痕成纤维细胞的增殖活性进行检测。结果显示,敲减bag3后的细胞,其增殖活性在干预后显著低于对照组。(参见图3所示)。
[0118]
3.针对小鼠bag3的小核苷酸干扰可抑制小鼠增生性瘢痕形成
[0119]
建立经典的小鼠增生性瘢痕模型,来模拟人增生性瘢痕的病理学改变(参见图4所示)。对取材后的小鼠瘢痕进行了masson染色。结果显示,干预bag3后,皮肤增生性瘢痕的横截面积显著降低(p<0.001),小鼠增生性瘢痕被抑制。
[0120]
4.针对小bag3的小核苷酸干扰可抑制小鼠皮肤瘢痕相关标记物的表达
[0121]
用小核苷酸对小鼠模型中bag3的表达进行干扰,将所得皮肤样本进行q-pcr检测和western blot检测。结果显示,对bag3进行干扰,可显著降低瘢痕相关标记物col1a1、fibronectin与α-sma在mrna和蛋白层面上的表达(p<0.001)(参见图5所示)。
[0122]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1