诱导Goodpasture综合征粘膜耐受的口服药物
诱导goodpasture综合征粘膜耐受的口服药物
技术领域
1.本发明涉及生物医药领域,具体涉及口服pcol28-40肽在诱导新生儿goodpasture综合征免疫耐受中的应用。
背景技术:
2.goodpasture综合征(gs)是一种罕见疾病,年发病率为每百万人1例。在大约20%的快速进展性或新月体肾小球肾炎病例中,它是导致急性肾功能衰竭的原因。gs是一种器官特异性自身免疫病,其特征是循环和沉积的抗肾小球基底膜抗体伴有局灶性坏死伴有新月体形成的肾小球肾炎。以免疫抑制剂为基础的标准疗法是大剂量皮质类固醇和环磷酰胺,它们具有很强的副作用。
3.大量使用人抗肾小球基底膜(抗gbm)抗体的研究表明,iv型胶原α3链(col4a3nc1)的非胶原结构域1为goodpasture抗原;在实验性自身免疫性肾小球肾炎(eag)的动物模型建立中使用col4a3nc1作为抗原进行免疫正支持了上述观点。在jean wu的一系列研究中,定位了肾炎的t细胞表位col4a3nc1,并鉴定了一种有效的肾炎抗原pcol28-40(sqttanpscpegt)。pcol28-40在所有免疫的wky大鼠中诱导严重的肾小球肾炎,并在76%的免疫大鼠中引发自身抗体。
4.粘膜耐受可通过自身抗原的粘膜给药诱导,已在涉及自身免疫性疾病的实验性啮齿动物模型的研究中得到广泛报道,包括格雷夫病、葡萄膜炎、胶原蛋白诱导的关节炎、糖尿病和系统性红斑狼疮(sle)。john reynolds及其同事对eag的粘膜耐受性进行了一系列研究。这些研究揭示了在口服或鼻腔给药的gbm预免疫大鼠制备eag中呈现剂量依赖性抑制作用。gbm(肾小球基底膜)预处理通过下调th1反应延迟了eag的发作并降低了eag的严重程度。此外,他们验证了鼻腔给药pcol24-38(一种来自col4a3nc1的免疫优势肽,可诱发新月体肾炎)对已建立的eag的抑制作用,并观察到剂量依赖性效应。综上所述,这些研究结果表明,增强粘膜耐受性是预防eag发生的有效方法。
5.然而,上述研究均未验证在新生儿期进行自身抗原处理的效果,而在此期间免疫系统特别容易产生耐受性。此外,人们普遍认为,新生儿耐受性在提供长期保护以防止自身免疫性疾病的发展方面具有更大的潜力。另外,由于口服疗法比静脉或皮下注射更容易给药,患者依从性更好。因此,本领域迫切获得一种在新生儿期通过口服给药自身抗原建立goodpasture综合征免疫耐受的方法。
技术实现要素:
6.基于现有技术存在的缺陷,本发明通过对新生期wky大鼠进行pcol28-40肽灌胃,研究以不同剂量和频率施用pcol28-40对goodpasture综合征的粘膜耐受的诱导的效果,发现在新生儿阶段一次性口服适当剂量的pcol28-40抗原可诱导粘膜耐受,这为goodpasture综合征的预防和治疗提供了新的思路。
7.本发明第一方面提供了pcol28-40肽在制备预防goodpasture综合征口服药物中
的应用。
8.进一步地,所述pcol28-40肽的序列sqttanpscpedt。
9.进一步地,所述预防为诱导免疫耐受。
10.进一步地,所述诱导免疫耐受为诱导粘膜免疫耐受。
11.进一步地,所述诱导免疫耐受发生在新生期。
12.进一步地,所述新生期为出生后24小时内。
13.进一步地,所述goodpasture综合征为肾小球肾炎,优选为抗肾小球基底膜(抗一gbm)肾炎。
14.本发明第二方面提供了预防goodpasture综合征的口服药物组合物,所述组合物的主要活性成分为pcol28-40肽。
15.进一步地,所述口服药物组合物包括免疫佐剂。
16.进一步地,所述免疫佐剂为弗氏完全佐剂(fca)。
17.进一步地,所述goodpasture综合征为肾小球肾炎,优选为抗肾小球基底膜(抗-gbm)肾炎
18.本发明第三方面提供了一种通过口服pcol28-40肽建立goodpasture综合征粘膜耐受动物模型的方法,其特征在于,包括如下步骤:在动物出生后的24小时内,一次性口服给药pcol28-40抗原。
19.进一步地,所述动物为大鼠。
20.进一步地,所述大鼠为wky大鼠。
21.进一步地,所述wky大鼠为8~10周龄、体重160~200g。
22.进一步地,所述给药剂量为100μg。
23.进一步地,所述goodpasture综合征为肾小球肾炎,优选为抗肾小球基底膜(抗-gbm)肾炎。
24.本发明第四方面提供了第三方面方法获得的动物模型在goodpasture综合征药物筛选,发病机理研究中的应用。
25.本发明第五方面提供了一种给药装置,包括本发明第二方面所述的药物组合物,所述给药装置用于所述药物组合物的施用。
26.本发明第六方面提供了一种建立goodpasture综合征粘膜免疫耐受的方法,其特征在于,包括在新生期一次性口服pcol28-40肽的步骤。
27.本发明相对于现有技术具有以下技术效果:
28.1)本发明首次报道了新生儿阶段口服抗原pcol28-40肽的粘膜免疫耐受的作用。
29.2)本发明通过口服给药方式建立免疫耐受,相对于静脉或皮下注射更容易给药,患者依从性更好。
30.3)本发明验证了免疫前通过管饲法以不同剂量和频率施用pcol28-40的效果,结果发现在新生儿阶段一次性口服适当剂量的pcol28-40抗原可有效诱导粘膜耐受。
31.4)本发明发现在wky大鼠新生24小时内一次性口服总剂量100μg pcol28-40肽导致循环抗pcol28-40抗体数量、蛋白尿和肾炎严重程度显着降低,脾脏t细胞的体外增殖反应显着降低。此外,一次给予100μg pcol28-40的大鼠表现出cd4
+
cd25
+
foxp3
+
调节(treg)细胞和相关细胞因子il-10和tgf-β的表达上调。
32.5)本发明为goodpasture综合征、肾小球肾炎、抗肾小球基底膜(抗-gbm)肾炎的预防和治疗提供新的思路和有效的依据。
附图说明
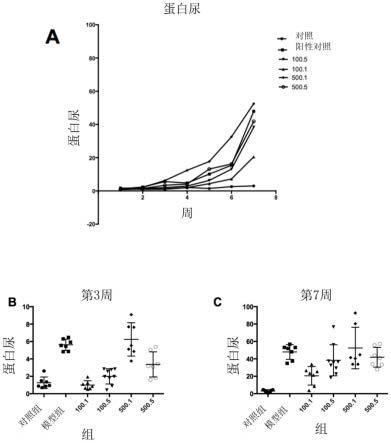
33.图1:pcol28-40口服给药对wky大鼠(n=7-9)蛋白尿的影响。所显示的结果代表了每个组的平均值。(a)各组尿蛋白水平随时间变化情况;(b)pcol28-40免疫后第3周尿蛋白水平;(c)pcol28-40免疫后第7周尿蛋白水平。
34.图2:pcol28-40对wky大鼠(n=7-9)肾脏病理改变的影响。(a)肾脏切片he染色的典型显微照片。(b)肾小球病变的严重程度,分为正常、轻度、中度和重度。
35.图3:pcol28-40口服给药对不同组wky大鼠循环中抗pcol28-40抗体的影响。结果表明,免疫后第7周各组的平均标准偏差;**,p《0.01(阳性对照与100.1对照)。
36.图4:pcol28-40口服给药对不同组别wky大鼠脾脏t细胞体外增殖的影响。结果显示,免疫后第7周各组的平均标准偏差;**,p《0.01(阳性对照与100.1对照)。
37.图5:pcol28-40口服给药对不同组大鼠cd4
+
cd25
+
foxp3
+
细胞百分比的影响。结果显示,免疫后第7周各组的平均标准偏差;**,p《0.01(阳性对照与100.1对照)。
38.图6:pcol28-40口服给药对不同组大鼠cd4
+
cd25
+
foxp3
+
细胞相关细胞因子的影响。(a)tgf-beta1;(b)il-10.结果显示,免疫后第7周各组的平均标准偏差p《0.05(阳性对照与100.1对照);**,p《0.01(阳性对照与100.1对照)。
具体实施方式
39.为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式并参照附图,对本发明进一步详细说明。应该理解,这些描述只是示例性的,而并非要限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。
40.实施例1实验动物的培育
41.实验动物为8~10周龄、体重160~200g的wky大鼠,购自vital river实验动物中心(中国北京)。所有动物都饲养在标准条件下,可以自由获得标准实验室饮食和水。对于新生大鼠的传代,通过将一只成年雄性和两只雌性关在一起来建立繁殖集。当怀孕明显时,雌性被分开并单独关在笼子里。后代在达到3周龄时断奶。所有实验程序均按照机构动物护理委员会的指导方针进行。
42.实施例2 gbm抗原的制备
43.t细胞表位肽pcol28-40使用f-moc化学技术在自动肽合成仪(life technologies invitrogen,美国)上合成,随后在制备型hplc上通过反相c18柱纯化。纯化的肽通过hplc分析纯度,并通过质谱分析确定正确序列。纯度超过95%的肽溶解在milli-q水(millipore,billerica,ma)中至1mm浓度,用于免疫或其他研究目的。
44.实施例3新生期给药和成年期免疫
45.使用两种不同的方案进行给药:对1日龄新生雌性大鼠给药a)单剂量100μg(100.1)或500μg(500.1)pcol28
–
40溶于100μl磷酸盐缓冲盐水(pbs)或b)连续5天给药5次,相当于总体积为500μl磷酸盐缓冲盐水(pbs)的pcol28
–
40总剂量为100μg(100.5)或500μg
(500.5)。通过以相同方式施用等体积的pbs来建立对照组。所有给药均通过用1毫升体积的球型喂食针管饲法进行。在4周龄时,通过在一个后足垫和尾巴根部注射在等体积cfa(完全弗氏佐剂)中乳化的pcol28-40(0.125μmol)对大鼠进行免疫。在第一次免疫后2周,对所有大鼠在另一后足垫和尾巴末端用第一次免疫中所用肽剂量的一半进行加强免疫。仅注射cfa的大鼠作为对照。
46.实施例4 gn评估
47.通过蛋白尿和肾脏组织病理学评估gn(肾炎)的严重程度。将动物放入代谢笼中后,获得在24小时内收集的尿液样本,动物可以自由饮水。每周由西安交通大学第一附属医院检测尿蛋白。第一次免疫后7周处死实验动物。固定在bouin溶液中的肾组织用于h&e染色。计数有新月体病变、细胞增多或无损伤的肾小球,计算肾小球损伤评分:((新月体肾小球数
×
100)+(多细胞肾小球数
×
50))/总肾小球数。应用以下量表:0=正常形态,肾小球损伤评分≤25%;1=肾小球基底轻度扩张,肾小球损伤评分25%-50%;2=中度肾小球肾炎和系膜细胞增生或节段性坏死,肾小球损伤评分50%-75%;3=重度肾小球肾炎伴广泛新月体病变和严重肾小管萎缩,肾小球损伤评分≥75%。
48.蛋白尿水平如附图1所述,可见,蛋白尿在阳性对照、500.1和500.5组3周时首次出现,500.1组在4周时变得严重。然而,在阳性对照组中,严重蛋白尿在第5周出现并持续到第7周。与人类goodpasture综合征的进展一致,早期蛋白尿发展缓慢,晚期(约5周)突然发展为重度蛋白尿,迅速导致死亡。100.1和100.5组起病较其他组晚,100.1组末期蛋白尿不是很严重。
49.肾脏组织病理学结果如图2所示:7周肾组织光镜显示,阳性对照组和500.5组动物出现弥漫性坏死性肾小球肾炎,影响约100%肾小球,重度节段性坏死/新月体形成(>50%肾小球)影响75%肾小球.除了新月体形成之外,还观察到严重的肾小管萎缩、填充肾小管的蛋白质管型的存在以及炎症细胞对肾间质的浸润。100.5和500.5组的动物也表现出影响约75%肾小球的肾小球肾炎,约50%的肾小球出现严重变化。相比之下,100.1组的动物在不到50%的肾小球中表现出肾小球肾炎,并且没有节段性坏死或新月体形成的组织学证据。单独施用fca的阴性对照动物显示正常的肾组织学。
50.实施例5抗体活性检测
51.使用elisa检测对抗原肽的抗体。简而言之,用含10μm肽的碳酸盐缓冲液(ph 9.5)包被板子。将稀释的血清(1:20)加入到每个孔中,一式两份。使用3,3',5,5-四甲基联苯胺(tmb;sigma,usa)作为底物,通过hrp标记的山羊抗大鼠igg(1:2000;bioss,china)检测结合的大鼠igg abs。在elisa读数器(titertek multiskan,美国)上在450nm处读取板。
52.循环抗gbm抗体的检测结果如附图3所示。可以看出,到第7周,所有阳性对照大鼠都具有高水平的循环抗gbm抗体。pcol28-40的口服给药对循环抗体水平具有剂量特异性影响。500.1组大鼠的水平与阳性对照组相似;100.5和500.5组的水平略低于对照组,但差异不显著。在100.1组中观察到抗体浓度显著降低。单独注射fca的阴性对照动物没有产生循环抗体。
53.实施例6淋巴细胞增殖试验
54.根据制造商的说明,使用cck-8试剂盒(dojindo,日本)进行淋巴细胞增殖测定。简而言之,从免疫的大鼠制备淋巴细胞并在96孔板中以1
×
106个细胞/孔在200μl rpmi1640
培养基中培养。将pcol28-40(10μm)一式三份加入每个孔中,并使用丝裂原伴刀豆球蛋白a(2.5μg/ml;sigma)作为阳性对照。将细胞在37℃下在湿润的5%co2环境中孵育48小时,然后用cck-8(100μl/孔)脉冲处理3小时。然后在elisa读数器(titertek multiskan,美国)上读取板在450nm处的吸光度。结果表示为od值(含抗原的平均三次od减去不含抗原的平均三次cpm)。
55.淋巴细胞增殖实验结果如图4所示,可以看出,来自施用pcol28-40和fca的动物的脾细胞显示出显著的t细胞增殖反应,无论它们是否与浓度为10μm的pcol28-40一起在体外培养2天(光密度:对照0.5vs.pcol28-40免疫1.2)。然而,在用pcol28-40培养的脾细胞和不用它培养的脾细胞之间观察到一些差异。与没有pcol28-40一起培养时,阳性对照组动物的脾细胞显示出更强的增殖反应,而在对照组中,无论有无pcol28-40培养物,脾细胞均未表现出增殖反应。与来自对照组的细胞相似,来自动物的脾细胞以100μg口服给药一次pcol28-40,对pcol28-40没有表现出抑制反应或表现出轻微的抑制反应。相比之下,一次给予500μg pcol28-40的动物的脾细胞显示出比阳性对照细胞更强的增殖反应,尽管差异不显著。
56.实施例7流式细胞分析cd4
+
cd25
+
细胞上foxp3的表达
57.如先前报道的那样分离脾细胞。然后,根据以下方案预处理细胞:将细胞以1
×
107/ml的终浓度悬浮在流式细胞术染色缓冲液(ebioscience,usa)中。根据制造商的说明,使用小鼠/大鼠调节性t细胞染色试剂盒(ebioscience,美国)检测cd4+cd25+t细胞上的foxp3表达。简而言之,如上所示制备的大鼠脾细胞用抗大鼠cd4 fitc和抗大鼠cd25 apc进行表面标记。固定和透化后,根据制造商的说明,用抗大鼠foxp3 pe或匹配的同种型对照对细胞进行染色。使用配备有cell quest软件的facscan(becton dickinson)进行三色流式细胞术分析。
58.流式细胞分析了cd4+cd25+细胞上foxp3的表达的结果附图5所示。对照组的动物和阳性对照组的动物之间没有差异。然而,一次性口服100μg pcol28-40显著上调foxp3表达。
59.实施例8 elisa检测细胞因子il-10和tgf-β水平
60.通过il-10elisa试剂盒(raybio,美国)和tgf-βelisa试剂盒(ebioscience,usa)测定大鼠血清中il-10和tgf-β的水平,这两种主要细胞因子促进treg启动。简而言之,处死大鼠后获得大鼠血清,并按照制造商的说明通过特定的固相夹心酶免疫分析法分析细胞因子浓度。
61.结果如附图6所示,pcol28-40溶解在fca中免疫大鼠导致il-10和tgf-β表达高度下调,与阳性组相比,一次性口服100μg pcol28-40增加il-10和tgf-β的表达,与对照组相比,p《0.05。
62.结果表明大鼠eag模型中的pcol28-40预处理增强了treg功能,并且il-10和tgf-β表达可能参与了这种增强。
63.应当理解的是,本发明的上述具体实施方式仅仅用于示例性说明或解释本发明的原理,而不构成对本发明的限制。因此,在不偏离本发明的精神和范围的情况下所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。此外,本发明所附权利要求旨在涵盖落入所附权利要求范围和边界、或者这种范围和边界的等同形式内的全部变化和修
改例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1