一种双靶向功能的LDL-MLN纳米药物及其应用
一种双靶向功能的ldl-mln纳米药物及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种双靶向功能的ldl-mln纳米药物及其应用。
背景技术:
2.原发性骨髓纤维化(pmf)是由异常造血细胞增生,过度分泌细胞因子导致造血组织胶原增生从而引起的骨髓增殖性肿瘤(mpn)。其中位生存期为5年,并且有20%转化为急性髓系白血病的可能。
3.研究表明,骨髓增殖性肿瘤(mpn)患者体内存在大量未成熟的巨核细胞,该类巨核细胞中蛋白激酶aurora kinase a(aurka)的活性升高,靶向aurka的小分子抑制剂mln8237能够有效抑制异常巨核细胞的增殖,诱导细胞的分化和凋亡。随后,小分子抑制剂mln8237进入临床一期实验,单独mln8237作用于骨髓增殖性肿瘤患者,但仅1/3患者在经历全程治疗后有较好的疾病负担减轻现象,其治疗效果仍有待于进一步提高。
4.低密度脂蛋白(low density lipoprotein,ldl)是一种体内存在的天然载脂蛋白,主要在血液循环中承担运输胆固醇的作用。ldl主体结构为外层磷脂单分子层,胆固醇则存在于疏水核心中。在ldl表面还有一个载脂蛋白apob-100,这一蛋白能有效识别细胞膜上的ldl受体。ldl通过apob-100与细胞表面ldl受体结合进入细胞,在胞内经过溶酶体的降解释放出疏水核心中胆固醇用于细胞的生命活动。
技术实现要素:
5.本发明的目的是提供一种双靶向功能的ldl-mln纳米药物及其应用。
6.为了实现上述目的,本发明首先提供了双靶向功能的ldl-mln纳米药物的新用途。
7.本发明提供了ldl-mln纳米药物在如下1)-8)中任一种中的应用:
8.1)制备预防和/或治疗骨髓增殖性肿瘤的产品;
9.2)预防和/或治疗骨髓增殖性肿瘤;
10.3)制备预防和/或治疗原发性骨髓纤维化的产品;
11.4)预防和/或治疗原发性骨髓纤维化;
12.5)制备预防和/或治疗急性髓系白血病的产品;
13.6)预防和/或治疗急性髓系白血病;
14.7)制备抑制肿瘤细胞增殖和/或促进肿瘤细胞分化与凋亡的产品;
15.8)抑制肿瘤细胞增殖和/或促进肿瘤细胞分化与凋亡;
16.所述ldl-mln纳米药物是以ldl颗粒作为药物载体,将小分子抑制剂mln8237进行包埋后得到的。
17.上述应用中,所述ldl颗粒和所述mln8237的质量比可为1:(0.02-0.03),具体可为1:0.025。
18.进一步的,所述ldl-mln纳米药物的制备方法包括如下步骤:
19.1)将ldl颗粒与马铃薯淀粉混合,然后冷冻干燥,得到ldl-淀粉混合物;
20.2)完成步骤1)后,用庚烷从所述ldl-淀粉混合物中提取内源性脂质,得到提取后产物,然后将mln溶液与所述提取后产物混合,孵育,得到ldl-mln混合物;
21.所述mln溶液由甲苯、mln8237、月桂酸和硬脂酸组成。
22.更进一步的,所述1)中,所述ldl颗粒与所述马铃薯淀粉的配比可为1:(10-15),具体可为1:12.5。
23.所述2)中,所述mln溶液的溶剂为甲苯,溶质及其浓度分别为mln8237 0.25mg/ml,月桂酸8mg/ml,硬脂酸2mg/ml。
24.用庚烷从所述ldl-淀粉混合物中提取内源性脂质的次数至少为3次,优选3次。
25.所述孵育后还包括在冰浴、氩气条件下去除甲苯的步骤。
26.所述方法还包括纯化的步骤。所述纯化的方法可包括如下步骤:将所述ldl-mln混合物分散在缓冲液中,离心,收集上清液,然后将所述上清液进行过滤。具体可包括如下步骤:将所述ldl-mln混合物分散在tricine缓冲液(10mm,ph=8.4)中,在4℃条件下放置18小时;然后2000rpm离心10分钟,收集初始清液;再将所述初始清液进行两轮10000rpm离心10分钟,收集上清液;最后将所述上清液通过0.22μm无菌过滤器进行过滤。
27.上述ldl-mln纳米药物也属于本发明的保护范围。
28.为了实现上述目的,本发明还提供了一种产品;所述产品的功能为如下a-d中任一种:
29.a、预防和/或治疗骨髓增殖性肿瘤;
30.b、预防和/或治疗原发性骨髓纤维化;
31.c、预防和/或治疗急性髓系白血病;
32.d、抑制肿瘤细胞增殖和/或促进肿瘤细胞分化与凋亡。
33.本发明提供的产品的活性成分为上述ldl-mln纳米药物。
34.上述任一所述应用或产品中,所述肿瘤细胞可为巨核细胞异常导致的肿瘤细胞。
35.进一步的,所述巨核细胞异常导致的肿瘤细胞可为骨髓增殖性肿瘤细胞或急性髓系白血病细胞。
36.更进一步的,所述骨髓增殖性肿瘤细胞具体可为mpn原代细胞,所述急性髓系白血病细胞具体可为hel细胞。
37.ldl颗粒或ldl蛋白在作为针对异常巨核细胞的药物运输载体中的应用也属于本发明的保护范围。
38.本发明为了提高小分子抑制剂mln8237的治疗效果,将ldl蛋白作为小分子抑制剂mln8237的药物载体,设计了一种新型双靶向功能的ldl包埋mln8237的纳米药物ldl-mln,以进一步提高对于异常巨核细胞的靶向性。进一步的,通过将ldl-mln纳米药物分别应用于体外和体内实验,检测了ldl-mln纳米药物处理后异常巨核细胞的增殖、分化和凋亡水平的变化。结果表明:ldl-mln纳米药物可有效抑制hel细胞和mpn原代细胞增殖、促进hel细胞和mpn原代细胞分化和凋亡、减少pmf小鼠的疾病负担,且具有很好的安全性。本发明通过实验证明了ldl是良好的针对异常巨核细胞的药物运输载体,本发明制备的ldl-mln纳米药物具有良好的应用前景。
附图说明
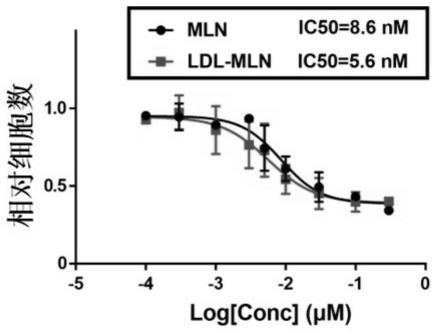
39.图1为ldl-mln/mln在hel细胞中的ic50的测定。
40.图2为ldl-mln/mln给药处理72小时后hel细胞增殖曲线。
41.图3为ldl-mln/mln给药处理72小时后hel细胞存活率。
42.图4为ldl-mln/mln给药处理72小时后hel细胞凋亡水平。
43.图5为ldl-mln/mln给药处理72小时后hel细胞表面分化标志物的表达量。
44.图6为ldl-mln/mln给药处理72小时后hel细胞内dna含量测定。
45.图7为ldl-mln/mln在mpn原代细胞中ic50的测定。
46.图8为ldl-mln/mln给药处理48小时后mpn原代细胞存活率。
47.图9为ldl-mln/mln给药处理48小时后mpn原代细胞gfp表达水平。
48.图10为ldl-mln/mln给药处理48小时后mpn原代细胞表面标志物的表达量。
49.图11为ldl-mln/mln给药处理48小时后mpn原代细胞内dna含量测定。
50.图12为ldl-mln/mln安全性实验中骨髓各系细胞占比变化。
51.图13为ldl-mln/mln安全性实验中病理切片。
52.图14为ldl-mln/mln给药处理后pmf小鼠外周血gfp水平变化。
53.图15为ldl-mln/mln给药处理后pmf小鼠病理切片。
54.图16为ldl-mln/mln给药处理后pmf小鼠脾脏细胞分化水平。
55.图17为ldl-mln/mln给药处理后pmf小鼠骨髓细胞分化水平。
56.图18为通过流式细胞术检测细胞中的gfp表达水平。
具体实施方式
57.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
58.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
59.实施例1、ldl包埋mln8237纳米药物ldl-mln的合成
60.按照文献(zhu c,pradhan p,huo d,et al.reconstitution of low-density lipoproteins with fatty acids for the targeted delivery of drugs into cancer cells.angew chem int ed engl.2017;56(35):10399-10402.doi:10.1002/anie.201704674)中的方法合成ldl包埋mln8237纳米药物(简称:ldl-mln)。具体步骤如下:
61.1、ldl-mln颗粒的制备
62.1)将1mg天然ldl颗粒(lee biosolutions,货号为360-10)与12.5mg马铃薯淀粉涡旋混合,然后冷冻干燥过夜,得到ldl-淀粉混合物。
63.2)完成步骤1)后,用庚烷提取步骤1)获得的ldl-淀粉混合物中的内源性脂质三次,去除天然ldl颗粒中的脂质物质,得到提取后产物;然后将100μl预混有效载荷(预混有效载荷的溶剂为甲苯,溶质及其浓度分别为mln8237(selleck,s1133)0.25mg/ml,月桂酸8mg/ml,硬脂酸2mg/ml)添加到提取后产物中,在-20℃条件下孵育20分钟后在冰浴、氩气条
件下去除甲苯,得到ldl-mln混合物。
64.同时将预混有效载荷替换为对照预混液,得到ldl-blank混合物。对照预混液的溶剂为甲苯,溶质及其浓度分别为月桂酸8mg/ml,硬脂酸2mg/ml。
65.3)完成步骤2)后,先将ldl-mln混合物分散在300μl tricine缓冲液(10mm,ph=8.4)(sigma,t0377)中,在4℃条件下放置18小时。然后2000rpm离心10分钟,收集初始清液。再将初始清液进行两轮10000rpm离心10分钟,收集上清液。最后将上清液通过0.22μm无菌过滤器(millipore)进行过滤,得到ldl-mln颗粒溶液(含有mln)。
66.同时将ldl-mln混合物替换为ldl-blank混合物,得到ldl-blank颗粒溶液(不含有mln)。
67.ldl-mln颗粒溶液和ldl-blank颗粒溶液4℃储存以备后续使用。
68.2、mln浓度的测定
69.为了量化封装的ldl-mln颗粒溶液中的mln浓度,将ldl-mln颗粒溶液在超声条件下用甲醇进行提取。然后10000rpm离心5分钟,收集上清液。再通过紫外/可见光谱仪(shimadzu,uv-2600)测量两个样品的上清液。最后参照mln在甲醇中的校准曲线确定mln浓度。经检测,ldl-mln颗粒溶液中的mln浓度为35μmol/l。
70.3、ldl-mln颗粒的表征
71.通过透射电子显微镜表征所有rldl颗粒的形态。
72.实施例2、ldl-mln在抑制hel细胞增殖,促进hel细胞分化和凋亡中的应用
73.一、ldl-mln/mln在hel细胞中的ic50测定
74.在24孔板中每孔(每孔培养液体积为2ml)加入0.8
×
106个hel细胞(购自中国科学院细胞库),然后加入ldl-mln进行药物处理,使其终浓度分别为300nm、100nm、30nm、10nm、5nm、3nm、1nm、0.3nm、0.1nm和0nm,同时以mln作为对照。药物处理24小时后,通过台盼蓝染色法(细胞悬液与0.4%溶液1:1混合)计算每孔细胞总数,并通过graphpad prism 7.0计算细胞的ic50。
75.结果如图1所示,结果表明:在体外进行药物处理24小时后,通过台盼蓝染色法测定ldl-mln与mln在hel细胞中的ic50可以发现,ldl-mln的ic50相对较低,ldl包埋后纳米药物对于hel细胞的增殖抑制效果更加显著。
76.二、ldl-mln/mln给药处理72小时细胞增殖曲线
77.在24孔板中每孔(每孔培养液体积为2ml)加入0.8
×
106个hel细胞(购自中国科学院细胞库),然后加入ldl-mln进行药物处理,使其终浓度为30nm,同时以mln、ldl-blank和tricine缓冲液(con)作为对照。药物处理72小时后,通过台盼蓝染色法(细胞悬液与0.4%溶液1:1混合)计算每孔细胞总数。
78.结果如图2所示,结果表明:通过台盼蓝染色法检测给药浓度为30nm时hel细胞增殖变化,可以发现ldl-mln对于hel细胞的增殖效果更加显著。
79.三、ldl-mln/mln给药处理72小时后细胞存活率检测
80.分别取50μl终浓度为30nm的ldl-mln/mln/ldl-blank/tricine(con)处理72小时后的hel细胞于1.5ml离心管中,使用acea流式细胞术分析仪分析细胞存活率。
81.结果如图3所示,结果表明:使用流式细胞术检测细胞给药72小时后细胞的存活率可以发现,当给药剂量为30nm时,ldl-mln处理组的细胞存活率更高,ldl-mln的细胞毒性相
对较小。
82.四、ldl-mln/mln给药处理72小时后细胞凋亡水平检测
83.分别取0.5
×
106个终浓度为30nm的ldl-mln/mln/ldl-blank/tricine(con)处理72小时后的hel细胞于1.5ml离心管中,使用凋亡试剂盒(bd 550474)在室温、避光条件下孵育15min,孵育后用acea流式细胞分析仪进行apc信号检测。
84.结果如图4所示,结果表明:通过流式细胞术检测给药72小时后hel细胞的磷酯酰丝氨酸ps表达水平发现,相同浓度的mln与ldl-mln的凋亡诱导水平相似。当给药剂量为30nm时均能显著诱导hel细胞的凋亡。
85.五、ldl-mln/mln给药处理72小时后细胞表面分化标志物的表达量检测
86.巨核细胞分化过程中,细胞表面分化标志物cd41与cd42表达量的上调是巨核细胞分化成熟的标志,通过检测细胞表面标志物表达水平变化能够衡量细胞的分化情况。
87.分别取0.5
×
106个终浓度为30nm的ldl-mln/mln/ldl-blank/tricine(con)处理72小时后的hel细胞于1.5ml离心管中,使用流式抗体cd41a-apc,cd42a-pe(bd pharmingen
tm
apc mouse anti-human cd41a,559777;bd pharmingen
tm
pe mouse anti-human cd42a,558819)在4℃、避光条件下孵育15min,孵育后用acea流式细胞分析仪进行apc信号和pe信号检测。
88.结果如图5所示,结果表明:通过流式细胞术检测给药72小时后的hel细胞cd41和cd42的表达水平可以发现,ldl-mln、mln均能有效促进cd41和cd42的表达,其中,ldl-mln对于早期分化标志物cd41的上调更为显著,mln对于晚期分化标志物cd42的上调更为显著。
89.六、ldl-mln/mln给药处理72小时后细胞内dna含量测定
90.巨核细胞分化过程伴随着细胞内dna的复制而细胞质不分裂,因此会出现多倍体现象,检测细胞内的dna含量的变化是判断巨核细胞分化水平的标准。
91.分别取0.5
×
106个终浓度为30nm的ldl-mln/mln/ldl-blank/tricine(con)处理72小时后的hel细胞于1.5ml离心管中,使用dna染料hoechst 33342(invitrogen h3570)在37℃、避光条件下孵育40min,孵育后用acea流式细胞分析仪进行pacific blue信号检测。
92.结果如图6所示,结果表明:通过流式细胞术检测给药72小时后hel细胞的dna含量发现,ldl-mln、mln均显著提高了胞内dna含量水平,并且ldl-mln处理组的多倍体化现象更为显著。结合图5可以得出结论:ldl-mln促进了非均质细胞群hel细胞中整体细胞的分化水平。
93.实施例3、ldl-mln在抑制mpn原代细胞增殖,促进mpn原代细胞分化和凋亡中的应用
94.在骨髓增殖性肿瘤中常伴随着基因突变的出现。mplw515k/l基因突变是导致mpn发生的主要分子病因。通过逆转录病毒转导方式将mplw515l突变转导到小鼠骨髓c-kit阳性细胞中,在体外构建mpn原代细胞系模拟体内状况。并对mpn原代细胞系进行给药处理,检测药物处理后细胞的增殖和分化水平变化。具体步骤如下:
95.一、mpn原代细胞的构建
96.1、取小鼠骨髓细胞,使用c-kit磁珠分选系统(miltenyi biotec 130-091-224)分选出c-kit阳性骨髓细胞(记作c-kit+细胞)。
97.2、完成步骤1后,通过trans10化学感受态细胞进行mplw515l质粒(mplw515l质粒
记载于如下文献中:wen,qiang jeremy et al.“targeting megakaryocytic-induced fibrosis in myeloproliferative neoplasms by aurka inhibition.”nature medicine vol.21,12(2015):1473-80.doi:10.1038/nm.3995)的转化和提取。
98.3、完成步骤2后,在转染前一天将5
×
106个plat-e细胞接种在10厘米的培养皿中,使用x-tremegene
tm
9 dna转染试剂(罗氏)将mplw1515l质粒转染至plat-e细胞,转染48小时后收集病毒上清液。
99.4、完成步骤3后,将1ml病毒上清液与2
×
106个c-kit+细胞以及8μg/ml聚凝胺(sigma,tr-1003)混合,然后在32℃、2,500rpm条件下离心90分钟,重复离心操作两次,之后去除病毒上清,向沉淀中加入细胞培养液培养,通过流式细胞术检测细胞中的gfp表达水平(mplw515l质粒携带gfp荧光蛋白),得到过表达mplw515l的c-kit+细胞,并将其记作mpn原代细胞。流式检测gfp为20.2%,结果如图18所示。
100.二、ldl-mln/mln在mpn原代细胞中ic50的测定
101.在24孔板中每孔(每孔培养液体积2ml)加入0.8
×
106个mpn原代细胞,然后加入ldl-mln进行药物处理,使其终浓度分别为1000nm、500nm、300nm、100nm、50nm、30nm、10nm、5nm、1nm和0nm,同时以mln作为对照。药物处理48小时后,通过台盼蓝染色法(细胞悬液与0.4%溶液1:1混合)计算每孔细胞总数,并通过graphpad prism 7.0计算细胞的ic50。
102.结果如图7所示,结果表明:在体外进行给药处理48小时后,通过台盼蓝染色法测定ldl-mln与mln在mpn原代细胞中的ic50可以发现,ldl-mln的ic50相对较低。
103.三、ldl-mln/mln给药处理48小时后mpn原代细胞存活率
104.分别取50μl终浓度为300nm的ldl-mln/mln/ldl-blank/tricine(con)处理48小时后的mpn原代细胞于1.5ml离心管中,使用acea流式细胞术分析仪分析细胞存活率。
105.结果如图8所示,结果表明:使用流式细胞术检测细胞给药48小时后mpn原代细胞的存活率可以发现,当给药剂量为300nm时,mln处理组的细胞存活率更高,ldl-mln对于mpn原代细胞的杀伤作用更强。
106.四、ldl-mln/mln给药处理48小时后mpn原代细胞gfp表达水平
107.mpn原代细胞表达gfp蛋白,检测细胞群中gfp表达水平的变化可以判断mpn细胞的存活率。
108.分别取50μl终浓度为300nm的ldl-mln/mln/ldl-blank/tricine(con)处理48小时后的mpn原代细胞于1.5ml离心管中,mplw515l阳性细胞可自发荧光gfp,使用acea流式细胞术分析仪分析细胞gfp表达水平。
109.结果如图9所示,结果表明:通过流式细胞术检测gfp表达水平发现,在给药处理48小时后,ldl-mln与mln处理的mpn原代细胞群中gfp显著降低,并且ldl-mln对于mpn原代细胞有更强的杀伤作用。
110.五、ldl-mln/mln给药处理48小时后mpn原代细胞表面分化标志物的表达量检测
111.分别取0.5
×
106个终浓度为300nm的ldl-mln/mln/ldl-blank/tricine(con)处理48小时后的mpn原代细胞于1.5ml离心管中,使用流式抗体cd41a-pe-cy7(ebioscience
tm
25-0411-82)在4℃、避光条件下孵育15min,孵育后用acea流式细胞分析仪进行pe-cy7信号检测。
112.结果如图10所示,结果表明:通过流式细胞术检测给药处理后mpn原代细胞表面分
化标志物cd41的表达水平可以发现,ldl-mln处理组的cd41表达显著上调,说明ldl-mln相比较于mln有更好的mpn细胞分化促进作用。
113.六、ldl-mln/mln给药处理48小时后mpn原代细胞内dna含量测定
114.分别取0.5
×
106个终浓度为300nm的ldl-mln/mln/ldl-blank/tricine(con)处理48小时后的mpn原代细胞于1.5ml离心管中,使用dna染料hoechst 33342(invitrogen h3570)在37℃、避光条件下孵育40min,孵育后用acea流式细胞分析仪进行pacific blue信号检测。
115.结果如图11所示,结果表明:检测给药48小时后mpn原代细胞中的dna含量可以发现,mln与ldl-mln处理组的细胞内dna含量均显著升高,并且ldl-mln对于细胞多倍体的促进水平更加显著。结合图10可知,ldl-mln相比较于mln有更好的mpn原代细胞的分化诱导效果。
116.实施例4、ldl-mln安全性评价
117.为了评估ldl-mln给药剂量为0.01mg/kg时的安全性,选取8周龄c57bl/6n小鼠(购自维通利华)进行尾静脉给药,频次为每隔2天给一次,每次给药剂量为0.01mg/kg。同时以ldl-blank(给药剂量:0.01mg/kg)、mln(给药剂量:0.01mg/kg)以及未进行给药处理(wt)作为对照。小鼠给药处理2周后分析小鼠外周血细胞类群变化和肝脏脾脏细胞群变化。具体实验方法如下:
118.1、小鼠骨髓细胞流式分析
119.1)细胞准备
120.骨髓细胞准备:用pbs吹出小鼠骨髓中细胞后,300g离心10min,收集细胞沉淀,用红细胞裂解液室温孵育5min,去除红细胞,备用。
121.2)流式分析
122.红系分析:取裂解红细胞前细胞悬液(细胞个数为0.5
×
106),使用流式抗体bd pharmingen
tm
apc rat anti-mouse ter-119/erythroid cells(557909)和bd pharmingen
tm
pe rat anti-mouse cd71(553267)进行孵育,孵育条件为4℃、避光、15min,最后用acea流式细胞分析仪进行apc信号和pe信号检测。
123.粒系分析:取裂解红细胞后细胞悬液(细胞个数为0.5
×
106),使用流式抗体bd pharmingen
tm
pe rat anti-mouse cd11b(557397)和bd pharmingen
tm
apc rat anti-mouse ly-6g(560599)进行孵育,孵育条件为4℃、避光、15min,最后用acea流式细胞分析仪进行apc信号和pe信号检测。
124.巨核系分析:取裂解红细胞后细胞悬液(细胞个数为0.5
×
106),使用流式抗体cd41a-pe-cy7(ebioscience
tm
25-0411-82)进行孵育,孵育条件为4℃、避光、15min,最后用acea流式细胞分析仪进行pe-cy7信号检测。
125.2、染色
126.肝脏和脾脏he染色:取小鼠5μm组织石蜡切片,烘干后脱蜡至水,用苏木精染色液染色5min,伊红染色液染色6min后固定,显微镜观察细胞形态。
127.血涂片:尾静脉采血10μl,均匀涂片固定后使用吉姆萨染色液染色15min,显微镜观察细胞形态。
128.结果如图12所示,结果表明:通过流式细胞术分析可以看出ldl-mln给药处理小鼠
81),bd pharmingen
tm
alexa647rat anti-mouse cd34(ebioscience,560230)进行孵育,孵育条件为4℃、避光、15min,最后用acea流式细胞分析仪进行检测。
142.结果如图16所示,结果表明:ldl-mln给药组小鼠脾脏中的肿瘤细胞显著减少,几乎清零。对gfp+细胞的lsk细胞(lin-sca-1-c-kit+)进行分析可以看出,ldl-mln有效减少了异常干细胞的含量,并且lsk细胞中cmp、gmp与mep各谱系细胞占比更加趋近于健康小鼠。
143.五、ldl-mln/mln给药处理后pmf小鼠骨髓细胞分化水平
144.在建模15天后开始进行ldl-mln给药处理,每隔2天给一次,每次给药剂量为0.01mg/kg,给药7次后通过流式细胞术分析给药处理后pmf小鼠骨髓中肿瘤细胞分化水平,同时以mln、ldl-blank和未进行给药处理(con)作为对照。具体分析方法如下:取裂解红细胞后细胞悬液(细胞个数为6
×
106),使用流式抗体anti-mo ly-6a/e d7 pe(ebioscience,12-5981-81),streptavidin percp-cyn5.5(ebioscience,45-4317-82),anti-mo cd117 2b8 apc-ef780(ebioscience,47-1171-82),anti-mo cd41 mwreg30 pe-cyn7(ebioscience,25-0411-82),anti-mo cd16/32 93pe-cyn7(ebioscience,25-0161-81),bd pharmingen
tm
alexa647 rat anti-mouse cd34(ebioscience,560230)进行孵育,孵育条件为4℃、避光、15min,最后用acea流式细胞分析仪进行检测。
145.结果如图17所示,结果表明:ldl-mln给药组小鼠骨髓中的肿瘤细胞显著减少,几乎清零。gfp+细胞的lsk细胞含量减少,并且lsk细胞中cmp、gmp与mep各谱系细胞占比更加趋近于健康小鼠。作为异常巨核细胞祖细胞的mep细胞显著减少,意味着骨髓中过表达mplw515l的细胞减少,肿瘤细胞分化水平提高。
146.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1