介导cbl降解P-TFEB并激动TFEB的化合物在制备抗肿瘤药物中的应用
介导cbl降解p-tfeb并激动tfeb的化合物在制备抗肿瘤药物中的应用
技术领域
1.本发明涉及医药技术领域,特别是涉及介导cbl降解p-tfeb并激动 tfeb的化合物在制备抗肿瘤药物中的应用。
背景技术:
2.肺癌是目前癌症死亡的主要原因,占所有癌症死亡的近20%。肺癌的治疗主要有术疗、放疗、化疗、靶向及免疫治疗。术疗和放疗有一定的局限性,且不宜单独使用。化疗、靶向及免疫治疗最突出问题为耐药及爆发性进展,临床长期疗效仍不理想。如近期临床研究表明,10%接收免疫治疗的患者出现肿瘤爆发性进展。到目前为止,肺癌病人的平均五年生存期仍未有显著性突破。因此,开发新的治疗非小细胞肺癌的策略仍是社会迫切所需。天然化合物抗肿瘤机制研究犹如一把钥匙能开启新的抗肿瘤靶途径,为药物开发提供新思路。
3.tfeb为转录因子,是溶酶体激活及自噬的关键上游调控因子。正常情况下,磷酸化的tfeb(即p-tfeb)与14-3-3蛋白结合,保留在细胞质内。当药物干预或应激时,tfeb去磷酸化,与14-3-3蛋白解离进入细胞核,激动其活性。药物诱导tfeb激动有很多种方式,但是通过cbl降解磷酸化tfeb,增加tfeb/tfeb二聚体,从而激动tfeb的方式尚未有报道。且通过此途径诱导肺癌细胞铁死亡的亦未有报道。
技术实现要素:
4.本发明的目的是针对现有技术的缺陷,提供介导cbl降解p-tfeb并激动tfeb的化合物在制备抗肿瘤药物中的应用,这是一种药物激动tfeb 的新途径,且通过此途径诱导铁死亡产生抗肿瘤。
5.具体技术方案如下:
6.本发明一方面提供了介导cbl降解p-tfeb并激动tfeb的化合物在制备抗肿瘤药物中的应用。
7.作为优选,所述化合物通过诱导cbl降解p-tfeb,进而减少 p-tfeb/tfeb异二聚体,增加tfeb/tfeb二聚体,实现tfeb核转移,从而激活tfeb,诱导非小细胞癌细胞铁死亡。
8.作为优选,所述肿瘤为肺癌。更为优选,所述肺癌细胞为a549非小细胞肺癌细胞。
9.作为优选,所述p-tfeb中磷酸化位点为s122。
10.作为优选,介导cbl降解p-tfeb并激动tfeb的化合物为银杏双黄酮;银杏双黄酮与tfeb蛋白有结合作用;银杏双黄酮促进cbl与p-tfeb结合,并降低p-tfeb含量,同时促进tfeb/tfeb同源二聚体的形成,进而促进 tfeb入核,并激动其下游溶酶体活性及自噬标记物的增加,且其效应可以被tfeb沉默所逆转。
11.本发明另一方面提供了一种抗肿瘤药物,其特征在于包括介导cbl降解p-tfeb并激动tfeb的化合物。
12.作为优选,所述药物的剂型为医学上认可的任何一种剂型。
13.本发明又一方面提供了一种药物组合物,包括介导cbl降解p-tfeb 并激动tfeb的化合物,以及药学上可接受的载体。
14.本发明提出tfeb可以被药物通过非经典的新途径而激活。实验结果显示:cbl与p-tfeb在肿瘤细胞内未有结合,而在介导cbl降解p-tfeb 并激动tfeb的化合物(例如银杏双黄酮)能与tfeb结合作用下,能产生结合。cbl是e3泛素连接酶,能调节泛素化促进降解。cbl与p-tfeb 的结合促进了p-tfeb的降解。tfeb在形成同源二聚体后才能在核内激动,作用于下游基因的启动区,促进下游基因的转录。介导cbl降解p-tfeb并激动tfeb的化合物(例如银杏双黄酮)诱导的cbl与p-tfeb结合及 p-tfeb降低,促进了tfeb/tfeb同源二聚体的形成。此过程促进了tfeb 入核,并激活了下游效应溶酶体活性及自噬标志物的增加。介导cbl降解 p-tfeb并激动tfeb的化合物(例如银杏双黄酮)与tfeb结合,且通过 cbl降解p-tfeb而激活tfeb的途径为本发明首次报道。同时,tfeb激动后能直接诱导铁死亡,且为铁死亡的关键调控点。本发明首次提出化合物通过与tfeb蛋白结合激动tfeb诱导铁死亡作为肿瘤(例如非小细胞肺癌)的途径。本发明报道的抗非小细胞肺癌的作用新途径能为防治肿瘤 (例如非小细胞肺癌)以及针对此靶途径的药物开发提供理论及实践基础。
附图说明
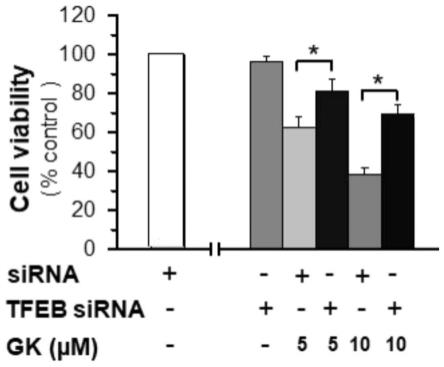
15.图1为实施例1不同浓度银杏双黄酮与tfeb蛋白有结合作用的结果示意图;其中a为银杏双黄酮与tfeb蛋白结合的biacore传感图,b为银杏双黄酮与tfeb蛋白结合的亲和力曲线图;
16.图2为实施例2的银杏双黄酮诱导p-tfeb与cbl结合,cbl与银杏双黄酮诱导的p-tfeb降解呈正相关的结果示意图;其中a为p-tfeb与cbl 结合的免疫沉淀图,b为银杏双黄酮作用于mef细胞及cbl敲除mef细胞后p-tfeb的变化;
17.图3为实施例3的银杏双黄酮促进tfeb磷酸化,与结合蛋白14-3-3 分离,并促进tfeb/tfeb二聚体形成的结果示意图;其中a为银杏双黄酮作用于非小细胞肺癌细胞3、6、12、24h后tfeb及p-tfeb的变化,b 为银杏双黄酮作用于非小细胞肺癌3、6、12、24h后tfeb与14-3-3结合的免疫沉淀图,c为银杏双黄酮作用于非小细胞肺癌后,p-tfeb/tfeb以及tfeb/tfeb二聚体形成的免疫沉淀图;
18.图4为实施例4的银杏双黄酮促进tfeb核转移及自噬标记物增加的结果示意图;
19.图5为实施例5的tfeb是银杏双黄酮诱导溶酶体激活及自噬的关键调控点的结果示意图;其中a为tfeb沉默后对银杏双黄酮诱导的非小细胞肺癌溶酶体激活的影响,b为tfeb沉默后对银杏双黄酮诱导的自噬标记物lc3增加的影响;
20.图6为实施例6的银杏双黄酮对肺癌细胞的抑制作用能被tfeb敲降而逆转的结果示意图;
21.图7为实施例7的银杏双黄酮诱导肺癌细胞铁死亡,且能被tfeb敲降而逆转的结果示意图;其中a为非小细胞肺癌tfeb沉默后,银杏双黄酮对铁死亡相关蛋白的影响,b为非小细胞肺癌tfeb沉默后,银杏双黄酮对脂质过氧化物的影响;c为非小细胞肺癌tfeb沉默后,银杏双黄酮对不稳定铁池的影响。
22.图1-图7中,gk为银杏双黄酮。
具体实施方式
23.以下结合具体实施例对本发明作进一步详细的说明。
24.实施例1:银杏双黄酮与tfeb蛋白有结合作用
25.tfeb蛋白及其截短体通过胺基共价固定在cm5芯片上,固定化水平为 6500ru。不同浓度的银杏双黄酮溶液(100μm,33.3μm,11.1μm,3.7μm, 1.2μm,0.41μm,0.14μm)流过芯片表面,实时采集互作信号。整个系统在10mm hepes,ph 7.4,150mm nacl,0.05%p2o,2%dmso缓冲溶液中进行。采用ge life sciences biacore s200系统进行检测及数据分析。结果显示,银杏双黄酮与tfeb蛋白有结合作用(图1)。
26.实施例2:银杏双黄酮诱导p-tfeb与cbl结合,cbl与银杏双黄酮诱导的p-tfeb降解呈正相关
27.a549细胞在1640培养基中培养,该1640培养基含10%胎牛血清、青酶素100u/ml、庆大酶素100ug/ml,培养箱温度为37℃,含5%co2。采用分子克隆技术,将tfeb磷酸化位点s122进行突变,构建磷酸化位点突变质粒pcdna3.1-tfeb
s122d
,模拟tfeb持续磷酸化。
28.将pcdna3.1,pcdna3.1-tfeb与pcdna3.1-tfeb
s122d
分别转染至 a549细胞,给予银杏双黄酮。而后收集细胞,裂解提取蛋白,与tfeb抗体及protein g-beads共同孵育,缓冲液洗protein g-beads 4次,用尿素溶解蛋白。而后用胰酶消化成肽段,用lc-ms/ms进行蛋白质组学分析。结果显示cbl可以选择性得与磷酸化tfeb(p-tfeb)结合。用免疫沉淀方法进行验证,结果发现,cbl与pcdna3.1-tfeb
s122d
共转染至a549,银杏双黄酮可以诱导两者的结合,且此结合在未给予银杏双黄酮的样本中未发现,说明cbl与p-tfeb(s122)的结合依赖于银杏双黄酮。此结果提示,cbl 可能参与了tfeb的去磷酸化。将银杏双黄酮给予mef细胞及cbl敲除的 mef细胞,发现cbl与tfeb s122位点的去磷酸化成正相关(图2)。
29.实施例3:银杏双黄酮促进tfeb磷酸化,与结合蛋白14-3-3分离,并促进tfeb/tfeb二聚体形成。
30.a549细胞给予银杏双黄酮后不同时间(3、6、12、24h)收集细胞,裂解细胞,提取蛋白,用westernblot检测p-tfeb的变化,结果显示,银杏双黄酮能够时间依赖性得降低p-tfeb的水平(图3a)。
31.tfeb磷酸化水平降低,会导致其与结合蛋白14-3-3的分离,游离的 tfeb、p-tfeb之间会形成三种形式的二聚体,分别为p-tfeb二聚体, tfeb二聚体,p-tfeb\tfeb异二聚体。其中,tfeb二聚体才能入核发挥转录因子功能,而p-tfeb在二聚体中的出现将影响tfeb活性的激活。采用免疫沉淀的方法观察银杏双黄酮给予a549细胞不同时间点(3、6、 12、24h)后,tfeb与14-3-3的结合。结果显示,tfeb与14-3-3的结合呈现时间依赖性的减少(图3b)。
32.为观察tfeb二聚体形成情况,采用银杏双黄酮给药后tfeb与14-3-3 分离最明显的时间点24h,进行免疫共沉淀实验。将a549肺癌细胞共转染myc-tfeb(wt)和egfp-tfeb,或磷酸化myc-tfeb(aa)和egfp-tfeb,分别给予或不给予银杏双黄酮24h。而后将细胞裂解,提取蛋白,总裂解液与标签抗体myc和protein g beads 4℃摇晃孵育过夜。免疫沉淀反应后,离心弃上清,缓冲液洗protein g-beads 4次,加入上样缓冲液变性蛋白, western检测二聚体形成情况。结果显示,银杏双黄酮作用下,形成的 tfeb/tfeb同源二聚体显著高于p-tfeb/tfeb异二聚体的量(图3c)。
33.综上所述,银杏双黄酮能促进a549肺癌细胞tfeb的去磷酸化,使得其与14-3-3分离,增加同源二聚体tfeb/tfeb的产生。
34.实施例4:银杏双黄酮促进tfeb核转移及自噬标记物增加。
35.将a549肺癌细胞接种于盖玻片上,细胞贴壁后给予银杏双黄酮24h。pbs 冲洗,甲醛固定15min后,pbs冲洗,bsa封闭1h。4℃过夜孵育tfeb和lc3 一抗,pbs冲洗后孵育荧光二抗及dapi,封片。采用激光共聚焦显微镜观察tfeb细胞核分布,及lc3的表达情况。结果显示,表示tfeb蛋白的绿色荧光以a549细胞内细胞质内分布为主,细胞核内绿色荧光较弱,且与代表细胞核的蓝色荧光重叠较少,说明tfeb大部分分布在细胞质,细胞核内分布较少。同时,代表lc3的红色荧光较弱。银杏双黄酮给药组内,绿色荧光在核内显著增强,呈现高密度状态,与蓝色荧光重叠较多,且细胞质的绿色荧光有所减弱。这说明tfeb发生了核转移,在核对的表大量显著增加。此外,自噬是tfeb调控的下游事件,自噬标记物lc3的红色荧光显著增加,说明lc3的表达量有所增加。tfeb的入核是其激动的关键步骤,上述结果说明,银杏双黄酮诱导了tfeb的入核,并可能激动了自噬等下游事件的发生(图4)。
36.实施例5:tfeb是银杏双黄酮诱导溶酶体激活及自噬的关键调控点。
37.tfeb激动后能增加溶酶体活性及自噬水平。为进一步说明银杏双黄酮通过激活tfeb产生的效应,我们在肺癌细胞内过表或敲降tfeb后观察肺癌细胞给予银杏双黄酮后溶酶体活性及自噬标记物lc3的变化。a549肺癌细胞接种于盖玻片上,转染tfeb,或者sirnatfeb后给予银杏双黄酮,用溶酶体探针red dnd-99染色细胞,而后将盖玻片固定于细胞室中,用激光共聚焦观察活细胞内溶酶体活性的变化。观察lc3的变化时,则将样本固定,pbs洗后,敷育一抗及荧光二抗,并用dapi进行核染,封片后用激光共聚焦进行观察。结果显示,银杏双黄酮处理后红色荧光增强,说明溶酶体活性增加,tfeb过表后能增强此作用,而敲降后能逆转此过程(图5a)。同样地,银杏双黄酮诱导的自噬增加能被tfeb的敲降而逆转(图5b)。上述结果说明,tfeb是银杏双黄酮诱导溶酶体激活及自噬水平改变的关键调控点。
38.实施例6:银杏双黄酮对肺癌细胞的抑制作用能被tfeb敲降而逆转。
39.将a549细胞种于96孔板,每孔细胞密度约5
×
103个细胞,24h细胞贴壁后,分别转染sirna以及tfeb sirna,12h后给予不同浓度的银杏双黄酮(5,10μm),48h后加入mtt染色,染色4h后,舍弃原有培养液,加入dmso溶解,放入酶标仪,使用570nm检测波长测定吸光度。结果显示银杏双黄酮对a549非小细胞肺癌细胞具有较强的细胞毒性作用, tfeb敲降后能逆转此作用(图6)。
40.实施例7:银杏双黄酮诱导肺癌细胞铁死亡,且能被tfeb敲降而逆转。
41.a549细胞种于10cm细胞培养皿,当密度到70%时,分别转染sirna 以及tfeb sirna,12h之后加入10μm银杏双黄酮。给药48h之后,弃培养基,收集细胞,裂解提取蛋白,用westernblot检测铁死亡相关蛋白的变化。结果显示,银杏双黄酮能显著降低铁死亡负相关蛋白gpx4、 slc40a1的表达,同时显著提高正相关蛋白transferrin的含量。上述蛋白变化均能被tfeb的敲降而逆转(图7a)。
42.铁死亡的核心时间是脂质过氧化物及不稳定铁池的增加。为进一步证明银杏双黄酮能诱导铁死亡,且tfeb在此过程中的关键作用。继而检测了脂质过氧化物和不稳定铁池的含量。
43.a549细胞种于6孔板上,每孔细胞密度约5
×
104个细胞,过夜让细胞贴壁,分别转染sirna以及tfeb sirna,12h之后加入银杏双黄酮(10 μm),加药之前更换培养液。给药24小时后,加入含有终浓度为5μm的 bodipy 589/591c11的无血清培养基与37℃荧光标记0.5小时。而后用胰酶消化后,收集细胞,pbs冲洗后重悬,流式细胞仪检测lipid ros的含量。结果显示,银杏双黄酮给予之后,lipid ros的含量显著上升,当tfeb敲降后,lipid ros的上升被逆转(图7b)。
44.a549细胞种于6孔板上,每孔细胞密度约5
×
104个细胞,过夜让细胞贴壁,分别转染sirna以及tfeb sirna,12h之后加入银杏双黄酮(10 μm),以5
×
105/ml的密度加入ca-am(0.5μm),37℃孵育15min。而后每组细胞收集分成两部分,分别给予或不给予铁螯合剂dfp(deferiprone)100 μm孵育1h,用流式细胞仪检测每组细胞给予及不给予dfp的样本的平均荧光强度,计算差值,比较此差值在每个组的区别。结果显示,银杏双黄酮能显著增加细胞内不稳定铁池的含量,且此增加能被tfeb的沉默所逆转(图7c)。
45.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
46.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1