一种注射用盐酸表柔比星冻干粉针及其制备方法与流程
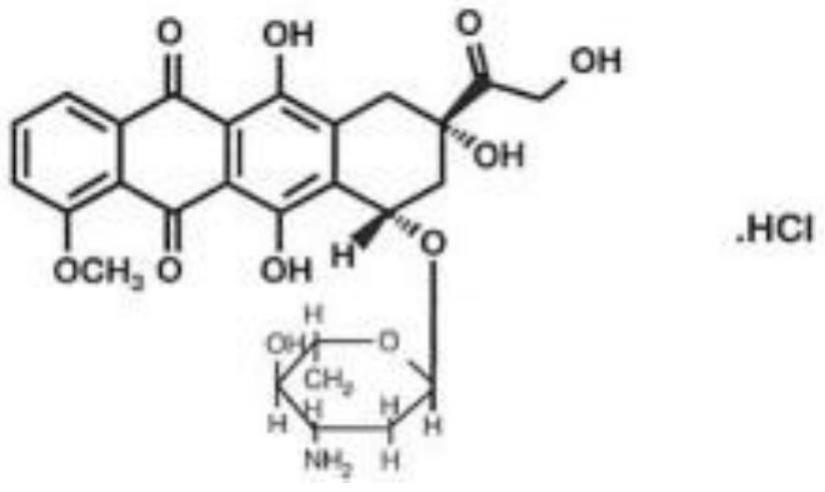
1.本发明属于医药制剂技术领域,特别是一种注射用盐酸表柔比星冻干粉针及其制备方法。
背景技术:
2.在妇科三大恶性肿瘤之中,卵巢癌的病死率位居首位,严重威胁女性的健康。根据我国2020年恶性肿瘤流行情况分析,卵巢癌发病率为8.04/10万,死亡率3.85/10万。卵巢癌病因尚不明确,可能与遗传、生育、生殖内分泌等多种因素有关。
3.虽然可以通过阴道超声与血清肿瘤标志物进行联合检查,但尚未找到早期发现卵巢癌的有效方法,临床确诊时多为晚期。手术联合化疗是卵巢恶性肿瘤的主要治疗方式。近年来,抗血管靶向治疗、parp抑制剂应用于上皮性卵巢癌取得显著进展,可望提高卵巢癌的生存率。
4.盐酸表柔比星注射液,适应症为用于治疗白血病、恶性淋巴瘤、多发性骨髓瘤、乳腺癌、肺癌、软组织肉瘤、胃癌、结肠直肠癌、卵巢癌等。
5.本品活性成份化学名称为:(8s,10s)-10-[(3
’‑
氨基-2’,3’,6
’‑
三脱氧-α-l-阿拉伯吡喃糖基)氧代]-6,8,11-三羟基-8-(羟乙酰基)-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐。其结构式为:
[0006][0007]
一方面,盐酸表柔比星溶液性质不稳定,见光分解,需要进行避光保存,同时还需要抗氧化剂,以防止注射液被氧化分解。
[0008]
另一方面,还需要增溶剂,以增加活性成分在溶液中的溶剂能力,以此能提高盐酸表柔比星溶液的稳定性。
[0009]
cn105560174a公开了15-羟基硬脂酸聚乙二醇酯作为药物增溶剂应用于盐酸表柔比星注射液的配方中,能一定地提高盐酸表柔比星注射液的活性成分的溶解度,以此提高盐酸表柔比星注射液在高温下的稳定性,但是15-羟基硬脂酸聚乙二醇酯作为一种新型的增溶剂,价格比较昂贵,导致生产成本显著增加,不适于工业生产。
[0010]
cn113876704a公开了盐酸表柔比星注射液,所述注射液采用d-山梨醇为增溶剂,egcg作为抗氧化剂,一方面增加了盐酸表柔比星的溶解性,一方面也防止了盐酸表柔比星被氧化分解,但是d-山梨醇作为增溶剂有时会发生过敏反应,发生率约为5%~40%,存在一定的安全风险因素。
[0011]
egcg是绿茶茶多酚中含量最高的物质,也是目前公认的茶叶中最主要的抗氧化成分。然而现有研究已经证实,表型儿茶素的异构体如没食子儿茶素没食子酸酯gcg,其化学结构如式1所示,在某些方面表现出较强的生理活性,如抗氧化和清除自由基活性等。
[0012][0013]
因此,开发一种稳定性较好,安全有效的注射用盐酸表柔比星制剂是目前亟需解决的问题。
技术实现要素:
[0014]
为了克服现有技术的不足,本发明通过大量试验进行注射用盐酸表柔比星冻干粉针配方的筛选和优化,发明人在试验中意外地发现,磺丁基倍他环糊精钠作为赋形剂,能对盐酸表柔比星的起到很好的增溶作用,使盐酸表柔比星达到所需浓度,同时选用gcg作为抗氧化剂,防止了盐酸表柔比星被氧化,提供了一种稳定性更好的注射用盐酸表柔比星冻干粉针制剂。
[0015]
为实现上述目的,本发明目的之一是提供了注射用盐酸表柔比星冻干粉针,主要由盐酸表柔比星、赋形剂、抗氧化剂、ph调节剂和注射用水组成。
[0016]
所述赋形剂为甘露醇、d-山梨醇、右旋糖酐、葡萄糖、氯化钠、磺丁基倍他环糊精钠中的一种或多种,优选为磺丁基倍他环糊精钠。
[0017]
所述抗氧化剂选自抗坏血酸衍生物、硫代衍生物、氨基酸类、有机酸类、酚类、胺类中的至少一种;
[0018]
所述抗氧化剂选自酚类中至少一种;
[0019]
所述抗氧化剂优选为gcg;
[0020]
所述盐酸表柔比星与gcg的重量比为1:0.85~1.0,优选为1:0.9;
[0021]
所述盐酸表柔比星与磺丁基倍他环糊精钠的重量比为1:10~15,优选为1:12;
[0022]
所述ph调节剂选为柠檬酸盐缓冲液或磷酸盐缓冲液,所述ph范围为4.0~5.0,优选为4.5。
[0023]
所述注射用水的体积为1000ml。
[0024]
本发明目的之二,是提供上述注射用盐酸表柔比星冻干粉针的制备工艺,主要包括以下步骤:
[0025]
称取处方量盐酸表柔比星、赋形剂、抗氧化剂,溶于约60%配制体积的注射用水
中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;
[0026]
加注射用水至全量,搅拌均匀,调节ph值至4.0~5.0,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;
[0027]
开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40小时;再次提高搁板温度至40℃,保持2~4小时,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0028]
本发明经过影响因素试验表明质量稳定,完全达到车间规模化生产的工艺质量要求。
[0029]
本发明所述的上述目的具有以下有益效果:
[0030]
1.磺丁基倍他环糊精钠具备良好的水溶性,溶解度超过50g,神毒性更低,溶血性和生物刺激性均较小,能很好地保持了冻干粉针的稳定性,解决了冻干粉针中活性成分溶解性不好且易分解变质的问题,适用于冻干粉针剂的制备。
[0031]
2.选用gcg作为抗氧化剂,既能避免盐酸表柔比星被氧化分解,同时gcg作为绿茶茶多酚的主要组成成分,具有抗炎以及抗肿瘤作用。
[0032]
3.由实施例和对比实施例所制得制剂的长期考察可知:本发明所得制剂经过灭菌后各项指标均符合规定,长期实验数据显示制剂稳定性良好。
附图说明
[0033]
图1实施例1、对比实施例7、国产和原研产品加速试验的含量变化对比图
[0034]
图2实施例1、对比实施例7、国产和原研产品加速试验的有关物质变化对比图
具体实施方式
[0035]
下面结合实施例对本发明的具体实施方式作进一步描述,但这些实施例仅是范例性的,仅用于说明本发明并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。下列实施案例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件,实施例中所用的各种试剂均为普通市售产品。
[0036]
磺丁基倍他环糊精钠sbcd山东滨州智源生物科技有限公司生产批号sb20210505、sb20210620、sb20211106。
[0037]
实施例1
[0038]
注射用盐酸表柔比星冻干粉针的制备
[0039]
[0040]
制备工艺:
[0041]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0042]
实施例2
[0043]
注射用盐酸表柔比星冻干粉针的制备
[0044][0045]
制备工艺:
[0046]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,磷酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0047]
实施例3
[0048]
注射用盐酸表柔比星冻干粉针的制备
[0049][0050]
制备工艺:
[0051]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.8g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,
保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0052]
实施例4
[0053]
注射用盐酸表柔比星冻干粉针的制备
[0054][0055]
制备工艺:
[0056]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 4.93g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0057]
实施例5
[0058]
注射用盐酸表柔比星冻干粉针的制备
[0059][0060]
制备工艺:
[0061]
称取盐酸表柔比星5.8g、d-山梨醇58.0g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0062]
实施例6
[0063]
注射用盐酸表柔比星冻干粉针的制备
[0064][0065]
制备工艺:
[0066]
称取盐酸表柔比星5.8g、甘露醇78.8g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.0,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0067]
实施例7
[0068]
注射用盐酸表柔比星冻干粉针的制备
[0069][0070]
制备工艺:
[0071]
称取盐酸表柔比星5.8g、右旋糖酐69.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至5.0,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0072]
对比实施例1
[0073]
注射用盐酸表柔比星冻干粉针的制备
[0074]
[0075]
制备工艺:
[0076]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 2.9g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0077]
对比实施例2
[0078]
注射用盐酸表柔比星冻干粉针的制备
[0079][0080][0081]
制备工艺:
[0082]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 8.7g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0083]
对比实施例3
[0084]
注射用盐酸表柔比星冻干粉针的制备
[0085][0086]
制备工艺:
[0087]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠46.4g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,
保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0088]
对比实施例4
[0089]
注射用盐酸表柔比星冻干粉针的制备
[0090][0091][0092]
制备工艺:
[0093]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠98.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0094]
对比实施例5
[0095]
注射用盐酸表柔比星冻干粉针的制备
[0096][0097]
制备工艺:
[0098]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至1.0,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0099]
对比实施例6
[0100]
注射用盐酸表柔比星冻干粉针的制备
[0101][0102]
制备工艺:
[0103]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至8.0,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0104]
对比实施例7
[0105]
注射用盐酸表柔比星冻干粉针的制备
[0106][0107]
制备工艺:
[0108]
称取盐酸表柔比星5.8g、gcg 5.22g,溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0109]
对比实施例8
[0110]
注射用盐酸表柔比星冻干粉针的制备
[0111][0112]
制备工艺:
[0113]
称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g溶于约60%配制体积的注射
用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0114]
对比实施例9
[0115]
注射用盐酸表柔比星冻干粉针的制备
[0116]
盐酸表柔比星
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5.8g
[0117]
枸橼酸钠缓冲液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
适量
[0118]
注射用水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
加至1000ml
[0119]
制备工艺:
[0120]
称取盐酸表柔比星5.8g溶于约60%配制体积的注射用水中,加入0.1%(w/v)针用活性炭,搅拌20分钟,脱炭过滤至药液澄清;加注射用水至全量,搅拌均匀,枸橼酸钠缓冲液调节ph值至4.5,药液经0.22μm的微孔滤膜除菌过滤后罐装于西林瓶中,半加塞,放入冻干箱中;开启冻干机,将冻干搁板降至-40℃~-50℃,待产品温度降至-40℃,保温约2~5小时;开始抽真空,然后逐步提高搁板温度至-15℃,保持20~40h;再次提高搁板温度至40℃,保持2~4h,真空度维持在0~10pa,直至制品水分合格冻干结束,全加塞出箱;轧铝盖,检验,包装,即得。
[0121]
对比实施例10
[0122]
注射用盐酸表柔比星冻干粉针的制备
[0123][0124][0125]
制备工艺:
[0126]
在无菌操作室内称取盐酸表柔比星5.8g、磺丁基倍他环糊精钠69.6g、gcg 5.22g,置于适当无菌容器中,加入到60%配制体积的注射用水中,搅拌使其溶解,加枸橼酸钠缓冲液调节ph值至4.5,补加注射用水至全量,然后加入0.1%(w/v)针用活性炭,搅拌20分钟,用无菌抽滤漏斗铺两层灭菌滤纸过滤,再用经灭菌的g6垂溶漏斗精滤,滤液检查合格后,分装于2ml安瓿中,低温冷冻干燥约26h后无菌熔封即得。
[0127]
验证实施例
[0128]
将实施例1-7和对比实施例1-10所制得的制剂分别在高温下灭菌,灭菌前后进行测定,并在2-8℃条件下进行0、6、12、24个月外观性状、可见异物、有关物质、含量等项目的长期考察,样品检测结果见表1:
[0129]
表1实施例1~7和对比实施例1~10制剂检测结果
[0130]
[0131]
[0132][0133]
由实施例1~7和对比实施1~10例所制得制剂的长期考察可知:对比实施例1~7中的制剂虽然符合要求,但是长期试验考察可知,其可见异物(白点)等指标发生改变,尤其是对比实施例9在缺少抗氧化剂和增溶剂时,制剂在灭菌的过程中就已经发生变质,而本发明实施例1~7所得制剂经过灭菌后各项指标均符合规定,长期实验数据显示制剂稳定性良好。
[0134]
将实施例1、对比实施例7、国产注射用盐酸表柔比星(浙江海正药业)和原研产品(美国辉瑞制药)进行加速试验,观察对注射用表柔比星的影响,结果见表2。
[0135]
表2加速试验对注射用表柔比星的影响
[0136][0137]
从加速试验和长期实验结果来看,实施例1所制得冻干粉针制剂,选用磺丁基倍他环糊精钠作为赋形剂,gcg作为抗氧化剂,所得产品质量稳定,与原研相比无明显差异,甚至优于国内同类别产品。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1