米糠活性肽在预防或治疗脂毒性相关疾病中的应用的制作方法
1.本发明涉及蛋白领域,特别涉及米糠活性肽在预防或治疗脂毒性相关疾病中的应用。
背景技术:
2.随着人们对于食物的精细化要求,稻谷副产物的开发和利用成为了一个研究的热点。米糠是将糙米加工成白米这一过程中产生的主要副产物,其米糠蛋白在其营养性和致敏性方面有良好的优势。因此,由米糠蛋白经水解制备的具有多项生物活性功能的米糠活性肽也逐渐受到重视。米糠活性肽已经在清除体内活性氧、抗氧化、抗衰老方面取得较好的效果。
3.秀丽隐杆线虫(c.elegans)是当今世界唯一一个身体中所有细胞都能被逐个盘点归类的生物,并且具有寿命短、身体透明易于观察、饲养成本低、容易获取大量同期化样本、可长期保存、实验可操作性强等优点,已经成为人们科研探索中常用的模式生物。同时由于在秀丽隐杆线虫中核心的脂肪和糖代谢途径是保守的,其脂肪调节途径在哺乳动物中起着类似的作用,因此秀丽隐杆线虫也是研究脂代谢调节和脂毒性研究的一个很好的模式生物。hepg2细胞是人肝癌细胞株,在细胞水平中研究脂毒性和脂代谢具有在个体中同等的生物学效应,因此hepg2细胞是在细胞水平中研究脂毒性相关的常用细胞。c57bl/6j小鼠特别适合t2d糖尿病、肥胖、动脉粥样硬化等代谢异常的病症,因此用c57bl/6j小鼠作为在代谢异常中研究脂毒性是一种可行的模式生物。
4.所谓脂毒性是指脂质及其中间产物的过度积累会导致机体的代谢异常和细胞死亡,其特点是引起氧化应激、内质网应激、炎症等,常见于肥胖症、脂肪肝、ii型糖尿病、动脉粥样硬化等代谢异常的病症中。当脂质的持续性积累或机体中脂毒性持续性存在使代谢功能出现异常,导致代谢性疾病的发生。降低脂毒性,可以从根本上改善代谢异常带来应激反应,从而改善机体由脂质代谢异常引起的代谢性疾病。
5.目前未见我国有关于米糠活性肽在改善细胞脂毒性的相关文献研究,因此关于米糠活性肽在预防或治疗脂毒性相关疾病方面的研究尚待探索。
技术实现要素:
6.本发明的目的在于提供米糠活性肽在预防或治疗脂毒性相关疾病中的应用,为米糠活性肽的进一步开发利用与推广提供参考理论依据。
7.为实现上述目的,本发明的技术方案如下:
8.米糠活性肽在制备预防或治疗脂毒性相关疾病的制剂或食品中的应用,所述米糠活性肽序列为lys-his-asn-arg-gly-asp-glu-phe或lys-his-asn-arg-gly-asp-glu。
9.所述的米糠活性肽作为单一活性成分或者与其他预防或治疗脂毒性相关疾病的制剂或食品共同作为活性成分。
10.优选的,所述脂毒性相关疾病包括肥胖症、脂肪肝、ⅱ型糖尿病、动脉粥样硬化、糖
尿病肾病。
11.本发明的又一种实施方式中,提供了一种用于预防或治疗脂毒性相关疾病的制剂或食品,该药物制剂或食品包括米糠活性肽作为单一活性成分或者与其他预防或治疗脂毒性相关疾病的制剂或食品共同作为活性成分;所述米糠活性肽序列为lys-his-asn-arg-gly-asp-glu-phe或lys-his-asn-arg-gly-asp-glu。
12.制剂的活性成分含有所述的米糠活性肽及其在药学上可接受的盐、酯、溶剂合物的一种或多种形式的组合物。
13.食品的活性成分含有所述的米糠活性肽及其在食品上可接受酸、盐、溶解混合等处理形式。
14.药学上可接受的载体或赋形剂包括一种或多种固体、半固体或液体辅料。
15.食品上可接受的载体或赋形剂包括固体、半固体、液体附加成分或食品添加剂。
16.本领域技术人员可以理解,本发明的制剂适用于各种给药方式,例如口服给药、经皮给药、静脉给药、肌肉内给药、局部给药、经鼻给药等。根据所采用的给药方式,可将本发明的米糠活性肽的制剂制成各种合适的剂型,其中包含至少一种有效剂量的本发明的米糠活性肽和至少一种药学上可接受的药用载体。适当剂型的实例为片剂、胶囊、糖衣片剂、粒剂、口服溶液和糖浆,用于皮肤表面的油膏和药贴,气雾剂、鼻喷剂,以及可用于注射的无菌溶液。
17.含有本发明米糠活性肽的制剂可以制成溶液或者冻干粉末以用于胃肠外给药,在使用前可加入适当溶剂或其他可药用的载体将粉末重新配置,液体配方一般是缓冲液、等渗溶液和水溶液。
18.本发明的制剂或食品的用量可以在一个较大范围内变动,本领域技术人员可以根据一些客观的因素,如根据疾病的种类、病情严重程度、病人体重、剂型以及给药途径等因素很容易的加以确定。
19.本发明还要求保护一种米糠活性肽,其序列为lys-his-asn-arg-gly-asp-glu。
20.本发明还要求保护所述米糠活性肽的提取方法,包括:
21.酸性条件下,在kf-8米糠活性肽中加入模拟胃液进行酶解,后调整ph至中性,加入模拟肠液进行酶解,反应结束后得到消化产物,分离提纯得到所述米糠活性肽;
22.所述kf-8米糠活性肽的序列为lys-his-asn-arg-gly-asp-glu-phe。
23.优选的,所述酸性条件为ph值为2.0。
24.优选的,所述模拟胃液为胃蛋白酶的盐酸溶液。
25.优选的,所述胃蛋白酶与底物的质量比为1:40;模拟胃液的酶解时间2h。
26.优选的,所述模拟肠液包括胆汁盐和胰蛋白酶的nahco3溶液。
27.优选的,所述胰蛋白酶与胆汁盐的质量比为4:25。
28.优选的,所述模拟肠液的酶解时间2h。
29.进一步优选的,所述米糠活性肽的提取方法,包括:
30.将kf-8米糠活性肽配置成浓度为40mg/ml的生理盐水溶液,取10ml kf-8溶液先加入1ml模拟胃液(0.05g胃蛋白酶(购自sigma)溶于5ml的0.01m hcl中),再迅速用2mol/l的hcl调节ph=2.0。并在37℃恒温水浴摇床震荡消化2h,经沸水浴10min使胃蛋白酶失活,冷却后经4000r/min离心10min后取上清备用。取5ml模拟胃消化的溶液加入1mol/l nahco3至
ph=7.0,加入1ml模拟肠液(25g胆汁盐(购自sigma)和4g胰蛋白酶(购自sigma)溶于1l的0.1mol/lnahco3溶液)再置于37℃恒温水浴摇床中消化2h。反应结束后,将样品加热到85℃持续20min终止酶反应,3500r/min离心15min后取上清液真空浓缩冷冻干燥获得米糠活性肽kf-8的消化产物。将其消化产物通过sp-sephadex g-15离子交换层进一步洗脱得到(pa-pe)得到中间产物pa,再将其进行rt-hplc(采用0.1%三氟乙酸的乙腈/水)进行梯度洗脱分离纯化肽段,得到pa-β,将其冷冻干燥得到米糠活性肽ke-7。
31.所述的米糠活性肽在预防或治疗脂毒性相关疾病的具体技术方案如下:
32.油红o染色主要是对秀丽隐杆线虫和hepg2细胞脂滴表达进行表征,通过脂滴的数量和大小来判断米糠活性肽对脂毒性的恢复作用。
33.线虫实验分为空白组、米糠活性肽ke-7组(100mg/l)、米糠活性肽kf-8组(100mg/l),每组30条线虫。l2期秀丽隐杆线虫转移至含有1m棕榈酸的ngm板中(对照组不含棕榈酸),在20℃下培养36h后,将线虫用m9缓冲液清洗3次,然后在室温条件下进行,油红o染色过夜。染色完成将线虫挑至在琼脂玻片上在荧光倒置显微镜下,200倍镜下进行拍照,记录脂滴表达位置变化。之后对图片进行分析,计算秀丽隐杆线虫脂滴表达含量,数据分析后绘图。
34.细胞实验分为空白组、棕榈酸损伤组、米糠活性肽低剂量组(30μg/ml)、米糠活性肽中剂量组(40μg/ml)、米糠活性肽高剂量组(50μg/ml)。每组铺设细胞(密度为1
×
105cell/ml)在六孔板中,在培养箱培养细胞贴壁之后加入棕榈酸(400μm)和米糠活性肽(对照组不含两种效应物),在培养24h后进行油红o染色30min,染色完成,放置在荧光倒置显微镜下200倍镜下进行拍照,记录脂滴表达的变化,之后进行数据分析处理后绘图。培养箱条件37℃、5%co2。
35.活性氧主要是对秀丽隐杆线虫和hepg2细胞进行氧化损伤表征,通过活性氧来判断米糠活性肽对脂毒性引起的氧化损伤的恢复作用。
36.线虫实验分为空白组、米糠活性肽ke-7组(100mg/l)、米糠活性肽kf-8组(100mg/l),每组30条线虫。l2期秀丽隐杆线虫转移至含有1m棕榈酸的ngm板中(对照组不含棕榈酸),在20℃下培养36h后,将线虫用m9缓冲液清洗3次,然后在室温条件下进行,dcfh-da探针孵育。孵育完成将线虫挑至在琼脂玻片上在荧光倒置显微镜下,进行荧光定量,之后记录数据绘图。
37.细胞实验分为空白组、棕榈酸损伤组、米糠活性肽高剂量组(50μg/ml)。每组铺设细胞(密度为1
×
105cell/ml)在小皿中,在培养箱培养细胞贴壁之后加入棕榈酸(400μm)和米糠活性肽(对照组不含两种效应物),在培养24h后进行dcfh-da探针孵育,经流式细胞仪进行数据收集,分析处理后绘图。培养箱条件37℃、5%co2。
38.细胞存活率主要是对hepg2细胞毒性进行表征,通过细胞存活率来判断米糠活性肽对细胞毒性的恢复作用。
39.细胞实验分为空白组、棕榈酸损伤组、米糠活性肽ke-7低剂量组(30μg/ml)、米糠活性肽ke-7中剂量组(40μg/ml)、米糠活性肽ke-7高剂量组(50μg/ml)、米糠活性肽kf-8低剂量组(30μg/ml)、米糠活性肽kf-8中剂量组(40μg/ml)、米糠活性肽kf-8高剂量组(50μg/ml)。每组铺设细胞(密度为1
×
105cell/ml)在96孔板中,在培养箱培养细胞贴壁之后加入棕榈酸(400μm)和米糠活性肽(control组不含两种效应物),在培养24h后,加入cck-8培养
1h,酶标仪450nm条件下测量吸光度,之后进行数据分析处理后绘图。培养箱条件37℃、5%co2。
40.本发明的优点:
41.1)本发明的米糠活性肽具有良好的生物学活性;
42.2)本发明的米糠活性肽对于脂毒性相关疾病具有良好的干预和治疗效果;
43.3)本发明的米糠活性肽为全天然的提取肽,不易产生耐药性。
附图说明
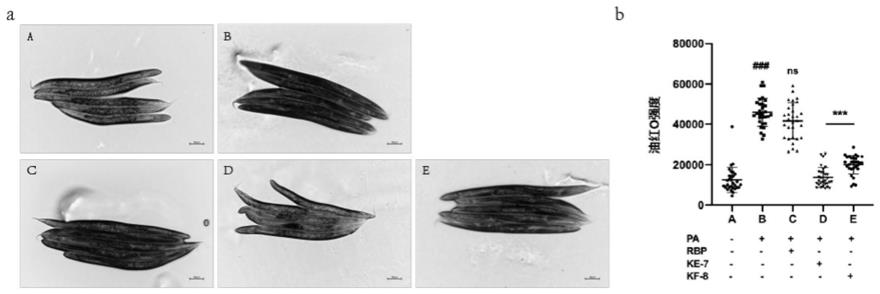
44.图1为秀丽隐杆线虫脂滴表征实验的结果图,其中单因素方差分析,###:与con组相比,p《0.001;ns:与pa组相比,p》0.05;***:与pa组相比,p《0.001;
45.图2为秀丽隐杆线虫的活性氧测定的实验结果图,单因素方差分析,###:与con组相比,p《0.001;ns:与pa组相比,p》0.05;***:与pa组相比,p《0.001;*:与pa组相比,p《0.05;
46.图3为ke-7处理hepg2细胞的脂滴表征实验的结果图,单因素方差分析,###:与con组相比,p《0.001;ns:与pa组相比,p》0.05;***:与pa组相比,p《0.001;**:与pa组相比,p《0.01;
47.图4为kf-8处理hepg2细胞的脂滴表征实验的结果图,单因素方差分析,##:与con组相比,p《0.01;ns:与pa组相比,p》0.05;**:与pa组相比,p《0.01;*:与pa组相比,p《0.005;
48.图5为hepg2细胞毒性实验的结果图,单因素方差分析,###:与con组相比,p《0.001;***:与pa组相比,p《0.001;
49.图6为hepg2细胞的活性氧测定的实验结果图,单因素方差分析,###:与con组相比,p《0.001;ns:与pa组相比,p》0.05;**:与pa组相比,p《0.01;
50.图7为c57bl/6j小鼠的葡萄糖耐量的结果图,单因素方差分析,###:与wt组相比,p《0.001;***:与hfd组相比,p《0.001;
51.图8为c57bl/6j小鼠血液中总胆固醇水平的结果图,单因素方差分析,###:与wt组相比,p《0.001;*:与hfd组相比,p《0.05;
52.图9为c57bl/6j小鼠血液中甘油三酯水平的结果图,单因素方差分析,###:与wt组相比,p《0.001;**:与hfd组相比,p《0.01;
具体实施方式
53.实施例1
54.米糠活性肽的提取
55.米糠经过榨油后得到废渣,烘干粉碎得到脱脂米糠,过60目筛后,加水调节ph=9.0、水浴40℃、4h后以8000r/min离心15min,取上清。再调节ph=4.0,以8000r/min离心15min,取沉淀。水洗三次、调节ph=7.0后冷冻干燥48h,分级纯化提取米糠谷蛋白。米糠谷蛋白加水溶解后得到5%谷蛋白悬浮液,调节ph后恒温酶解。酶解完成后85℃灭酶10min,3500r/min离心15min后取上清液真空浓缩冷冻干燥获得米糠蛋白酶水解产物。使用sp-sephadex g-25离子交换层析进一步洗脱米糠蛋白酶水解产物得到7个组分(pa-pg),选择pf组分用sephadex g-15凝胶层析将其分离得到pf1、pf2、pf3。利用制备rp-hplc对pf3进一步分成5个组分后得到pf3-γ,冷冻干燥后获得物质即为实验后续所用的kf-8米糠活性肽。
(参考:中南林业科技大学.一种米糠抗氧化活性肽的分离制备方法:中国,cn106636274b[p].2021-06-11)。
[0056]
将kf-8米糠活性肽配置成浓度为40mg/ml的生理盐水溶液,取10ml kf-8溶液先加入1ml模拟胃液(0.05g胃蛋白酶(购自sigma)溶于5ml的0.01m hcl中),再迅速用2mol/l的hcl调节ph=2.0。并在37℃恒温水浴摇床震荡消化2h,经沸水浴10min使胃蛋白酶失活,冷却后经4000r/min离心10min后取上清备用。取5ml模拟胃消化的溶液加入1mol/l nahco3至ph=7.0,加入1ml模拟肠液(25g胆汁盐(购自sigma)和4g胰蛋白酶(购自sigma)溶于1l的0.1mol/l nahco3溶液)再置于37℃恒温水浴摇床中消化2h。反应结束后,将样品加热到85℃持续20min终止酶反应,3500r/min离心15min后取上清液真空浓缩冷冻干燥获得米糠活性肽kf-8的消化产物。将其消化产物通过sp-sephadex g-15离子交换层进一步洗脱得到(pa-pe)得到中间产物pa,再将其进行rt-hplc(采用0.1%三氟乙酸的乙腈/水)进行梯度洗脱分离纯化肽段,得到pa-β,将其冷冻干燥得到米糠活性肽ke-7。
[0057]
实施例2
[0058]
线虫的复苏与常规培养
[0059]
从-80℃超低湿冰箱取出程序降温盒,于室温自然解冻后取出线虫冻存管。完全解冻后2000r/min离心2min,弃上清,剩下的线虫悬浮液用枪头加到涂有4倍e.coli op50的线虫生长培养基(ngm培养基)平板上,旋转平板使其分布均匀,20℃培养箱培养,湿度为40-60%。
[0060]
复苏完成后,进行切块传代培养。准备含有大量秀丽隐杆线虫的培养皿(称ngm a皿),涂完e.coli op50的ngm皿(称ngm b皿)酒精灯、刀片、镊子。将刀片用酒精棉擦拭。然后置于酒精灯外焰灼烧,稍稍放凉;在ngm a皿中找寻一个干净的虫子数量多的地方,用刀片划一个0.5cm
×
0.5cm区域,将这块ngm块转移至ngm b皿中;将其放入培养箱30min,此时大部分ngm块中的虫子爬行到ngm b皿中,将ngm块挑走;继续在培养箱培养。
[0061]
实施例3
[0062]
线虫同期化流程
[0063]
为保证实验的准确性,在进行每一批实验前,需要将线虫同期化处理,以保证其生长阶段的一致。首先准备3个含有秀丽隐杆线虫的培养皿,待线虫进入l4期(产卵期),用4ml的m9溶液将线虫全部皿表面冲下,收集至10ml离心管中,3000r/min离心2min,弃掉上清加入3.5ml m9缓冲液后,再加入1000μl次氯酸钠和500μl氢氧化钠(5mol/l),混合均匀后上下颠倒或涡旋裂解4min左右(根据虫子多少可进行调整)2000r/min离心1min,弃上清。再加入5ml m9缓冲液洗涤虫卵,然后置于600r/min、离心2min,弃上清,再依照此步骤重复三次。吸取虫卵悬浮液点到ngm空皿中,20℃培养箱待孵化,24h孵出幼虫转至涂有op50的ngm平板培养。
[0064]
实施例4
[0065]
秀丽隐杆线虫油红o染色实验
[0066]
1、将处于产卵期的秀丽隐杆线虫裂解后,将虫卵在含有op50的ngm板中,置于20℃的培养箱内孵化15h。
[0067]
2、待虫卵孵化后培养约半天至l2期,用m9缓冲液洗至离心管中,在3000r/min条件下离心后,除去上清液(剩余250μl的液体),将秀丽隐杆线虫悬液吹打重悬,吸取50μl悬液
加入到含有1m棕榈酸的ngm平板中(对照组不含棕榈酸)。其中设置的a-e五个组中,a为对照组(con),即不含棕榈酸(pa),b-e都加入了棕榈酸,b为棕榈酸对照组(pa),a和b中的op50不加其他物质,c-e组中的op50中依次含100mg/l的米糠蛋白(rbp)、100mg/l的米糠活性肽ke-7、100mg/l的米糠活性肽kf-8。
[0068]
3、在20度下培养36h后,将每组线虫用m9缓冲液洗涤三次,然后用4%甲醛固定15分钟,用60%异丙醇脱水15分钟。将油红o(oro)溶液(0.5g/100ml异丙醇)在双蒸馏水稀释至60%工作溶液并过滤。将固定的线虫在室温下在oro工作溶液中孵育过夜。让线虫沉淀后,用含有0.01%triton x-100的200μl的m9洗涤蠕虫。
[0069]
4、将染色完全的线虫在相同的设置和曝光时间下,随机选择大约30只oro染色线虫,用尼康倒置荧光显微镜进行成像。image pro-plus用于量化oro强度。
[0070]
5、将量化数据收集汇总,所有数据绘图均使用graphpad prism,数据分析使用spss。
[0071]
结果:如图1所示。油红o染色主要是对秀丽隐杆线虫脂滴表达进行表征,与损伤组相比,100mg/l的rbp、ke-7、kf-8保护组分别将脂滴含量降低了8.53%、70.06%、53.12%。通过给予米糠蛋白和米糠活性肽,发现米糠蛋白虽然能降低脂滴的表达量,但其作用非常有限,是不显著的;而米糠活性肽能够显著恢复由棕榈酸引起秀丽隐杆线虫的脂滴表达增高。说明米糠活性肽组减少脂滴的能力要明显优于米糠蛋白组。当给予棕榈酸时,其脂滴增多在线虫的头部和尾部;通过给予米糠活性肽,能够使头部和尾部的脂滴减少。其中ke-7和kf-8都能极显著的减少脂滴表达,说明米糠活性肽能改善脂质积累或促进脂质代谢。
[0072]
实施例5
[0073]
秀丽隐杆线虫氧化损伤实验
[0074]
1、将处于产卵期的秀丽隐杆线虫裂解后,将虫卵在含有op50的ngm板中,置于20℃的培养箱内孵化15h。
[0075]
2、待虫卵孵化后培养约半天至l2期,用m9缓冲液洗至离心管中,在3000r/min条件下离心后,除去上清液(剩余250μl的液体),将秀丽隐杆线虫悬液吹打重悬,吸取50ul悬液加入到含有1m棕榈酸的ngm平板中(对照组不含棕榈酸)。其中设置的a-e五个组中,a为对照组,即不含棕榈酸,b-e都加入了棕榈酸(b为棕榈酸损伤组),a和b中的op50不加其他物质,c-e组中的op50中依次含100mg/l的米糠蛋白(rbp)、100mg/l的米糠活性肽ke-7、100mg/l的米糠活性肽kf-8。
[0076]
3、在20度下培养36h后,将每组线虫用m9缓冲液洗至离心管中并用m9清洗三次。每次用800r/min离心2min,留下沉淀。
[0077]
4、向离心管中加入荧光探针dcfh-da(终浓度10mm),25℃孵育30min。孵育过程上下颠倒使虫子孵育充分。
[0078]
5、孵育完成,离心去上清,用m9缓冲液清洗2次。使用移液枪将虫子与液体混匀后吸出滴加在琼脂垫片上,同时在有虫子区域滴加2%左旋咪唑麻醉线虫。
[0079]
6、将琼脂垫片放置在荧光倒置显微镜下,4倍镜下用设备拍摄。后使用image-pro plus进行处理分析。
[0080]
结果:如图2所示。活性氧测定主要是对秀丽隐杆线虫氧化损伤进行表征,棕榈酸带来损伤导致活性氧急速增加,与空白对照组相比,b组的荧光强度从20.12上升至34.12。
而在损伤的同时给予100mg/l的米糠蛋白和米糠活性肽(ke-7或kf-8),可以发现其活性氧的荧光强度从34.12分别降至30.69、26.18、27.32。表明米糠蛋白基本不能改善氧化损伤,而ke-7和kf-8能够显著改善因脂毒性引起秀丽隐杆线虫的氧化损伤,说明米糠活性肽对其脂毒性具有一定的恢复作用。
[0081]
实施例6
[0082]
hepg2细胞油红o染色实验
[0083]
1、将处于对数生长期的细胞,接种到6孔板(细胞密度1
×
105cell/ml),在培养箱里培养(培养箱条件37℃、5%co2)。
[0084]
2、待细胞贴壁后,向每组加入对应的效应物,在培养箱内培养24h。其中设置组别为con为空白对照组、pa为棕榈酸损伤组(加入400μm的棕榈酸)、ke-7保护组(加入棕榈酸和30、40、50mg/ml ke-7米糠活性肽)和kf-8保护组(加入棕榈酸和30、40、50mg/ml kf-8米糠活性肽)
[0085]
3、准备油红o染液、pbs缓冲液、双蒸水和固定液。将6孔板拿出吸取细胞培养液,向孔边缘缓慢加入1ml pbs清洗细胞,加入4%的多聚甲醛固定液室温固定8min,再用pbs漂洗两次。
[0086]
4、向孔内加入60%异丙醇覆盖细胞15s,再吸走后,稍稍晾干水分。
[0087]
5、向板内加入1ml油红o染色液(现配现用,需用滤纸过滤3次),室温避光染色30min,去除染液;加入60%异丙醇快速分化3~5s,纯水洗三次,每次5min。
[0088]
6、最后加入pbs覆盖细胞,放置在荧光倒置显微镜下200倍镜下进行拍照,记录脂滴表达的变化,之后进行数据分析处理后绘图。
[0089]
结果:如图3和图4所示。油红o染色主要是对hepg2细胞脂滴表达进行表征,与空白对照组相比,棕榈酸损伤组极显著增加了脂滴量,hepg2细胞周围一周形成密集聚集较大脂滴;而与棕榈酸损伤组相比,给予米糠蛋白和米糠活性肽都能够降低脂滴的表达量,其中图3和图4的米糠蛋白组分别降低了6.51%和21.42%(当细胞批次不同时,降低脂滴的效果略有不同,但其趋势没有差异),但其使脂滴聚集的程度是处理组中最小的;与棕榈酸损伤组相比,米糠活性肽ke-7的三个浓度(30、40、50μg/ml)分别降低了46.98%、83.93%、96.88%,米糠活性肽kf-8的三个浓度(30、40、50μg/ml)分别降低了94.51%、91.94%、82.45%,发现同样浓度下的ke-7和kf-8能够比米糠蛋白组使脂滴变的更小更少,且显著很多。这可能是由于米糠蛋白的大分子聚集使其生物活性肽段包裹,不能发挥本身具有的生物活性。同时与空白对照组相比,米糠活性肽(ke-7和kf-8)的高浓度没有显著差异,说明米糠活性肽在细胞水平上能改善脂质堆积和聚集,使其恢复到未损伤的程度。本技术人通过实验也发现,本技术的米糠活性肽的改善脂质堆积和聚集的效果甚至明显优于米糠甾醇。
[0090]
实施例7
[0091]
hepg2细胞毒性实验
[0092]
1、将处于对数生长期的细胞,接种到96孔板中(细胞密度1
×
105cell/ml),在培养箱里培养(培养箱条件37℃、5%co2)。
[0093]
2、待细胞贴壁后,向每组加入对应的效应物,在培养箱内培养24h。其中设置组别为con为空白对照组、pa为棕榈酸损伤组(加入400μm的棕榈酸)、ke-7保护组(加入棕榈酸和30、40、50mg/ml ke-7米糠活性肽)和kf-8保护组(加入棕榈酸和30、40、50mg/ml kf-8米糠
活性肽)。
[0094]
3、每孔直接加入10μl cck-8溶液,在培养箱孵育1h,在450nm条件下测量其吸光度。
[0095]
4、数据分析及处理:
[0096]
结果:如图5所示。细胞存活率主要是对hepg2细胞毒性进行表征,与对照组相比,棕榈酸损伤组显著降低了细胞活力,其细胞活力仅为79.43%;通过给予米糠活性肽(ke-7或kf-8),表示米糠活性肽能够显著恢复由脂毒性引起的细胞毒性。其中米糠活性肽50μg/ml时,其细胞活力为97.79%(ke-7)和97.81%(kf-8)能显著降低细胞毒性,并且其细胞活力并与空白对照组无差异。说明米糠活性肽对脂毒性引起的细胞毒性具有显著的恢复作用。
[0097]
实施例8
[0098]
hepg2细胞氧化损伤实验
[0099]
1、将处于对数生长期的细胞,接种到6cm培养皿中(细胞密度1
×
105cell/ml),在培养箱里培养(培养箱条件37℃、5%co2)。
[0100]
2、待细胞贴壁后,向每组加入对应效应物然后在培养箱内培养24h。其中设置的a-e五个组中,a为对照组,即不含任何效应物,b为棕榈酸损伤组(加入400μm棕榈酸),c为米糠蛋白保护组(加入400μm棕榈酸和50μg/ml rbp),d为米糠活性肽ke-7保护组(加入400μm棕榈酸和50μg/ml ke-7),d为米糠活性肽ke-8保护组(加入400μm棕榈酸和50μg/ml kf-8)。
[0101]
3、除去培基,用含edta的胰酶消化细胞,吸走液体,加入2ml预冷的pbs离心2次(每次800rpm,5min),弃去上层清液。
[0102]
4、收集细胞,加入按照1:1000用无血清培养液稀释dcfh-da,使终浓度为10μmol/l。
[0103]
5、将稀释好的dcfh-da重新悬浮各组分细胞,在37℃细胞培养箱内孵育20min。每隔5分钟颠倒混匀一下,使探针和细胞充分接触。
[0104]
6、用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da,并在1h内上流式细胞仪检测。
[0105]
结果:如图6所示。活性氧是氧化损伤最直接的表征指标。对hepg2进行活性氧检测,通过对荧光强度进行定量分析,可以发现,棕榈酸使活性氧水平显著增高到9.83。与棕榈酸损伤组相比,米糠蛋白和米糠活性肽(ke-7和kf-8)分别使活性氧水平降低了11.01%、46.56%、48.38%,表明米糠蛋白能使恢复活性氧水平但效果不显著,而米糠活性肽处理组(ke-7或kf-8)能显著降低由脂毒性引起的活性氧水平,从而使细胞免受氧化损伤。且ke-7或kf-8的处理效果之间差异不明显。
[0106]
实施例9
[0107]
c57bl/6j小鼠的葡萄糖耐量实验
[0108]
1、将雄性c57bl/6j(n=24,7周龄)于明暗循环12h,温度为22
±
3℃,湿度为50%~60%环境中,适应性生长一周。
[0109]
2、将所有小鼠随机分为4组:c57bl/6j+正常饮食(wt,n=6),c57bl/6j+高脂肪饮
食(hfd,n=6),c57bl/6j+高脂肪饮食+米糠活性肽ke-7(hfd+ke-7,n=6)c57bl/6j+高脂肪饮食+米糠活性肽kf-8(hfd+kf-8,n=6)。将米糠活性肽(30mg/kg)或0.9%生理盐水(空白对照组和模型组)灌胃到小鼠体内,隔天一次,持续12周。正常饮食含10%kcal脂肪,高脂肪饮食含60%kcal脂肪。高脂肪饮食经过一段时间的饲养后,明显呈现出肥胖症状,取相关指标验证,显示其造模成功。
[0110]
3、进食16h后,腹腔注射1g/kg体重的葡萄糖,分别在0、15、30、60、90和120min后,尾部采血用血糖仪测定血糖浓度。
[0111]
4、记录数据,分析数据。
[0112]
结果:如图7所示。糖耐量是判断机体对血糖调节能力好坏的表征指标,其能检测葡萄糖代谢功能,是判断糖尿病的指标之一。相比于空白对照组,高脂饮食组的血糖浓度明显升高。而与高脂饮食组相比,通过给予米糠活性肽(ke-7或kf-8),能够显著降低由高脂饮食小鼠的血糖水平。且ke-7的血糖水平与空白对照组相当,而kf-8组的血糖水平波动明显低于ke-7和空白组,说明米糠活性肽对脂毒性引起的高血糖具有显著的恢复作用,且kf-8组的糖耐性明显增强。
[0113]
实施例10
[0114]
c57bl/6j小鼠的总胆固醇水平
[0115]
1、将雄性c57bl/6j(n=24,7周龄)于明暗循环12h,温度为22
±
3℃,湿度为50%~60%环境中,适应性生长一周。
[0116]
2、将所有小鼠随机分为4组:a组为c57bl/6j+正常饮食(wt,n=6),b组为c57bl/6j+高脂肪饮食(wt+hfd,n=6),c组为c57bl/6j+高脂肪饮食+米糠活性肽ke-7(wt+hfd+ke-7,n=6),d组为c57bl/6j+高脂肪饮食+米糠活性肽kf-8(wt+hfd+kf-8,n=6)。将米糠活性肽(30mg/kg)或0.9%生理盐水灌胃到小鼠体内,隔天一次,持续12周。正常饮食含10%kcal脂肪,高脂肪饮食含60%kcal脂肪。高脂肪饮食经过一段时间的饲养后,明显呈现出肥胖症状,取相关指标验证,显示其造模成功。
[0117]
3、经12周治疗后,进行眼部采血。
[0118]
4、血液自然凝固20min,3000r/min离心20min,仔细收集上清(如有沉淀物,要再离心)。
[0119]
5、按照总胆固醇试剂盒(购自solarbio)说明书直接进行测量并计算。
[0120]
结果:如图8所示。总胆固醇升高是动脉粥样硬化、糖尿病中常见的表征性指标,通过给予米糠活性肽(ke-7或kf-8),能够显著降低由脂毒性引起的总胆固醇水平,与高脂饮食组相比,分别降低了16.45%和16.17%。说明米糠活性肽对脂毒性引起的总胆固醇水平异常具有显著的恢复作用。
[0121]
实施例11
[0122]
c57bl/6j小鼠的甘油三酯水平
[0123]
1、将雄性c57bl/6j(n=24,7周龄)于明暗循环12h,温度为22
±
3℃,湿度为50%~60%环境中,适应性生长一周。
[0124]
2、将所有小鼠随机分为4组:a组为c57bl/6j+正常饮食(wt,n=6),b组为c57bl/6j+高脂肪饮食(wt+hfd,n=6),c组为c57bl/6j+高脂肪饮食+米糠活性肽ke-7(wt+hfd+ke-7,n=6),d组为c57bl/6j+高脂肪饮食+米糠活性肽kf-8(wt+hfd+kf-8,n=6)。将米糠活性肽
(30mg/kg)或0.9%生理盐水灌胃到小鼠体内,隔天一次,持续12周。正常饮食含10%kcal脂肪,高脂肪饮食含60%kcal脂肪。高脂肪饮食经过一段时间的饲养后,明显呈现出肥胖症状,取相关指标验证,显示其造模成功。
[0125]
3、经12周治疗后,进行眼部采血。
[0126]
4、血液自然凝固20min,3000r/min离心20min,仔细收集上清(如有沉淀物,要再离心)。
[0127]
5、按照试甘油三酯剂盒(购自solarbio)说明书进行直接测量并计算。
[0128]
结果:如图9所示。甘油三酯增多是脂毒性并发症中常见的表征性指标,与空白对照组相比,高脂饮食组能显著增加血液中甘油三酯含量;通过给予米糠活性肽(ke-7或kf-8),能够显著降低由脂毒性引起的甘油三酯水平。与高脂饮食组相比,米糠活性肽(ke-7和kf-8)的甘油三酯水平降低了40.68%、36.88%。说明米糠活性肽对脂毒性引起的甘油三酯水平异常具有显著的恢复作用。
[0129]
综上,我们可以发现米糠活性肽能调节脂质转运使脂滴减少,脂毒性降低,能显著预防或治疗脂毒性相关疾病。
[0130]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1