雄激素剥夺在抑制雄激素非依赖性肿瘤生长中的应用的制作方法
1.本发明涉及肿瘤治疗技术领域,具体涉及雄激素剥夺在抑制雄激素非依赖性肿瘤生长中的应用。
背景技术:
2.伴随年龄增加,免疫系统功能进行性下降,导致个体对病原体易感性增加,对疫苗反应性减低,而罹患肿瘤和自身免疫病的风险上升。免疫衰老(immunosenescence)的标志性改变包括:1)初始淋巴细胞减少,而记忆细胞比例增加;2)对新抗原刺激应答能力下降;3)持续低水平炎症。尽管免疫衰老影响到免疫系统的方方面面,但受累最严重的还是t淋巴细胞及其介导的免疫应答。老年个体中,初始t细胞数量和t细胞受体(tcr)库多样性显著减低,而记忆t细胞比例增加;同时,t细胞功能也发生改变,主要表现为存活、增殖、细胞因子分泌和杀伤能力的下降。免疫衰老的原因可能是多方面,但很多改变都源于胸腺功能的退化。
3.胸腺是t淋巴细胞发育分化的场所。骨髓中的造血祖细胞从皮髓结合部迁入胸腺,遵从一个多阶段的、高度有序的发育程序,向成熟t细胞分化。根据cd4和cd8表达如否,胸腺t细胞发育分为三个主要阶段,即双阴性(dn)、双阳性(dp)和单阳性(sp)阶段。除发育中的t细胞外,胸腺中还另有一类重要细胞,即胸腺上皮细胞(thymic epithelial cell,tec),其在t细胞发育中发挥不可或缺的支持作用,tec分为皮质(ctec)和髓质(mtec)两种。尽管胸腺在t细胞发育分化中发挥不可替代的作用,但它的形态和功能从生命早期即开始发生进行性退化。在形态方面,由上皮细胞和发育中t细胞构成的功能性组织逐渐减少,而由脂肪细胞和成纤维细胞形成的血管周边组织则逐渐增加。在功能方面,胸腺产生和输出t细胞的能力明显降低,35岁时相当于新生儿的20%,65岁时仅约2%。在t细胞产生和输出减少的情况下,为维持外周t细胞数量的相对恒定,外周t细胞库发生稳态扩增,导致初始t细胞减少,而记忆性t细胞增加。同时,由于稳态扩增具有一定的克隆选择性,某些克隆更易自我增殖,最终导致tcr多样性降低。此外,在长期生存过程中,外周t细胞不可避免地累积越来越多的功能缺陷,导致t细胞应答能力减弱。因此,胸腺退化和免疫衰老息息相关。
4.雄激素剥夺治疗(androgen deprivation therapy,adt)是前列腺癌的常用治疗方法,能够直接诱导癌细胞凋亡,发挥直接杀伤肿瘤细胞的作用。雄激素剥夺治疗的手段主要包括手术去势和药物去势。目前,许多化学药物都可以达到雄激素剥夺的目的,包括促性腺激素释放激素(gnrh)激动剂(如leuprolide)和拮抗剂(如degarelix),雄激素合成抑制剂(abiraterone)以及ar拮抗剂(如flutamide)和降解促进剂(如asc-509)等。
5.近年来,以anti-pd-1为代表的肿瘤免疫疗法在部分患者取得了令人瞩目的成功,但70%以上患者对治疗缺乏反应性。导致免疫治疗原发抵抗的原因还不完全清楚。鉴于肿瘤组织中淋巴细胞浸润程度是一个重要的疗效预测指标,有理由推测基础抗肿瘤免疫水平决定了患者的反应性。然而,肿瘤患者多为老年个体,免疫衰老导致老年个体对包括肿瘤抗原在内的抗原刺激应答能力降低。而且,这种情形还会因放化疗对免疫细胞的损伤而进一
步恶化。因此,亟需提高肿瘤免疫疗法治疗效果的治疗手段。
技术实现要素:
6.本发明的目的是提供雄激素剥夺制剂在制备用于治疗雄激素非依赖性肿瘤的产品中的应用。
7.本发明在对雄激素剥夺的老龄小鼠的研究中发现,12-18月龄鼠的pbmc中,抗雄激素治疗(adt)组sjtrec水平明显升高,提示胸腺输出增加。利用rag2-gfp报告基因小鼠关注新近输出胸腺细胞(rte)水平,结果显示,经adt治疗后rte数目显著增多。经进一步研究发现,在以前列腺癌为代表的雄激素依赖性肿瘤中,adt不仅能直接诱导癌细胞凋亡,还可通过促进胸腺再生而发挥抗肿瘤作用。更值得关注的是,adt对雄激素非依赖性肿瘤,如肺癌、肝癌、肠癌细胞生长也有显著抑制作用;而且,adt还可以在雄激素非依赖性肿瘤中,与免疫治疗发挥协同作用。
8.基于上述发现,本发明提供以下技术方案:
9.第一方面,本发明提供降低雄激素含量的治疗剂和/或雄激素受体信号传导途径抑制剂在制备用于改善因衰老导致的胸腺功能退化的产品中的应用。
10.上述应用中,胸腺功能退化可表现为以下(1)-(5)中的任意一种或多种:
11.(1)由胸腺上皮细胞和发育中t细胞构成的胸腺功能性组织减少,由脂肪细胞和成纤维细胞形成的血管周边组织增加;
12.(2)胸腺产生和输出t细胞的能力降低;
13.(3)初始t细胞减少,记忆性t细胞增加;
14.(4)tcr多样性降低;
15.(5)t细胞应答能力减弱。
16.第二方面,本发明提供降低雄激素含量的治疗剂和/或雄激素受体信号传导途径抑制剂在制备用于改善免疫衰老的产品中的应用。
17.上述应用中,免疫衰老可表现为以下(1)-(3)中的任意一种或多种:
18.(1)初始淋巴细胞减少,记忆细胞比例增加;
19.(2)对新抗原刺激应答能力下降;
20.(3)持续低水平炎症。
21.第三方面,本发明提供降低雄激素含量的治疗剂和/或雄激素受体信号传导途径抑制剂在制备用于提高胸腺输出功能的产品中的应用。
22.上述应用中,胸腺输出功能优选为胸腺产生和输出t细胞的功能。
23.第四方面,本发明提供胸腺功能再生促进剂在制备用于治疗雄激素非依赖性肿瘤的产品中的应用。
24.上述应用中,胸腺功能再生促进剂为能够促进胸腺功能再生的治疗剂,包括但不限于降低雄激素含量的治疗剂、雄激素受体信号传导途径抑制剂等。
25.第五方面,本发明提供降低雄激素含量的治疗剂和/或雄激素受体信号传导途径抑制剂在制备用于治疗雄激素非依赖性肿瘤的产品中的应用。
26.第六方面,本发明提供降低雄激素含量的治疗剂和/或雄激素受体信号传导途径抑制剂在制备用于促进雄激素依赖性肿瘤患者的胸腺功能再生的产品中的应用。
27.第七方面,本发明提供免疫检查点抑制剂以及选自降低雄激素含量的治疗剂、雄激素受体信号传导途径抑制剂中的一种或多种在制备用于治疗雄激素非依赖性肿瘤的产品中的应用。
28.以上所述的应用中,所述降低雄激素含量的治疗剂为用于降低体内雄激素含量的治疗剂,包括但不限于抑制雄激素合成、分泌的治疗剂。
29.其中,所述抑制雄激素合成、分泌的治疗剂包括选自gnrh(或lhrh)激动剂、gnrh(或lhrh)拮抗剂、雄激素合成抑制剂中的一种或多种。
30.所述雄激素受体信号传导途径抑制剂包括选自ar(雄激素受体,androgen receptor)拮抗剂、ar降解促进剂、ar转录活性抑制剂的一种或多种。
31.所述免疫检查点抑制剂优选为肿瘤免疫检查点抑制剂,包括但不限于ctla-4抗体、pd-1抗体、pd-l1抗体等。
32.本发明中,gnrh(或lhrh)激动剂包括但不限于亮丙瑞林(leuprolide)、戈舍瑞林、曲普瑞林等;
33.gnrh(或lhrh)拮抗剂包括但不限于地加瑞克(degarelix)、西曲瑞克、阿巴瑞克、费蒙格等;
34.雄激素合成抑制剂包括但不限于阿比特龙(abiraterone)等。
35.ar拮抗剂为能够与雄激素受体结合并抑制雄激素激活其受体的治疗剂,包括但不限于氟他胺(flutamide)等;
36.ar降解促进剂为能够促进雄激素受体降解的治疗剂,包括但不限于asc-509等;
37.ar转录活性抑制剂为能够抑制ar基因转录调控作用的治疗剂,包括但不限于epi-506等。
38.本发明中,所述雄激素依赖性肿瘤的肿瘤细胞包括但不限于前列腺癌和乳腺癌,其特征是,在与不同浓度(1μm,5μm,10μm,15μm)的雄激素受体拮抗剂flutamide共培养72小时后,活细胞计数大幅减少,并呈现明显剂量依赖性。而对雄激素受体拮抗剂flutamide不敏感的肿瘤则为雄激素非依赖性肿瘤,包括但不限于肝癌、肺癌,结肠癌等。优选为肝癌或肺癌。
39.本发明中,所述治疗雄激素非依赖性肿瘤包括抑制肿瘤生长等。
40.以上所述的应用中,所述产品优选为药物或试剂盒。
41.第八方面,本发明提供一种药物,其包含免疫检查点抑制剂以及选自降低雄激素含量的治疗剂、雄激素受体信号传导途径抑制剂中的一种或多种。
42.优选地,所述降低雄激素含量的治疗剂为用于降低体内雄激素含量的治疗剂,包括但不限于抑制雄激素合成、分泌的治疗剂。
43.其中,所述抑制雄激素合成、分泌的治疗剂包括选自gnrh激动剂、gnrh拮抗剂、雄激素合成抑制剂中的一种或多种。
44.所述雄激素受体信号传导途径抑制剂包括选自ar拮抗剂、ar降解促进剂、ar转录活性抑制剂中的一种或多种。
45.所述免疫检查点抑制剂优选为肿瘤免疫检查点抑制剂,包括但不限于ctla-4抗体、pd-1抗体、pd-l1抗体等。优选地,所述免疫检查点抑制剂为pd-1抗体。
46.第九方面,本发明提供雄激素剥夺在雄激素非依赖性肿瘤治疗中的应用。
47.第十方面,本发明提供雄激素剥夺联合免疫检查点抑制剂在雄激素非依赖性肿瘤治疗中的应用。
48.本发明的有益效果在于:本发明发现雄激素剥夺治疗剂可用于重建衰老胸腺功能,从而促进雄激素非依赖性肿瘤的治疗,进而提供了雄激素剥夺治疗剂的新用途;本发明还发现在雄激素非依赖性肿瘤的治疗中,雄激素剥夺治疗剂与免疫检查点抑制剂能够产生协同增效作用,更有效地抑制雄激素非依赖性肿瘤的生长,为雄激素非依赖性肿瘤的治疗提供了新的策略,为拓展抗雄激素治疗的适用范围奠定基础,并为肿瘤免疫治疗新策略的开发提供思路。
附图说明
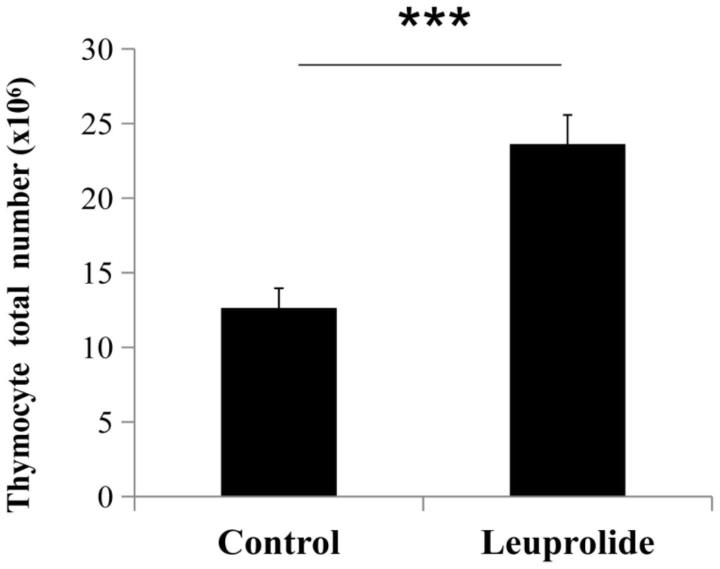
49.图1为本发明实施例1中胸腺细胞总数的检测结果。
50.图2为本发明实施例1中胸腺细胞各发育阶段分析结果。
51.图3为本发明实施例1中外周血单个核细胞(pbmc)中sjtrec水平检测结果。
52.图4为本发明实施例1中,rag-gfp报告基因小鼠的同一个体用药前后,pbmc细胞中gfp
+ t细胞比例的检测结果。
53.图5为本发明实施例1中,分组用药比较rag-gfp报告基因小鼠淋巴结中gfp
+ t细胞比例的检测结果。
54.图6为本发明实施例1中,分组用药比较rag-gfp报告基因小鼠脾细胞中gfp
+ t细胞比例的检测结果。
55.图7为本发明实施例2中,adt对前列腺癌的作用,其中,a为雄激素受体拮抗剂flutamide对体外培养的前列腺癌细胞rm-1生长的影响;b为老龄鼠rm-1皮下移植瘤模型中,flutamide和leuprolide对肿瘤生长的作用;c为leuprolide治疗对rm-1移植瘤中免疫细胞浸润的影响;d为在用药前实施胸腺切除术的老龄鼠移植瘤模型中,比较leuprolide对rm-1移植瘤生长的影响。
56.图8为本发明实施例2中,adt对结肠癌的作用,其中,a为flutamide对体外培养的结肠癌细胞mc-38生长的影响;b为老龄鼠mc-38皮下移植瘤模型中,leuprolide对结肠癌生长的作用;c为adt治疗对mc38移植瘤中免疫细胞浸润影响。
57.图9为本发明实施例2中adt对雄激素非依赖性肿瘤生长的作用,其中,a为flutamide对体外培养的肺癌细胞llc生长的影响;b为老龄鼠llc移植瘤模型中leuprolide对肿瘤生长的作用;c为flutamide对体外培养的肝癌hepa 1-6细胞生长的作用;d为老龄鼠hepa 1-6移植瘤模型中leuprolide对肿瘤生长的作用。
58.图10为本发明实施例2中adt治疗对hepa1-6移植瘤中免疫细胞浸润的影响。
59.图11为本发明实施例3中leuprolide、anti-pd-1单独以及二者联合使用对肺癌llc细胞和肝癌hepa 1-6细胞移植瘤生长的作用,其中,a为肺癌llc细胞;b为肝癌hepa 1-6细胞。
60.图12为本发明实施例3中leuprolide、anti-pd-1单独以及二者联合使用对前列腺癌rm-1细胞移植瘤生长的作用。
具体实施方式
61.以下实施例用于说明本发明,但不用来限制本发明的范围。
62.实施例1 adt诱导老龄动物胸腺再生
63.1.1.胸腺细胞总数增加
64.本实施例中使用的所有小鼠的遗传背景均为c57bl/6j,老龄鼠为12-18月龄。腹腔注射leuprolide 2mg/kg,3次/周,用药周期为4周,以生理盐水注射组作为对照(control)。处死小鼠后获取胸腺,制备胸腺细胞悬液,计数活细胞。结果如图1所示,leuprolide处理组的小鼠胸腺细胞总数显著升高。
65.1.2胸腺细胞发育大致正常
66.根据cd4和cd8的表达,胸腺细胞发育过程顺次分为dn,dp和sp三个阶段。而进一步基于cd44和cd25的表达,dn细胞又可分为四个亚群:dn1:cd25-cd44
+
;dn2:cd25
+
cd44
+
;dn3:cd25
+
cd44-;dn4:cd25-cd44-。利用流式染色分析上述1.1中adt处理后小鼠的胸腺细胞发育情况。结果显示,dn、dp、cd4 sp和cd8 sp细胞比例无明显改变;但针对dn细胞进行更细致分群的结果表明,adt用药组小鼠胸腺细胞发育中dn1阶段细胞比例显著降低(图2),提示细胞加速分化。
67.1.3胸腺输出增加
68.对sjtrec进行定量分析是公认的胸腺功能检测指标。通过实时定量pcr检测小鼠pbmc中sjtrec水平,并由此推断外周初始t细胞数目和胸腺输出功能。以梯度稀释(107,106,105,104,103和102)的标准质粒ct值为纵坐标,以标准质粒的拷贝数为横坐标,产生直线型标准曲线及一元回归方程。经内参标准化的不同样本的ct值由该一元回归方程可换算成样本的trec拷贝数,从而进行样本间的比较。对上述1.1中adt处理后小鼠的外周血单个核细胞(pbmc)中sjtrec水平进行定量分析,结果显示,leuprolide处理组sjtrec水平明显升高,提示胸腺输出增加(图3)。
69.rag-gfp报告基因小鼠中,gfp表达受rag启动子驱动,从胸腺细胞发育的dp后期即停止表达,此后随蛋白降解,荧光信号逐渐降低。因此,外周能检测到的gfp
+
t细胞均为过去1-2周从胸腺输出rte。以rag2-gfp报告基因小鼠为实验对象,对小鼠给予如上1.1中所述的leuprolide处理。从纵向,即收取同一个体leuprolide处理前和处理后25天的外周血pbmc,通过流式染色分析其gfp
+ t细胞比例(图4);同时从横向,对比未进行leuprolide处理以及leuprolide处理4周的12月龄老年鼠的外周淋巴细胞和脾细胞中gfp
+ t细胞比例(图5、图6)。结果表明,外周cd4和cd8 t细胞中gfp
+ rte细胞比例显著增加,提示胸腺输出水平增加。
70.实施例2 adt在肿瘤治疗中的作用
71.取1.5~4
×
106对数生长期前列腺癌rm-1、结肠癌mc-38、肺癌llc,肝癌hepa1-6细胞,皮下接种于12-18月龄c57bl/6j老龄鼠。其后开始腹腔给药:促性腺素释放激素激动剂leuprolide,2mg/kg,雄激素受体拮抗剂flutamide,50mg/kg,每周给药3次。隔日测量肿瘤体积(长
×
宽
×
宽/2),观测用药后小鼠的肿瘤生长状况。
72.体外培养上述肿瘤细胞系,加入不同浓度(1μm,5μm,10μm,15μm)flutamide,观察其对细胞生长的影响。体外培养时使用flutamide而非leuprolide,原因在于后者必须通过下丘脑-垂体-性腺轴发挥作用。
73.2.1 adt对前列腺癌生长的抑制作用部分依赖于其介导的胸腺再生
74.前列腺癌rm-1细胞体外培养中,加入上述浓度的flutamide,培养72小时后进行活细胞计数。结果如图7所示,flutamide导致活细胞减少,并呈现明显剂量依赖性,在15μm时,细胞死亡率超过90%,显示rm-1生长是雄激素依赖的(图7的a)。
75.在12-18月龄鼠建立rm-1皮下移植瘤模型,考察flutamide和leuprolide对肿瘤生长的影响。与预期一致,flutamide和leuprolide均能显著抑制肿瘤生长(图7的b)。
76.获取上述经leuprolide治疗的rm-1移植瘤样本,通过多色荧光染色,观察肿瘤组织中cd4 t细胞,cd8 t细胞及b淋巴细胞侵润情况。结果显示,leuprolide治疗组的免疫细胞浸润明显增多(图7的c)。为求证leuprolide诱导的胸腺再生在肿瘤抑制中可能发挥的作用,在给药前摘除老龄鼠胸腺。结果显示,leuprolide对rm-1移植瘤生长的抑制作用在胸腺切除小鼠中明显减弱(图7的d),说明leuprolide对前列腺癌的疗效很大程度上依赖于其促进胸腺再生的作用。
77.2.2 adt对雄激素非依赖性肿瘤生长的抑制作用
78.一般认为,结肠癌是雄激素非依赖肿瘤。但高浓度flutamide对结肠癌mc38细胞生长也有一定的抑制作用(图8的a)。在皮下移植瘤模型中,leuprolide亦能显著抑制结肠癌的肿瘤生长(图8的b)。同时获取上述经leuprolide治疗的mc38移植瘤样本,通过多色荧光染色,观察肿瘤组织中cd4 t细胞,cd8 t细胞和巨噬细胞浸润情况。结果显示,leuprolide治疗组的免疫浸润细胞明显增多(图8的c)。
79.类似地,在肺癌llc细胞(图9的a)和肝癌hepa 1-6细胞(图9的c)体外培养中,分别加入1μm、5μm、10μm、15μm的flutamide,用药72小时后进行活细胞计数。flutamide对这两种雄激素非依赖性肿瘤细胞的体外生长无明显影响。但在体内模型中,leuprolide介导的雄激素剥夺能显著抑制llc(图9的b)和hepa 1-6(图9的d)移植瘤生长。同时获取上述hepa1-6移植瘤样本,通过多色荧光染色,观察肿瘤组织中cd4 t细胞,cd8 t细胞和b淋巴浸润情况。结果显示,leuprolide治疗组的免疫浸润细胞明显增多(图10)。
80.实施例3 adt对免疫检查点抑制剂抗肿瘤效应的影响
81.本实施例分别以雄激素依赖性肿瘤(前列腺癌rm-1)和雄激素非依赖性肿瘤(肺癌llc细胞和肝癌hepa 1-6细胞)为研究对象,将上述肿瘤细胞皮下接种于受体鼠(遗传背景均为c57bl/6j,12-18月龄),其后开始腹腔给药:leuprolide,2mg/kg;anti-pd-1,200μg/只;均每周给药3次。隔日测量肿瘤体积(长
×
宽
×
宽/2),观测用药后小鼠的肿瘤生长状况。
82.用药对雄激素非依赖性肿瘤生长的影响如图11所示,leuprolide和anti-pd-1各自对肺癌llc细胞(图11的a)和肝癌hepa 1-6细胞(图11的b)移植瘤的生长有抑制作用,更重要的是,二者联合使用(剂量如上)呈现更强的抗肿瘤协同增效作用。
83.用药对雄激素依赖性肿瘤生长的影响如图12所示,在对雄激素依赖性的rm-1肿瘤治疗中,尽管adt和anti-pd-1均有抑制肿瘤生长的作用,但二者并无协同效应。
84.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1