一种川贝母总生物碱提取物、制备方法及应用与流程
1.本发明属于中药技术领域,尤其涉及一种川贝母总生物碱提取物、制备方法及应用。
背景技术:
2.目前,肺纤维化(pf)是肺间质弥漫性渗出、浸润和纤维化为主要病变的一类疾病,其主要症状包括呼吸困难、气短、干咳、喘憋现象,严重时会导致患者呼吸衰竭而死亡。目前对其发病机制仍不太清楚,随着环境污染的不断恶化,发病率正在逐年增加。目前西医对于肺纤维化的传统治疗手段主要是采用激素和免疫抑制剂类药物,但是疗效不理想而且还有副作用。中医文献没有关于肺纤维化的疾病名称,根据其症状可归属于“肺痹”、“肺痿”、“咳嗽”等,临床与实践表明中医药治疗肺纤维化显示一定的优势。
3.肺纤维化难以用单一病机来解释,很多医家认为:肺纤维化当属本虚标实,以肺肾气虚为本,以痰浊、瘀血、热毒等邪实内阻为标。在本病的发生、发展的整个过程中,正气不足是本病之本,“虚”、“痰”、“瘀”一直贯穿于疾病的始终。所以从化痰角度治疗具有重要意义。
4.《中国药典》(2020版)所记载的川贝母为百合科植物川贝母本品为百合科植物川贝母fritillariacirrhosad.don、暗紫贝母fritillariaunibracteatahsiaoetk.c.hsia、甘肃贝母fritillariaprzezvalskiimaxim.、梭砂贝母fritillariadelavayifranch.、太白贝母fritillariataipaiensisp.y.li或瓦布贝母fritillariaunibracteatahsiaoetk.chsiavanwabuensis(y.tangets.c.yue)z.d.liu,s.wangets.c.chen的干燥鳞茎。川贝母的已知用途有清热润肺,化痰、止咳、平喘、降压、抗肿瘤、正性肌力作用、抗溃疡、抗炎、抗菌等作用,可以治疗哮喘、咳嗽、癌症、高血压、胃溃疡等疾病。迄今为止,尚未有报道川贝母及其总生物碱提取物在防治肺纤维化上的用途。
5.通过上述分析,现有技术存在的问题及缺陷为:迄今为止,尚未有报道川贝母及其总生物碱提取物在防治肺纤维化上的用途。
6.解决以上问题及缺陷的难度为:
7.1.川贝母是我国传统名贵的中药材,而研究表明其主要的活性成分为生物碱,但是川贝母中的生物碱的含量只占生药材的0.07%,因此富集其中的生物碱就显得至关重要。
8.2.肺纤维化发病机制尚未明确,目前缺乏有效治疗手段,预后较差。临床多用糖皮质激素、免疫调节剂等药物治疗,但效果并不显著,新药吡非尼酮、尼达尼布虽有一定疗效,但价格昂贵,不良反应明显,临床应用受限。
9.解决以上问题及缺陷的意义为:
10.1.通常现在采用的是用溶剂进行萃取,成本不但昂贵而且效率还比较低下,还无法用于大规模生产。但是采用大孔树脂或者离子交换树脂去富集生物碱,不但降低了成本而且提高了效率,用于大规模生产也是没有问题的。
11.2.经过药理学研究,川贝母总生物碱对肺纤维化有明显的防治作用。
12.3.对肺纤维疾病的治疗提供了新的治疗药物。
13.4.使用川贝母总生物碱治疗肺纤维化的毒副作用比使用现有的药物小。
14.5.在改善患者肺功能、延缓肺纤维化进程、降低病死率方面具有明显优势。
技术实现要素:
15.针对现有技术存在的问题,本发明提供了一种川贝母总生物碱提取物、制备方法及应用。
16.本发明是这样实现的,一种川贝母总生物碱提取物的制备方法,所述川贝母总生物碱提取物的制备方法包括以下步骤:
17.步骤一,将川贝母鳞茎晾干、粉碎,过筛、称重;
18.步骤二,按照料液比1:8-1:15加入65-95%的乙醇进行回流提取2-3次;
19.步骤三,过滤,合并滤液,提取液经浓缩,干燥后得到川贝母浸膏,再进行纯化,以获得川贝母总生物碱。
20.经过上述步骤,本发明节约了成本,提高了纯度。
21.进一步,步骤二中,所述热回流提取的温度为60~100℃,每次提取时间为2-4h。
22.进一步,步骤三中,所述纯化方法,包括:
23.用2-4%盐酸溶解,过滤,除掉不溶物;用饱和的氢氧化钠溶液进行调节ph至7-10,使1ml药液0.2-2.8g生药材;将调节好ph的上样液,装到处理好的大孔吸附树脂(ab-8大孔吸附树脂、d101大孔吸附树脂、hpd100大孔吸附树脂、h103大孔吸附树脂)上,重复上样,上样完毕后,以流速为1-4bv/h按照以下步骤进行梯度洗脱;(1)用水进行洗脱8-12个bv;(2)用30%乙醇进行洗脱6-8个bv;(3)用90%乙醇进行洗脱8-12个bv;(4)用无水乙醇洗脱3-8个bv;(5)收集90%乙醇和无水乙醇洗脱的部位;将收集到的部位经旋浓缩、干燥。既得川贝母总生物碱。其中,所述总生物碱含量》35%。
24.进一步,所述大孔吸附树脂(ab-8大孔吸附树脂、d101大孔吸附树脂、hpd100大孔吸附树脂、h103大孔吸附树脂)按照生药材比树脂体积的比值为4:1-1:5进行装柱。
25.进一步,所述色谱条件为:以十八烷基硅烷键合硅胶为填充剂;以0.03%二乙胺a-乙腈b为流动相,流速为1ml/min,柱温25℃,漂移管温度为40℃,进行梯度洗脱;其中,所述洗脱程序为:线性梯度洗脱流程:0~10min、70%a;10~35min、70%
→
40%a;35~45min、40%a;45~65min、40%
→
10%a;65~75min、10%a;75~80min、10%
→
70%a;80~90min 70%a;总生物碱含量》35%,
26.进一步,步骤三中,所述纯化方法,还包括:
27.用2-4%的盐酸溶解、过滤,除掉不溶物;用饱和得氢氧化钠溶液,调节ph值为1-4。使1ml药液0.2-2.0g生药材;将调节好ph的上样液,装到已经处理好的h型离子交换树脂(732型阳离子交换树脂、lsd-001大孔型阳离子交换树脂、001
×
1阳离子交换树脂、001
×
7阳离子交换树脂、d152阳离子交换树)上,重复上样,上样完毕后,以流速为2-6bv/h按照以下步骤进行梯度洗脱:(1)用水洗脱6-10bv;(2)用5%氯化钠的60%乙醇溶液洗脱5-12个bv;(3)收集5%氯化钠的60%乙醇溶液洗脱部位;将收集到的洗脱部位经浓缩除盐干燥后,即得川贝母总生物碱;其中,所述总生物碱含量》40%。
28.进一步,所述离子交换树脂按照生药材比树脂体积的比值为4:1-1:5进行装柱。
29.进一步,所述色谱条件为:以十八烷基硅烷键合硅胶为填充剂;以0.03%二乙胺a-乙腈b为流动相,流速为1ml/min,柱温25℃,漂移管温度为40℃,进行梯度洗脱;其中,所述洗脱程序为:线性梯度洗脱流程:0~10min、70%a;10~35min、70%
→
40%a;35~45min、40%a;45~65min、40%
→
10%a;65~75min、10%a;75~80min、10%
→
70%a;80~90min 70%a;总生物碱含量》40%。
30.本发明的另一目的在于提供一种应用所述的川贝母总生物碱提取物的制备方法制备得到的川贝母总生物碱提取物。
31.本发明的另一目的在于提供一种应用所述的川贝母总生物碱提取物的确定川贝母总生物碱提取物对肺纤维化模型sd大鼠干预作用的方法,所述确定川贝母总生物碱提取物对肺纤维化模型sd大鼠干预作用的方法,包括:
32.(1)造模与分组
33.180~220g雄性sd大鼠60只,随机分为6组;空白组10只,生理盐水组;模型组10只,生理盐水组;阳性组10只,吡非尼酮,150mg/kg;药物组30只,川贝母总生物碱提取物,分别为低中高三个剂量组,每组10只,剂量分别为40.5mg/kg、81mg/kg、162mg/kg;除空白组外其余各组大鼠乙醚吸入麻醉后,保持小鼠呈直立状,根据大鼠的呼吸,自鼻腔缓慢滴入5mg/kg博莱霉素溶液4mg/ml,滴完后保持直立30秒,待苏醒后给予水和饲料,肺纤维化小鼠模型建立完成。
34.(2)给药方法
35.1)预防给药方法:
36.模型建立第2天后每日灌胃ig给予各组小鼠相应的药物进行干预28天,空白组和模型组ig等量生理盐水;吡非尼酮给药量为150mg/kg;药物组给药量分别为40.5mg/kg、81mg/kg、162mg/kg,给药容量统一为10ml/kg。
37.2)治疗给药方法
38.模型建立第14天后每日灌胃ig给予各组小鼠相应的药物进行干预14天,空白组和模型组ig等量生理盐水;吡非尼酮给药量为150mg/kg;药物组给药量分别为40.5mg/kg、81mg/kg、162mg/kg,给药容量统一为10ml/kg。
39.(3)观察指标
40.将小鼠肺左大叶固定于4%多聚甲醛溶液中,常规石蜡包埋,切片,采用he和masson染色观察肺组织病理改变以及肺纤维化程度;取右肺中叶,在生理盐水中充分漂洗后,滤纸吸干表面水分,精密称取30~50mg,于-80℃冰箱保存,待测肺组织中羟脯氨酸hyp含量;余肺留存并用生理盐水制备成10%肺组织匀浆,用于测定肺组织匀浆中的超氧化物岐化酶sod活力、丙二醛mda含量和tgf-β的含量;he染色观察肺组织病理切片和masson染色观察胶原纤维的分布情况;心脏取血获得的血清采用elisa法测tnf-α、白介素-1β和白介素-6含量。
41.(4)统计学方法
42.所有数据均以表示,使用spss17.0软件中单因素方差分析方法进行统计分析;homegeneity检验方差齐性,若方差齐时采用最小显著法lsd检验;若方差不齐时采用dunnett’su检验;等级资料采用spss17.0软件中非参数检验法统计分析。
43.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的川贝母总生物碱提取物,具体涉及川贝母总生物碱提取物的成分,川贝母总生物碱的制备方法,以及在防治肺纤维化疾病的用途。由验证实验结果可知,川贝母总生物碱提取物可用于开发抗肺纤维化的新药,特别是针对抗肿瘤化疗药物造成的肺纤维化。
44.本发明提供的川贝母总生物碱提取物的办法,不但使富集生物碱在工业化大批量生产成为了可能,而且还避免了萃取时使用的众多溶剂,避免了引入更多的复杂成分。从成本上来说,使用大孔树脂或离子交换树脂富集生物碱,所使用的溶剂种类要比采用萃取的办法所使用的种类要少,而且溶剂的成本也更低。从效率上来说,使用大孔树脂或离子交换树脂的办法所涉及的步骤要比萃取的步骤要少,而且采用大孔树脂或离子交换树脂的办法要比采用萃取的办法更安全更稳定。
45.本发明的另一目的在于提供一种所述的川贝母总生物碱提取物在制备抗肺纤维化药物中的应用,所述肺纤维化特别针对抗肿瘤化疗药物造成的肺纤维化。
46.本发明发现,川贝母总生物碱提取物可以通过多靶点,多信号通路来抗肺纤维化;可以减缓甚至阻断肺纤维化的发展进程;可以弥补现有药物治疗肺纤维化副作用大,经济成本高的不足。
47.本发明提供的药物处方是根据中医“辨证论治”的思想,合理用药,以求达标本皆治之效。发明人根据先前对川贝母总生物碱提取物的研究,进一步采用中药药理学方法和分子生物学方法,对抗肿瘤药博莱霉素诱导的sd大鼠肺纤维化进行药效及其初步机制研究。实验结果表明,该药有效性及其药理作用机制,可用于开发治疗肺纤维化的中药新药。
附图说明
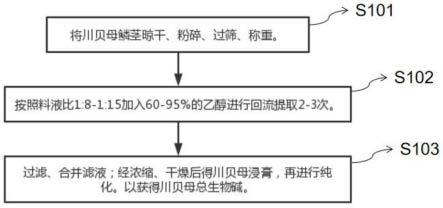
48.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
49.图1是本发明实施例提供的川贝母总生物碱提取物的制备方法流程图。
50.图2是本发明实施例提供的指纹图谱和结构式。
51.图2(a)是本发明实施例提供的大孔树脂纯化示意图。
52.图2(b)是本发明实施例提供的离子交换树脂纯化示意图。
53.图2(c)是本发明实施例提供的贝母辛、西贝母碱苷、西贝母碱的结构式。
54.图3是本发明实施例提供的he染色病理切片示意图。
55.图3(a)是本发明实施例提供的空白组的he染色病理切片示意图。
56.图3(b)是本发明实施例提供的模型组的he染色病理切片示意图。
57.图3(c)是本发明实施例提供的阳性组的he染色病理切片示意图。
58.图3(d)是本发明实施例提供的药物组的he染色病理切片示意图。
59.图4是本发明实施例提供的masson染色病理切片示意图。
60.图4(a)是本发明实施例提供的空白组的masson染色病理切片示意图。
61.图4(b)是本发明实施例提供的模型组的masson染色病理切片示意图。
62.图4(c)是本发明实施例提供的阳性组的masson染色病理切片示意图。
63.图4(d)是本发明实施例提供的药物组的masson染色病理切片示意图。
具体实施方式
64.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
65.针对现有技术存在的问题,本发明提供了一种川贝母总生物碱提取物、制备方法及应用,下面结合附图对本发明作详细的描述。
66.如图1所示,本发明实施例提供的川贝母总生物碱提取物的制备方法包括以下步骤:
67.s101,将川贝母鳞茎晾干、粉碎,过筛、称重;
68.s102,按照料液比1:8-1:15加入60-95%的乙醇进行回流提取2-3次;
69.s103,过滤,合并滤液,提取液经浓缩,干燥后得川贝母浸膏,再进行纯化,以获得川贝母总生物碱。
70.下面结合具体实施例对本发明的技术方案作进一步描述。
71.实施例1:川贝母总生物碱提取物的制备
72.将川贝母鳞茎晾干、粉碎,过筛、称重。按照料液比1:8-1:15加入60-95%的乙醇进行热回流(60-100℃)提取2-3次,每次提取时间为2-4h。过滤,合并滤液,提取液经浓缩,干燥后得川贝母浸膏,然后进行纯化,以获得总生物碱。
73.两种纯化方法:
74.方法一:用2-4%盐酸进行溶解,过滤,除掉不溶物;用饱和的氢氧化钠溶液调节ph至7-10,使1ml药液0.2-2.8g生药材。将调节好ph的上样液,装到处理好的大孔吸附树脂(ab-8大孔吸附树脂、d101大孔吸附树脂、hpd100大孔吸附树脂、h103大孔吸附树脂)上(按照生药材比树脂体积的比值为4:1-1:5进行装柱),重复上样,上样完毕后,以流速为1-4bv/h按照以下步骤进行洗脱;(1)用水进行洗脱8-12个bv;(2)用30%乙醇进行洗脱6-8个bv;(3)用90%乙醇进行洗脱8-12个bv;(4)用无水乙醇洗脱3-8个bv;(5)收集90%乙醇和无水乙醇洗脱的部位;将收集到的部位经浓缩,干燥。既得川贝母总生物碱。色谱条件:以十八烷基硅烷键合硅胶为填充剂;以0.03%二乙胺(a)-乙腈(b)为流动相,流速为1ml/min,柱温25℃,漂移管温度为40℃,进行梯度洗脱,洗脱程序为:线性梯度洗脱流程:0~10min、70%a;10~35min、70%
→
40%a;35~45min、40%a;45~65min、40%
→
10%a;65~75min、10%a;75~80min、10%
→
70%a;80~90min 70%a;结果见图2(a)。总生物碱含量》35%。
75.方法二:用2-4%的盐酸溶解,过滤,除掉不溶物,用饱和得氢氧化钠溶液,调节ph值为1-4。使1ml药液0.2-2.0g生药材。将调节好ph的上样液装到已经处理好的h型离子交换树脂(732型阳离子交换树脂、lsd-001大孔型阳离子交换树脂、001
×
1阳离子交换树脂、001
×
7阳离子交换树脂、d152阳离子交换树)上(按照生药材比树脂的比值为4:1-1:5进行装柱),重复上样,上样完毕后,以流速为2-4bv/h按照以下步骤进行洗脱。(1)用水洗脱6-10bv;(2)用5%氯化钠的60%乙醇溶液洗脱5-12个bv;(3)收集5%氯化钠的60%乙醇溶液洗脱部位;将收集到的洗脱部位经浓缩除盐干燥后,即得川贝母总生物碱。色谱条件为:以十八烷基硅烷键合硅胶为填充剂;以0.03%二乙胺a-乙腈b为流动相,流速为1ml/min,柱温
25℃,漂移管温度为40℃,进行梯度洗脱;其中,所述洗脱程序为:线性梯度洗脱流程:0~10min、70%a;10~35min、70%
→
40%a;35~45min、40%a;45~65min、40%
→
10%a;65~75min、10%a;75~80min、10%
→
70%a;80~90min 70%a。;结果见图2(b)。总生物碱含量》40%。
76.实施例2:川贝母总生物碱提取物对肺纤维化模型sd大鼠的干预作用
77.1、实验材料
78.1.1实验动物
79.180-220g左右spf级雄性sd大鼠,合格证号:scxk(川)2020-030,由成都达硕实验动物有限公司提供。
80.1.2药物与试剂
81.取“实施例1”所制备的川贝母总生物碱提取物为实验治疗药物;吡非尼酮(98%,麦克林,生产批号:m823668);博莱霉素(1.5-2.0units/mg,麦克林,产品批号:b802467);羟脯氨酸试剂盒(碱)(南京建成生物工程研究所);sod试剂盒(南京建成生物工程研究所);mda试剂盒(南京建成生物工程研究所);tgf-βelisa测试盒(基因美,产品批号:jym0762ra);tnf-αelisa测试盒(基因美,产品批号:jym0635ra);il-1βelisa测试盒(基因美,产品批号:jym0419ra);il-6elisa测试盒(基因美,产品批号:jym0646ra)。
82.1.3实验主要仪器
83.bx60显微镜(olympus日本)
84.td-5m低速离心机(四川蜀科仪器有限公司)
85.全波长酶标仪(thermo fisher scientific公司美国)
86.tgl-16s型高速冷冻离心机(四川蜀科仪器有限公司)
87.紫外分光光度计(tu-1901/1900北京普析通用仪器有限公司)
88.电子天平(hzt-a+200美国康州hz电子科技有限公司)
89.转轮式切片机(徕卡-2016,德国)
90.jt-12s自动组织脱水机(武汉俊杰电子有限公司)
91.bmj-a型包埋机(常州郊区中威电子仪器厂)
92.rs36型全自动染色机(常州派斯杰医疗设备有限公司)
93.phy
‑ⅲ
型病理组织漂烘仪(常州市中威电子仪器有限公司)
94.数码三目摄像显微镜(ba210digital,麦克奥迪实业集团有限公司)
95.2、方法
96.2.1造模与分组
97.180-220g雄性sd大鼠60只,随机分为6组,每组10只:空白组(10只,生理盐水组)、模型组(10只,生理盐水组)、阳性组(10只,吡非尼酮,150mg/kg)、药物组(30只,川贝母总生物碱提取物,分别为低中高三个剂量组,每组10只,剂量分别为40.5mg/kg、81mg/kg、162mg/kg)。除空白组外其余各组大鼠乙醚吸入麻醉后,保持小鼠呈直立状,根据大鼠的呼吸,自鼻腔缓慢滴入5mg/kg博莱霉素溶液(4mg/ml),滴完后保持直立30秒,待其苏醒后给予水和饲料,肺纤维化小鼠模型建立完成。
98.2.2给药方法
99.(1)预防给药方法:
100.模型建立第2天后每日灌胃(ig)给予各组小鼠相应的药物进行干预28天,空白组和模型组ig等量生理盐水。吡非尼酮给药量为150mg/kg;药物组给药量分别为40.5mg/kg、81mg/kg、162mg/kg,给药容量统一为10ml/kg。
101.(2)治疗给药方法
102.模型建立第14天后每日灌胃(ig)给予各组小鼠相应的药物进行干预14天,空白组和模型组ig等量生理盐水。吡非尼酮给药量为150mg/kg;药物组给药量分别为40.5mg/kg、81mg/kg、162mg/kg,给药容量统一为10ml/kg。
103.2.3观察指标
104.各组小鼠分别于给药14天后处死,打开小鼠胸腔,取出肺脏,小鼠肺左大叶固定于4%多聚甲醛溶液中,常规石蜡包埋,切片,采用he和masson染色观察肺组织病理改变以及肺纤维化程度;取右肺中叶,在生理盐水中充分漂洗后,滤纸吸干表面水分,精密称取30-50mg,于-80℃冰箱保存,待测肺组织中羟脯氨酸(hyp)含量;余肺留存并用生理盐水制备成10%肺组织匀浆,用于测定肺组织匀浆中的超氧化物岐化酶(sod)活力、丙二醛(mda)含量和tgf-β的含量。he染色观察肺组织病理切片和masson染色观察胶原纤维的分布情况;心脏取血获得的血清采用elisa法测tnf-α、白介素-1β(il-1β)和白介素-6(il-6)含量。
105.2.4统计学方法
106.所有数据均以表示,使用spss17.0软件中单因素方差分析方法进行统计分析;homegeneity检验方差齐性,若方差齐时采用最小显著法(lsd)检验;若方差不齐时采用dunnett’su检验;等级资料采用spss17.0软件中非参数检验法统计分析。
107.3、结果
108.3.1各组大鼠肺系数(肺湿重g/体重g)比较
109.与空白组相比,模型组肺系数(肺湿重g/体重g)(p<0.05),与模型组相比,各给药组肺系数(肺湿重g/体重g)均较模型组显著降低(p<0.05)。药物组hyp含量和空白组无显著性差异,见表1。
110.表1肺系数(肺湿重g/体重g)比较
[0111][0112]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0113]
3.2各组大鼠肺组织中hyp含量(ug/mg湿重)比较
[0114]
与空白组相比,模型组肺组织中hyp含量明显升高(p<0.05),与模型组相比,各给药组hyp含量均较模型组显著降低(p<0.05)。药物组hyp含量和空白组无显著性差异,见表2。
[0115]
表2肺组织中hyp含量(ug/mg湿重)比较
[0116][0117]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0118]
3.3各组大鼠肺组织均浆中总sod活力比较
[0119]
与空白组相比,模型组肺组织均浆中总sod活力明显降低(p<0.01),与模型组相比,各给药组肺组织均浆中总sod活力均较模型组显著降升高(p<0.05)。药物组肺组织均浆中总sod活力和空白组无显著性差异,见表3。
[0120]
表3肺组织中sod含量(u/ml湿重)比较
[0121][0122]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0123]
3.4各组大鼠肺组织均浆中mda含量(nmol/ml)比较
[0124]
与空白组相比,模型组肺组织均浆中mda含量明显升高(p<0.01),与模型组相比,各给药组肺组织均浆中mda含量均较模型组显著降低(p<0.05)。药物组肺组织均浆中mda含量和空白组无显著性差异,见表4。
[0125]
表4肺组织中mda含量(nmol/ml)比较
[0126][0127]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0128]
3.5各组大鼠肺组织均浆中转化生长因子β含量(pg/ml)比较
[0129]
转化生长因子β(tgf-β)在肺纤维化的发病过程中起重要的作用,故观察川贝母总
生物碱提取物对肺组织中tgf-β含量的影响。取肺组织制成10%匀浆,离心取上清液。按tgf-β试剂盒说明测定其含量。川贝母总生物碱提取物可降低被升高的tgf-β的含量,见表5。
[0130]
表5肺组织均浆中tgf-β含量(pg/ml)比较
[0131][0132]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0133]
3.6各组大鼠血清中tnf-α含量(pg/ml)比较
[0134]
与空白组比较,模型组血清中tnf-α水平均显著升高(p<0.05-0.01);与模型组比较,各给药组tnf-α水平显著性降低(p<0.01),见表6。
[0135]
表6血清中tnf-α含量(pg/ml)比较
[0136][0137]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0138]
3.7各组大鼠血清中il-1β含量(pg/ml)比较
[0139]
与空白组比较,模型组血清中il-1β水平均显著升高(p<0.01);与模型组比较,各给药组il-1β水平显著性降低(p<0.01),见表7。
[0140]
表7血清中il-1β含量(pg/ml)比较
[0141][0142]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0143]
3.8各组大鼠血清中il-6含量(pg/ml)比较
[0144]
与空白组比较,模型组血清中il-6水平均显著升高(p<0.01);与模型组比较,各给药组il-6水平显著性降低(p<0.01),见表8。
[0145]
表8血清中il-6含量(pg/ml)比较
[0146][0147][0148]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0149]
3.9各组大鼠肺组织病理形态学观察
[0150]
光学显微镜下观察,预防给药和治疗给药两种方法的空白组肺结构清晰,肺泡上皮细胞、肺间质血管上皮细胞未见或少见炎症细胞浸润,支气管、肺泡、血管壁均未见胶原纤维明显增生。预防给药和治疗给药两种方法的模型组大鼠均有肺泡炎,表现为肺泡充血、水肿,部分肺泡有透明膜形成,肺泡上皮细胞有中至重度损伤,肺泡炎稍减轻;肺纤维化程度最重,多呈3级肺纤维化变化,胶原纤维组织增生、变厚,肺气肿严重。各给药组都有明显的改善,但预防给药的治疗效果要比治疗给药的效果好。肺组织病理学分析结果见表9、图3和图4。
[0151]
表9各组大鼠肺泡炎、肺纤维化程度比较
[0152][0153]
注:与空白组比较,*p<0.05,**p<0.01;与模型组比较,
#
p<0.05,
##
p<0.01。
[0154]
因此,川贝母总生物碱提取物可用于开发抗肺纤维化的新药,特别是针对抗肿瘤化疗药物造成的肺纤维化。
[0155]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1