一种广谱抗冠状病毒的制剂及其制备方法
1.本发明涉及一种广谱抗冠状病毒的制剂及其制备方法,属于冠状病毒治疗技术领域。
背景技术:
2.本世纪爆发了三次人畜共患冠状病毒大流行,第一次是2003年严重急性呼吸综合征冠状病毒(sars-cov),第二次是2012年中东呼吸综合征冠状病毒(mers-cov)第三次是最近的新型冠状病毒(sars-cov-2)。这些冠状病毒的大流行对全球公共卫生和经济已造成巨大威胁和挑战。其中,sars-cov-2属于rna病毒,其本身具有突变频率高的特点,目前已有多株流行突变株被鉴定出来。虽然几种sars-cov-2疫苗已被批准作为紧急使用,但由于其对突变株的保护效率下降,难以完全阻止正在进行的大流行。抗体已被证明可抑制sars-cov-2的感染,然而,它们对sars-cov-2 变异毒株的治疗效果显着降低,甚至失去中和能力,并且对其他种类的冠状病毒无作用。
3.sars-cov和sars-cov-2通过与宿主细胞表面人血管紧张素转换酶2 (hace2)的特异性结合进入细胞,mers-cov则由人二肽基肽酶4 (hdpp4)介导入胞。决定冠状病毒的高感染性和传播性的重要原因之一为病毒s蛋白的受体结合结构域(rbd)与宿主细胞表面受体之间的高亲和力。sars-cov-2变异毒株通常在rbd中发生氨基酸改变并且对hace2表现出比野生型毒株更高的亲和力,导致其传播性、免疫逃逸和抗体抗性增强。随着新冠病毒在持续传播中自发突变及广泛的疫苗接种计划等可能形成的选择压力所导致的突变增加,制定全面覆盖突变株的广谱干预措施是克服当前sars-cov-2大流行的紧迫需求,并在防御未来可能新出现的高致病性冠状病毒的大流行。
4.因此,急需开发有效的抗冠状病毒的药物。
技术实现要素:
5.本发明提供了一种广谱抗冠状病毒的制剂及其制备方法,可以有效解决上述问题。
6.本发明是这样实现的:
7.一种广谱抗冠状病毒的制剂,所述制剂为冠状病毒特异性受体嵌合的并负载抗炎药物的工程化细胞膜囊泡复合物。
8.作为进一步改进的,所述冠状病毒特异性受体包括mers-cov特异性受体hdpp4,sars-cov、sars-cov-2及其变异毒株特异性受体hace2。
9.作为进一步改进的,所述抗炎药物包括地塞米松、氢化可的松或阿司匹林中的至少一种。
10.作为进一步改进的,所述工程化细胞膜囊泡复合物的粒径为 100-200nm。
11.一种上述的广谱抗冠状病毒的制剂的制备方法,包括以下步骤:
12.s1,通过基因工程技术将冠状病毒特异性受体基因转入真核细胞中,使真核细胞
的细胞质膜上表达冠状病毒特异性受体蛋白,筛选获得能够稳定表达冠状病毒特异性受体的目标细胞株;
13.s2,对稳定表达冠状病毒特异性受体的目标细胞株进行扩大培养,挑选生长对数期的细胞,加入含有蛋白酶抑制剂的缓冲液,充分浸润并收集细胞,使用低功率超声破碎细胞,诱导细胞膜工程化囊泡的产生,采用多次差速离心法纯化工程化囊泡;
14.s3,将工程化囊泡和抗炎药物混合均匀,以低功率超声处理后,4℃静置10-20min,用脂质体挤压器依次在400nm、200nm孔径的薄膜下连续挤压,获得尺寸均一的冠状病毒特异性受体嵌合的工程化囊泡复合物。
15.作为进一步改进的,所述真核细胞包括hek-293t细胞、vero细胞、 h1299细胞或患者自体分离培养的细胞中的至少一种。
16.作为进一步改进的,所述多次差速离心法为首先用3000g、5000g分别低温离心8-12min,收集上清,以去除细胞核、细胞器及粒径较大的囊泡,然后15000g低温离心1-1.5h收集沉淀,即为纯化的工程化囊泡。
17.作为进一步改进的,所述低功率超声的功率范围为15-30w。
18.作为进一步改进的,所述工程化囊泡和抗炎药物的用量比为1:1-2。
19.作为进一步改进的,所述蛋白酶抑制剂的终浓度为0.1-0.2mm。
20.本发明的有益效果是:
21.本发明提出了一种新形式的具有广谱抗冠状病毒作用的细胞膜工程化囊泡,能够在生物膜表面展示mers-cov受体hdpp4或sars-cov、sars-cov-2及其变异毒株受体hace2,在低功率超声诱导下,自发组装成同时展示hdpp4或hace2的受体嵌合工程化囊泡复合物;该工程化囊泡可竞争性结合mers-cov、sars-cov、sars-cov-2及其变异毒株,抑制病毒对宿主细胞的感染,阻断病毒传播;该工程化囊泡可以进一步负载抗炎药物,形成一种新的抗炎复合物,以递送抗炎药物,降低炎性细胞因子的产生,缓解肺炎症状。利用工程化囊泡进行受体蛋白与抗炎药物递送,具有非细胞治疗的安全性,具备大规模生产的可能性,在多种高致病性冠状病毒及变异毒株感染的防治中提供一种新的思路和策略。
22.本发明采用mers-cov、sars-cov、sars-cov-2的s蛋白特异性结合的hdpp4和hace2作为工程化囊泡(mosaic-mv)表面展示蛋白,实现对人类已知的三种高致病性冠状病毒mers-cov、sars-cov、sars-cov-2 广谱中和的作用,克服sars-cov-2单抗类药物对其他冠状病毒无作用的问题。
23.本发明采用病毒受体分子发挥抗冠状病毒作用,避免了使用抗体治疗可能出现的抗体依赖性增强效应(antibody dependent enhancement,ade)。
24.本发明可有效的同时展示hdpp4和hace2分子,在新冠病毒及变异毒株感染的防治中发挥重要作用,同时对以hace2或hdpp4分子为受体的其他病毒及其变异毒株也具有普适性疗效,具有战略储备价值。
25.本发明避免了疫苗或抗体的复杂且较漫长的研发流程,具有良好和普适性,为病毒治疗提供了新的方法和思路。
附图说明
26.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用
的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
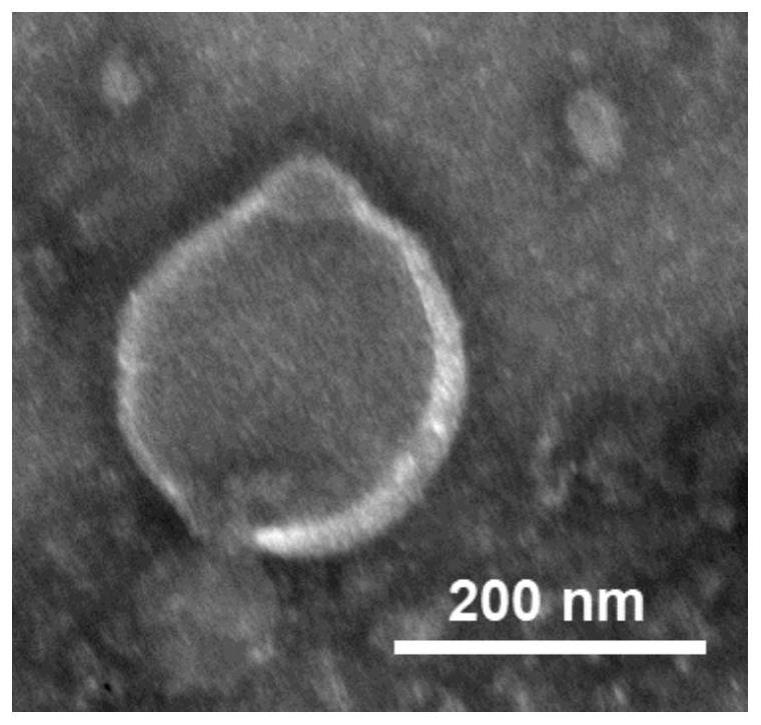
27.图1是本发明实施例提供的透射电镜对mosaic-mv形貌表征。
28.图2是本发明实施例提供的mosaic-mv对两种高致病性冠状病毒: mers-cov、sars-cov假病毒的中和作用。
29.图3是本发明实施例提供的mosaic-mv对sars-cov-2及其所有who 认定的值得关注的变异株(variants of concern,voc)b.1.1.7(alpha)、 b.1.351(beta)、b.1.1.28(gamma)、b.1.617.2(delta)和b.1.1.529 (omicron)假病毒的中和作用。
30.图4是本发明实施例提供的mosaic-mv对细胞的毒性评价。
31.图5是本发明实施例提供的mosaic-mv-dex对sars-cov-2变异毒株 b.1.351(beta)真病毒在叙利亚仓鼠体内的中和作用。
32.图6是本发明实施例提供的mosaic-mv-dex抑制sars-cov-2变异毒株b.1.351(beta)真病毒感染的叙利亚仓鼠体内炎性细胞因子mrna水平。
具体实施方式
33.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式中的附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下对在附图中提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
34.在本发明的描述中,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
35.本发明实施例提供一种广谱抗冠状病毒的制剂,所述制剂为冠状病毒特异性受体嵌合的并负载抗炎药物的工程化细胞膜囊泡复合物。
36.所述冠状病毒特异性受体包括mers-cov特异性受体hdpp4, sars-cov、sars-cov-2及其变异毒株特异性受体hace2,但不限于此,只要是对冠状病毒亲和力高的冠状病毒特异性受体即可。
37.所述抗炎药物包括地塞米松、氢化可的松或阿司匹林中的至少一种,但不限于此,只要该抗炎药物易于与细胞膜囊结合形成复合物,并对冠状病毒引起的炎症起到抗炎作用即可。
38.该工程化细胞膜囊泡复合物可竞争性结合mers-cov、sars-cov、 sars-cov-2及其变异毒株,抑制病毒对宿主细胞的感染,阻断病毒传播。同时,该工程化细胞膜囊泡复合物负载抗炎药物,形成一种新的抗炎复合物,向该工程化细胞膜囊泡富集的病毒递送抗炎药
物,降低炎性细胞因子的产生,有效缓解冠状病毒引起的肺炎症状。
39.在一实施例中,所述工程化细胞膜囊泡复合物的粒径为100-200nm,具有良好的可重复性和可操作性。
40.本发明实施例还提供一种上述的广谱抗冠状病毒的制剂的制备方法,包括以下步骤:
41.s1,通过基因工程技术将冠状病毒特异性受体基因转入真核细胞中,使真核细胞的细胞质膜上表达冠状病毒特异性受体蛋白,筛选获得能够稳定表达冠状病毒特异性受体的目标细胞株。所述真核细胞包括hek-293t 细胞、vero细胞、h1299细胞或患者自体分离培养的细胞中的至少一种,但不限于此,只要便于基因工程操作和冠状病毒特异性受体蛋白的表达即可。所述冠状病毒特异性受体包括mers-cov特异性受体hdpp4, sars-cov、sars-cov-2及其变异毒株特异性受体hace2,但不限于此。
42.s2,对稳定表达冠状病毒特异性受体的目标细胞株进行扩大培养,挑选生长对数期的细胞,加入含有蛋白酶抑制剂的缓冲液,抑制蛋白酶对冠状病毒特异性受体蛋白的抑制,提高冠状病毒特异性受体蛋白的浓度;充分浸润并收集细胞,使用低功率超声破碎细胞,诱导细胞膜工程化囊泡的产生,采用多次差速离心法纯化工程化囊泡。所述低功率超声的功率范围为15-30w。所述多次差速离心法为首先用3000g、5000g分别低温离心 8-12min,收集上清,以去除细胞核、细胞器及粒径较大的囊泡,然后15000g 低温离心1-1.5h收集沉淀,即为纯化的工程化囊泡。
43.s3,将各工程化囊泡和抗炎药物混合均匀,以低功率超声处理后,4℃静置10-20min,用脂质体挤压器依次在400nm、200nm孔径的薄膜下连续挤压,获得尺寸均一的冠状病毒特异性受体嵌合的工程化囊泡复合物。所述抗炎药物包括地塞米松、氢化可的松或阿司匹林中的至少一种。
44.本发明实施例使用低功率超声及差速离心,可以制备出平均尺寸在 100-200nm的、形态均一的纳米级工程化囊泡,具有良好的可重复性和可操作性。该工程化囊泡复合物可以通过溶液形式滴鼻或鼻腔喷雾给药,以获得较高的肺部富集。
45.实施例1mosaic-mv的制备
46.1)用胰蛋白酶消化对数生长期的hek-293t细胞,以含10%血清的培养基调整细胞密度为每毫升5
×
105个细胞,重新接种于细胞培养皿,37℃、 5%co2培养箱内培养。待细胞密度达70%~80%时即可用于转染,转染前将细胞培养基更换为无血清培养基。
47.2)将hace2基因构建至质粒载体ires-h2b-irfp670-2a-puror,获得表达hace2的重组质粒ace2irb3(参见small methods.2021feb 15;5(2):2001031.virus-free and live-cell visualizing sars-cov-2cell entryfor studies of neutralizing antibodies and compound inhibitors),将含hace2 的重组质粒ace2irb3转染hek-293t细胞;采用相同的载体,构建获得含hdpp4的重组质粒dpp4irb3,转染hek-293t细胞。将上述转染后的细胞置于37℃,5%co2的细胞培养箱中培养。
48.3)使用10μg/ml的puromycin(sigma-aldrich),对转染的真核细胞进行筛选,多轮筛选后分别获得能够稳定表达hace2的293t-hace2细胞株和稳定表达hdpp4的293t-hdpp4细胞株。
49.4)将细胞培养基中puromycin的浓度更换为1μg/ml,对上述两种细胞株进行维持
mosaic-mv对包括omicron在内的所有voc增强的中和作用表明其能够克服疫苗或抗体效果下降,甚至失效的问题,对已存在及未来可能出现的变异毒株发挥直接有效的广谱抗病毒作用。
68.3.mosaic-mv对细胞的毒性评价(图4):
69.为验证mosaic-mv对病毒的中和作用是否是由自身对细胞的毒性所导致,将mosaic-mv进行相同浓度的梯度稀释后加入易感细胞,孵育48h后采用cck8法检测细胞活性。如图4所示,所使用浓度的mosaic-mv无明显细胞毒性,表明mosaic-mv对病毒感染的抑制不是由自身细胞毒性引起,而通过其表面受体分子发挥阻断病毒感染作用。
70.4.mosaic-mv-dex对叙利亚仓鼠体内sars-cov-2变异毒株b.1.351 (beta)病毒的中和作用(图5):
71.(1)相较于小鼠,叙利亚仓鼠对sars-cov-2的感染更加敏感,是目前国际主流的sars-cov-2感染模型之一。使用1
×
104pfu剂量的 sars-cov-2变异毒株b.1.351(beta)病毒直接滴鼻感染叙利亚仓鼠,感染后1小时、以及第1、2、3、4天以滴鼻方式给予仓鼠dex、mosaic-mv 或mosaic-mv-dex治疗,并且每天记录体重变化。感染后第5天处死仓鼠,使用rt-pcr方法检测其肺组织匀浆液中的病毒核酸载量。
72.(2)结果表明,暴露于sars-cov-2变异毒株b.1.351(beta)的叙利亚仓鼠,在感染后第5天,未治疗组体重减轻17.4
±
2.3%,mosaic-mv,dex 和mosaic-mv-dex治疗组体重分别降低5.8
±
2.5%,9.7
±
1.3%和1.4
±
1.2% (图5a);相比未治疗组,mosaic-mv和mosaic-mv-dex治疗组肺部病毒核酸载量分别降低了23.99、28.12倍(图5b),表明mosaic-mv或 mosaic-mv-dex显著降低病毒在模型动物肺部的感染和复制,降低死亡率。
73.5.mosaic-mv-dex显著抑制sars-cov-2变异毒株b.1.351(beta)真病毒感染的叙利亚仓鼠肺组织中炎性细胞因子的产生(图6):
74.(1)为了确定mosaic-mv-dex是否能够抑制sars-cov-2感染导致的细胞因子风暴,感染后第5天处死仓鼠,使用rt-pcr方法检测其肺组织匀浆液中的促炎细胞因子(ifrn-γ\tnf-α\il-6)的mrna水平。
75.(2)结果表明,dex和mosaic-mv-dex的治疗均能降低被感染仓鼠肺部ifrn-γ\tnf-α\il-6促炎因子水平,且共递送形式的mosaic-mv-dex 疗效更为显著,ifrn-γ\tnf-α\il-6的mrna水平分别下降3.94
×
104、 6.08
×
105、4.14
×
106倍,阻止轻症向危重症的转化,保护所治疗的全部实验动物免受病毒感染引起的致死性肺炎(图6)。
76.随着新冠病毒在持续传播中自发突变及广泛的疫苗接种计划等可能形成的选择压力所导致的突变增加,制定全面覆盖突变毒株的广谱干预措施是克服当前sars-cov-2大流行的紧迫需求,并防御未来可能出现或重新出现的高致病性冠状病毒的大流行。
77.综上所述,本发明通过mosaic-mv表面双价受体与多种高致病性冠状病毒受体结合区极高的亲和力,高效阻断目前已知的三种人类高致病性冠状病毒mers-cov、sars-cov、sars-cov-2及包括所有voc在内的 sars-cov-2变异毒株感染,发挥广谱抗冠状病毒作用;通过共递送抗炎药物,显著降低sars-cov-2变异毒株真病毒感染的叙利亚仓鼠体内病毒核酸载量,抑制细胞因子风暴,阻止轻症向危重症的转化,保护所治疗的全部实验动物免受病毒感染引起的致死性肺炎,克服因病毒突变导致的传播性、免疫逃逸和抗体抗性增强的难题。
78.以上所述仅为本发明的优选实施方式而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1