一种可促进成骨分化的天然超分子水凝胶材料的制备方法
1.本发明涉及水凝胶生物植入材料领域,尤其涉及一种可促进成骨分化的天然超分子水凝胶材料的制备方法。
背景技术:
2.颅骨的骨组织具有高度多孔、均匀致密的特点。颅骨缺损会严重影响患者的生活质量。这些缺陷可能源于颅骨感染,严重的颅面创伤,如交通和运动事故以及其他身体攻击,或由于先天性颅面畸形或神经外科或颌面手术后的副作用而发生。颅骨成形术是指修复颅骨缺陷或畸形的外科手术,这可以通过使用颅骨植入物来实现。这些缺陷的重建主要是为了重建缺失颅骨的结构和功能。无瑕疵的颅骨对于确保大脑下层软组织的生物力学保护以及使颅内压正常化和恢复正常的脑脊液流动动力学至关重要。明胶不仅是一种水解降解胶原的天然超分子,结构上还含有rgd位点可促进细胞粘附和增殖;β-环糊精是一种环状低聚糖,具有内部疏水空腔及外表具有亲水性,可与疏水性基团和药物进行弱的主客体交联;阿仑膦酸钠是维生素d3的衍生物,为氨基二膦酸盐,与骨内羟磷灰石有强亲和力。能进入骨基质羟磷灰石晶体中,能抑制破骨细胞活性,并通过成骨细胞间接起抑制骨吸收作用。
3.水凝胶是超分子材料,具有高含水量和不同的物理性质。水凝胶是由交联的亲水聚合物链组成的三维网络,具有广泛的可调物理和化学性质,并能在水中吸收数千倍干重的水。它们可以被设计成类似于身体组织的细胞外环境,从而使它们能够用于医疗植入物、生物传感器和药物传递装置。水凝胶可以应用于干细胞研究中,可以调节细胞命运的关键变量、趋化因子、细胞因子、生长因子等,也可在分子水平上调节细胞活动。对于易于控制药物释放或优化药代动力学的水凝胶,材料的多孔结构及其载药量高低可以通过化学方法控制,同时不会减弱其与天然组织固有的物理化学兼容性。在再生医学中,水凝胶被用来将细胞分层培养成类似组织的结构,其结构和分子可以通过空间和时间上的表现来调节多细胞形态形成。
4.为解决水凝胶促成骨分化的问题,在这里,我们提出了一种简单、高效的方法,以生产可自愈可促进成骨分化的水凝胶。总的来说,将明胶与制备的ac-β-环糊精和ac-阿仑膦酸钠混合形成首先配置含有16% wt%明胶、7wt% ac-β-环糊精和100m 阿仑膦酸钠的杜氏磷酸盐缓冲混合溶液,然后制备再配置100m cacl2、mgcl2(ca:mg=5:3)和0.5wt% 2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮的杜氏磷酸盐缓冲混合溶液,将两种溶液混合紫外照射10min后从而形成gca水凝胶。这允许水凝胶包覆干细胞后先在体外分化培养以及支持原生组织中的细胞向水凝胶中迁移的性质可保证并提高体内骨组织的修复效率。水凝胶的可自愈则可保证对各种形状骨缺损的简单高效填充。上述支架材料还同时具备有制备简单、成本低廉、操作简便、利于临床推广的特点。
技术实现要素:
[0005]
针对现有技术的不足,本发明的目的是提出了一种简单、高效的方法,以生产可自
愈可促进成骨分化的水凝胶。明胶与制备的ac-β-环糊精和ac-阿仑膦酸钠混合形成首先配置含有16% wt%明胶、7wt% ac-β-环糊精和100m 阿仑膦酸钠的杜氏磷酸盐缓冲混合溶液,然后制备再配置100m cacl2、mgcl2(ca:mg=5:3)和0.5wt% 2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮的杜氏磷酸盐缓冲混合溶液,将两种溶液混合紫外照射10min后从而形成gca水凝胶。
[0006]
为了实现本发明的目的,具体技术方案如下:1. 一种基于gca水凝胶的柔性应变传感器的制备方法,其特征在于,包括以下步骤:(1) 制备ac-β-环糊精:通过丙烯酰氯改性-β-环糊精,使酰氯与β-环糊精上的羟基反应成功制得ac-β-环糊精;(2) 制备ac-阿仑膦酸钠:利用n-丙烯酰氧基琥珀酰亚胺改性阿仑膦酸钠,形成带双键的ac-阿仑膦酸钠;(3) 将明胶、步骤(1)制得的ac-β-环糊精与步骤(2)制得的ac-阿仑膦酸钠溶解于杜氏磷酸盐缓冲溶液中,再将cacl2、mgcl2和2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮溶解于杜氏磷酸盐缓冲溶液中,两种溶液混合经过紫外光照射从而形成gca水凝胶;(4) 将人体间充质干细胞平铺在步骤(3)制得的gca水凝胶表面,水凝胶环境中生长4天后,进行骨髓间充质干细胞活/死细胞染色法检测细胞活性。
[0007]
(5) 将人体间充质干细胞包覆在步骤(3)制得的gca水凝胶内部,水凝胶环境中生长21天后,进行骨髓间充质干细胞茜素红染色检测细胞矿化和对成骨表达因子进行检测。
[0008]
2.上述步骤(1)所述的ac-β-环糊精制备方法为:先将10g β-环糊精溶于150ml dmf,将溶液冰浴降温,加入三乙胺7.2ml,滴加5-10ml丙烯酰氯(0.5-1.5h),反应过夜,随后将反应的溶液旋转蒸发浓缩到5-10ml左右,在400-500ml丙酮中沉淀,抽滤并用丙酮洗涤沉淀,真空干燥形成最终的ac-β-环糊精产物。
[0009]
3. 上述步骤(2)所述的ac-阿仑膦酸钠制备方法为:将1.4g阿仑膦酸钠溶于400ml teoa缓冲溶液中,用5m naoh调节ph至8,反应1-2天,随后将反应的溶液旋转蒸发浓缩,在400-500ml冰乙醇中沉淀,抽滤并用乙醇洗涤沉淀,真空干燥形成最终的ac-阿仑膦酸钠产物。
[0010]
4. 上述步骤(3)所述的gca水凝胶的形成,制备方法如下:首先配置含有16% wt%明胶、7wt% ac-β-环糊精和100m 阿仑膦酸钠的杜氏磷酸盐缓冲混合溶液1;再配置100m cacl2、mgcl2(ca:mg=5:3)和0.5wt% 2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮的杜氏磷酸盐缓冲混合溶液2;将混合溶液2加入到混合溶液1中,均匀混合,并且用20w紫外灯照射10min后形成gca水凝胶。
[0011]
5. 上述步骤(4)所述的gca水凝胶的生物相容性性能,检测方法如下:根据步骤(3)中的方法制备gca水凝胶支架先用75%酒精浸泡30min灭菌,在紫外光照射下照射2h,然后以2
×
104细胞/孔的密度将细胞接种在样品上培养。放置于37℃下的co2培养箱中进行培养。培养1和4天后,使用活/死细胞染色法检测水凝胶上的细胞增殖情况。用倒置荧光显微镜观察活/死细胞状态。
[0012]
6. 上述步骤(5)所述的gca水凝胶促进人体间充质干细胞的成骨分化性能,检测方法如下:根据步骤(3)中的方法准备材料并对水凝胶前体溶液进行消毒后对人体间充质
干细胞分别进行包覆后成胶。包覆后的四组gca支架材料首先置于37℃下孵育4h,随后放入co2培养箱中进行体外培养。21天后将样品取出并使用茜素红试剂盒子测定细胞中磷酸钙的形成用于判定矿化。进一步对i型胶原蛋白(col-i)、骨钙素(ocn)基因和runt相关转录因子(runx-2)的基因表达情况进行测试。
[0013]
采用上述技术方案后,本发明具有如下特点和优点:1、生产工艺简单,没有工艺复杂有害的合成手段;2、使用明胶 (gel)、β-环糊精(β-环糊精)和阿仑膦酸钠具有生物相容和环境友好的特性;3、在不牺牲自身强度的情况下保持水凝胶的自愈性,贴合不规则骨缺损伤口;4、gca水凝胶具有良好的生物相容性为解决不规则颅骨修复再生的提供了更大的可能。
附图说明
[0014]
图1为本发明实施例中的gca水凝胶的表征图;图中:a是 ac-阿仑膦酸钠核磁共振氢谱图,b是ac
‑ꢀ
β-环糊精的核磁共振氢谱图。
[0015]
图2为本发明实施例中的gca水凝胶的力学性能;图中:(a)为时间流变曲线图;(b)为频率流变曲线图;(c)为应变流变曲线图; (d)为高低剪切应变流变曲线图;。
[0016]
图3为本发明实施例中的gca水凝胶促成骨分化的自愈性的检测;图中: gca水凝胶的自愈合过程图。
[0017]
图4为本发明实施例中的gca水凝胶促成骨分化的微观结构性能的表征;图中:(a)为gca0水凝胶(0mm ac-阿仑膦酸钠)的sem图;(b) gca100水凝胶(100mm ac-阿仑膦酸钠)的sem图;(c) gca200水凝胶(200mm ac-阿仑膦酸钠)的sem图;(d) gca300水凝胶(300mm ac-阿仑膦酸钠)的sem图。
[0018]
图5为本发明实施例中的gca水凝胶促成骨分化的钙镁离子缓释的表征:图中:(a)为gca水凝胶的钙离子缓释图;(b)为gca水凝胶的镁离子缓释图。
[0019]
图6为本发明实施例中的gca水凝胶与人体间充质干细胞生物相容性的检测;图中:细胞活死细胞染色图。
[0020]
图7为本发明实施例中的gca水凝胶促进人体间充质干细胞成骨分化的检测;图中:(a) ars测量人体间充质干细胞的成骨情况;(b) gca水凝胶中col
ꢀⅰ
、ocn和runx-2的相对基因表达图。
具体实施方式
[0021]
本发明提出了一种简单、高效的方法,以生产可自愈可促进成骨分化的水凝胶。总的来说,将明胶与制备的ac-β-环糊精和ac-阿仑膦酸钠混合形成首先配置含有16% wt%明胶、7wt% ac-β-环糊精和100m 阿仑膦酸钠的杜氏磷酸盐缓冲混合溶液,然后制备再配置100m cacl2、mgcl2(ca:mg=5:3)和0.5wt% 2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮的杜氏磷酸盐缓冲混合溶液,将两种溶液混合紫外照射10min后从而形成gca水凝胶。这允许水凝胶包覆干细胞后先在体外分化培养以及支持原生组织中的细胞向水凝胶中迁移的性质可保证并提高体内骨组织的修复效率。水凝胶的可自愈则可保证对各种形状骨缺损的简单高效填充。上述支架材料还同时具备有制备简单、成本低廉、操作简便、利于临床推广的特点。
[0022]
实施例11、gca水凝胶的制备。
[0023]
(1制备ac-β-环糊精:通过丙烯酰氯改性β-环糊精,使酰氯与β-环糊精上的羟基反应成功制得ac-β-环糊精,具体方法为:β-环糊精溶解于150 ml n,n-二甲基甲酰胺中,置于室温冰浴中。冰浴搅拌时,向混合溶液中加入7.2 ml三乙胺。然后加入6ml丙烯酰氯,将混合溶液在冰浴中搅拌8 h,反应后的混合溶液过滤去除沉淀物。混合物在减压下浓缩。粗产物在加入冷的无水丙酮后从水中沉淀。沉淀物经过滤收集,用冷丙酮洗涤,然后真空干燥72小时形成最终的ac-β-环糊精产物;(2) 制备ac-阿仑膦酸钠:利用n-丙烯酰氧基琥珀酰亚胺改性阿仑膦酸钠形成带双键的ac-阿仑膦酸钠,具体制备方法为:阿仑膦酸钠和n
ꢀ‑
丙烯氧基琥珀酰亚胺溶于160 ml 100 ml三乙醇胺缓冲液中。用5m naoh调节ph至8.5。反应在室温下持续搅拌1-2天。胶囊在减压下被浓缩。粗品从水中加入冷的无水乙醇沉淀。沉淀物经过滤收集,用冷乙醇洗涤,然后在真空中干燥72小时形成最终的ac-阿仑膦酸钠产物;(3) 制备gca水凝胶:首先配置含有16wt%明胶、7wt% ac-β-环糊精和100m 阿仑膦酸钠的杜氏磷酸盐缓冲混合溶液1;再配置100m cacl2、mgcl2(ca:mg质量比=5:3)和0.5wt% 2-羟基-2-甲基-1-[4-(2-羟基乙氧基)苯基]-1-丙酮的杜氏磷酸盐缓冲混合溶液2;将混合溶液2加入到混合溶液1中,均匀混合,并且用20w紫外灯照射10min后形成gca水凝胶;(4) 基于步骤(3)的gca水凝胶构建的水凝胶材料检测其生物相容性的方法:根据步骤(3)中的方法制备gca水凝胶支架先用75%酒精浸泡30min灭菌,在紫外光照射下照射2h,然后以2
×
104细胞/孔的密度将细胞接种在样品上培养。放置于37℃下的co2培养箱中进行培养。培养1和4天后,使用活/死细胞染色法检测水凝胶上的细胞增殖情况。用倒置荧光显微镜观察活/死细胞状态。
[0024]
(5) 基于步骤(3)的gca水凝胶构建的水凝胶材料检测其促成骨分化能力的方法:根据步骤(3)中的方法准备材料并对水凝胶前体溶液进行消毒后对人体间充质干细胞分别进行包覆后成胶。包覆后的四组gca支架材料首先置于37℃下孵育4h,随后放入co2培养箱中进行体外培养。21天后将样品取出并使用茜素红试剂盒子测定细胞中磷酸钙的形成用于判定矿化。进一步对i型胶原蛋白(col-i)、骨钙素(ocn)基因和runt相关转录因子(runx-2)的基因表达情况进行测试。
[0025]
2、材料表征。
[0026]
在步骤1中,为了制备出优异的gca水凝胶,通过丙烯酰氯改性β-环糊精,用n-丙烯酰氧基琥珀酰亚胺改性阿仑膦酸钠,在图1中的(a)上可以看出丙烯酰基特征峰出现在6.10-6.48 ppm处。取代度是根据ac-β-环糊精上1号位h上的峰面积进行积分计算为1.07。即平均一个β-环糊精上成功接枝1.07个丙烯酰键。证明了ac-β-环糊精成功制备。在ac-阿仑膦酸钠的0.5-1.5h nmr谱图中(图1中的 b)的6.2-6.4ppm处出现丙烯酰基特征峰,根据阿仑膦酸钠上的亚甲基中的h面积积分计算测得ac-阿仑膦酸钠的双键取代度为0.75。相当于平均每个阿仑膦酸钠上成功接枝了0.75个双键。证明了阿仑膦酸钠成功改性。
[0027]
3、力学性能测试本次表征采用四个组:第一组是gca0水凝胶组(0mm ac-阿仑膦酸钠),第二组是gca100水凝胶组(100mm ac-阿仑膦酸钠),第三组是gca200水凝胶组(200mm ac-阿仑膦酸
钠),第四组是gca300水凝胶组(300mm ac-阿仑膦酸钠)。在图2 中的(a)的时间扫描曲线中所有gca水凝胶的弹性模量(g’)都大于损耗模量(g”),且在任意时间段都保持这样的趋势。这样的趋势向我们证明所有gca水凝胶保持在凝胶状态。在25℃时,弹性模量g’和损耗模量随着纳米粒子含量的增加而进一步增强,这与之前的微观结构、溶胀行为、降解行为和缓释行为的结论是一致的。在图2 中的(b)的频率扫描曲线中显示,随着频率的变化,所有水凝胶的弹性模量g’和损耗模量g”逐渐增加。这明显是含有物理交联的水凝胶特有的应力弛豫。当较小的频率时,gca水凝胶中的物理交联包括主客体交联和明胶自身三螺旋结构可以通过成键和断键来抵抗和消化震荡力。这也侧面印证了gca水凝胶存在物理交联。通过应变扫描测试,更进一步了解gca水凝胶的0.1%-1000%应变下的模量变化(图2中的c)。当应力逐渐增大,水凝胶会由g”>g’转变为g”<g’,这表明水凝胶由“凝胶”化转变为“溶胶”化,所有水凝胶交点处的应变都在 100%-200%之间。说明当应变高于交点时,gca水凝胶内部的大部分交联断裂。在上述的应变扫描中,观测到所有水凝胶的交点应变,因此选定1%和500%作为阶跃交替应变扫描测试中的应变参数。通过测试,图2中的(d)中gca水凝胶随着高/低剪切应变的循环会呈现出“凹”字型“溶胶-凝胶”化循环。当处于高剪切应变时,gca水凝胶显示处于“溶胶”化状态(g”<g’),但当应变降低至1%时水凝胶又可以恢复至“凝胶”化状态(g”>g’)。而在经过三个循环后,gca水凝胶的弹性模量和损耗模量依旧可以恢复到原来的状态。这表明在应变减小后,gca水凝胶中的主客体交联、明胶分子间氢键以及离子络合作用得以迅速成键重组。综上所述,gca水凝胶具有优异的自愈重组能力。
[0028]
4、自愈性能测试。
[0029]
在之前的研究中,讨论了gca水凝胶流变学行为,发现水凝胶具有优异的重组能力,所以选流变性能最强的gca300水凝胶验证其可自愈性(图3)。将制备的圆形、三角形和星星状的gca300水凝胶分别用亚甲基蓝或者甲基橙溶液染色,将黄色的圆形水凝胶成两半,与蓝色的三角形水凝胶重新愈合成一个爱心形状,并在37℃下的水浴环境中也没有散开。而两个不同颜色的星星状水凝胶切断之后重新组合成为一个双色的星星水凝胶。动态的主客体交联、可重组的离子络合作用和明胶中的分子间氢键是gca300水凝胶的自愈合机制的重要原因。使得gca300水凝胶在外力作用下断键,而在撤销外力后的适宜处境下可以实现重组。
[0030]
5、扫描电子显微镜测试。
[0031]
为了研究水凝胶的微观结构,利用扫描电子显微镜(sem)研究了水凝胶的截面内部结构(图5)。gca0水凝胶在低倍放大下(
×
100倍)均表现出高度多孔的蜂窝状结构(图4中的a),在高倍放大下(
×
1000倍)表现出相对光滑的孔隙表面。与此相反,加入ac-阿仑膦酸钠和钙镁离子的水凝胶 (gca100、gca200和gca300) 表现出致密化的结构,并附着许多不同形状和大小的纳米/微珠(图4中的b-d)。随着ac-阿仑膦酸钠、钙离子和镁离子的浓度攀升,水凝胶网络逐渐变得致密,网络孔径逐渐减小,gca300水凝胶甚至几乎看不出孔径。在放大的gca100、gca200和gca300水凝胶中,颗粒形状不规则,粒径较大(约10
µ
m)。这表明,在紫外照射下,由于纳米离子表面的丙烯酸酯基团和ac-β-环糊精和ac-阿仑膦酸钠上的甲基丙烯酸酯基团的自由基聚合而聚集在一起,从而导致了gca水凝胶中的大尺寸微域的形成。在eds分析中,为了避免pbs中元素的干扰,水凝胶样品用去离子水制备,漂洗去除未交联的成分后冷冻干燥处理。eds分析显示,纳米/微球的sem观察位置有大量的钙和镁的信号,从
而验证了ac-阿仑膦酸钠、ca
2+
和mg
2+
参与了这些结构的形成。实验结果表明gca水凝胶有着致密的网络以及成功负载ac-阿仑膦酸钠以及钙镁离子,有希望成为理想的修复颅骨缺损材料的潜能。
[0032]
6、钙镁离子缓释测试。
[0033]
然之前有报道钙镁离子促进骨再生,但过度释放实际上可能导致骨丢失。因此,要小心控制钙镁离子从医用材料中的释放速率。所以需进一步测试了钙镁离子在模拟体内环境下的释放行为。图5表明了gca100、gca200和gca300水凝胶的钙离子(图5中的a)和镁离子(图5中的b)的缓释行为。而这三组水凝胶的中的ac-阿仑膦酸钠和钙离子镁离子的浓度增加,虽然钙镁离子缓释百分比降低,这是与交联密度密切相关。值得注意的是,这里的百分比是按照原始添加的总量来计算的,所以看得出来,缓释量并没有爆发式的增长,而增加ac-阿仑膦酸钠和钙离子镁离子的浓度只会缓慢增加钙镁离子缓释浓度。从第三天起所有组分缓释速率都明显降低,在缓释五天后gca300水凝胶镁离子缓释量为29%,钙离子缓释量为27%。可预见在水凝胶完全降解前钙镁离子缓释量都会由于微粒上与含有丙烯酰基的阿仑膦酸钠相结合而镶嵌在聚合链上,有这样稳定的机制存在,因而有着较低的缓释率。此外,膦酸钙比膦酸镁更加稳定和不溶,因此钙离子跟镁离子在与ac-阿仑膦酸钠结合的时候呈现出竞争关系,所以各组水凝胶达到缓释平衡后钙离子的总缓释量总是低于镁离子。研究表明,gca水凝胶具有适宜的缓释曲线,可以长期持续释放钙离子和镁离子,使得在水凝胶植入颅骨缺损处时发生协同作用,促进人体间充质干细胞的成骨分化,这为成为理想的颅骨缺损组织工程材料提供了更大的进步。
[0034]
实施例2基于gca水凝胶促成骨分化的材料生物相容性检测。
[0035]
制备方法如下:以人体间充质干细胞(人体间充质干细胞)为材料,研究水凝胶体系的生物相容性。水凝胶支架先用75%酒精浸泡30min灭菌,在紫外光照射下照射2h,然后以2
×
104细胞/孔的密度将细胞接种在样品上培养。放置于37℃下的co2培养箱中进行培养。培养1和4天后,使用活/死细胞染色法检测水凝胶上的细胞增殖情况。用倒置荧光显微镜观察活/死细胞状态。
[0036]
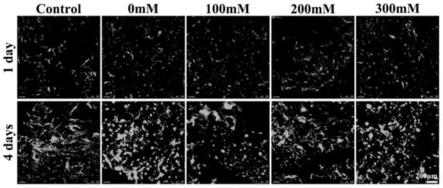
为了研究gca水凝胶的生物相容性,在空白组、gca0、gca100、gca200、gca300水凝胶表面培养人体间充质干细胞细胞并进行观测。从图6可以看出,在第1天,五组的活细胞和死细胞数量没有显著差异。此时,新鲜种植的细胞刚刚贴壁,还处于适应阶段,这些结果表明四种材料对细胞没有明显的毒副作用。但经过4天的培养后,差异逐渐显现。虽然4天后所有组的细胞活力增强但是增殖速度有所差异,与空白对照组相比,实验组中的四组水凝胶上细胞都表现出更强的增殖特征,且gca0水凝胶中细胞增殖效果最好,但是总体差异不大,且均有铺展行为。这强有力的证明了水凝胶具有良好的生物相容性,为接下来的骨修复提供了更大的可能性。
[0037]
实施例3基于gca水凝胶促人体间充质干细胞体外成骨分化的检测。
[0038]
制备方法如下:在体外实验成骨分化实验中,在对水凝胶前体溶液进行消毒后对人体间充质干细胞分别进行包覆后成胶。包覆后的四组gca支架材料首先置于37℃下孵育4h,随后放入co2培养箱中进行体外培养。21天后将样品取出并使用茜素红试剂盒子测定细
胞中磷酸钙的形成用于判定矿化。进一步对i型胶原蛋白(col-i)、骨钙素(ocn)基因和runt相关转录因子(runx-2)的基因表达情况进行测试。
[0039]
在体内实验中,将人体间充质干细胞接种于对照组和四组gca水凝胶支架中(n=3),培养21天后进行茜素红染色。人体间充质干细胞在分化为成骨细胞时,在细胞表面会沉积出钙盐,形成钙结节。茜素红与钙发生显色反应,产生一种深红色的带色化合物。如图7中的a所示,在21天后,对照组和gca100组仅观察到少量红色矿化结节。相比之下,gca300组比其他组具有更强烈和分布更多的红色、形状不规则和颜色不均匀的矿化结节。验证了gca300水凝胶具有最优的体外分化结果。为了进一步评价不同组水凝胶对成骨分化的影响,因此分析了成骨细胞的标志基因(col
‑ⅰ
、ocn、runx-2)表达(图7中的b)。从基因在不同材料中的相对表达情况来看,gca300水凝胶中的三种基因表达明显增加并且优于其他四组。这些结果表明,本实验制备的gca300水凝胶具有较强的矿化诱导能力,可促进成骨分化。同时有利于成骨细胞在体外的存活和繁殖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1