一种载药型人工皮肤及其制备方法与流程
1.本发明属于生物医用材料技术领域,尤其涉及一种载药型人工皮肤及其制备方法。
背景技术:
2.皮肤作为人体最大的器官,皮肤约占称人体重的16%,其结构由表皮、真皮和皮下组织组成,有保护、分泌、感知和代谢的功能,皮肤缺失是常见的组织损伤性疾病,但人的皮肤是一种再生能力很强的组织,即使大面积的损伤,也会由于治疗得到逐渐的恢复,不过大面积的烧伤或是创伤,皮肤就不能靠自己修复,需要人工皮肤作为治疗过程中的一种暂时性的创面保护覆盖材料来帮助。
3.自体植皮、同种异体植皮、异种植皮是常用的皮肤缺损修复途径,但是具有供区不足,免疫排斥及传播疾病等缺点;中国发明专利cn101143231b公开了一种含肌细胞的组织工程皮肤及其制备方法,其是从对所取组织进行消化,分离成表皮细胞,纤维细胞,并对其进行分离培养和扩增,达到一定的数量后重组成双层人工皮肤组织,此人工皮肤原料取材于人体组织,存在一定的风险,且价钱昂贵,一般患者很难接受。因此,如何研制出结构和功能与人体正常皮肤相似的人工皮肤,作为损伤皮肤的替代物,发挥保护创面和促进创面愈合的作用,是临床上亟待解决的问题,且人工皮肤易于保存运输,技术可靠,可成批生产,生产安全及质量控制趋于成熟,占据市场发展的主流。
4.人工皮肤可分为人工表皮、人工真皮和同时具有表皮和真皮的复合性皮肤,人工表皮移植能够防止创面液体流失,阻断外界微生物侵入,但由于缺乏真皮结构,在深度创面上不能形成正常的锚定纤维,导致移植成活率低,创面挛缩明显,抗感染能力差。人工真皮植入全层皮肤缺损创面,能迅速与创面粘着,并有丰富的血管长入,但由于缺乏表皮成分,抗感染能力及保存液体的能力也比较差,通常在人工真皮移植后,还需进行第二次自体皮移植。复合性皮肤同时具有表皮层和真皮层,当其植入损伤部位后,半渗透的表皮层能起到保护、透气和防止细菌侵袭等作用,而真皮层具有三维多孔支架结构,在术后几周后,随着支架不断降解,成纤细胞和毛细血管长入三维结构,在充足的血供条件下,长入的细胞保持高的活力,细胞分泌出胶原蛋白,真皮得以重建。商品化复合性人工皮肤的真皮层由胶原和6-硫酸软骨素共价交联制成的海绵组成,表皮层为硅胶膜,虽然真皮层复合多孔支架力学性能稍有改善,但由于胶原、6-硫酸软骨素结构、性能等差异较大,该人工皮肤又存在降解周期难以控制、多孔结构不规则等不足和缺陷;如中国发明专利申请cn107050521a公开了一种双层胶原真皮支架及其制备方法,表皮层为硅胶膜,真皮层为胶原-硫酸软骨素复合支架,也存在真皮层多孔结构杂乱的不足。
5.另外,临床治疗的过程中,细菌感染是患者面临的一大难题,经研究发现,葡萄糖菌和链球菌是引起皮肤感染的主要细菌,治疗细菌感染常用的方法是全身给药方式注射抗生素,导致了细菌的耐药性,局部给药是一个很好的选择,因此面对现有人工皮肤存在多孔结构杂乱、血管化、创面感染等问题,亟待提供一种具有较好的物理性能和抗菌性能的人工
皮肤用于皮肤创面的治疗。
6.胶原蛋白是人体皮肤中主要的成分,皮肤中胶原蛋白占72%,真皮中80%是胶原蛋白,大量的生物学和物理学研究结果表明,胶原具有活跃的生物功能,可主动参与细胞的迁移、分化和增殖,能与血液直接接触,可改善表皮细胞的微环境,促进皮肤组织新陈代谢所必需的氨基酸的合成,加速皮肤再生和修复。胶原具有良好生物相容性、生物降解性、低免疫原性、低细胞毒性以及促进细胞生长等性能,已广泛用于人工皮肤研制,但胶原的缺点是无弹性、强度低,在体内降解的速度快,从而限制了其的应用。
7.丝素蛋白是一种天然纤维蛋白,含有18种氨基酸,其中的11种为人体必需的氨基酸,丝素蛋白对人体无毒害作用,安全可靠,具有良好的生物活性、机械性能及理化性能,丝素蛋白与人体皮肤蛋白都属于纤维蛋白,结构相似,丝素蛋白及其水解物与人体皮肤的亲和性是任何其他天然蛋白所不能比拟的。相较于胶原蛋白,丝素蛋白生物相容性良好且同时具备足够的力学强度,且丝素蛋白较慢的降解速度可以为细胞生长提供长久的支持,丝素蛋白与胶原蛋白的复合材料集两种材料优势于一身,克服了单一材料的应用不足,增加胶原蛋白基产品的机械强度,缓解其降解速率,而且其降解速率可调控。然而,目前同时采用胶原蛋白和丝素蛋白形成表皮层和真皮层且性能优异的人工皮肤还未见报道。
8.综上,非常有必要提供一种新型的载药型人工皮肤及其制备方法。
技术实现要素:
9.为了解决现有技术中存在的一个或者多个技术问题,本发明提供了一种载药型人工皮肤及其制备方法。本发明提供的载药型人工皮肤,是由i型胶原蛋白和丝素蛋白及莫匹罗星组成的载药型人工组织工程皮肤,同时具有表皮层和真皮层,在组成、结构上进行了最大程度上的仿生,其中表皮层是由胶原蛋白和丝素蛋白组成,混有莫匹罗星抗菌药,且表皮层具有微孔结构,在阻菌、抗菌,防止水分和液体从创面溢出的同时,赋予膜透气的功能;真皮层是由胶原蛋白及丝素蛋白采用纺丝技术而得到的阶梯网状结构,通过电纺丝技术调节纺丝的直径和孔径,解决了现有人工皮肤存在的多孔结构杂乱的问题,便于成纤细胞和毛细血管长入三维结构,在充足的血供条件下,长入的细胞保持高的活力,细胞分泌出胶原蛋白,真皮得以重建。
10.本发明在第一方面提供了一种载药型人工皮肤,所述载药型人工皮肤包括表皮层和真皮层;所述表皮层由胶原蛋白、丝素蛋白和莫匹罗星复合而成;所述真皮层包括上真皮层和下真皮层,所述上真皮层为由胶原蛋白和丝素蛋白组成的细纤维结构层,所述下真皮层为由胶原蛋白和丝素蛋白组成的粗纤维结构层。
11.优选地,所述载药型人工皮肤具有如下一个或者多个性质:
12.所述表皮层的厚度为0.07~1.2mm;
13.所述真皮层的厚度为2~4mm,所述上真皮层的厚度为1~2mm;
14.所述上真皮层的纤维直径为580~647nm,孔隙率为50~60%;
15.所述下真皮层的纤维直径为700~780nm,孔隙率为65~80%;
16.所述上真皮层相比所述下真皮层更靠近所述表皮层;
17.所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,优选的是,所述微孔的孔径为60~110μm;
18.所述表皮层靠近所述上真皮层的一面粗糙,所述表皮层背离所述上真皮层的一面光滑,所述表皮层粗糙的一面具有网状结构;
19.所述上真皮层和所述下真皮层均通过电纺丝技术制备而成。
20.本发明在第二方面提供了一种载药型人工皮肤的制备方法,所述载药型人工皮肤包括表皮层和真皮层,所述真皮层包括上真皮层和下真皮层,所述方法包括如下步骤:
21.(1)将莫匹罗星溶解在水中,得到莫匹罗星溶液;
22.(2)将丝素蛋白和胶原蛋白加入醋酸溶液中并搅拌均匀,得到丝素蛋白-胶原蛋白溶液;
23.(3)将所述莫匹罗星溶液与所述丝素蛋白-胶原蛋白溶液混合并搅拌均匀,得到混合溶液;
24.(4)将所述混合溶液注入模具中,并通过模板法进行造孔,然后经过干燥、脱模和交联,制得表皮层;
25.(5)将胶原蛋白和丝素蛋白加入六氟异丙醇或醋酸溶液中,制备浓度为4~6%的第一纺丝液和浓度为7~9%的第二纺丝液;
26.(6)采用所述第二纺丝液通过电纺丝技术制得下真皮层,然后采用所述第一纺丝液通过电纺丝技术在所述下真皮层的基础上制得上真皮层,然后经过交联,制得真皮层;
27.(7)在所述表皮层上涂覆胶原蛋白的醋酸溶液,然后覆盖在所述真皮层包括的上真皮层上,再经冷冻干燥和交联,制得载药型人工皮肤。
28.优选地,步骤(4)制得的所述表皮层的一面光滑,另一面粗糙;在步骤(7)中,在所述表皮层粗糙的一面上涂覆胶原蛋白的醋酸溶液,然后覆盖在所述真皮层包括的上真皮层上,再经冷冻干燥和交联,制得载药型人工皮肤。
29.优选地,在步骤(1)中,所述莫匹罗星溶液中含有莫匹罗星的质量分数为0.5~1.5%,优选为1%;在步骤(2)中,所述丝素蛋白与所述胶原蛋白的质量比为1:(0.5~2),所述丝素蛋白-胶原蛋白溶液的浓度为4~7%;在步骤(4)中,所述模具的底端具有用激光打的微孔,所述微孔内插设有直径为50-100μm的铜丝,且所述铜丝的底部插有无纺布网,所述无纺布网平铺在所述模具的底端,优选的是,所述无纺布网为140~300目的无纺布网;在步骤(5)中,胶原蛋白和丝素蛋白的质量比为1:(0.5~2),优选为2:1,所述第一纺丝液的浓度为6%,所述第二纺丝液的浓度为8%;在步骤(4)、步骤(6)和/或步骤(7)中,所述交联为:紫外照射12~48h;和/或在步骤(7)中,所述胶原蛋白的醋酸溶液中含有胶原蛋白的质量分数为4~8%,优选为5%。
30.优选地,制备上真皮层和/或下真皮层的电纺丝参数为:电压15~25kv,接收距离10~17cm,所述第一纺丝液和/或所述第二纺丝液的流速为1~3ml/h。
31.优选地,所述醋酸溶液中含有醋酸的质量分数为4~8%,优选为5%;和/或所述胶原蛋白为i型胶原蛋白。
32.优选地,在步骤(2)中,搅拌的时间为2~4h;和/或在步骤(3)中,搅拌的时间为1~3h。
33.本发明在第三方面提供了由本发明在第二方面所述的制备方法制得的载药型人工皮肤,所述表皮层由胶原蛋白、丝素蛋白和莫匹罗星复合而成;所述上真皮层为由胶原蛋白和丝素蛋白组成的细纤维结构层,所述下真皮层为由胶原蛋白和丝素蛋白组成的粗纤维
结构层。
34.优选地,所述载药型皮肤具有如下一个或者多个性质:
35.所述表皮层的厚度为0.07~1.2mm;
36.所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,优选的是,所述微孔的孔径为60~110μm;
37.所述表皮层粗糙的一面具有网状结构;
38.所述真皮层的厚度为2~4mm,所述上真皮层的厚度为1~2mm;
39.所述上真皮层的纤维直径为580~647nm,孔隙率为50~60%;
40.所述下真皮层的纤维直径为700~780nm,孔隙率为65~80%。
41.本发明与现有技术相比至少具有如下有益效果:
42.(1)本发明提供的是载药型人工皮肤,此人工皮肤具有表皮层和真皮层,在一些优选的实施方案中,此表皮层的厚度0.07-1.2mm,与人体皮肤表皮层厚度相似,膜一面光滑,一面粗糙,粗糙面与人皮真皮层表面的乳突层类似,有利于与真皮层的复合,表皮层是采用模板法,利用自制模具形成的带孔结构半通明薄膜,在阻菌、抗菌,防止水分和液体从创面溢出的同时,赋予膜透气的功能;此半透明膜与市场上硅胶膜表皮层相比,本发明中的表皮层不用二次取下,避免了二次取下给患者造成的伤害;此表皮层载有莫匹罗星抗菌药,莫匹罗星主要用于革兰氏阳性球菌引起的皮肤感染,莫匹罗星随着表皮层的降解而逐渐释放,从而赋予此人工皮肤具有抗菌的功能,避免患者二次感染的风险;本发明通过混溶方法将相应的莫匹罗星药物加入到人工皮肤的表皮层上,从而有效地预防治疗过程的感染并发症,进一步减轻患者在治疗过程中的痛苦。
43.(2)皮肤的真皮层是由乳头层和网状层组成,乳头层保持波浪形状,以保证皮肤的弹性,毛细管、淋巴腺及神经分布,网状层主要是由粗大的胶原纤维、弹性纤维和网状纤维组成的弹性结构,本发明中的载药型人工皮肤的真皮层模拟人体真皮层,具有双层结构,在一些优选的实施方案中,膜厚度为2-4mm,上层是由胶原蛋白和丝素蛋白组成的细纤维结构,纤维直径为580-647nm,孔隙率为50-60%,下层纤维直径为700-780nm,孔隙率为65%-80%,有效的模拟了人体的真皮层的网状结构,便于成纤细胞和毛细血管长入三维结构,在充足的血供条件下,长入的细胞保持高的活力,细胞分泌出胶原蛋白,重建真皮。
44.(3)本发明在所述载药型人工皮肤的表皮层与真皮层接触面采用胶原蛋白的醋酸溶液作为粘结剂,有效的将表皮层和真皮层粘结在一起,避免了引入生物胶的风险;本发明中的载药型人工皮肤的表皮层和真皮层都采用物理交联,避免了交联剂的引入,提高了人工皮肤的安全性。
45.(4)本发明方法制备的人工皮肤无免疫排斥反应,成本低廉,原料来源广泛,用于覆盖皮肤缺损区作为表皮、真皮的临时替代物,能够保持创面干净并有效控制疼痛,诱导自体皮肤再生修复。
附图说明
46.图1是本发明一些具体实施方式中制备丝素蛋白的工艺流程图。
47.图2是本发明一些具体实施方式中制备胶原蛋白的工艺流程图。
48.图3是本发明一些具体实施方式中制备所述载药型人工皮肤的表皮层的工艺流程
图。
49.图4是本发明一些具体实施方式中制备所述载药型人工皮肤的工艺流程图。
50.图5是本发明制备表皮层采用的模具的内部结构示意图。
51.图6是图5中的模具的底端放大示意图。
52.在图5和图6中:1:无纺布网;2:微孔;3:铜丝。
具体实施方式
53.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
54.本发明在第一方面提供了一种载药型人工皮肤,所述载药型人工皮肤包括表皮层和真皮层;所述表皮层由胶原蛋白(例如i型胶原蛋白)、丝素蛋白和莫匹罗星复合而成,优选的是,所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,所述微孔的孔径为60~110μm,优选的是,多个所述微孔呈阵列分布,每个所述微孔的孔径独立地为60~110μm,每个所述微孔的孔径可以相同或不相同,所述表皮层是由i型胶原蛋白、丝素蛋白以及莫匹罗星复合而成的载药、带孔、半透明人工表皮(半通透薄膜);在本发明中,所述表皮层由可降解的胶原蛋白、丝素蛋白以及莫匹罗星组成,与现有市售的硅胶表皮层相比,避免了二次取下给患者造成的伤害,且载有可以治疗革兰氏阳性球菌引起的皮肤感染的莫匹罗星,莫匹罗星随着表皮层的降解而逐渐释放,能够赋予本发明中的人工皮肤具有抗菌的性能;所述真皮层包括上真皮层和下真皮层,所述上真皮层为由胶原蛋白(例如i型胶原蛋白)和丝素蛋白组成的细纤维结构层,所述下真皮层为由胶原蛋白(例如i型胶原蛋白)和丝素蛋白组成的粗纤维结构层,使得所述真皮层为阶梯网状结构;在本发明中,细纤维结构层和粗纤维结构层是相对而言的,优选的是,所述细纤维结构层为纤维为直径为580-647nm,孔隙率为50-60%的细纤维结构层,所述粗纤维结构层为纤维直径700-780nm,孔隙率为65~80%的粗纤维结构层;在本发明中,优选的是,所述真皮层是由胶原蛋白及丝素蛋白采用电纺丝技术而得到的阶梯网状结构,便于成纤细胞和毛细血管长入三维结构,在充足的血供条件下,长入的细胞保持高的活力,细胞分泌出胶原蛋白,真皮得以重建;此外,所述载药型人工皮肤由于包含有丝素蛋白,能够有效提高胶原蛋白的机械强度,且与皮肤具有相似的柔软性。
55.根据一些优选的实施方式,所述载药型人工皮肤具有如下一个或者多个性质:
56.所述表皮层的厚度为0.07~1.2mm(例如0.07、0.08、0.09、0.1、0.12、0.15、0.18、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、0.95、1.0、1.1或1.2mm);所述真皮层的厚度为2~4mm(例如2、2.5、3、3.5或4mm),所述上真皮层的厚度为1~2mm(例如1、1.2、1.5、1.8或2mm);所述上真皮层的纤维直径为580~647nm,孔隙率为50~60%;所述下真皮层的纤维直径为700~780nm,孔隙率为65~80%;所述上真皮层相比所述下真皮层更靠近所述表皮层;所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,优选的是,所述微孔的孔径为60~110μm;在本发明中,所述表皮层沿厚度方向具有微孔结构,所述表皮层靠近所述上真皮层的一面粗糙(相对粗糙),所述表皮层背离所
述上真皮层的一面光滑(相对光滑),所述表皮层粗糙的一面具有网状结构;所述上真皮层和所述下真皮层均通过电纺丝技术制备而成;本发明对所述表皮层两面的粗糙度和光滑度没有特别的要求,所述粗糙和所述光滑都是相对而言的。
57.根据一些优选的实施方式,所述真皮层具有双层结构,所述真皮层的厚度为2-4mm,上真皮层是由胶原蛋白和丝素蛋白组成的细纤维结构,纤维直径为580-647nm,孔隙率为50-60%,下真皮层由胶原蛋白和丝素蛋白组成的粗纤维结构,纤维直径为700-780nm,孔隙率65%-80%,这有效的模拟了人体的真皮层的网状结构,便于成纤细胞和毛细血管长入三维结构,在充足的血供条件下,长入的细胞保持高的活力,细胞分泌出胶原蛋白,真皮得以重建。
58.本发明在第二方面提供了一种载药型人工皮肤的制备方法,所述载药型人工皮肤包括表皮层和真皮层,所述真皮层包括上真皮层和下真皮层,所述方法包括如下步骤:
59.(1)将莫匹罗星溶解在水(纯化水)中,得到莫匹罗星溶液;
60.(2)将丝素蛋白和胶原蛋白加入醋酸溶液中并搅拌均匀,得到丝素蛋白-胶原蛋白溶液;本发明对所述丝素蛋白和i型胶原蛋白的来源没有特别的限制;
61.(3)将所述莫匹罗星溶液与所述丝素蛋白-胶原蛋白溶液混合并搅拌均匀,得到混合溶液;
62.(4)将所述混合溶液注入模具中,并通过模板法进行造孔,然后经过干燥、脱模和交联,制得表皮层;优选为制得的所述表皮层的一面光滑,另一面粗糙;在本发明中,光滑、粗糙都是相对而言的;在本发明中,所述干燥例如可以将注入有所述混合溶液的模具在常温下(例如20~30℃)直接干燥(干燥时间例如不小于10h),可以保证得到半透明表皮层,所述表皮层呈半透明状可以监测伤口愈合情况;
63.(5)将胶原蛋白和丝素蛋白加入六氟异丙醇或醋酸溶液(例如质量浓度为4~8%的醋酸溶液)中,制备浓度为4~6%的第一纺丝液和浓度为7~9%的第二纺丝液;
64.(6)采用所述第二纺丝液通过电纺丝技术制得下真皮层,然后采用所述第一纺丝液通过电纺丝技术在所述下真皮层的基础上制得上真皮层,然后经过交联,制得真皮层;
65.(7)在所述表皮层上涂覆胶原蛋白的醋酸溶液,然后覆盖在所述真皮层包括的上真皮层上,再经冷冻干燥和交联,制得载药型人工皮肤;本发明对所述表皮层上涂覆胶原蛋白的醋酸溶液的厚度没有特别的要求,涂上薄薄一层即可;本发明对所述冷冻干燥的条件没有特别的限制,采用现有常规冷冻干燥条件进行即可,优选地,可以按照表1中的冷冻干燥条件进行所述冷冻干燥,所述冷冻干燥包括预冻阶段、第一升华阶段、第二升华阶段,各阶段的目标温度和时长如下表1所示。
66.表1:冷冻干燥条件。
67.[0068][0069]
在本发明中,优选的是,在所述表皮层粗糙的一面上涂覆胶原蛋白的醋酸溶液,然后覆盖在所述真皮层包括的上真皮层上,再经冷冻干燥和交联,制得载药型人工皮肤。
[0070]
根据一些优选的实施方式,步骤(4)制得的所述表皮层的一面光滑,另一面粗糙;在步骤(7)中,在所述表皮层粗糙的一面上涂覆胶原蛋白的醋酸溶液,然后覆盖在所述真皮层包括的上真皮层上,再经冷冻干燥和交联,制得载药型人工皮肤。
[0071]
根据一些优选的实施方式,在步骤(1)中,所述莫匹罗星溶液中含有莫匹罗星的质
量分数为0.5~1.5%(例如0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%或1.5%),优选为1%;在步骤(2)中,所述丝素蛋白与所述胶原蛋白的质量比为1:(0.5~2)(例如1:0.5、1:0.8、1:1、1:1.2、1:1.5、1:1.8或1:2),所述丝素蛋白-胶原蛋白溶液的浓度为4~7%(例如4%、4.5%、5%、5.5%、6%、6.5%或7%);在本发明中,所述丝素蛋白-胶原蛋白溶液的浓度为4~7%指的是,所述丝素蛋白-胶原蛋白溶液中含有丝素蛋白和胶原蛋白的总质量分数为4~7%;本发明发现,加入丝素蛋白有利于提高产品的力学性能,但是丝素蛋白加入太高的话会影响产品的降解时间,在本发明中,优选为所述丝素蛋白与所述胶原蛋白的质量比为1:(0.5~2),本发明通过体外降解试验发现,当丝素蛋白与胶原蛋白的质量比为1:2时,力学性能与降解时间能更好地符合人工皮肤对基本力学性能和降解时间的要求。
[0072]
根据一些优选的实施方式,在步骤(4)中,所述模具(模具内部)的底端(底部)具有用激光打的多个微孔(微孔的孔径为60-110μm),多个所述微孔未贯穿所述模具的底部,多个所述微孔在所述模具的底部例如呈阵列分布,每个所述微孔内插设有直径为50-100μm,长度例如为5cm的铜丝,且所述铜丝的底部插有无纺布网,所述无纺布网平铺在所述模具的底端,优选的是,所述无纺布网为140~300目的无纺布网;在本发明中,所述无纺布网的设置,使得制得的所述表皮层的一端(一面)是具有网状结构的粗糙面,而所述表皮层的另一端(另一面)由于模具未设置有无纺布网形成光滑面;在本发明中,采用模板法,优选为利用该特制模具进行造孔,使本发明所述的载药型人工皮肤包括的表皮层在阻菌、抗菌,防止水分和液体从创面溢出的同时,能够赋予膜透气的功能;本发明采用模板法,通过该特制模具进行造孔,制得的所述表皮层一面光滑,一面粗糙,粗糙面与人皮真皮层表面的乳突层类似,且进行了物理交联,在提高其强度,延缓降解速度的同时,避免了化学交联产生的毒性。在本发明中,制备所述表皮层采用的所述模具的内部示意图如图5所示,模具底端平铺一层无纺布网,上插数根细铜丝;所述模具的底部放大示意图如图6所示,图6中未示意出插设的全部铜丝,图6仅仅为说明目的提供,图中各部分的比例、尺寸以及数量不一定与实际产品一致;在本发明中,优选的是,所述微孔的孔径为60-110μm,所述铜丝的直径为50-100μm,所述无纺布网为140~300目的无纺布网;在本发明中,更优选的是,所述无纺布网的网孔孔径尺寸与铜丝的直径尺寸相匹配,一方面方便铜丝穿插,另一方面,无纺布网的网孔孔径尺寸如果大于所述铜丝的直径尺寸过多,在成型时,灌模液体就会透过无纺布,在无纺布及模具铜丝之间成型。
[0073]
根据一些优选的实施方式,在步骤(5)中,胶原蛋白和丝素蛋白的质量比为1:(0.5~2)(例如1:0.5、1:0.8、1:1、1:1.2、1:1.5、1:1.8或1:2),优选为2:1,如此更有利于纺丝液成丝,而若丝素蛋白含量较胶原蛋白含量相对较高,则纺丝液不易于成丝;所述第一纺丝液的浓度为6%,所述第二纺丝液的浓度为8%,在本发明中,所述第一纺丝液的浓度指的是,所述第一纺丝液中含有的胶原蛋白和丝素蛋白的总质量分数,同样地,所述第二纺丝液的浓度指的是,所述第二纺丝液中含有的胶原蛋白和丝素蛋白的总质量分数;在步骤(4)、步骤(6)和/或步骤(7)中,所述交联为:紫外照射12~48h,具体地例如可以在强度为56mw/cm2的紫外光下照射12~48h(例如12、16、20、24、28、32、36、40、44或48h);和/或在步骤(7)中,所述胶原蛋白的醋酸溶液中含有胶原蛋白的质量分数为4~8%(例如4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%或8%),优选为5%;在本发明中,所述胶原蛋白的醋酸溶液
(简记为胶原液)采用醋酸溶液与胶原蛋白配制而成,优选的是,采用的醋酸溶液中含有醋酸的浓度(质量分数)为4~8%。
[0074]
根据一些优选的实施方式,制备上真皮层和/或下真皮层的电纺丝参数为:电压15~25kv(例如15、16、17、18、19、20、21、22、23、24或25kv),接收距离10~17cm(例如10、11、12、13、14、15、16或17cm),所述第一纺丝液和/或所述第二纺丝液的流速为1~3ml/h(例如1、1.5、2、2.5或3ml/h);本发明发现并不是任何电纺丝参数都可以制得所述上真皮层和所述下真皮层,在一些更优选的实施方式中,在步骤(5)中,胶原蛋白和丝素蛋白的质量比为2:1,所述第一纺丝液的浓度为6%,所述第二纺丝液的浓度为8%,制备上真皮层和下真皮层的电纺丝参数为:电压20kv,接收距离11cm,所述第一纺丝液和所述第二纺丝液的流速为2ml/h,如此有利于得到纺丝效果好、纺丝效率高,纺丝均匀,表面光滑的所述上真皮层和所述下真皮层;本发明通过采用不同浓度的第一纺丝液和第二纺丝液,在合适的电纺丝参数下,调节了得到的所述上真皮层和所述下真皮层的纤维直径和孔径,有效解决了现有人工皮肤存在的多孔结构杂乱的问题。
[0075]
根据一些优选的实施方式,所述醋酸溶液中含有醋酸的浓度(质量分数)为4~8%(例如4%、5%、6%、7%或8%),优选为5%。
[0076]
根据一些优选的实施方式,在步骤(2)中,搅拌的时间为2~4h(例如2、2.5、3、3.5或4h);和/或在步骤(3)中,搅拌的时间为1~3h(例如1、1.5、2、2.5或3h)。
[0077]
根据一些优选的实施方式,所述胶原蛋白为i型胶原蛋白(即i型胶原)。
[0078]
根据一些具体的实施方式,所述载药型人工皮肤的制备包括如下步骤:
[0079]
步骤s1制备丝素蛋白,具体包括:
[0080]
步骤s1-1:将0.1-0.5g桑蚕丝加入到质量分数为0.5%的na2co3溶液中,煮沸30分钟,重复三次,进行脱胶,将蚕丝取出烘干;
[0081]
步骤s1-2:将所述蚕丝加入cacl2/c2h5oh/h2o三元溶液中于65
±
5℃进行溶解2h-4h,常温下冷却,8000-10000r/min离心10min-15min,取上清液,得到丝素蛋白溶液;在所述cacl2/c2h5oh/h2o三元溶液中,cacl2、c2h5oh与h2o的摩尔比为1:2:8;
[0082]
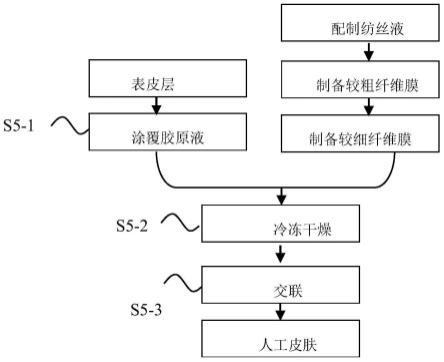
步骤s1-3:将溶解的丝素蛋白溶液灌于透析袋(透析袋的分子量为8000-14000)中透析48-72h,透析液为纯化水,每12h换一次水;
[0083]
步骤s1-4:将透析后的丝素蛋白进行冷冻干燥,制备出再生丝素蛋白,即为本发明所优选的丝素蛋白;本发明对制备所述丝素蛋白的冷冻干燥的条件没有特别的限制,采用现有常规的冷冻干燥条件即可。
[0084]
步骤s2制备i型胶原蛋白,具体包括:
[0085]
步骤s2-1:去除一定质量的牛跟腱上的脂肪、筋膜,清洗,冷冻;
[0086]
步骤s2-2:将冷冻后的牛跟腱进行切割,厚度为0.8mm左右;
[0087]
步骤s2-3:将s2-2切割后的薄片置于质量分数为1.0%-1.5%的碳酸氢钠溶液中浸泡12-24h,然后用纯化水清洗数次脱脂;
[0088]
步骤s2-4:将s2-3脱脂后的薄片加入到ph为1-3的酸溶液中,在温度为0℃-25℃下酶解48-96h,去除端肽,得到酶解液;所用的酸溶液采用醋酸、柠檬酸、磷酸中的一种或是多种制成;在本发明中,优选为ph为2的酸溶液进行酶解,因为加入的胃蛋白酶的活化的最佳条件是常温,ph值为2-3之间,常温酶解48-96h,优选96h,酶解彻底,产量高;
[0089]
步骤s2-5:将步骤s2-4所得的酶解液使用离心机离心,取上清液,使用盐溶液析出胶原蛋白絮状物,其中盐为氯化钠、氯化钾、碳酸钠、碳酸钾中的一种或多种,所述盐溶液例如为过饱和盐溶液;
[0090]
步骤s2-6:将步骤s2-5中获得的白色絮状物加入透析袋中透析,为了保证透析外液的环境变化比较温和避免透析外液变化过剧,从而引起透析内液中的胶原不可逆析出,因此,采用梯度透析的方式,例如逐渐降低外液乙酸的浓度,最后使用纯化水透析来完成胶原的提纯;所述梯度透析的方式例如可以是:首先将透析袋置于45l的ph=3透析液中透析4天,透析温度为15
±
3℃,每2天更换1次透析液;再将透析袋置于45l的ph=4透析液中透析5天,透析温度为15
±
3℃,每1天更换1次透析液;将透析袋置于45l纯化水中透析6天,透析温度为15
±
3℃,每天更换3次透析液,早中晚各一次;在本发明中,ph=3的透析液和ph=4透析液例如均是由乙酸与纯化水配制而成的乙酸溶液,ph=3的透析液的配制例如可以为:在透析罐中加入45000ml的纯化水,然后用量筒及移液枪准确取146.694ml乙酸加入到透析罐中,搅拌均匀,即得ph=3的乙酸溶液;ph=4的透析液的配制例如可以为:在透析罐中加入45000ml的纯化水,然后用移液枪准确取1.479ml乙酸加入到透析罐中,搅拌均匀,即得ph=4的乙酸溶液。
[0091]
步骤s2-7:将s2-6生产的一定质量和固含量的胶原凝胶置于均质机中,加入一定质量的水,配制成浓度为0.5%-0.9%的胶原溶液,均质频率为20-50hz,时间为15-60min;
[0092]
步骤s2-8:将步骤s2-7均质后的胶原凝胶进行冷冻干燥,得到质地均匀的i型胶原蛋白;本发明对制备所述i型胶原蛋白的冷冻干燥的条件没有特别的限制,采用现有常规的冷冻干燥条件即可。
[0093]
步骤s3制备载药型人工皮肤的表皮层,具体包括:
[0094]
步骤s3-1:将一定质量的莫匹罗星溶解在纯化水中,配制成质量分数为1%的莫匹罗星溶液;
[0095]
步骤s3-2:将制备的丝素蛋白及i型胶原蛋白按质量比为1/2-2/1先后加入质量分数为5%的醋酸溶液中,充分搅拌2-4h,得到丝素蛋白及胶原蛋白的混合溶液即丝素蛋白-胶原蛋白溶液,溶液浓度为4%-7%;
[0096]
步骤s3-3:将步骤s3-1配制的莫匹罗星溶液和s3-2制备的丝素蛋白-胶原蛋白溶液进行混合,搅拌1-3h,得到混合溶液;
[0097]
步骤s3-4:将s3-3配制的混合溶液注入到特制聚四氟乙烯模具中,此模具底端具有用激光打的多个微孔(微孔的孔径为60-110μm),每个微孔中插入直径为50-100μm,长度为5cm的铜丝,铜丝插入140~300目的无纺布网,此无纺布网平铺模具底端;将所述混合溶液注入该特制聚四氟乙烯模具后,采用模板法,进行造孔。
[0098]
步骤s3-5:将s3-4注好的模具常温下直接干燥;
[0099]
步骤s3-6:脱模;为了便于干燥后脱模,在灌模前铜丝表面涂有甘油;脱模后得到厚度为0.07-1.2mm的半透明薄膜,其中薄膜的一面是具有网状结构的粗糙面;
[0100]
步骤s3-7:制得的薄膜紫外照射12-48h,进行弱交联,制得表皮层,所述表皮层粗糙的一面具有网状结构;所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,优选的是,所述微孔的孔径为60~110μm。
[0101]
步骤s4制备载药型人工皮肤的真皮层,具体包括:
[0102]
s4-1:将一定质量的胶原蛋白和丝素蛋白按质量比为1/2-2/1加入六氟异丙醇溶液或醋酸溶液中,制备成浓度为4%-6%的第一纺丝液和浓度为7-9%的第二纺丝液;
[0103]
s4-2:首先用第二纺丝液来制备真皮层的下层(对应下真皮层),通过调节电纺丝的参数,使真皮层的下层的纤维直径及孔隙率都较高,纺丝薄膜达到1-2mm时,更换第一纺丝液,使得真皮层的上层(对应上真皮层)纤维较细,孔隙率较低,制得纤维直径和孔隙具有梯度的薄膜,所述薄膜的总厚度为2-4mm,制备真皮层的上层和/或真皮层的下层的电纺丝参数为:电压15~25kv(例如15、16、17、18、19、20、21、22、23、24或25kv),接收距离10~17cm(例如10、11、12、13、14、15、16或17cm),所述第一纺丝液和/或所述第二纺丝液的流速为1~3ml/h(例如1、1.5、2、2.5或3ml/h);
[0104]
s4-3:将s4-2制得的薄膜紫外照射12-48h交联,制得所述真皮层。
[0105]
步骤s5制备载药型人工皮肤,具体包括:
[0106]
s5-1:将s3制备的表皮层的粗糙面涂覆一层浓度为5%的i型胶原蛋白的醋酸溶液并覆盖在s4-3交联的真皮层的上真皮层上,得到复合薄膜;
[0107]
s5-2:将s5-1得到的复合薄膜进行冷冻干燥和交联,即得所述载药型人工皮肤。
[0108]
本发明在第三方面提供了由本发明在第二方面所述的制备方法制得的载药型人工皮肤;所述表皮层由胶原蛋白、丝素蛋白和莫匹罗星复合而成;所述上真皮层为由胶原蛋白和丝素蛋白组成的细纤维结构层,所述下真皮层为由胶原蛋白和丝素蛋白组成的粗纤维结构层;在本发明中,细纤维结构层和粗纤维结构层是相对而言的,优选的是,所述细纤维结构层为纤维为直径为580-647nm,孔隙率为50-60%的细纤维结构层,所述粗纤维结构层为纤维直径为700~780nm,孔隙率为65~80%的粗纤维结构层。
[0109]
根据一些优选的实施方式,所述载药型皮肤具有如下一个或者多个性质:所述表皮层的厚度为0.07~1.2mm;所述表皮层具有微孔结构,所述微孔结构由多个微孔均匀分布形成,优选的是,所述微孔的孔径为60~110μm;所述表皮层粗糙的一面具有网状结构;所述真皮层的厚度为2~4mm,所述上真皮层的厚度为1~2mm;所述上真皮层的纤维直径为580~647nm,孔隙率为50~60%;所述下真皮层的纤维直径为700~780nm,孔隙率为65~80%。
[0110]
下文将通过举例的方式对本发明进行进一步的说明,但是本发明的保护范围不限于这些实施例。本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
[0111]
本发明在进行下述各实施例之前,对制备本发明所述的上真皮层和下真皮层的电纺丝参数进行了多个探究实验,部分探究实验对应的电纺丝参数以及电纺丝结果如下表2所示;本发明表2中显示了在以溶剂为六氟异丙醇、胶原蛋白与丝素蛋白质量比为2:1、电纺丝溶液浓度为6%、电压为20kv、接收距离为11cm、纺丝液流速为2ml/h的同样纺丝条件下进行的多个探究实验,这些相同条件下得到的纳米纤维的平均直径略有差别,但分布在580~647nm的范围内,且纺丝结果都很好。
[0112]
[0113][0114]
实施例1
[0115]
步骤s1制备丝素蛋白,具体包括:
[0116]
步骤s1-1:将0.3g桑蚕丝加入到质量分数为0.5%的na2co3水溶液中,煮沸30分钟,重复三次,进行脱胶,将蚕丝取出烘干;
[0117]
步骤s1-2:将所述烘干蚕丝加入cacl2/c2h5oh/h2o三元溶液中于65
±
5℃进行溶解4h,常温下冷却9000r/min离心15min,取上清液,得到丝素蛋白溶液;在所述cacl2/c2h5oh/h2o三元溶液中,cacl2、c2h5oh与h2o的摩尔比为1:2:8;
[0118]
步骤s1-3:将上述溶解的丝素蛋白溶液灌于透析袋(透析袋的分子量为8000-14000)中透析72h,透析液为纯化水,每12h换一次水;
[0119]
步骤s1-4:将透析后的丝素蛋白进行冷冻干燥,制备出再生丝素蛋白,即为本实施例进行下述步骤所采用的丝素蛋白。
[0120]
步骤s2制备i型胶原蛋白,具体包括:
[0121]
步骤s2-1:去除一定质量的牛跟腱上的脂肪、筋膜,清洗,冷冻;
[0122]
步骤s2-2:将冷冻后的牛跟腱进行切割,厚度为0.8mm左右;
[0123]
步骤s2-3:将s2-2切割后的薄片置于质量分数为1.5%的碳酸氢钠水溶液中浸泡24h,然后用纯化水清洗数次脱脂;
[0124]
步骤s2-4:将s2-3脱脂后的薄片加入到ph为2的醋酸溶液中,在常温下加入胃蛋白酶进行酶解96h,去除端肽,得到酶解液;
[0125]
步骤s2-5:将步骤s2-4所得的酶解液使用离心机离心,取上清液,使用氯化钠过饱和溶液析出胶原蛋白絮状物;
[0126]
步骤s2-6:将步骤s2-5中获得的白色絮状物加入透析袋中透析,首先将透析袋置于45l的ph=3透析液中透析4天,透析温度为15
±
3℃,每2天更换1次透析液;再将透析袋置于45l的ph=4透析液中透析5天,透析温度为15
±
3℃,每1天更换1次透析液;将透析袋置于45l纯化水中透析6天,透析温度为15
±
3℃,每天更换3次透析液,早中晚各一次;
[0127]
步骤s2-7:将s2-6生产的一定质量和固含量的胶原凝胶置于均质机中,加入一定质量的水,配制成浓度(质量分数)为0.5%的胶原溶液,均质频率为40hz,时间为40min;
[0128]
步骤s2-8:将步骤s2-7均质后的胶原凝胶进行冷冻干燥,得到质地均匀的i型胶原蛋白。
[0129]
步骤s3制备载药型人工皮肤的表皮层,具体包括:
[0130]
步骤s3-1:将一定质量的莫匹罗星溶解在纯化水中,配制成质量分数为1%的莫匹罗星溶液;
[0131]
步骤s3-2:将制备的丝素蛋白及i型胶原蛋白按质量比为1:2先后加入质量分数为5%的醋酸溶液中,充分搅拌4h,得到丝素蛋白及胶原蛋白的混合溶液即丝素蛋白-胶原蛋白溶液,丝素蛋白-胶原蛋白溶液浓度为4%;
[0132]
步骤s3-3:将步骤s3-1配制的莫匹罗星溶液和s3-2制备的丝素蛋白-胶原蛋白溶液进行混合,搅拌3h,得到混合溶液;
[0133]
步骤s3-4:将s3-3配制的混合溶液注入到聚四氟乙烯模具中,此模具底端具有用激光打的多个微孔(微孔的孔径为80μm),每个微孔中插入直径为75μm,长度为5cm的铜丝,铜丝插入200目的无纺布网,此无纺布网平铺在模具底端;将所述混合溶液注该聚四氟乙烯模具后,采用模板法,进行造孔。
[0134]
步骤s3-5:将s3-4注好的模具常温下直接干燥15h;
[0135]
步骤s3-6:脱模;为了便于干燥后脱模,在灌模前铜丝表面涂有甘油;脱模后得到厚度为1mm,且具有多个孔径为80μm的微孔的半透明薄膜,其中薄膜的一面是具有网状结构的粗糙面;
[0136]
步骤s3-7:将制得的薄膜在强度为56mw/cm2的紫外光下照射48h,进行交联,制得表皮层。
[0137]
步骤s4制备载药型人工皮肤的真皮层,具体包括:
[0138]
s4-1:将一定质量的i型胶原蛋白和丝素蛋白按质量比为2:1加入六氟异丙醇中,制备成浓度为6%的第一纺丝液和浓度为8%的第二纺丝液;
[0139]
s4-2:首先用浓度为8%的第二纺丝液通过电纺丝技术来制备真皮层的下层,使真皮层的下层的纤维直径及孔隙率都较高,纺丝薄膜达到1mm时,更换浓度为6%第一纺丝液,使得真皮层的上层纤维较细,孔隙率较低,制得纤维直径和孔隙具有梯度的薄膜,所述薄膜的总厚度为2mm,制备真皮层的上层和真皮层的下层的电纺丝参数为:电压20kv,接收距离11cm,所述第一纺丝液和所述第二纺丝液的流速均为2ml/h。
[0140]
s4-3:将s4-2制得的薄膜在强度为56mw/cm2的紫外光下照射48h交联,制得所述真皮层;制得的所述真皮层包括的上真皮层的纤维直径(平均直径)为598nm,孔隙率为56%,包括的下真皮层的纤维直径(平均直径)为740m,孔隙率为76%;
[0141]
步骤s5制备载药型人工皮肤,具体包括:
[0142]
s5-1:将s3制备的表皮层的粗糙面涂覆一层浓度为5%的i型胶原蛋白的醋酸溶液并覆盖在s4-3交联得到的真皮层包括的上真皮层上,得到复合薄膜;
[0143]
s5-2:将s5-1得到的复合薄膜进行冷冻干燥(按照表1中的条件进行冷冻干燥)和交联(在强度为56mw/cm2的紫外光下照射48h),即得所述载药型人工皮肤。
[0144]
实施例2
[0145]
实施例2与实施例1基本相同,不同之处在于:
[0146]
在步骤s3-4中:将s3-3配制的混合溶液注入到普通可以成型表皮层的聚四氟乙烯模具中;
[0147]
步骤s3-5:将s3-4注好的模具常温下直接干燥;
[0148]
步骤s3-6:脱模,得到表面光滑的不具有微孔结构的薄膜;
[0149]
步骤s3-7:将制得的薄膜在强度为56mw/cm2的紫外光下照射48h,进行交联,制得表皮层。
[0150]
实施例3
[0151]
实施例3与实施例1基本相同,不同之处在于:
[0152]
步骤s4制备载药型人工皮肤的真皮层,具体包括:
[0153]
s4-1:将一定质量的i型胶原蛋白和丝素蛋白按质量比为2:1加入六氟异丙醇中,制备成浓度为6%的纺丝液;
[0154]
s4-2:用浓度为6%的纺丝液通过电纺丝技术来制备厚度为2mm的薄膜,制备该薄膜的电纺丝参数为:电压20kv,接收距离11cm,所述纺丝液的流速为2ml/h;
[0155]
s4-3:将s4-2制得的薄膜在强度为56mw/cm2的紫外光下照射48h,制得真皮层;制得的所述真皮层的纤维直径(平均直径)为623nm,孔隙率为58%。
[0156]
实施例4
[0157]
实施例4与实施例1基本相同,不同之处在于:
[0158]
步骤s4制备载药型人工皮肤的真皮层,具体包括:
[0159]
s4-1:将一定质量的i型胶原蛋白和丝素蛋白按质量比为2:1加入六氟异丙醇中,制备成浓度为8%的纺丝液;
[0160]
s4-2:用浓度为8%的纺丝液通过电纺丝技术来制备厚度为2mm的薄膜,制备该薄膜的电纺丝参数为:电压20kv,接收距离11cm,所述第一纺丝液和所述第二纺丝液的流速为2ml/h;
[0161]
s4-3:将s4-2制得的薄膜紫外照射48h交联,制得真皮层;制得的所述真皮层的纤维直径(平均直径)为715nm,孔隙率为72%。
[0162]
对比例1
[0163]
参考中国专利申请cn101716375b的实施例1中相同的方法制得一种加入生长因子的人工皮肤。
[0164]
对比例2
[0165]
对比例2参考中国专利申请cn106729985a的实施例1中相同的方法制得一种人工皮肤。
[0166]
本发明对实施例1~4以及对比例1~2中的人工皮肤进行了透气性、撕裂强度和拉伸强度测试;其中,透气性测试为:采用透湿杯法测定,透气性杯中装入无水cacl2,将人工皮肤封装于杯口,并置于37℃,相对湿度为80%的环境中,每隔1h测重,计算公式为:
[0167]
透气率=24
×
δm/s t
[0168]
式中:δm—同一试样组合体两次称重差
[0169]
s—试样面积
[0170]
t—试验时间
[0171]
测试6个样,取平均值。
[0172]
撕裂强度测试选用三泉中石sld1000z型撕裂强度测试仪,采用gb/t16578.2-2009标准方法进行测试;拉伸强度测试选用xlw-pc型智能电子拉力机,采用gb/t1040.3-2006标准方法进行测试,结果如表3所示。
[0173]
表3:实施例1~4以及对比例1~2中的人工皮肤的透气性、撕裂强度和拉伸强度的性能测试结果。
[0174][0175]
本发明还对实施例1~4以及对比例1~2中的人工皮肤进行了伤口修复实验,结果如表4所示。
[0176]
实验方法为:第一步,麻醉实验小鼠。第二步,利用脱毛膏脱去小鼠背部毛发,酒精消毒;在小鼠背部制作1.0cm
×
1.0cm全层皮肤缺损创面,保证每个小鼠创面深度基本相同。第三步,将实施例1~4以及对比例1~2制备的人工皮肤移植覆盖到创面,计算人工皮肤移植后第7天和第14天创面愈合率,创面愈合率为创面愈合面积与初始创面面积之比,结果如表4所示,并在人工皮肤移植后对创面是否感染情况进行了观察,结果如表4所示。
[0177]
表4:实施例1~4以及对比例2中的人工皮肤创口修复结果。
[0178][0179]
本发明未详细说明部分为本领域技术人员公知技术。
[0180]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1