功能化UCNPs载体、治疗骨质疏松症的UCNPs纳米复合物及其制备和应用
功能化ucnps载体、治疗骨质疏松症的ucnps纳米复合物及其制备和应用
技术领域
1.本发明涉及生物材料科学领域,具体涉及一种功能化ucnps载体、治疗骨质疏松症的ucnps纳米复合物及其制备和应用。
背景技术:
2.骨质疏松症被认为是最常见的系统性骨骼疾病之一,它会导致骨密度降低、骨微结构破坏、骨蛋白量和种类改变,并增加腰椎和髋部骨折的风险。由于预期寿命的延长,骨质疏松症及其后遗症的发病率正大幅上升,目前是全世界最大的医疗负担之一。骨质疏松症的主流治疗方法是通过药物刺激促进成骨或抑制破骨。雌激素和雷洛昔芬已被应用于骨质疏松症的治疗,以延缓绝经后妇女的骨折并降低骨折风险。虽然激素替代疗法可以治疗骨质疏松症,但也有一定的局限性和副作用,如绝经后妇女患乳腺癌、子宫出血、中风、血栓、心血管疾病风险增加,限制了他们长期遵守和服用。因此,开发一种新的治疗骨质疏松症的策略在临床医学中是非常紧迫的。
3.间充质干细胞(mscs)主要存在于骨髓,是一种多能干细胞,可以作为未分化的细胞复制并分化成多种间充质表型。由于其易于获得和潜在的治疗应用,已被用于骨质疏松症、软骨修复、阿尔兹海默病和心血管疾病的治疗。此外,mscs因其成骨分化能力而被广泛用于骨再生和骨修复,许多临床前研究表明,在骨质疏松动物,如大鼠、小鼠、兔子和山羊中进行mscs移植可以帮助增强雌激素缺乏引起的骨质疏松症,在这些研究中发现骨组织的骨密度明显增加,表明骨破坏和丢失可以在一定程度上逆转。因此,mscs移植被认为是一种可行的治疗策略,可以预防或治疗刺激素缺乏和年龄相关的骨质疏松症,然而,如何实时控制mscs在体内分化为特定类型的细胞仍然是再生医学的一个严峻挑战,因此,设计能够诱导mscs向成骨细胞分化的生物材料,可以为mscs治疗骨质疏松症提供一个可行和新颖的解决方案。
4.光刺激在许多应用中特别有趣,因为它可以对生物材料的特性和固有时空进行非接触远程操作控制。光刺激传递的主要问题是光敏小分子一般对紫外光响应,而不是可见光或近红外光。与近红外光相比,紫外光具有微弱的组织穿透力和较强的光毒性,因此近红外光受到了广泛的关注。稀土上转换纳米颗粒(ucnps)具有光稳定性强、低毒性、组织穿透能力强、对生物组织无损伤、背景荧光干扰低、成像灵敏度高等典型优点,此外,许多研究已经报道过,tm/er掺杂的ucnps可以将近红外光转化为紫外(365nm)和可见光(475/540/650nm),在生物医学上具有广阔的应用前景。
5.介孔二氧化硅具有比表面积大、介孔结构具有较高的载药量和生物相容性好等优点,此外,介孔二氧化硅包覆的纳米粒子作为药物载体和光探针,在生物医学上具有广泛的应用前景,已被广泛应用于癌症等疾病的治疗和检测中。
6.小分子化合物淫羊藿苷(icariin,ica)具有合成简单,成本低,使用方便等优点,可用于诱导mscs成骨分化进而可以作为治疗骨质疏松症的潜在药物,但其水溶性差,如果
使用有机溶剂会产生细胞毒性。因此,亟需通过一种简单实用的方法将ica靶向运输到mscs中诱导mscs成骨分化进而治疗骨质疏松症。
7.因此,开发一种结构简单,能实现高效、安全、精准的向细胞内运输诱导mscs成骨分化的诱导剂,将对促进间充质干细胞成骨分化的研究发展及对骨质疏松症的医学基础研究和组织工程研究有至关重要的作用。
技术实现要素:
8.基于此,本发明设计了一种基于稀土上转换纳米颗粒的光响应纳米复合物,采用近红外光远程控制细胞内ica的释放以调节mscs的成骨分化用于骨质疏松症的治疗。
9.本发明采取的技术方案如下:
10.一种功能化ucnps载体,由内向外包括核壳结构ucnps、包覆核壳结构ucnps的介孔二氧化硅、在介孔二氧化硅表面偶联的光敏小分子ona和笼状分子β-cd及细胞靶向肽rgd。
11.具体地,所述功能化ucnps载体的粒径范围为40-60nm。
12.具体地,所述的功能化ucnps载体用于负载治疗骨质疏松症的药物小分子淫羊藿苷(icariin,ica)。
13.本发明提供一种光控诱导mscs成骨分化治疗骨质疏松症的ucnps纳米复合物,包括功能化ucnps载体和药物小分子ica,所述功能化ucnps载体负载药物小分子ica;所述功能化ucnps载体由内向外包括核壳结构ucnps、包覆核壳结构ucnps的介孔二氧化硅、在介孔二氧化硅表面偶联的光敏小分子ona、笼状分子β-cd及细胞靶向肽rgd。
14.具体地,所述功能化ucnps载体的粒径范围为40-60nm。
15.具体地,所述功能化ucnps载体和药物小分子ica的质量比为10:1。
16.具体地,所述药物小分子ica的紫外吸收峰为314nm。
17.与现有技术相比,所述ucnps纳米复合物尺寸小且具有良好的生物相容性,无毒副作用,易于表面修饰,可用作药物载体并可通过近红外光远程控制药物小分子的释放及细胞的定向分化,在生物医学研究中具有广泛的应用前景。该ucnps纳米复合物除具有尺寸小、结构简单、生物相容性好、无毒副作用,便捷、高效、精准运输诱导mscs成骨分化的药物小分子ica到相应的靶细胞,通过近红外光远程控制诱导mscs成骨分化的药物小分子ica释放的优点,可以成为研究干细胞基础科学研究的有力工具,在骨质疏松症的治疗中具有广阔的临床应用前景。
18.本发明的所述ucnps纳米复合物中,稀土上转换纳米颗粒(ucnps)具有光稳定性强、低毒性、组织穿透能力强、对生物组织无损伤、背景荧光干扰低、成像灵敏度高等典型优点,此外,许多研究已经报道过,tm/er掺杂的ucnps可以将近红外光转化为紫外(365nm)和可见光(475/540/650nm),在生物医学上具有广阔的应用前景;
19.介孔二氧化硅具有比表面积大、介孔结构具有较高的载药量和生物相容性好等优点,此外,介孔二氧化硅包覆的纳米粒子作为药物载体和光探针,在生物医学上具有广泛应用前景;
20.纳米颗粒上的rgd配体可以与整合素结合,促进细胞摄取,特别是对干细胞,rgd的偶联促进了mscs对ucnps纳米颗粒的内化,在近红外光的照射下,有效的控制了细胞内ica的释放,从而促进mscs的成骨分化。
21.通过近红外光照射ucnps纳米复合物后进行紫外-可见光分光光度测定实验,可知,药物小分子ica成功装载到ucnps纳米载体中,且ucnps纳米复合物在近红外光的刺激下可以剂量依赖性的释放ica,随着照射强度和照射时间的增加,ica的释放量逐渐增加,表明近红外光可触发ica的释放,在体内和体外控制mscs成骨分化治疗骨质疏松症。
22.本发明还提供ucnps纳米复合物的制备方法,包括如下步骤:
23.(1)制备核壳结构ucnps;
24.(2)在核壳结构ucnps外包覆介孔二氧化硅形成ucnp@msio2;
25.(3)在ucnp@msio2表面偶联光敏小分子ona和笼状分子β-cd及细胞靶向肽rgd,形成所述功能化ucnps载体;
26.(4)将所述功能化ucnps载体与药物小分子ica混合得到所述ucnps纳米复合物。
27.本发明还提供所述ucnps纳米复合物在制备用于治疗骨质疏松症的药物中的用途,具体是在制备用于光控诱导mscs成骨分化治疗骨质疏松症的药物中的用途。
28.采用本发明的方法制备ucnps纳米复合物,操作简单,成本低,收率高,制备工艺设备简易,且可在短时间内完成操作,易于推广,细胞毒性低,且能成功用于光控mscs的成骨分化治疗骨质疏松症,具有广阔的应用前景。
29.为了更好地理解和实施,下面结合附图和具体实施例详细说明本发明。
附图说明
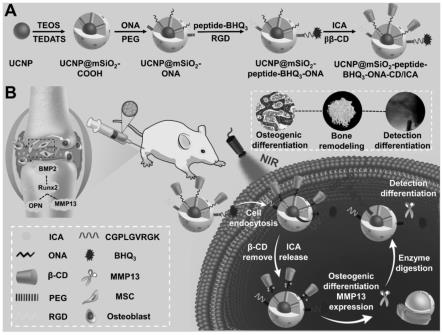
30.图1为本发明中功能化ucnp纳米平台的合成及在近红外光的控制下诱导并实时监测mscs的成骨分化用于骨质疏松症的治疗并评价治疗效果的应用示意图。
31.图2为实施例1的功能化ucnps载体的透射电镜图、ucnp和ucnp@msio2的x-射线多晶衍射图、紫外-可见光吸收图和傅里叶变换红外光谱图。
32.图3为实施例2的负载了ica的ucnps纳米复合物的紫外-可见光吸收光谱图。
33.图4为实施例2的ucnps纳米复合物经近红外光照射后ica的释放曲线图。
34.图5为实验1中mscs诱导成骨分化后的western blot结果图。
35.图6为实验1中mscs诱导成骨分化后的alp/ars细胞染色图。
36.图7为实验2中骨质疏松症大鼠治疗八周后股骨分micro-ct成像图。
37.图8为实验2中骨质疏松症大鼠治疗八周后股骨切片的he、masson和免疫组织化学染色图。
具体实施方式
38.如图1所示,本发明提供的光控诱导mscs成骨分化治疗骨质疏松症的ucnps纳米复合物,包括功能化ucnps载体和药物小分子ica,所述功能化ucnps载体负载药物小分子ica。
39.所述功能化ucnps载体由内向外包括核壳结构ucnps、包覆核壳结构ucnps的介孔二氧化硅、在介孔二氧化硅表面偶联的光敏小分子ona、笼状分子β-cd及细胞靶向肽rgd。
40.具体地,所述功能化ucnps载体的粒径范围为40-60nm。
41.具体地,所述功能化ucnps载体和药物小分子ica的质量比为10:1。
42.具体地,所述药物小分子ica的紫外吸收峰为314nm。
43.所述ucnps纳米复合物的制备方法,包括如下步骤:
44.(1)制备核壳结构ucnps;
45.(2)在核壳结构ucnps外包覆介孔二氧化硅形成ucnp@msio2;
46.(3)在ucnp@msio2表面偶联光敏小分子ona和笼状分子β-cd及细胞靶向肽rgd,形成所述功能化ucnps载体;
47.(4)将所述功能化ucnps载体与药物小分子ica分散到乙醇溶液中,搅拌后离心得到所述ucnps纳米复合物。
48.所述ucnps纳米复合物用于治疗骨质疏松症,具体通过光控诱导mscs成骨分化治疗骨质疏松症。
49.实施例1
50.本实施例中,按如下步骤合成功能化ucnps载体:
51.将ycl3·
6h2o(482.3mg)、ybcl3·
6h2o(155.0mg)、tmcl3·
6h2o(2.75mg)和ercl3·
6h2o(0.69mg)分别溶于1ml甲醇溶液并转移到含15ml油酸和30ml 1-十八烯的锥形瓶中,160℃加热30min。将10ml溶有nh4f(1.6mmol)和naoh(1mmol)的甲醇溶液加入锥形瓶中室温搅拌1h。然后在氮气保护下300℃加热1h,8000rpm离心5min收集ucnps,用乙醇洗涤3次,采用上述方法合成了ucnps核。ycl3·
6h2o(1mmol)与6ml油酸和15ml 1-十八烯混合,形成黄色、均匀、透明的溶液,将制备好的ucnps核加入到上述溶液中,采用与ucnps核相同的方法合成并收集核壳型ucnps,进行x-射线多晶衍射分析。
52.然后,10mg核壳型ucnps溶于1ml环己烷后转移到0.2m的ctab溶液中,搅拌12h,80℃加热30min蒸发环己烷,随后加入5ml蒸馏水,超声、搅拌交替进行2h,加入150μl 0.1m的naoh溶液、150μl体积分数为20%的teos并搅拌24h,在反应结束前6h加入tedats,8000rpm离心5min离心收集得到ucnp@msio2,在铜网上制样,并进行120kv透射电镜观察、x-射线多晶衍射分析、紫外-可见光吸收和傅里叶转换红外光谱。
53.然后,10mg介孔二氧化硅包覆的ucnps与2mm dcc和1mm dmap在dmf中反应4h,在溶液中加入5mg oh-peg-mal和1mg ona,反应12h,8000rpm离心5min收集得到ucnp@msio
2-ona,检测紫外-可见光吸收和傅里叶转换红外光谱。
54.然后,200μl 2mm cgrgd和1μl dipea混合并与10mgucnp@msio
2-ona室温反应12h,8000rpm离心5min得到ucnp@msio
2-rgd-ona,检测紫外-可见光吸收和傅里叶转换红外光谱。
55.然后,10mg ucnp@msio
2-rgd-ona、10mg edc-hcl和5mg nhs加入溶液中搅拌4h,随后,加入8mgβ-cd和1μl dipea搅拌6h,8000rpm离心5min收集得到功能化ucnps载体:ucnp@msio
2-rgd-ona-cd,检测紫外-可见光吸收和傅里叶转换红外光谱。
56.请参照图2,图2中a示出了制得的ucnp@msio
2-rgd-ona-cd的透射电镜图,该图是取纳米载体在铜网上制样,进行120kv透射电镜观察,获得透射电镜图,由该图可知,所述用于运载诱导mscs成骨分化药物的载体的粒径约为60nm。
57.图2中b示出了ucnps和ucnp@msio2的x-射线多晶衍射图谱。
58.图2中c示出了ucnp@msio2、ucnp@msio
2-ona、ucnp@msio
2-rgd-ona和ucnp@msio
2-rgd-ona-cd的紫外-可见光吸收光谱图,其中从上至下的第一条曲线对应于ucnp@msio
2-rgd-ona,第二条曲线对应于ucnp@msio
2-rgd-ona-cd,第三条曲线对应于ucnp@msio
2-ona,第四条曲线对应于ucnp@msio2。
59.图2中d示出了ucnp@msio2、ucnp@msio
2-ona、ucnp@msio
2-rgd-ona和ucnp@msio
2-rgd-ona-cd的傅里叶转换红外光谱图,其中从上至下的第一条至第四条曲线分别对应于ucnp@msio2、ucnp@msio
2-ona、ucnp@msio
2-rgd-ona和ucnp@msio
2-rgd-ona-cd,在1680cm-1
处有峰,说明纳米载体已形成酰胺键(-co-nh-),即多肽rgd成功偶联到ucnp@msio2上。
60.实施例2
61.本实施例中,将实施例1得到的功能化ucnps载体:ucnp@msio
2-rgd-ona-cd,作为运输诱导mscs成骨分化并治疗骨质疏松症药物小分子ica的纳米载体,将所述纳米载体与诱导mscs成骨分化并治疗骨质疏松症药物小分子ica混合制备ucnps纳米复合物,合成步骤如下:
62.按照质量之比为:功能化ucnps载体:ica=10:1将两者分散到乙醇/水=1:1的溶液中,搅拌24h,8000rpm离心5min纯化收集得到ucnps纳米复合物:ucnp@msio
2-rgd-ona-cd/ica,检测紫外-可见光吸收。
63.通过近红外光照射ucnp@msio
2-rgd-ona-cd/ica后进行紫外-可见光分光光度测定实验,验证可通过近红外光远程控制ucnps纳米复合物中ica的释放,步骤如下:
64.将2mg ucnp@msio
2-rgd-ona-cd/ica溶于1ml pbs溶液,用980nm的近红外光照射不同的时间(0.5/1/2h,nir:1w/cm2)或不同功率(0.5/1/2w/cm2,1h)后离心,收集上清液测定ica的紫外吸收光谱,记录316nm处的吸收值。
65.请参照图3和图4。图3的紫外-可见光吸收光谱中的曲线a、曲线b和曲线c分别对应于ucnp@msio
2-rgd-ona-cd/ica、ucnp@msio
2-rgd-ona-cd和ica,从图3可以看出,与ucnp@msio
2-rgd-ona-cd相比,ucnp@msio
2-rgd-ona-cd/ica在316nm和350nm处表现出ica的特征峰,表明ica成功加载到ucnp@msio
2-rgd-ona-cd中,得到ucnp@msio
2-rgd-ona-cd/ica。
66.图4表明红外光照射ucnp@msio
2-rgd-ona-cd/ica后上转换产生紫外光,光裂解光敏小分子ona,β-cd离去,释放药物ica,累计ica释放谱进一步表明,ucnps纳米复合物在近红外光的刺激下可以剂量依赖性的释放ica,随着照射强度和照射时间的增加,ica的释放量逐渐增加。
67.实验1
68.将实施例2得到的所述ucnps纳米复合物用于光控诱导mscs成骨分化,步骤如下:
69.将细胞接种于24孔板,在5%co2,37℃的细胞培养箱中过夜培养。将细胞分为5组,分别为:对照组(mscs),ucnp组(mscs+500μg/ml ucnp@msio
2-rgd-ona-cd),ucnp/ica组(mscs+500μg/ml ucnp@msio
2-rgd-ona-cd/ica),ucnp+ica组(mscs+500μg/ml ucnp@msio
2-rgd-ona-cd+10μm ica),ucnp/ica+nir组(mscs+500μg/ml ucnp@msio
2-rgd-ona-cd/ica,1h间断的nir照射,1w/cm2,ica释放量~16.25μm),每组重复3次。孵育4h后,pbs洗涤3次,用成骨分化培养液替代普通培养液后连续培养,每3天更换一次培养液,培养7天后,收集细胞,提取细胞蛋白进行western blot实验。
70.培养10天后,用4%的多聚甲醛固定液固定并用碱性磷酸酶试剂盒染色后用倒置荧光显微镜成像。
71.培养12天后,用4%的多聚甲醛固定液固定并用茜素红s染液染色后用倒置荧光显微镜成像。
72.请参照图5和图6。图5为本发明中将细胞诱导培养7天后,收集细胞,提取蛋白进行
western blot实验的结果,表明ucnp/ica组没有近红外光触发ica的释放来诱导mscs的成骨分化,ucnp/ica+nir组runx2,bmp-2和opn蛋白的表达较高,这是由于近红外光触发ica的释放后诱导mscs显著的成骨分化。
73.图6为碱性磷酸酶和茜素红s染液染色后的实验结果图,ucnp/ica+nir组细胞染色颜色相较于ucnp/ica组明显加深,表明近红外光触发ica的释放后诱导mscs显著的成骨分化。
74.实验2
75.将实施例2得到的所述ucnps纳米复合物用于光控诱导mscs成骨分化进而治疗骨质疏松症,步骤如下:
76.将骨质疏松症组大鼠被随机分为4组(n=3):ucnp控制组(1mg/ml ucnp@msio
2-rgd-ona-cd),ucnp/ica组(1mg/ml ucnp@msio
2-rgd-ona-cd/ica),ucnp+ica组(1mg/ml ucnp@msio
2-rgd-ona-cd,20μm ica)和ucnp/ica+nir组(1mg/ml ucnp@msio
2-rgd-ona-cd/ica 1h间断的近红外照射,1w/cm2,ica的释放量约为32.5μm),上述各组大鼠右膝关节每两天注射补剂0.2ml,正常组(normal)大鼠注射等量的生理盐水,连续注射治疗8周。之后取出股骨用4%多聚甲醛固定液固定24h以上,并使用micro-ct扫描仪扫描,micro-ct分析软件进行分析。
77.取上述各组大鼠的股骨,用4%多聚甲醛固定液固定24h以上,脱钙,石蜡包埋,切片后根据制造商的说明进行he、masson和免疫组织化学染色,随后用相机检查染色切片并用image-pro-plus进行半定量分析评价骨质疏松症的治疗。
78.请参照图7和图8。其中图7为骨质疏松症大鼠经治疗后的micro-ct图,结果表明ucnp/ica+nir组大鼠的骨微结构明显改善,这得益于近红外光触发ucnp纳米复合物中ica的释放,进而诱导mscs成骨分化,促进骨修复。
79.图8为骨质疏松症大鼠经治疗后的he、masson和免疫组织化学染色结果图,结果表明ucnp/ica+nir组大鼠的骨微结构明显改善,这得益于近红外光触发ucnp纳米复合物中ica的释放,进而诱导mscs成骨分化,促进初级成骨细胞的成熟。
80.本发明提供一种基于上转换纳米颗粒(ucnps)的纳米载体,可以负载可特异性诱导间充质干细胞(mscs)成骨分化的小分子淫羊藿苷(icariin,ica)并靶向mscs输送,然后采用近红外光(nir)诱发ica释放诱导mscs成骨分化治疗骨质疏松。首先合成ucnps并包覆介孔二氧化硅用以负载ica,随后将光裂解小分子间羟甲基苯甲酸(ona)和oh-peg-mal linker偶联在ucnp@msio2表面:ona用于连接β-环糊精(β-cd),oh-peg-mal用于连接细胞靶向肽(rgd),得到的ucnps纳米载体负载ica后在近红外光的照射下,nir被ucnps转换为紫外光,致使ona断裂解除β-cd封盖释放ica,特异性诱导mscs成骨分化,缓解op大鼠骨质疏松症状。这种光响应的ucnps纳米平台为利用近红外光远程调控mscs成骨分化治疗骨质疏松症提供了潜力。
81.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1