一种含利那洛肽的药物组合物、胶囊制剂及其制备方法与流程
1.本发明属于医药技术领域,具体涉及一种稳定性好的含利那洛肽的药物组合物、胶囊制剂及其制备方法。
背景技术:
2.便秘型肠易激综合征(ibs-c)是一种反复发作,以便秘为主要特征并伴随腹痛、腹胀和腹部不适的功能性肠道疾病,主要症状是与排便相关的腹部疼痛或腹部不适,以及以排便紊乱为特征的肠道习惯改变,严重影响工作和生活质量。据统计,全球成人发生率10-20%,但是仅30-50%就诊,低于3%发展成器质性肠道疾病,年康复10%,年新发10%,新发者持续2-10年。肠易激综合征(ibs)会给患者的日常生活带来负面影响,造成了巨大的社会和经济压力。在基层医疗体系和二级医疗体系中,该疾病在胃肠道疾病中占绝大部分的比例。鉴于此疾病的复杂性,ibs尚无治愈手段,现有的治疗选择也极少。在美国,利那洛肽胶囊已被fda批准用于治疗伴有便秘的肠易激综合征(ibs-c)和慢性特发性便秘(cic)。临床试验证实利那洛肽能影响人类胃肠道的生理机能,包括可减轻内脏痛、减轻腹胀和加快胃肠转运,这可引起大便次数增加以及大便稠度改善。
3.目前全球上市的利那洛肽制剂只有硬木药品公司的利那洛肽胶囊,用于在成年中有便秘(ibs-c)或慢性特发性便秘(cic)的治疗,推荐剂量分别为290μg每天口服1次、145μg 每天口服1次。
4.利那洛肽的化学性质不稳定,例如在水分作用下会发生降解反应,诸如水解、脱酰胺、异构体和多聚化。在生产剂量较低的利那洛肽制剂时,这些困难更加突出。
5.原研制剂专利cn102186490b公开了稳定的利那洛肽胶囊制备方法,其保护了起稳定作用的ca
2+
阳离子、空间位阻作用的亮氨酸以及组合物的比例,以及利那洛肽微丸的水溶液上药工艺。虽然原研制剂添加了ca
2+
阳离子及亮氨酸等稳定剂,但其在25℃、60%相对湿度的条件下储存18个月后,利那洛肽的色谱纯度最高可降低10%。另外,水性溶液微丸上药、微丸填充胶囊工艺也存在上药时间长、效率低下等问题。因此,仍需要一种性能更优的新的利那洛制剂制备技术,以解决现有制剂中稳定性较差的问题。
技术实现要素:
6.针对上述存在的技术问题,本发明提供了一种稳定性好的含利那洛肽的药物组合物、胶囊制剂及其制备方法。
7.本发明的技术方案为:
8.本发明提供了一种含利那洛肽的药物组合物的制备方法,包括如下步骤:
9.s1、将利那洛肽分散于聚乙二醇400中,在0-6℃条件下浸润固化1-3h后,在流化床将上述物料低温喷洒在含有瓜尔胶的底物上;
10.s2、然后外加崩解剂和润滑剂进行终混,混合均匀,得到含利那洛肽的药物组合物。
11.优选地,s1步骤中低温喷洒的条件为:物料温度为25-28℃,喷液速度为6-8rpm,进风温度为30-35℃,雾化压力为0.2-0.3mpa。
12.优选地,s2步骤中混合转速为12rpm,混合时间为5min。
13.优选地,所述底物中瓜尔胶的质量百分比为94.68-100%。
14.优选地,所述底物为瓜尔胶或者瓜尔胶与微晶纤维素101的混合物。
15.优选地,各组分的用量如下:利那洛肽的质量百分比为0.29%,聚乙二醇400的质量百分比为29.0%,底物的质量百分比为62.71%,崩解剂的质量百分比为为5.0%,润滑剂的质量百分比为为3.0%。
16.优选地,所述崩解剂为交联羧甲纤维素钠、羧甲基淀粉钠和淀粉中至少一种。
17.优选地,所述润滑剂为硬脂酸镁、硬脂酸和氢化植物油中至少一种。
18.本发明还提供了一种含利那洛肽的药物组合物,采用上述制备方法制得。
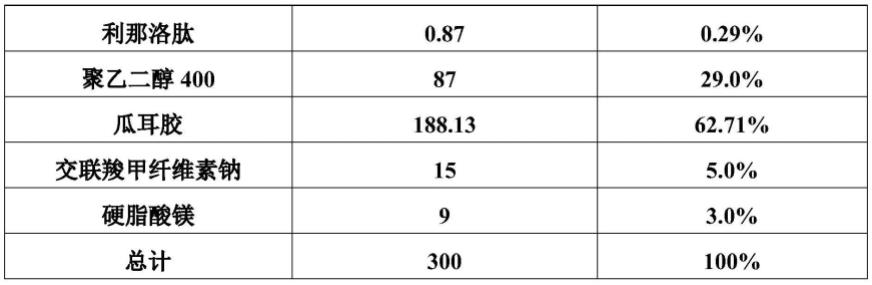
19.本发明还提供了一种胶囊制剂,包括上述含利那洛肽的药物组合物,将含利那洛肽的药物组合物充填胶囊,得到胶囊制剂。
20.本发明的有益效果是:
21.本发明将浸润于聚乙二醇400中的利那洛肽喷洒分散于含瓜耳胶的底物表面,两者结合使利那洛肽本身更稳定的前提下,进行溶胀包裹保护,不容易受外界温湿热的影响,可以提高利那洛肽胶囊的稳定性;本发明所制备的利那洛肽胶囊制剂置于40
±
2℃、75
±
5%的相对湿度储存条件下,存放6个月,分别测定利那洛肽的初始和储存终点的含量,发现利那洛肽的含量没有明显降低,说明本发明所制备的利那洛肽胶囊制具有较好的稳定性;此外,本发明采用一步法的制粒工艺,节省时间,效率较高且制得颗粒均匀,流动性好。
具体实施方式
22.为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式,对本发明进一步详细说明。应该理解,这些描述只是示例性的,而并非要限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。
23.实施例1
24.1.含利那洛肽的药物组合物的处方如下:
25.组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%瓜耳胶188.1362.71%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
26.2.利那洛肽胶囊制剂的制备过程如下:
27.(1)将利那洛肽分散于聚乙二醇400中,在0-6℃条件下浸润固化2h后,在流化床将上述物料低温喷洒在底物瓜耳胶上,物料温度为25-28℃,喷液速度为6-8rpm,进风温度为30-35℃,雾化压力为0.2-0.3mpa;
28.(2)然后外加交联羧甲纤维素钠和硬脂酸镁进行终混,混合转速为12rpm,混合时
间为5min,混合均匀,得到含利那洛肽的药物组合物;
29.(3)含利那洛肽的药物组合物充填胶囊,得到胶囊制剂。
30.实施例2
31.1.含利那洛肽的药物组合物的处方如下:
32.组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%瓜耳胶188.1362.71%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
33.2.本实施例利那洛肽胶囊制剂的制备过程与实施例1相比,不同点在于浸润固化时间为1h,其余制备过程和条件与实施例1相同。
34.实施例3
35.1.含利那洛肽的药物组合物的处方如下:
[0036][0037][0038]
2.本实施例利那洛肽胶囊制剂的制备过程与实施例1相比,不同点在于浸润固化时间为3h,其余制备过程和条件与实施例1相同。
[0039]
实施例4
[0040]
1.含利那洛肽的药物组合物的处方如下:
[0041]
组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%微晶纤维素101103.33%瓜耳胶178.1359.38%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
[0042]
2.本实施例底物为瓜耳胶和微晶纤维素101的混合物,利那洛肽胶囊制剂的制备过程和条件与实施例1相同。
[0043]
对比例1
[0044]
1.含利那洛肽的药物组合物的处方如下:
[0045]
组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%瓜耳胶188.1362.71%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
[0046] 2.本实施例利那洛肽胶囊制剂的制备过程与实施例1相比,不同点在于将利那洛肽分散于聚乙二醇400中,不进行浸润固化,直接在流化床将上述物料低温喷洒在底物瓜耳胶上,其余制备过程和条件与实施例1相同。
[0047]
对比例2
[0048]
1.含利那洛肽的药物组合物的处方如下:
[0049]
组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%微晶纤维素101188.1362.71%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
[0050]
2.本实施例用微晶纤维素101代替瓜耳胶,利那洛肽胶囊制剂的制备过程和条件与实施例1相同。
[0051]
对比例3
[0052]
1.含利那洛肽的药物组合物的处方如下:
[0053]
组分用量(按3000粒)/g质量百分比利那洛肽0.870.29%聚乙二醇4008729.0%瓜耳胶168.1356.04%微晶纤维素101206.67%交联羧甲纤维素钠155.0%硬脂酸镁93.0%总计300100%
[0054]
2.本实施例底物为瓜耳胶和微晶纤维素101的混合物,利那洛肽胶囊制剂的制备过程和条件与实施例1相同。
[0055]
对比例4
[0056]
1.含利那洛肽的药物组合物的处方如下:
[0057][0058][0059]
2.本实施例去除瓜耳胶,底物选择微晶纤维素101,将利那洛肽在0-6℃条件下放置 2h,然后直接在流化床将利那洛肽低温喷洒在底物微晶纤维素101上,利那洛肽胶囊制剂的其余制备过程和条件与实施例1相同。
[0060]
将实施例1-4以及对比例1-4所制备的利那洛肽胶囊制剂置于40
±
2℃、75
±
5%的相对湿度储存条件下,存放6个月,分别测定利那洛肽的初始和储存终点的含量,具体结果将下表:
[0061] 初始含量40
±
2℃、75
±
5%,6个月实施例199.8%97.6%实施例299.2%94.6%实施例399.5%96.2%实施例499.9%97.5%对比例197.8%90.8%对比例298.0%90.4%对比例399.3%92.7%对比例497.1%89.7%
[0062]
从上表可以看出,本发明的利那洛肽在0-6℃充分分散浸润于聚乙二醇400后,低温喷洒于瓜耳胶或者瓜尔胶含量较高的底物上,可以明显提高所制备的利那洛肽胶囊制剂的稳定性。
[0063]
应当理解的是,本发明的上述具体实施方式仅仅用于示例性说明或解释本发明的原理,而不构成对本发明的限制。因此,在不偏离本发明的精神和范围的情况下所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。此外,本发明所附权利要求旨在涵盖落入所附权利要求范围和边界、或者这种范围和边界的等同形式内的全部变化和修改例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1