一种组合物的医药用途的制作方法
一种组合物的医药用途
1.本技术要求2021年4月27日向中国国家知识产权局提交的,专利申请号为202110460793.5,发明名称为“一种组合物的医药用途”的在先申请的优先权。所述申请的全文通过引用的方式结合于本技术中。
技术领域
2.本发明涉及医药领域,具体涉及一种右美沙芬或其药学上可接受的盐和奎尼丁或其药学上可接受的盐的联合用药的新用途。更具体的,涉及右美沙芬或其药学上可接受的盐和奎尼丁或其药学上可接受的盐联合用于治疗或缓解疾病中的吞咽困难和流涎。
背景技术:
3.吞咽障碍和流涎是神经系统疾病伴随的常见胃肠道问题之一,发生比例较高。有研究表明,帕金森病患者吞咽困难的发生率是11-87%。超过50%的急性脑梗死患者伴有不同程度的吞咽障碍。脑卒中患者中吞咽困难的发病率约为51~73%。约三分之一的多发性硬化症患者存在吞咽困难的症状。吞咽困难常导致严重的并发症,如脱水、营养不良、气道阻塞和吸入性肺炎等,严重的甚至会危及生命。另外,由于上述疾病的患者流涎的主要原因是吞咽唾液困难,而不是唾液分泌过多,所以流涎常伴随吞咽困难,是神经系统疾病患者常见的症状。吞咽困难和流涎不仅对身体产生影响,还会产生生活和社会活动上的不便,影响患者的情绪,导致抑郁,从而使患者生活质量下降。
4.目前,由于尚未有药物被批准用于治疗或缓解吞咽困难和流涎,常通过饮食调整、口腔康复练习、针灸、鼻胃管、深部脑刺激等手段来治疗或改善吞咽困难。但这些手段存在患者顺应性差,有效性不确定、使用范围局限等问题,均无法满足临床需求。
5.综上所述,对吞咽困难和/或流涎相关药物的研究具有非常重要的临床意义,亟需开发一种能够治疗或缓解神经系统疾病中吞咽困难和/或流涎的药物。
技术实现要素:
6.本发明的目的在于解决现有技术中的问题,提供一种治疗或缓解神经系统疾病中吞咽困难和/或流涎症状的方法。
7.本发明的目的可通过以下技术方案实现:
8.本发明提供一种治疗或缓解疾病中吞咽困难和/或流涎症状的方法,包括给予有效量的:
9.右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶;以及
10.奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶;
11.其中,所述疾病不为肌萎缩侧索硬化。
12.在某些实施方案中,给予受试者右美沙芬、其同位素标记化合物、其药学上可接受
的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶与给予受试者奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶基本上同时进行。在某些实施方案中,给予受试者右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶在给予受试者奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶之前(例如,1至10分钟、10至60分钟、1至6小时或6至24小时之前)。在某些实施方案中,给予受试者右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶在给予受试者奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶之后(例如,1至10分钟、10至60分钟、1至6小时或6至24小时之后)。
13.在某些实施方案中,所述疾病为神经系统疾病。
14.在某些实施方案中,该疾病是神经退行性疾病。在某些实施方案中,该疾病是帕金森综合症、阿尔茨海默病、延髓空洞症、沃尔弗拉姆综合征或亨廷顿氏病。
15.在某些实施方案中,该疾病是脑血管疾病。在某些实施方案中,该疾病是脑卒中或脑梗死。
16.在某些实施方案中,该疾病是炎性疾病。在某些实施方案中,该疾病是多发性硬化、格林巴利综合征、脊髓灰质炎或莱姆病。
17.在某些实施方案中,该疾病是神经肌肉接头疾病。在某些实施方案中,该疾病是重症肌无力或神经白塞病。
18.在某些实施方案中,该疾病是感染性疾病。
19.在某些实施方案中,该疾病是肿瘤性疾病。在某些实施方案中,该疾病是癌症。在某些实施方案中,该疾病是中枢神经系统癌症。在某些实施方案中,该疾病是脑癌。在某些实施方案中,该疾病是脑干胶质瘤。在某些实施方案中,该疾病是恶性脑膜炎。在某些实施方案中,该疾病是高脑干肿瘤。
20.在某些实施方案中,该疾病是遗传疾病。在某些实施方案中,该疾病是肯尼迪氏病。在某些实施方案中,该疾病是急性间歇性卟啉病。
21.在某些实施方案中,该疾病是精神疾病。在某些实施方案中,该疾病是孤独症。在某些实施方案中,该疾病是重度抑郁症。
22.在某些实施方案中,该疾病是代谢疾病。在某些实施方案中,该疾病是渗透性脱髓鞘综合征。
23.在某些实施方案中,该疾病选自帕金森综合症、阿尔茨海默症、多发性硬化、脑卒中、脑梗死、亨廷顿舞蹈病、重症肌无力或脑膜炎。优选帕金森综合症、多发性硬化、脑卒中或脑梗死。
24.在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的摩尔比为1:1至10:1。在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可
接受的共晶的摩尔比为2:1至8:1。在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的摩尔比为3:1至6:1。在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的摩尔比为约4:1。
25.在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的质量比为1:2至10:1,例如为1:2,1:1,2:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1。在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的质量比为1:1至5:1。在某些实施方案中,右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶与奎尼丁、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶的质量比为1:1至2:1。
26.根据本发明,所述右美沙芬(dm)是下式的化合物:
[0027][0028]
其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或其互变异构体。在某些实施方案中,右美沙芬由基本上处于其天然丰度的同位素组成。在某些实施方案中,右美沙芬同位素标记化合物是氘代右美沙芬(例如,单氘代右美沙芬、多氘代右美沙芬或全氘代右美沙芬)。在某些实施方案中,右美沙芬同位素标记化合物是用一个或多个3h、一个或多个
14
c、一个或多个
15
n和/或一个或多个
18
o标记的右美沙芬。
[0029]
在某些实施方案中,右美沙芬的药学上可接受的盐是右美沙芬氢溴酸盐,优选的,右美沙芬的药学上可接受的盐是右美沙芬一氢溴酸盐。在某些实施方案中,右美沙芬的药学上可接受的溶剂化物是右美沙芬水合物(例如,右美沙芬一水合物)。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶是右美沙芬的药学上可接受的盐的水合物。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶是右美沙芬一氢溴酸盐一水合物。
[0030]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为15至150μmol。
[0031]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为30至100μmol。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为40至70μmol。在某些实施方案中,右美
沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为约54μmol。
[0032]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的质量为5至150mg。
[0033]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的质量为5至80mg。
[0034]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的质量为10至100mg。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至40mg。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至30mg。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的质量为20至60mg。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为约20mg。奎尼丁是下式的化合物:
[0035][0036]
其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或其互变异构体或其互变异构体。在某些实施方案中,奎尼丁由基本上处于其天然丰度的同位素组成。在某些实施方案中,奎尼丁同位素标记化合物是氘代奎尼丁(例如,单氘代奎尼丁、多氘代奎尼丁或全氘代奎尼丁)。在某些实施方案中,奎尼丁同位素标记化合物是用一个或多个3h、一个或多个
14
c、一个或多个
15
n和/或一个或多个
18
o标记的奎尼丁。在某些实施方案中,奎尼丁的药学上可接受的盐是奎尼丁硫酸盐,优选的,奎尼丁的药学上可接受的盐是奎尼丁半硫酸盐。在某些实施方案中,奎尼丁的药学上可接受的溶剂化物是奎尼丁水合物(例如,奎尼丁一水合物)。在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶是奎尼丁的药学上可接受的盐的水合物。在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶是奎尼丁半硫酸盐一水合物。
[0037]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为4至40μmol。
[0038]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为7至25μmol。在某些实施方案中,奎尼丁或其同位素标记化合物奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至20μmol。
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为约13μmol。
[0039]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为2.5至150mg。
[0040]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至150mg。
[0041]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至100mg。
[0042]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至60mg。
[0043]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为2.5至40mg。
[0044]
在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为5至30mg。在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为7至20mg。在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为10至15mg。在某些实施方案中,奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶的量为约10mg。
[0045]
在优选的实施方式中,所述右美沙芬、其同位素标记化合物、药学上可接受的盐、溶剂化物、多晶型物或药学上可接受的共晶,以及奎尼丁、其同位素标记化合物、药学上可接受的盐、药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶经口服、注射或胃肠外给药。
[0046]
在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶和奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶为两种单独的剂型。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶和奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶为单一剂型。
[0047]
本发明还提供一种药物组合物,所述药物组合物包括:
[0048]
(i)右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶体;
[0049]
(ii)奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶体。
[0050]
在一些方面,本发明提供所述药物组合物在制备用于治疗或缓解疾病中吞咽困难和/或流涎症状的药物中的用途。
[0051]
在另一方面,本发明提供右美沙芬、其同位素标记化合物、其药学上可接受的盐、
其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶在制备用于治疗或缓解疾病中吞咽困难和/或流涎症状的药物中的用途。
[0052]
在另一方面,本发明提供奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶在制备用于治疗或缓解疾病中吞咽困难和/或流涎症状的药物中的用途。
[0053]
根据本发明的实施方案,所述疾病同前文所定义。
[0054]
根据本发明的实施方案,所述药物组合物含有约15-150μmol右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0055]
根据本发明的实施方案,所述药物组合物含有10-150mg右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0056]
根据本发明的实施方案,所述药物组合物含有约4-40μmol奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0057]
根据本发明的实施方案,所述药物组合物含有10-150mg奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0058]
在某些实施方案中,本发明所述药物组合物,进一步包括一种或多种药学上可接受的赋形剂。
[0059]
在一些实施方案中,所述药物组合物以单位剂量形式。
[0060]
根据本发明的实施方案,所述单位剂量包含:(1)约15-150μmol右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶;(2)约4-40μmol奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0061]
根据本发明的实施方案,所述单位剂量中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶优选为30-100μmol,更优选为40-70μmol;奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶优选为7-25μmol,更优选为10-20μmol。
[0062]
根据本发明的实施方案,所述单位剂量包含:(1)15-150mg右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶;(2)约10-150mg奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0063]
根据本发明的实施方案,所述单位剂量中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶优选为10-100mg,更优选为20-60mg;奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶优选为10-100mg,更优选为10-60mg。
[0064]
根据本发明的实施方案,所述单位剂量适于口服或胃肠外给药。
[0065]
本发明的化合物和药物组合物可以通过任何途径给药,包括肠内(例如,口服)、肠胃外、静脉内、肌内、动脉内、髓内、鞘内、皮下、心室内、透皮、真皮间、直肠、阴道内、腹膜内、局部(如通过粉剂、膏剂、霜剂和/或滴剂)、粘膜、鼻、颊、舌下;通过气管内滴注、支气管滴注和/或吸入;和/或作为口腔喷雾剂、鼻腔喷雾剂和/或气雾剂。特别考虑的途径是口服给药、静脉内给药(例如全身静脉内注射)、通过血液和/或淋巴供应的局部给药和/或直接给药至受影响的部位。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶体和奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶中的一者或两者经口服给药。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶和奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶中的两者均经口服给药。在某些实施方案中,右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶和奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶中的一者或两者不经口服给药。
[0066]
在某些实施方案中,本发明的方法还包括给予有需要的受试者手术、放射疗法和/或移植或额外的药剂治疗。额外的药剂可在给予本发明的化合物或药物组合物的同时、之前或之后给药。
[0067]
在某些实施方案中,额外的药剂是额外的治疗活性或预防活性剂,包括但不限于细胞毒性化学治疗剂、表观遗传修饰剂、糖皮质激素、免疫治疗剂、抗增殖剂、抗癌剂、抗血管生成剂、抗炎剂、免疫抑制剂、抗菌剂、抗病毒剂、心血管药物、降胆固醇剂、抗糖尿病剂、抗过敏剂、避孕药、疼痛缓解剂及其组合。在一些实施方案中,额外的药剂是拓扑异构酶抑制剂、mcl1抑制剂、bcl-2抑制剂、bcl-xl抑制剂、brd4抑制剂、brca1抑制剂、brca2抑制剂、her1抑制剂、her2抑制剂、cdk9抑制剂、jummonji组蛋白脱甲基酶抑制剂或dna损伤诱导剂。在某些实施方案中,额外的药剂是激酶(例如酪氨酸激酶)的结合剂或抑制剂。
[0068]
在某些实施方案中,额外的药剂是抗体或其片段(例如,单克隆抗体)。在某些实施方案中,额外的治疗是免疫治疗(例如,免疫治疗单克隆抗体)。在某些实施方案中,额外的药剂是免疫抑制剂。在某些实施方案中,额外的药剂是免疫激活剂。在某些实施方案中,额外的药剂是免疫检查点抑制剂。在某些实施方案中,额外的药剂是程序性细胞死亡1蛋白(pd-1)抑制剂。在某些实施方案中,额外的药剂是程序性细胞死亡1蛋白配体1(pd-l1)抑制剂。在某些实施方案中,额外的药物是细胞毒性t淋巴细胞相关蛋白4(ctla-4)抑制剂。在某些实施方案中,额外的药剂是t细胞免疫球蛋白结构域和粘蛋白结构域3(tim3)抑制剂、淋巴细胞活化基因-3(lag3)抑制剂、含v-set结构域的t细胞活化抑制剂1(vtcn1或b7-h4)抑制剂、分化抗原簇276(cd276或b7-h3)抑制剂、b和t淋巴细胞衰减因子(btla)抑制剂、半乳凝素-9(gal9)抑制剂、检查点激酶1(chk1)抑制剂、腺苷a2a受体(a2ar)抑制剂、吲哚胺2,3-双加氧酶(ido)抑制剂、杀伤细胞免疫球蛋白样受体(kir)抑制剂或t细胞活化的igv-结构域抑制剂(vista)抑制剂。在某些实施方案中,额外的药剂是二甲双胍。在某些实施方案中,额外的药剂由管理机构(例如美国食品药品监督管理局(fda)或欧洲药品管理局(ema))批
准用于人和/或兽用。在某些实施方案中,本发明的化合物或药物组合物可以与手术、放射疗法和/或移植(例如,干细胞移植、骨髓移植)组合给药。
[0069]
在某些实施方案中,受试者是哺乳动物。在某些实施方案中,受试者是人。在某些实施方案中,受试者是18岁或以上的人。在某些实施方案中,受试者是21岁或以上的人。在某些实施方案中,受试者是12至18岁的人。在某些实施方案中,受试者是2至12岁的人。在某些实施方案中,受试者是29天至小于2岁的人。在某些实施方案中,受试者是小于29天的人。在某些实施方案中,受试者是非人哺乳动物。在某些实施方案中,受试者是驯化动物,例如狗、猫、牛、猪、马、绵羊或山羊。在某些实施方案中,受试者是陪伴动物,例如狗或猫。在某些实施方案中,受试者是家畜动物,例如牛、猪、马、绵羊或山羊。在某些实施方案中,受试者是动物园动物。在另一个实施方案中,受试者是研究动物,例如啮齿动物(例如小鼠、大鼠)、狗、猪或非人灵长类动物。在某些实施方案中,受试者是基因工程动物。在某些实施方案中,受试者是转基因动物(例如,转基因小鼠、转基因猪)。
[0070]
本发明提供了一种右美沙芬或其药学上可接受的盐和奎尼丁或其药学上可接受的盐的组合的新用途。该用途可治疗或缓解疾病中的吞咽障碍和流涎。并且,本发明提供的右美沙芬或其药学上可接受的盐和奎尼丁或其药学上可接受的盐的组合安全性高,可满足患者用药要求,可显著提高患者的生活质量。
[0071]
术语和范围等相关解释
[0072]
当列出了值的范围(“范围”)时,其旨在包括该范围内的每个值和子范围。除非另有说明,否则范围包括该范围两端值。
[0073]
术语“给予”、“施用”或“给药”是指植入、吸收、摄取、注射、吸入或以其它方式引入化合物或其药物组合物。
[0074]
术语“病症”、“疾病”和“障碍”可互换使用。
[0075]“本发明的化合物”、“本发明所述化合物”、“本发明活性成分”、“活性组成化合物”等术语表述包括组成本发明药物组合物/本发明联合治疗方案的任意药用活性成分,且涵盖这些活性成分的各种变形、存在形式,例如包括右美沙芬、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶;和/或奎尼丁、其同位素标记化合物、其药学上可接受的盐、其药学上可接受的溶剂化物、多晶型物、或其药学上可接受的共晶。
[0076]
术语“同位素标记化合物”是指除了在一个或多个位置的同位素组成与本发明化合物有区别之外(如氢相对于氘),其所具有的化学结构与化学式和本发明的化合物相同的结构,所述同位素标记化合物的至少一个原子包括至少一个富集在其天然丰度以上(例如,富集3倍、10倍、30倍、100倍、300倍、1000倍、3000倍或10000倍以上)的同位素,其中化合物由基本上处于其天然丰度的同位素组成。所述“同位素标记物”包括但不限于氢,碳,氮,氧,氟,硫和氯的同位素(例如2h,3h,
13
c,
14
c,
15
n,
18
o,
17
o,
18
f,
35
s和
36
cl)标记的本发明化合物。同位素标记的本发明化合物可用于化合物及其前药和代谢物的组织分布的测定;用于此类测定的优选同位素包括3h和
14
c。此外,在某些情况下,用较重的同位素(例如氘(2h或d))取代化合物可以提供更多的治疗优势效果,例如增加的代谢稳定性,增加的体内半衰期或减少的剂量需求等。本发明的同位素标记的化合物通常可以根据本文所述的方法通过用同位素标记的试剂取代非同位素标记的试剂来制备。
[0077]
术语“药学上可接受的盐”是指在合理的医学判断范围内,适用于与受试者(例如人)的组织接触而没有过度的毒性、刺激、过敏反应等,并且与合理的获益/风险比相称的盐。药学上可接受的盐是本领域所熟知的。例如,berge等在j.pharmaceutical sciences(1977)66:1-19中详细描述了药学上可接受的盐。本文描述的化合物的药学上可接受的盐包括衍生自合适的无机和有机酸和碱的盐。药学上可接受的无毒酸盐的示例为氨基基团与无机酸(例如盐酸、氢溴酸、磷酸、硫酸和高氯酸)或有机酸(例如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸)、或通过本领域使用的其它方法(例如离子交换)形成的盐。其它药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂烷硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一酸盐、戊酸盐等。衍生自合适的碱的盐包括碱金属盐、碱土金属盐、铵盐和n
+
(c
1-4
烷基)4盐。代表性的碱金属盐或碱土金属盐包括钠盐、锂盐、钾盐、钙盐、镁盐等。其它药学上可接受的盐包括,如合适,季盐。
[0078]
术语“溶剂化物”是指通常通过溶剂分解反应与溶剂缔合的化合物形式。这种物理缔合可以包括氢键键合。常规溶剂包括水、甲醇、乙醇、乙酸、dmso、thf、乙醚等。本发明的化合物可以例如以晶型制备,并且可以是溶剂化的。合适的溶剂化物包括药学上可接受的溶剂化物,并且还包括化学计量的溶剂化物和非化学计量的溶剂化物。在某些情况下,例如将一种或多种溶剂分子结合到结晶固体的晶格中时,溶剂化物将能够分离。“溶剂化物”包括溶液相的和可分离的溶剂化物。代表性溶剂化物包括水合物、乙醇化物和甲醇化物。术语“药学上可接受的溶剂化物”是指在合理的医学判断范围内,适用于与受试者(例如人)的组织接触而没有过度的毒性、刺激、过敏反应等,并且与合理的获益/风险比相称的溶剂化物。
[0079]
术语“水合物”是指与水缔合的化合物。通常,化合物的水合物中所含的水分子的数目与水合物中的化合物分子的数目成特定的比率。因此,化合物的水合物可以由例如通式r
·
x h2o表示,其中r为化合物,x为大于0的数。给定化合物可形成一种以上类型的水合物,包括例如一水合物(x为1)、低水合物(x为大于0且小于1的数,例如半水合物(r
·
0.5h2o))和多水合物(x为大于1的数,例如二水合物(r
·
2h2o)和六水合物(r
·
6h2o))。
[0080]
术语“互变异构体”是指为特定化合物结构的可互换形式的化合物,以及氢原子和电子分布不同的化合物。因此,通过π电子和原子(通常为h)的运动,两种结构可达到平衡。例如,烯醇和酮为互变异构体,因为它们通过用酸或碱处理而快速相互转化。
[0081]
术语“多晶型物”是指化合物(或其盐、水合物或溶剂化物)在特定晶体堆叠排布中的晶型。所有多晶型物具有相同的元素组成。不同的晶型通常具有不同的x-射线衍射图谱、红外光谱、熔点、密度、硬度、晶体形状、光学和电学性质、稳定性和溶解度。重结晶溶剂、结晶速率、储存温度和其它因素可导致一种晶型占多数。化合物的各种多晶型物可以通过在不同条件下结晶来制备。
[0082]
术语“病症”、“疾病”和“障碍”可互换使用。
[0083]
本发明的化合物/药物组合物的“有效量”是指足以引起期望的生物学反应,即缓解症状的量。有效量可根据诸如所需生物终点、给药方式和/或受试者年龄和健康等因素而变化。
[0084]
此外,本发明涵盖了所有变型、组合和排列,其中来自一项或多项所列权利要求的一个或多个限制、要素、条款和描述性术语被引入另一项权利要求。例如,任何从属于另一项权利要求的权利要求都可以被修改成包括在从属于同一基础权利要求的任何其他权利要求中发现的一个或多个限制。如各要素以列举形式呈现,则本发明也公开了要素的每一子组,且任何要素均可从该组中移除。还应注意,术语“包括”和“含有”意为开放式的,并且允许包括额外的要素或步骤。在给出范围的情况下,包括端点。此外,除非另外指明或根据上下文和本领域普通技术人员的理解中显而易见,否则表示为范围的值可在本发明的不同实施方案中采用范围内的任何具体值或子范围,直至范围下限单位的十分之一,除非上下文另有明确说明。
附图说明
[0085]
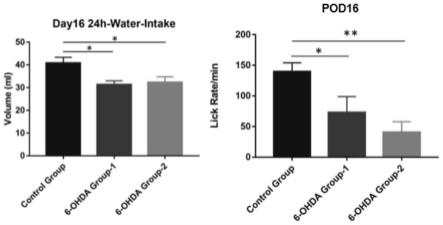
图1为本发明实施例1 6-ohda诱导的帕金森疾病模型中,诱导造模后第16天的大鼠24小时内水摄入量和舔舐率图;
[0086]
图2为本发明实施例1 6-ohda诱导的大鼠帕金森疾病模型中,给药第7天唤起吞咽反射的最小电流图;
[0087]
图3为本发明实施例1 6-ohda诱导的大鼠帕金森疾病模型中,给药后左侧和右侧黑质中平均th阳性核数量图;
[0088]
图4为本发明实施例1 6-ohda诱导的大鼠帕金森疾病模型中,给药后左侧和右侧纹状体的总dab阳性光密度图;
[0089]
图5为本发明实施例2maco诱导的大鼠中风模型中,给药第6天和第14天各组的舔舐率图;
[0090]
图6为本发明实施例3sod1转基因诱导的大鼠als模型中,给药第8天和第14天各组舔舐率图;
[0091]
图7为本发明实施例3sod1转基因诱导的大鼠als模型中,给药第14天唤起各组吞咽反射的最小电流图;
[0092]
图8为本发明实施例3sod1转基因诱导的大鼠als模型中,给药第14天各组60s内吞咽次数图。
具体实施方式
[0093]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0094]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0095]
实施例1 6-羟基多巴胺(6-ohda)诱导的大鼠帕金森综合症模型
[0096]
准确称取100mg氢溴酸右美沙芬和100mg硫酸奎尼丁,加入10ml甲基纤维素溶液
(1%w/v),超声30分钟形成右美沙芬奎尼丁悬浮液。
[0097]
将6-ohda-hcl溶解在含有0.02%抗坏血酸的盐水中,配备4.4mg/ml(对应3.0mg/ml游离碱6-ohda)的溶液,0℃下避光保存。
[0098]
将雄性sd大鼠(n=30,220-250g)饲养7天以适应环境,记录基线舔舐率。根据体重和舔舐率将大鼠随机分为空白组、模型组和治疗组,每组10只。向模型组和治疗组大鼠右侧内侧前脑束缓慢注入神经毒素6-羟基多巴胺(6-ohda)(最大速率:1μl/min,18μg/只)。诱导后第6天至第16天,每天测量各组大鼠24小时水摄入量。在诱导后2周,给予大鼠0.1mg/kg的阿扑吗啡,检测其阿扑吗啡诱导的旋转行为。根据旋转测试结果,将模型组和治疗组重新分组为6-ohda group-1和6-ohda group-2。group-1为新的模型组,group-2为新的治疗组。在第16天测量各大鼠的舔舐率。第16天各大鼠的24小时水摄入量和舔舐率检测结果见图1,其中pod指术后当天。
[0099]
结果表明,诱导后第16天,大鼠的24小时水摄入量和舔舐率与空白组相比均显著降低,表明大鼠出现吞咽困难。
[0100]
诱导后第20天,给予治疗组大鼠右美沙芬奎尼丁悬浮液(po,5ml/kg)。在给药后第六天,测试受试大鼠的舔舐率以确定吞咽功能是否有改善。若出现吞咽功能改善,则在给药第7天用体内肌电图(emg)测量各大鼠上喉神经的生物电信号,记录唤起吞咽反射的最小电流。结果如图2所示。由于是向右侧内侧前脑束注入6-ohda,左侧躯体运动功能会受损,且对右侧躯体功能有一定的补偿作用。图2结果表明,模型组大鼠唤起吞咽反射的最小电流较空白组高,使用右美沙芬奎尼丁治疗后,唤起大鼠吞咽反射的最小电流显著降低,表明右美沙芬奎尼丁可显著改善吞咽困难症状。
[0101]
将大鼠处死,对大鼠黑质和纹状体进行酪氨酸羟化酶阳性染色(免疫组化,dab染色);检测黒质中平均th阳性核团数量及纹状体的总dab阳性光密度,考察给药处理后对pd大鼠黑质和纹状体内多巴胺神经元形态水平的改善。结果见图3和图4。结果表明,经右美沙芬奎尼丁治疗后,大鼠黑质和纹状体的多巴胺能神经元水平均显著提高。由于帕金森疾病的运动障碍与纹状体区和黑质区多巴胺的耗竭相关,该结果表明右美沙芬奎尼丁可显著改善帕金森疾病伴随的运动障碍。
[0102]
实施例2大脑中动脉闭塞(mcao)诱导的大鼠中风模型
[0103]
将雄性sd大鼠(n=30,220-240g)饲养7天以适应环境,记录基线舔舐率。根据体重和舔舐率将大鼠随机分为空白组、模型组和治疗组,每组10只。将一根经过消毒的细丝插入模型组和治疗组颈外动脉(eca),将其向前穿入颈内动脉(ica)18
±
0.5mm,直到尖端阻塞大脑中动脉的起点,导致血流停止和大脑动脉的梗塞。1.5小时后将缝合线收回到eca的残端,实现再灌注。使用激光多普勒血流仪在基线、闭塞后和再灌注时测量脑血流(cbf)。cbf持续降低(rcbf≥70%)被认为是mcao模型构建成功的标志。
[0104]
按照与实施例1类似的方式,规律测量各大鼠24小时水摄入量和舔舐率以确认模型组和治疗组大鼠出现吞咽困难。诱导后第17天,治疗组按照实施例1中的给药方式给予右美沙芬奎尼丁悬浮液。在给药后的第6天和第14天,测试受试大鼠的舔舐率以确定吞咽功能是否有改善。结果如图5所示。
[0105]
结果表明,在给药后的第6天和第14天,治疗组大鼠舔舐率显著提高,表明dmq治疗组大鼠的吞咽功能均得到显著改善。
[0106]
实施例3als模型
[0107]
将雄性sod1转基因大鼠(疾病大鼠,n=20)和野生型大鼠(n=10)饲养7天以适应环境,并记录基线舔舐率。按照后肢功能每日对转基因大鼠进行神经评分(neuroscore,ns),评分标准为:
[0108]
ns 0(症状前):后肢呈现正常张开;
[0109]
ns 1(第一个症状):后肢呈现异常张开;
[0110]
ns 2(麻痹发作):后肢部分或完全塌陷,没有延伸太多;
[0111]
ns 3(麻痹):后肢僵硬麻痹或关节运动最小;
[0112]
ns 4(人为终点):后肢僵硬麻痹。
[0113]
排除ns为0和4的大鼠。按照与实施例1类似的方式,规律测量各大鼠24小时水摄入量和舔舐率以确认模型组和治疗组大鼠出现吞咽困难。出现吞咽困难后,治疗组按照实施例1中的给药方式给予右美沙芬奎尼丁悬浮液。在给药第14天,测试受试大鼠的舔舐率,结果如图6所示。在给药第15天用体内肌电图(emg)测量上喉神经的生物电信号,记录唤起吞咽反射的最小电流和60s内的吞咽次数,结果分别如图7和图8所示。
[0114]
图6结果表明,使用右美沙芬奎尼丁治疗后的第14天,治疗组与模型组大鼠的舔舐率无显著差异。
[0115]
图7和图8结果表明,唤起模型组大鼠吞咽反射的最小电流及60s内大鼠的吞咽次数与健康组相比无显著差异,使用右美沙芬奎尼丁治疗后,唤起大鼠吞咽反射的最小电流与模型组相比也无显著差异。
[0116]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。本领域技术人员将认识到或能够确定使用不超过常规实验的许多本文的具体实施方案的同等形式。本发明实施方案的范围不旨在受限于以上具体实施方式,而是如所附权利要求书中所陈述。本领域的普通技术人员将理解,在不脱离如所附权利要求中限定的本发明的精神或范围的情况下,可以对本说明书进行各种改变和修改,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1