千金藤素在制备抗蜱传脑炎病毒药物中的应用
3):10-15.)
4.千金藤素的化学分子式为c
37h38
n2o6,化学结构式如下:([9]rogosnitzkym,danksr.therapeuticpotentialofthebiscoclaurinealkaloid,cepharanthine,forarangeofclinicalconditions.pharmacolrep,2011,63(2):337-347.)
[0005][0006]
蜱传脑炎病毒(tick-borneencephalitisvirus,tbev)属于黄病毒科黄病毒属成员,通过虫媒蜱叮咬传播,是蜱传脑炎的病原体。蜱传脑炎是蜱传脑炎病毒感染造成人中枢神经系统损伤的自然疫源性疾病,致死率高达40%以上,主要流行于欧洲、亚洲的许多地区。在中国,蜱传脑炎出现在北部、西部及西南部地区。蜱传脑炎呈高发病趋势,正逐渐成为全球性公共健康问题。目前尚无有效的抗病毒治疗药物。蜱传脑炎病毒为高感染、高致病性的病原体,蜱传脑炎病毒的研究只能在生物安全三级实验室开展。鉴于此,本领域研究人员一直致力于寻找可有效抗击蜱传脑炎病毒的药物。([10]ruzekd,t,bordej,etal.tick-borneencephalitisineuropeandrussia:reviewofpathogenesis,clinicalfeatures,therapy,andvaccines.antiviralres,2019,164:23-51.[11]imjh,baekjh,dureya,etal.geographicdistributionoftick-borneencephalitisviruscomplex.jvectorbornedis,2020,57(1):14-22.[12]luz,m,liangg.tick-borneencephalitisinmainlandchina.vectorbornezoonoticdis,2008,8(5):713-720.)
技术实现要素:
[0007]
本发明的目的是提供千金藤素在制备抗蜱传脑炎病毒药物中的应用。
[0008]
为了实现上述目的,本发明采用的技术方案如下:
[0009]
本发明的第一个方面是提供千金藤素在制备抗蜱传脑炎病毒药物中的应用。
[0010]
所述抗蜱传脑炎病毒药物是以千金藤素为唯一的活性成份,或包含千金藤素的药物组合物。
[0011]
所述包含千金藤素的药物组合物是指千金藤素与药学上允许的一种或多种辅料构成的药物组合物。
[0012]
所述抗蜱传脑炎病毒药物中千金藤素的含量为0.1~99wt%;优选为0.5~90wt%。
[0013]
所述抗蜱传脑炎病毒药物是指预防或治疗蜱传脑炎病毒感染的药物。
[0014]
所述辅料为稀释剂、赋形剂、粘合剂、填充剂、崩裂剂、香味剂、甜味剂中的至少一种。所述药学上允许的一种或多种辅料是指药学领域常规的药物辅料,其中,稀释剂、赋形
剂如水等;粘合剂如纤维素衍生物、明胶或聚乙烯吡咯烷酮等;填充剂如淀粉等;崩裂剂如碳酸钙或碳酸氢钠;也可以在药物组合物中加入其他辅助剂如香味剂和/或甜味剂。
[0015]
所述千金藤素可以和药剂学上的常规药用辅料制成药物制剂。
[0016]
所述药物制剂是胶囊剂、混悬剂、片剂、粉剂、乳剂、溶液剂、糖浆剂或注射剂中的至少一种。所述药物制剂可采用医学领域常规的方法,将千金藤素作为全部或部分活性成分,与药剂学上的常规药用辅料制成各种药物制剂。当口服时,可将其制备成常规的固体制剂,如片剂、粉剂或胶囊剂等;用于注射时,可将其制备成注射剂。
[0017]
所述药物制剂的给药方式为口服、注射。
[0018]
所述千金藤素的化学结构式如下:
[0019][0020]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0021]
本发明利用蜱传脑炎病毒的多种易感细胞,包括人肝癌细胞huh-7、人肺腺癌细胞a549、人神经母细胞瘤细胞sh-sy5y和非洲绿猴肾细胞vero,以及蜱传脑炎病毒感染balb/c小鼠模型,检测千金藤素的抗蜱传脑炎病毒活性。实验结果显示,千金藤素能有效抑制蜱传脑炎病毒对上述易感细胞和动物模型的感染,证实了千金藤素能有效抑制蜱传脑炎病毒感染靶细胞,能够显著提高蜱传脑炎病毒感染小鼠的生存率,抑制小鼠体内蜱传脑炎病毒的增殖,对感染小鼠具有明显的保护作用,能够作为潜在的抗蜱传脑炎病毒药物,具有进一步的开发前景。
附图说明
[0022]
图1:千金藤素对蜱传脑炎病毒感染细胞内病毒抗原表达的抑制;
[0023]
其中,图1a为不同浓度千金藤素对a549细胞内病毒抗原表达的抑制;图1b为不同浓度千金藤素对vero细胞内病毒抗原表达的抑制;0μm为蜱传脑炎病毒感染组,dmso为药物溶剂对照组,显微镜的倍数为100
×
。
[0024]
图2:千金藤素对蜱传脑炎病毒感染细胞的保护作用;图a为a549细胞;图b为sh-sy5y 细胞;mock为不感染病毒的对照组,0μm为蜱传脑炎病毒感染组,20μm为20μm千金藤素处理的病毒感染组,显微镜的倍数为100
×
。
[0025]
图3:千金藤素降低蜱传脑炎病毒感染细胞内的病毒rna水平;图a和b为不同浓度千金藤素以共处理、预处理方式处理病毒感染的a549细胞内病毒rna水平;图c和d为不同浓度千金藤素以共处理、预处理方式处理病毒感染的sh-sy5y细胞内病毒rna水平; 0μm为蜱传脑炎病毒感染组,dmso为药物溶剂对照组;student’s t-test分析统计学差异, *p<0.05,**p<0.005,***p<0.002,****p<0.001。
[0026]
图4:千金藤素降低蜱传脑炎病毒感染细胞上清中的病毒滴度;图a和b为不同浓度
千金藤素通过共处理、预处理两种方式处理病毒感染的a549细胞上清中病毒滴度;图c和d 为不同浓度千金藤素通过共处理、预处理两种方式处理病毒感染的sh-sy5y细胞上清中病毒滴度;0μm为蜱传脑炎病毒感染组,dmso为药物溶剂对照组;student’s t-test分析统计学差异,*p<0.05,**p<0.005,***p<0.002,****p<0.001。
[0027]
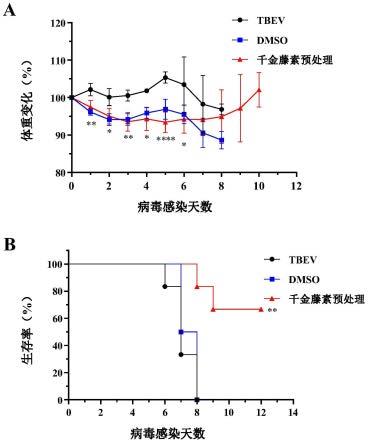
图5:千金藤素对蜱传脑炎病毒感染balb/c小鼠的保护作用;图a为千金藤素以预处理给药(25mg/kg)对病毒感染小鼠体重变化的影响;图b为千金藤素以预处理给药(25 mg/kg)对病毒感染小鼠生存率的影响;dmso为药物溶剂对照组;统计学分析,体重数据采用student’s t-test,生存数据采用log-rank,*p<0.05,**p<0.005,****p<0.001。
[0028]
图6:千金藤素抑制蜱传脑炎病毒感染balb/c小鼠脑、脾组织中病毒抗原的表达;千金藤素以预处理给药(25mg/kg)对病毒感染小鼠脑、脾组织中病毒抗原表达的影响;dmso 为药物溶剂对照组;显微镜的倍数为400
×
。
具体实施方式
[0029]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0030]
本发明实施例所用的千金藤素可以通过市售方式购买得到。
[0031]
实施例1
[0032]
一、实验药物、材料及试剂
[0033]
1.药物库与千金藤素:药物库包括2580种美国食品药品监督管理局(fda)认证药物,药物库与千金藤素均为美国selleck chemicals公司产品。
[0034]
2.细胞:人肝癌细胞huh-7、人肺腺癌细胞a549、人神经母细胞瘤细胞sh-sy5y和非洲绿猴肾细胞vero,购自中国科学院上海细胞所,由海军军医大学海军医学系生物医学防护教研室保存。
[0035]
3.动物:spf级6周龄雌性balb/c小鼠,购自上海灵畅生物科技有限公司(生产许可证号:scxk(沪)2018-0003,合格证号:20180003022307),体重15-17g。动物实验在海军军医大学生物安全三级实验室开展。
[0036]
4.蜱传脑炎病毒与病毒抗体:蜱传脑炎病毒与病毒免疫小鼠的腹水,由海军军医大学生物安全三级实验室保存。病毒滴度用空斑形成单位(plaque forming unit,pfu/ml)表示。
[0037]
5.细胞培养试剂:含10%胎牛血清、1%谷氨酰胺、1%非必需氨基酸、1%青霉素和链霉素的dmem细胞完全培养基,0.05%胰蛋白酶-edta细胞消化液,美国gibco公司产品。
[0038]
6.alexa fluor 488标记山羊抗鼠igg、dapi封固剂:英国abcam公司产品。
[0039]
7.cell titer aqueous细胞增殖检测试剂盒(mts):美国promega公司产品。
[0040]
8.二甲亚砜(dmso)、羧甲基纤维素钠:美国sigma-aldrich公司。
[0041]
9.m-mlv逆转录酶、dntp mix、eastep qpcr master mix:美国promega公司。
[0042]
10.随机引物、蜱传脑炎病毒非结构蛋白1引物、甘油醛三磷酸脱氢酶(gapdh)内参引物:北京六合华大基因科技股份有限公司合成。
[0043]
二、实验方法及结果
[0044]
(一)从2580个美国fda认证药物中初步筛选抗蜱传脑炎病毒活性的药物
[0045]
培养的人肝癌细胞huh-7接种于96孔培养板,37℃、5%co2培养箱培养12小时,细胞密度约为95%。相应溶剂溶解药物库中的药物,用dmem完全培养基稀释至浓度为40μm,蜱传脑炎病毒(感染复数moi为0.1)与稀释的药物混均后加入细胞,药物终浓度为10μm,培养24小时后通过检测蜱传脑炎病毒抗原的免疫荧光法评估药物对病毒的抑制活性,全自动细胞成像多功能微孔板检测系统扫描96孔培养板,并用gen 53.10软件进行图像采集与数据处理。计算药物对病毒的抑制率:病毒感染孔感染率(每孔病毒感染细胞数/每孔细胞总数)
ꢀ‑
药物孔感染率(每孔病毒感染细胞数/每孔细胞总数),每个浓度设置3孔,以抑制率≥70%为标准筛选出抗tbev活性药物。初步筛选出209种抗蜱传脑炎病毒活性的药物,主要为激酶抑制剂、抗肿瘤药物、抗生素、抗病毒药物、抗炎抗氧化药物、抗真菌药物、抗寄生虫药物、免疫抑制剂、蛋白酶抑制剂、雌激素受体药物等,其中抗炎抗氧化药物、抗病毒药物的信息见表1。
[0046]
表1抗炎抗氧化药物、抗病毒药物的名称
[0047][0048]
根据目前上述药物研究进展,结合药物在fda药物库中的作用描述,选择千金藤素进行抗蜱传脑炎病毒的研究。在对蜱传脑炎病毒易感的人肺腺癌细胞a549和非洲绿猴肾细胞vero 上,再次验证千金藤素的抗病毒活性。a549、vero细胞接种于96孔培养板,培养至细胞密度约90%,蜱传脑炎病毒感染细胞(moi=0.1),同时加入不同浓度的千金藤素。设置dmso 溶剂对照,每浓度设置3孔。培养48小时后,免疫荧光法检测病毒抗原的表达。如附图1 所示,千金藤素在a549、vero细胞中均表现抗病毒活性,抑制病毒抗原的表达(绿色荧光),且呈浓度依赖性抑制。采用graphpadprism 8.0软件,计算药物半数抑制浓度(ic
50
)。在a549 细胞千金藤素ic
50
为13.69μm,在vero细胞ic
50
为24.85μm。
[0049]
(二)千金藤素对多种细胞的毒性检测
[0050]
a549细胞、vero细胞、人神经母细胞瘤细胞sh-sy5y分别接种96孔培养板,培养至细胞密度约100%,加入不同浓度千金藤素。设置dmso溶剂对照组、空白组(dmem完全培养基),每组均设置3孔。培养48小时后,加入mts溶液,多功能酶标仪测od
490
值。采用graphpadprism 8.0软件,计算药物半数细胞毒性浓度(cc
50
):(od
对照组-od
空白组
)-(od 实验组-od
空白组
)/od
对照组
。结果表明,千金藤素对三种细胞有不同程度的毒性作用,千金藤素在a549细胞中的细胞毒性低于其对vero细胞与sh-sy5y细胞的毒性,毒性作用具有细胞型别依赖性。当浓度低于40μm时,千金藤素对a549细胞无明显毒性。当千金藤素浓度等于或高于30μm时,对vero与sh-sy5y细胞的生长具有一定抑制作用。计算所得千金藤素 cc
50
值见表2。
[0051]
表2千金藤素在三种细胞中的半数细胞毒性浓度
[0052][0053]
同时,基于上述千金藤素的cc
50
值,观察20μm千金藤素对病毒感染细胞的保护作用。千金藤素加至病毒感染的a549与sh-sy5y细胞,设置不感染病毒的细胞对照(mock组),培养48小时,显微镜下观察病毒致细胞病变效应。如附图2所示,与mock组相比,病毒感染的a549细胞、sh-sy5y细胞(0μm组)均出现明显病变,表现为胞体皱缩、变圆、细胞间隙增大,并出现细胞脱落。而20μm千金藤素则对病毒感染的两种细胞均具有保护作用,变现为细胞病变效应明显减弱。
[0054]
(三)千金藤素在细胞水平上对蜱传脑炎病毒抑制活性的评估
[0055]
1.千金藤素添加时间实验
[0056]
(1)共处理:a549、sh-sy5y细胞接种12孔培养板,培养至细胞密度约100%。吸弃孔内培养液,每孔加入500μl不同浓度千金藤素和500μl病毒(moi=0.1),设置dmso 溶剂对照,继续培养48小时,分别收集培养上清(用于空斑实验检测病毒滴度)和trizol 细胞裂解物(用于实时荧光定量pcr检测病毒rna)。
[0057]
(2)预处理:a549、sh-sy5y细胞接种12孔培养板,培养至细胞密度约100%。吸弃孔内培养液,每孔加入1ml不同浓度千金藤素,培养12小时。吸弃孔内液体,加入200μl/ 孔病毒(moi=0.1),37℃培养箱吸附2小时。吸弃孔内病毒液,洗涤后加入1ml/孔dmem 完全培养基,设置dmso溶剂对照,继续培养48小时。分别收集培养上清(用于空斑实验检测病毒滴度)和trizol细胞裂解物(用于实时荧光定量pcr检测病毒rna)。
[0058]
2.实时荧光定量pcr法检测千金藤素对蜱传脑炎病毒rna合成的抑制作用
[0059]
细胞rna提取试剂trizol抽提细胞总rna,用随机引物反转录为cdna。以gapdh 基因为内参,采用实时荧光定量pcr法检测千金藤素共处理、预处理病毒感染细胞内的蜱传脑炎病毒rna水平。gapdh扩增引物序列:正向引物5
′‑
tgggctacactgagcaccag-3
′
,反向引物5
′‑
aagtggtcgttgagggcaat-3
′
;蜱传脑炎病毒扩增引物序列:正向引物 5
′‑
tggayttyagacaggaaycaacaca-3
′
,反向引物 5
′‑
tccagagactytgrtcdgtgtgga-3
′
。实时荧光定量pcr法检测病毒rna的结果显示,在千金藤素共处理的a549细胞,病毒rna水平呈千金藤素浓度依赖性降低;与病毒感染组相比,20μm千金藤素显著降低病毒rna水平(p<0.005,附图3a)。在千金藤素预处理的a549细胞,病毒rna水平也呈千金藤素浓度依赖性降低;与病毒
感染组相比,20μm 千金藤素显著降低病毒rna水平(p<0.05,附图3b)。在千金藤素共处理的sh-sy5y细胞,与病毒感染组相比,10μm千金藤素显著降低病毒rna水平(p<0.002,附图3c)。在千金藤素预处理的sh-sy5y细胞,病毒rna水平在5μm千金藤素处理组即显著降低(p <0.05,附图3d)。因此,共处理、预处理两种方式加入的千金藤素均显著降低a549细胞、 sh-sy5y细胞内的病毒rna水平,抑制蜱传脑炎病毒的复制。
[0060]
3.空斑实验检测千金藤素对蜱传脑炎病毒滴度的抑制作用
[0061]
空斑实验检测千金藤素以两种方式处理蜱传脑炎病毒感染a549、sh-sy5y细胞上清中的病毒滴度。以2%羧甲基纤维素钠作为覆盖液,1%结晶紫染色,4%多聚甲醛固定,计数病毒空斑数目,确定病毒滴度。如附图4a-b所示,在千金藤素共处理的a549细胞,20μm千金藤素显著降低细胞上清中病毒滴度(p<0.05)。在千金藤素预处理的a549细胞,10μm千金藤素显著降低细胞上清中病毒滴度(p<0.05)。如附图4c-d所示,在千金藤素共处理的 sh-sy5y细胞,10μm千金藤素显著降低细胞上清中病毒滴度(p<0.001)。在千金藤素预处理的sh-sy5y细胞,5μm千金藤素即显著降低细胞上清中病毒滴度(p<0.005)。结果表明,千金藤素共处理、预处理两种方式均可降低蜱传脑炎病毒感染a549、sh-sy5y细胞上清中的病毒滴度,并且千金藤素通过预处理方式发挥的抑制作用强于共处理方式。千金藤素可抑制蜱传脑炎病毒在易感细胞a549、sh-sy5y内增殖。蜱传脑炎病毒产量的降低与千金藤素处理方式、作用浓度的关系见表3、表4。
[0062]
表3千金藤素对蜱传脑炎病毒在a549细胞增殖的抑制
[0063][0064]
表4千金藤素对蜱传脑炎病毒在sh-sy5y细胞增殖的抑制
[0065]
[0066]
(四)千金藤素在蜱传脑炎病毒感染balb/c小鼠模型上抗病毒作用的评估
[0067]
1.千金藤素对蜱传脑炎病毒感染小鼠的保护作用
[0068]
6周龄雌性balb/c小鼠通过腹腔注射途径接种蜱传脑炎病毒,103pfu/只,每只小鼠注射体积为50μl。千金藤素预处理组小鼠在攻毒前1小时给药,给药途径为腹腔注射,浓度为 25mg/kg,每只小鼠给药体积为200μl,给药当天记为第0天。dmso药物溶剂对照组小鼠经腹腔注射途径接受等体积的dmso溶液。连续给药5天,每次间隔24小时。每日观察小鼠发病情况,称量体重,记录死亡小鼠数量。如附图4a小鼠体重变化示意图,给药后,千金藤素预处理组小鼠体重呈下降趋势;与病毒感染组相比,小鼠体重在前6天显著降低 (p《0.05);自第6天,小鼠体重开始逐渐回升,恢复并超过第0天体重。附图4b为小鼠生存率变化示意图。病毒感染组小鼠第6天开始出现死亡,至第8天全部死亡。千金藤素预处理组小鼠在第7天和第8天各死亡1只,观察至第12天剩余小鼠仍存活(存活率为66.7%)。 dmso组小鼠在第7天出现死亡,第8天全部死亡。与病毒感染组小鼠相比,千金藤素预处理组小鼠生存率显著升高(p《0.005)。结果表明,提前给药的千金藤素降低蜱传脑炎病毒感染balb/c小鼠的死亡率,促进小鼠体重回升,对小鼠具有明显的保护作用。
[0069]
2.千金藤素抑制蜱传脑炎病毒感染小鼠脑、脾组织中病毒抗原的表达
[0070]
balb/c小鼠经腹腔注射途径接种蜱传脑炎病毒(103pfu/只),千金藤素连续给药5天(25 mg/kg),第7天取存活小鼠的脑、脾组织。通过免疫组织化学检测小鼠脑、脾组织中病毒抗原的表达情况。如附图5,结果显示病毒感染组、dmso溶剂对照组小鼠的脑、脾组织中均检测到蜱传脑炎病毒抗原(棕黄色),而在千金藤素预处理组小鼠的脑组织中未检测到病毒抗原,在脾组织中仅检测到极少量的病毒抗原。结果表明,蜱传脑炎病毒感染balb/c小鼠,在鼠脑、脾中复制增殖,而千金藤素明显抑制感染小鼠脑、脾组织中病毒抗原的表达,减弱小鼠体内蜱传脑炎病毒的增殖。
[0071]
上述体外和体内实验结果均表明,千金藤素具有显著的抗蜱传脑炎病毒感染活性,可用于制备抗蜱传脑炎病毒的药物。
[0072]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1