纳米载药系统及其制备方法和应用
1.本发明属于生化技术领域,尤其涉及纳米载药系统及其制备方法和应用。
背景技术:
2.纳米载体是纳米载药系统构成的重要部分,纳米载体负载药物得到0-1000纳米之间的药物制剂,可以通过增强滞留和渗透效应增加药物在肿瘤部位的蓄积,对药物增效减毒;同时增加药物的血液稳定性,避免药物过快被肾脏排泄而延长负载药物的半衰期,以提高药物的生物利用度。
3.目前已有多个用于动物模型的抗炎靶向递送系统的报道,如用透明质酸作为抗炎靶向递送系统,通过使用透明质酸纳米粒来探讨动脉粥样硬化相关的炎症,改善了动脉粥样硬化。又如用红细胞膜和血小板膜包plga来作为抗炎靶向递送系统。由此可见,目前绝大多数的抗炎靶向递送系统采用合成材料,或需要进行化学修饰,工艺相对复杂,在体内参与的生物化学反应和降解产物往往不够明确,这些都是临床转化面临的挑战。因此,对人体健康的潜在风险较大。因此,将利用化学物质改性或缔合的抗炎靶向系统用于人体时,其使用的安全性也是需要重点关注的问题。
4.急性肺损伤(acute lung injury,ali)是各种肺内外致病因素导致的以顽固性的低氧血症和呼吸窘迫为特征的全身炎症反应综合征。急性肺损伤常见的病因有脓毒症、创伤、休克等。脓毒症(sepsis)是其最多见的病因。由于急性肺损伤病因病机复杂,病死率高,目前临床上尚无确切有效的控制病死率的药物。常用的治疗方法有机械通气、β2受体激动剂、抗炎抗氧化、抗凝溶栓、表面活性剂等。肺炎是由于病原体侵犯肺实质,并在肺实质中过度生长超出宿主的防御能力,导致肺泡腔内出现渗出物,引发肺炎。肺炎的发生和严重程度主要由病原体因素和宿主因素之间的平衡决定。
技术实现要素:
5.针对上述问题,本发明提供纳米载药系统及其制备方法和应用,主要为了解决现有抗炎靶向药物的欠缺,以及一些肺部疾病治疗的药物欠缺的问题。
6.为了解决上述问题,本发明采用如下技术方案:
7.hes-ch化合物在制备抗炎靶向药物中的应用,其中hes-ch具有式i所示结构,
[0008][0009]
其中,n在1~100之间。
[0010]
在一些方式中,应用为hes-ch化合物在制备治疗肺部炎症或损伤药物中的应用。
[0011]
在一些方式中,所述肺部炎症或损伤为脓毒症肺部炎症或脓毒症肺部损伤。
[0012]
炎症内皮主动靶向纳米粒的制备方法,
[0013]
获取hes-ch;
[0014]
制取tpca-1@hcnps:
[0015]
在hes-ch溶液中缓慢加入tpca-1的油相溶液,旋蒸,上层清液提取tpca-1@hcnps;
[0016]
制取mab-tpca-1@hcnps:
[0017]
将tpca-1@hcnps溶液与dsc混合,透析,加入pecam-14g6 mab,反应获得mab-tpca-1@hcnps。
[0018]
在一些方式中,制备mab-tpca-1@hcnps时:向tpca-1@hcnps水溶液中加入足量dsc,搅拌过夜,随后透析,再加入pecam-14g6 mab,室温下搅拌反应,得到mab-tpca-1@hcnps纳米粒水溶液。
[0019]
mab-tpca-1@hcnps在制备体外huvec、raw264.7细胞活性抑制剂非诊断治疗中的应用。
[0020]
mab-tpca-1@hcnps在制备抗炎药物中的应用。
[0021]
mab-tpca-1@hcnps在制备肺部靶向治疗药物中的应用。
[0022]
mab-tpca-1@hcnps在制备治疗肺部炎症或损伤药物中的应用。
[0023]
在一些方式中,所述肺部炎症或损伤为脓毒症肺部炎症或脓毒症肺部损伤。
[0024]
在一些方式中,mab-tpca-1@hcnps在肺部炎症或损伤中至少表现为减少肺组织t细胞、巨噬细胞的浸润,减少活性氧生成。
[0025]
式i所示的hes-ch化合物的制备方法,
[0026]
将hes和足量溴丙胺氢溴酸充分共混,加入到naoh溶液中,在恒温油浴搅拌环境下,升温反应,加入浓盐酸,调节酸碱度至中性,除杂,获得hes-nh2;
[0027]
将ch分散于吡啶溶液体系中,并加入丁二酸酐,将混合物升温反应,随后旋蒸,并将沉淀物萃取,获取ch-cooh;
[0028]
将hes-nh2与ch-cooh共同溶解于dmso溶液中,随后加入edci与hobt,升温反应,从而得到hes-ch,所得到的聚合物除杂,纯化得hes-ch。
[0029]
在一些方式中,制备hes-nh2中,升温反应温度为45℃,浓盐酸质量浓度37%;
[0030]
制备ch-cooh中,升温反应温度为70℃,沉淀物通过酒精萃取,丁二酸酐与ch等量加入;
[0031]
制备hes-ch中,升温反应温度为80℃,edci与hobt等量加入。
[0032]
在一些方式中,hes-nh2的合成:将hes和足量溴丙胺氢溴酸充分共混,加入到naoh溶液中,在恒温油浴搅拌环境下,于45℃条件下反应,其后再加入浓盐酸,将酸碱度值滴定调节至7,通过透析袋充分透析除去杂质,最后获得纯化产物即hes-nh2;
[0033]
ch-cooh的合成:将ch分散于吡啶体系中,并加入等量丁二酸酐,将混合物在恒温油浴搅拌环境下,于70℃条件下反应,随后旋蒸,并将沉淀物通过酒精萃取,再次旋蒸去除乙醇,即获得ch-cooh,最后冻干得到ch-cooh粉末;
[0034]
hes-ch的合成:将hes-nh2与ch-cooh粉末共同溶解于dmso溶液中,随后加入edci与hobt,在80℃恒温油浴搅拌环境下反应,从而得到hes-ch,所得到的聚合物置于透析袋中透析过夜,然后将透析后的溶液冻干得到hes-ch粉末。
[0035]
本发明的有益效果是:
[0036]
纳米粒子结构稳定,生物相容性好。提供了一种新的载药纳米粒的制备方法,提供了新的抗炎药物。同时为肺部疾病提供了靶向治疗方式,如解决脓毒症肺损伤的靶向治疗。本发明能显著改善脓毒症肺损伤小鼠肺部病损程度、炎症细胞浸润和活性氧生成。
附图说明
[0037]
图1a为hes-ch材料合成路线示意图;
[0038]
图1b为hes-nh2的化学结构式;
[0039]
图1c为ch-cooh的化学结构式;
[0040]
图1d为hes-ch的化学通式;
[0041]
图1e为mab-tpca-1@hcnps的制备示意图;
[0042]
图1f为tpca-1的化学结构式;
[0043]
图2为mab-tpca-1@hcnps表征结果图;
[0044]
图3为mab-tpca-1@hcnps的药物释放和血液相容性,(a)游离tpca-1和mab-tpca-1@hcnps的药物释放,(b)梯度浓度mab-tpca-1@hcnps与红细胞悬液共孵育2h离心后的普通拍照,(c)红细胞溶血率曲线,(d)普通光学显微镜下的红细胞拍照(标尺为50μm);
[0045]
图4为mab-tpca-1@hcnps具有较好的细胞相容性,(a)和(b)分别系mab-tpca-@hcnps对huvec和raw264.7的毒性评估;
[0046]
图5为体外干预结果图,(a)抗氧化能力评价,(b)抑制巨噬细胞m1极化效果评价,(c)抑制巨噬细胞no产生评价,(d)~(f)分别系对(a)~(c)的统计学分析;
[0047]
图6为体外抗炎效果图,(a)和(b)分别系纳米药物减少巨噬细胞对il-6、tnf-α的分泌;
[0048]
图7为纳米粒能与发炎内皮细胞结合并在巨噬细胞中情况,(a)~(b)分别系mab-c6@hcnps与炎症刺激后huvec和maec结合的激光共聚焦图片(图a和b标尺分别为10μm和20μ
m),(c)mab-tpca-@hcnps在巨噬细胞的时间依赖性入胞监测和共定位分析(标尺为20μm);
[0049]
图8为剂量依赖性入胞及流式定量分析,(a)剂量依赖性入胞监测(标尺为20μm),(b)~(c)流式细胞术分别定量检测时间依赖性和剂量依赖性入胞;
[0050]
图9为药代动力学研究,(a)和(c)分别系dir@hcnps和mab-dir@hcnps的体内药代动力学行为,(b)和(d)分别系对(a)、(c)的荧光定量分析;
[0051]
图10为mab-tpca-1@hcnps在脓毒症ali模型的体内肺脏靶向性研究,(a)不同处理组的体内主要脏器生物分布,(b)对图a的定量和统计学分析,(c)肺组织切片免疫荧光(标尺为200μm);
[0052]
图11-12为纳米药物的药效研究,(a)不同处理组的肺组织切片h&e染色,(b)~(c)分别系t细胞和巨噬细胞的流式细胞术圈门策略,(d)~(e)分别系不同组小鼠肺组织的t细胞和巨噬细胞流式图,(f)不同处理组的肺损伤程度评分,(g)~(h)分别系对图(d)~(e)的统计学分析,(i)不同处理组的肺组织切片活性氧dhe染色荧光图(标尺为200μm);
[0053]
图13为体内生物安全性评估,(a)正常小鼠注入纳米粒后14天内的体重变化,(b)血常规分析,(c)血生化指标变化,(d)经过不同处理小鼠主要脏器的h&e染色(标尺为200μm)。
具体实施方式
[0054]
第一部分介绍hes-ch的新用途:
[0055]
其一,化合物hes-ch在制备抗炎靶向药物中的应用,其中hes-ch具有式i所示结构(如图1d),n在1~100之间。
[0056]
其中,其他在式i基础上通过简单置换基团对化合物进行改变,但并未影响主要性质的也应当等同在本发明范围内。其可制备靶向炎症内皮的药物。在一些方式中,抗炎靶向药物为肺部靶向。
[0057]
hes-ch(两亲性羟乙基淀粉偶联胆固醇聚合物)可采用如cn113105566b中公开的制备方法,也可采用其他可制备方法。
[0058]
hes-ch在药物中,主要作为靶向药物的载体,用于负载药物。hes-ch具有较好的肺部病灶靶向性;尤其具有较好的内皮靶向能力。
[0059]
其二,hes-ch在制备治疗肺部炎症或损伤药物中的应用。
[0060]
肺炎是肺泡、远端气道和肺间质的感染性炎症,可由细菌、病毒和其他病原体等因素感染引起,其中以细菌性和病毒性肺炎最为常见;同时也会由其他病症诱发。
[0061]
其中,在一些情况汇中,肺部炎症或损伤主要为脓毒症诱发的肺部疾病。所述肺部炎症或损伤为脓毒症肺部炎症或脓毒症肺部损伤。人体在脓毒血症状态下免疫力比较低下,容易引起肺部感染。脓毒症肺部损伤主要为脓毒症诱发急性肺损伤。
[0062]
第二部分介绍mab-tpca-1@hcnps纳米粒的制备:
[0063]
纳米粒的制备方法:
[0064]
制取tpca-1@hcnps:在hes-ch溶液中缓慢加入tpca-1的油相溶液,旋蒸,上层清液提取tpca-1@hcnps;
[0065]
制取mab-tpca-1@hcnps:将tpca-1@hcnps溶液与dsc混合,透析,加入pecam-14g6 mab,反应获得mab-tpca-1@hcnps。
[0066]
其中,在一些实例中,制备mab-tpca-1@hcnps时:向tpca-1@hcnps水溶液中加入足量dsc,搅拌过夜,随后透析,再加入pecam-14g6 mab,室温下搅拌反应,得到mab-tpca-1@hcnps纳米粒水溶液;优选的,所述tpca-1@hcnps水溶液浓度为1mg/ml。
[0067]
具体的一些反应物添加比例可参见后续的实施例,在不影响最终结果的前提下,本部分对具体比例不做过多限定。
[0068]
第三部分介绍mab-tpca-1@hcnps的新用途:
[0069]
mab-tpca-1@hcnps纳米粒子。其为前述第二部分制备所得纳米粒。对第二部分所得纳米粒进行分析表征的结果也同样能够表征本部分的mab-tpca-1@hcnps。但不限定其必须采用前述步骤制备。
[0070]
其一,mab-tpca-1@hcnps在制备体外huvec、raw264.7细胞活性抑制剂非诊断治疗中的应用。其主要针对在一些非治疗目的的试剂中的应用,用于调节细胞活性。
[0071]
其二,mab-tpca-1@hcnps在制备抗炎药物中的应用。由于mab-tpca-1@hcnps对炎症刺激后内皮具有靶向调节作用,其可用于抗炎药物中。肺部炎症为其中一种。mab-tpca-1@hcnps在体外实验中也具有相应的抗炎作用,使其也可用于其他病症抗炎药物中。
[0072]
其三,mab-tpca-1@hcnps在制备肺部靶向治疗药物中的应用。
[0073]
其中,作为肺部病灶靶向治疗的药物中,mab-tpca-1@hcnps在制备治疗肺部炎症或损伤药物中的应用。
[0074]
纳米粒具有炎症内皮主动靶向能力,其能够对内皮细胞进行靶向治疗。其能够有效结合炎症刺激后的内皮细胞。
[0075]
更具体的一些应用场景中,所述肺部炎症或损伤为脓毒症肺部炎症或脓毒症肺部损伤;和/或,mab-tpca-1@hcnps在肺部炎症或损伤中至少表现为减少肺组织t细胞、巨噬细胞的浸润,减少活性氧生成中之一。
[0076]
采用羟乙基淀粉和胆固醇偶联合成的两亲性聚合物作为纳米载体,通过包载疏水性抗炎药物tpca-1自组装形成纳米粒,并在表面修饰靶向pecam-1胞外段igd6区断裂点的4g6单克隆抗体构建得到mab-tpca-1@hcnps。
[0077]
mab-tpca-1@hcnps可为第二部分方法制备所得,也可为其他方法制备而得。
[0078]
第四部分结合具体的研究项目做进一步介绍:
[0079]
方案设计
[0080]
(1)通过nmr、ftir、质谱表征和验证两亲性羟乙基淀粉偶联胆固醇聚合(hes-ch)的合成。
[0081]
(2)通过pickering乳溶剂挥发法制备tpca-1@hcnps,以tem、dls、zeta电位、xps表征mab-tpca-1@hcnps。
[0082]
(3)通过dmso破膜法检测mab-tpca-1@hcnps的载药量和包封率;以透析法监测其药物释放行为,并以红细胞溶血实验检测血液相容性。
[0083]
(4)采用腹腔注射lps法建立脓毒症ali模小鼠型。
[0084]
(5)体外实验:通过cck8法检测该纳米粒的细胞毒性;以流式细胞术检测其体外抗氧化能力、对巨噬细胞m1极化和no产生的干预作用;以elisa检测纳米药物干预lps刺激的巨噬细胞分泌tnf-α、il-6水平;通过激光共聚焦显微镜观察其内皮靶向性并监测在巨噬细胞的入胞行为,同时以流式细胞术定量。
[0085]
(6)体内药代动力学研究:构建mab-dir@hcnps纳米粒,注入正常小鼠体内,多个时间点眶后取血,通过小动物活体成像系统检测并定量血液的荧光强度。
[0086]
(7)体内生物分布研究:将mab-dir@hcnps经尾静脉注入模型小鼠体内,12h后取出主要组织,以小动物活体成像系统测定荧光强度;此外,构建mab-c6@hcnps纳米粒,注入模型小鼠体内,通过免疫荧光观察纳米粒在肺内的分布。
[0087]
(8)体内疗效研究:将mab-tpca-1@hcnps注入模型小鼠体内,通过流式细胞仪测定肺组织t细胞和巨噬细胞的浸润程度,以ros组织荧光、h&e染色观察损伤程度。
[0088]
(9)生物安全性评估:将mab-tpca-1@hcnps注入正常小鼠,监测小鼠14天内体重变化,两周后取外周血检测血常规、肝功、肾功等指标,最后通过h&e染色观察主要器官有无形态学改变和损伤。
[0089]
结果说明:
[0090]
(1)两亲性hes-ch聚合物具有良好的自组装行为,能够包载疏水性抗炎药物,并做4g6抗体表面修饰,制备的mab-tpca-1@hcnps有良好稳定性、具有长循环效应、低细胞毒性和良好生物安全性。
[0091]
(2)mab-tpca-1@hcnps能够有效结合pecam-1胞外段断裂点,在体内外具有优异的发炎内皮和炎症肺脏靶向性。
[0092]
(3)mab-tpca-1@hcnps在体内外具有卓越的抗炎能力,可显著改善脓毒症ali模型肺脏的损伤和炎症细胞浸润。
[0093]
实验内容
[0094]
纳米粒子的制备
[0095]
hes-ch的合成及表征:
[0096]
材料合成路线示意图如图1a所示。
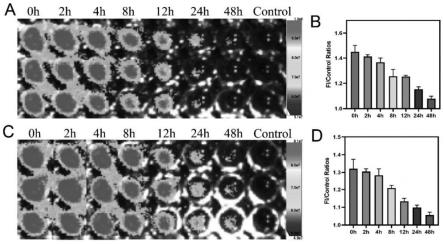
[0097]
聚合物化学合成具体实验步骤如下:
[0098]
(1)hes-nh2的合成:其化学结构式如图1b所示。
[0099]
(2)ch-cooh的合成:其化学结构式如图1c所示。
[0100]
(3)hes-ch的合成:其化学结构式(式i)如图1d所示,其中,n在1~100之间。
[0101]
(4)hes-nh2、ch-cooh、hes-ch的表征验证:
①
核磁共振波谱制样:将hes、hes-nh2、hes-ch粉末分别溶于氘代dmso中,终浓度为1mg/ml,氢谱扫描256次;
②
ftir制样:样品先置于烘箱中充分烘干,取一定量的hes、ch-cooh、hes-nh2、hes-ch分别与溴化钾置于研磨钵中,其中溴化钾的量为样品的两倍,充分研磨使之成为均匀混合的粉末。将粉末均匀铺在压片槽上,通过压片机以200kpa压10s,得到均匀薄片,用刀片平移至上样孔,置于样品池,即开始检测。
[0102]
(5)质谱仪:充分冻干的ch-cooh样品直接上机检测。
[0103]
mab-tpca-1@hcnps的制备及表征
[0104]
纳米粒组装和制备示意图如图1e所示。
[0105]
1)tpca-1@hcnps的组装:将50mg hes-ch溶于50ml去离子水中,使用超声破碎仪超声促溶10min(频率为50hz,超2s,停1s),得到1mg/ml的hes-ch水溶液,随后向该溶液中缓慢滴加5ml tpca-1的油相溶液(1mg/ml,溶于氯仿中),边滴加边用超声破碎仪超声5min,得到乳白色的均匀油/水混合溶液,随后以旋转蒸发仪在45℃条件下充分旋蒸以除去氯仿,其后
将得到的tpca-1@hcnps水溶液离心(5000rpm,10min),弃沉淀,将上清液透析过夜除去未包载的游离tpca-1,随后充分冻干,得到tpca-1@hcnps纳米粒粉末。同样,按照上述方法制备未包载药物的hes-ch nps(hcnps)、dir@hcnps和c6@hcnps纳米粒。其中疏水性tpca-1的化学结构式如图1f所示。
[0106]
2)mab-tpca-1@hcnps的制备:室温条件下,向1mg/ml tpca-1@hcnps水溶液中加入足量dsc,搅拌过夜,随后透析24h,再加入25ug pecam-14g6 mab,室温下搅拌反应3h,最终得到mab-tpca-1@hcnps纳米粒水溶液;同样,按照上述方法制备mab-dir@hcnps和mab-c6@hcnps纳米粒;
[0107]
3)表征实验:将tpca-1@hcnps、mab-tpca-1@hcnps水溶液分别通过激光粒度仪检测其粒径分布和zeta电位,并分别将上述纳米粒分散液,于37℃条件下,在pbs、10%fbs、rmpi1640中放置7天,每天监测mab-tpca-1@hcnps的粒径变化;向铜网上滴一滴tpca-1@hcnps、mab-tpca-1@hcnps溶液并在室温下风干,随后用0.2%(w/w)磷钨酸溶液负染60s,通过tem观察其形貌。
[0108]
4)载药量(dlc)和包封率(ee)测定:配置梯度浓度tpca-1的dmso溶液,浓度分别为125μg/ml、100μg/ml、50μg/ml、25μg/ml、12.5μg/ml,以dmso溶液空白对照,通过hplc得到标曲。随后用dmso对tpca-1@hcnps破膜(静置30min以充分破膜,纳米药物浓度为100μg/ml),得到的样品做hplc检测,并代入标曲,从而获得tpca-1的浓度及质量。
[0109]
dlc=(wt(tpca-1))/(wt(tpca-1@hcnps))
×
100%,
[0110]
ee=(wt(tpca-1))/(wt(total tpca-1))
×
100%,
[0111]
其中wt(tpca-1)为tpca-1@hcnps中tpca-1的质量,wt(tpca-1@hcnps)为tpca-1@hcnps纳米粒的质量,wt(total tpca-1)为制备纳米粒时投入tpca-1的总质量。
[0112]
mab-tpca-1@hcnps纳米粒的药物释放和血液相容性
[0113]
1)药物释放:将3ml mab-tpca-1@hcnps溶液(浓度为1mg/ml)置于分子截留量为10000da的透析袋中,对照组为等体积等量游离tpca-1溶液,分别封好投入含有5ml pbs蓝口瓶中,以pbs为释放介质,在转速为300rpm/min的37℃台式恒温振荡器中孵育24h,在2h、4h、8h、12h、24h各时间点分别取1ml释放介质,并同时向其中添加等量pbs,取出的液体通过hplc检测tpca-1的浓度。
[0114]
2)血液相容性:预先制备好1ml pbs和1%triton x-100溶液,同时以pbs为溶剂,制备一系列等体积(1ml)梯度浓度(5μg/ml、10μg/ml、25μg/ml、50μg/ml、100μg/ml、250μg/ml、500μg/ml)mab-tpca-1@hcnps溶液。
[0115]
通过摘眼球法取bal/bc小鼠外周血,以抗凝管收集,在超净工作台中以pbs缓缓清洗,动作要轻柔,随后以1500rpm/min*10min低速离心,直至上清澄清透明,再吸取红细胞沉淀,轻微振荡,得到均匀分散的红细胞悬浮液。将等体积的红细胞悬液加入上述预先制备好的溶液中,其后在转速为300rpm/min的37℃台式恒温振荡器中充分振荡2h,取出样品离心(1500rpm,10min),拍照,最后吸取上清液通过酶标仪检测血红蛋白吸光度od值,以加入1%triton x-100溶液组作为阳性对照,pbs组作为阴性对照,每个样品设置三个复孔,检测波长为541nm,依照od值,计算红细胞溶血率(hr,hemolysis ratio),其计算公式:
[0116]
[0117]
其中,odt为各实验组od值,odn为pbs阴性对照组od值,odp为1%triton x-100溶液阳性对照组od值。
[0118]
体外细胞实验
[0119]
1)cck8法测定细胞毒性:设置纳米材料各梯度浓度分组:250、200、150、100、50、0μg/ml,同时设置调零孔,每组5个复孔。
[0120]
①
取对数期生长细胞,常规消化细胞,离心细胞收集沉淀;
[0121]
②
用完全细胞培养基重悬细胞,吹打混匀,制成单细胞悬液;
[0122]
③
调整细胞密度为5
×
104/ml;
[0123]
④
每孔种植1
×
104细胞,放入37℃细胞培养箱中孵育24h;
[0124]
⑤
细胞贴壁后,各孔加入梯度浓度mab-tpca-1@hcnps药物(以完全细胞培养基为溶剂);
[0125]
⑥
37℃细胞培养箱中孵育24h后,每孔加入10μl cck8溶液;
[0126]
⑦
37℃细胞培养箱中孵育1~4h后,选择450nm波长通过酶标仪测定od值;
[0127]
⑧
结果分析,细胞相对活性:
[0128]
relative cell viability=(odt-odb)/(odc-odb)
×
100%
[0129]
其中odt为各梯度浓度孔od值,odb为调零孔od值,odc为空白对照组od值。
[0130]
2)体外抗炎能力评价:设置分组:空白对照组、lps组、lps+hcnps组、lps+tpca-1组、lps+tpca-1@hcnps组、lps+mab-tpca-1@hcnps组。取对数期生长raw264.7细胞系,以2
×
105/孔种植于六孔板中,每组三个复孔。孵育过夜,待其贴壁。次日弃细胞培养上清,以pbs润洗,随后加入100ng/ml lps预刺激2h,空白对照组不做任何处理。其后各组加入hcnps、tpca-1(0.02μg/ml)、相当0.02μg/ml tpca-1载药量的tpca-1@hcnps与mab-tpca-1@hcnps,lps组pbs润洗后不加入任何药物。37℃细胞培养箱中孵育24h后,取细胞培养上清,1000
×
g离心10min去除沉淀物,取上清通过elisa检测il-6、il-1β,检测步骤同6-1)。
[0131]
3)体外炎症刺激下抗氧化能力评价:设置分组,空白对照组、lps组、lps+hcnps组、lps+tpca-1组、lps+tpca-1@hcnps组、lps+mab-tpca-1@hcnps组。
[0132]
①
取对数期生长细胞,以2
×
105/孔种植于六孔板中,每组三个复孔。37℃细胞培养箱中孵育过夜。次日加入100ng/ml lps预刺激2h,空白对照组不做任何处理。其后各组加入hcnps、tpca-1、tpca-1@hcnps、mab-tpca-1@hcnps,lps组pbs润洗后加入完全细胞培养基,不加入任何药物;
[0133]
②
稀释dcfh-da(ros荧光探针),致其终浓度为10μmol/l。上述细胞于37℃细胞培养箱中孵育24h后,弃细胞培养上清,随后每孔原位装载探针,加入稀释后的dcfh-da液1ml,37℃细胞培养箱中避光孵育20min;
[0134]
③
避光环境下,将探针稀释液弃掉,用pbs洗涤细胞3次,以充分去除游离在细胞外的dcfh-da探针;
[0135]
④
收集细胞,轻轻吹打混匀,形成单细胞悬液,流式细胞仪上机,以fitc通道检测。
[0136]
4)体外炎症刺激下巨噬细胞no产生干预能力评价:设置分组,空白对照组、lps组、lps+hcnps组、lps+tpca-1组、lps+tpca-1@hcnps组、lps+mab-tpca-1@hcnps组。
[0137]
①
取对数期生长细胞,以2
×
105/孔种植于六孔板中,37℃细胞培养箱中过夜。次日加入100ng/ml lps预刺激2h,空白对照组不做任何处理。其后各组加入hcnps、tpca-1、
tpca-1@hcnps、mab-tpca-1@hcnps,lps组pbs润洗后加入完全细胞培养基,不加入任何药物;
[0138]
②
按照1:1000用稀释液稀释no荧光探针daf-fm da,致其终浓度为10μmol/l。上述细胞于37℃细胞培养箱中孵育24h后,弃细胞培养上清,随后每孔原位装载探针,加入稀释后的daf-fm da液1ml,37℃细胞培养箱中避光孵育20min;
③
避光环境下,将探针稀释液弃掉,用pbs洗涤细胞3次,以充分去除游离在细胞外的daf-fm da探针;
[0139]
④
收集细胞,轻轻吹打混匀,形成单细胞悬液,流式细胞仪上机,以fitc通道检测。
[0140]
5)体外炎症刺激下巨噬细胞m1极化干预能力评价:设置分组:空白对照组、lps组、lps+hcnps组、lps+tpca-1组、lps+tpca-1@hcnps组、lps+mab-tpca-1@hcnps组。
[0141]
①
取对数期生长细胞,以2
×
105/孔种植于六孔板中,37℃细胞培养箱中过夜孵育,以待细胞贴壁。次日以lps预刺激2h(lps浓度为100ng/ml),空白对照组不做任何处理。其后各组加入hcnps、tpca-1、tpca-1@hcnps、mab-tpca-1@hcnps,lps组pbs润洗后加入完全细胞培养基,不加入任何药物;
[0142]
②
24h后用流式管收集细胞,pbs润洗后离心(800rpm,10min)并以重悬为单细胞悬液,每管加入1μl fcr阻断剂,随后放于4℃冰箱中孵育10min;
[0143]
③
每管加入1μl mouse pe-anti-cd80流式抗体,室温下避光孵育30min;
[0144]
④
用pbs洗涤3次后,将离心后重悬得到的单细胞悬液经流式细胞仪上机,通过pe通道检测。
[0145]
6)纳米载药系统靶向能力评价和入胞监测:
[0146]
①
靶向能力评价:设置分组:空白组、lps组。取对数期生长huvec、maec、raw264.7细胞系,分别种植到共聚焦培养皿中,每皿种植1
×
105细胞,37℃细胞培养箱中过夜孵育。次日弃细胞培养上清,lps刺激组加入100ng/ml lps刺激24h,而空白对照组不做处理。24h后,弃上清,并以pbs润洗3次,随后加入20μg/ml mab-c6@hcnps纳米粒,孵育1h,随后pbs润洗三次以去除游离纳米药物,紧接着以多聚甲醛进行固定(15分钟),移除多聚甲醛并加入1ml dapi染色液染色15min,接着移除dapi,pbs漂洗3次,随后通过转盘激光共聚焦显微镜观察;
[0147]
②
入胞行为监测:将raw264.7以1
×
105细胞/皿种植到培养皿中,细胞贴壁后以100ng/ml lps刺激24h,弃上清后加入mab-c6@hcnps溶液。
[0148]
对于激光共聚焦监测入胞实验:a.对于剂量依赖性入胞监测实验,以梯度浓度的纳米药物:100μg/ml、50μg/ml、20μg/ml、10μg/ml、5μg/ml、1μg/ml分别与细胞于共聚焦皿中共孵育1h,随后移除mab-c6@hcnps溶液,pbs漂洗3次,以4%多聚甲醛固定15min,加入dapi染色液染核15min,用pbs漂洗3次,最后通过转盘激光共聚焦显微镜观察;b.对于时间依赖性入胞监测实验,以1μg/ml mab-c6@hcnp溶液分别与细胞于共聚焦皿中共孵育24h、12h、8h、4h、2h、0.5h。按照1:1:3:3:3:3用细胞培养基稀释lyso-tracker red溶酶体红色荧光探针,得到lyso-tracker red工作液,并在37℃细胞培养箱中预温。在每个时间点孵育完毕后,去除细胞培养基,加入lyso-tracker red工作液,随后放于37℃细胞培养箱中孵育30~120min,去除工作液,以pbs漂洗3次,以4%多聚甲醛固定15min,加入dapi染色液染核15min,用pbs漂洗3次,最后通过转盘激光共聚焦显微镜观察。
[0149]
对于流式细胞术检测入胞实验:a.对于剂量依赖性入胞检测,以梯度浓度的纳米
药物:100μg/ml、50μg/ml、20μg/ml、10μg/ml、5μg/ml、1μg/ml分别与细胞于六孔板共孵育1h,随后移除mab-c6@hcnps溶液,pbs漂洗3次,流式细胞仪上机,通过fitc通道检测;b.对于时间依赖性入胞监测实验,以1μg/ml mab-c6@hcnp溶液分别与细胞于共聚焦皿中共孵育24h、12h、8h、4h、2h、0.5h。在每个时间点孵育完毕后,去除细胞培养基,pbs漂洗3次,流式细胞仪上机,通过fitc通道检测。体内药代动力学研究:设置实验分组:dir@hcnps组、mab-dir@hcnps组,每组3只小鼠。其中,dir给药剂量为2mg/kg体重。将相当载药量的dir@hcnps和mab-dir@hcnps溶液分别通过尾静脉注射到正常小鼠体内,于多个时间点:0h、2h、4h、8h、12h、24h、48h眶后取血,每次取50μl铺于96孔板中,最后通过小动物成像仪检测其荧光强度,并做定量分析(dir:ex/em:748/780nm)。
[0150]
体内药代动力学研究
[0151]
设置实验分组:dir@hcnps组、mab-dir@hcnps组,每组3只小鼠。其中,dir给药剂量为2mg/kg体重。将相当载药量的dir@hcnps和mab-dir@hcnps溶液分别通过尾静脉注射到正常小鼠体内,于多个时间点:0h、2h、4h、8h、12h、24h、48h眶后取血,每次取50μl铺于96孔板中,最后通过小动物成像仪检测其荧光强度,并做定量分析(dir:ex/em:748/780nm)。
[0152]
体内生物分布研究
[0153]
(1)通过小动物活体成像仪检测主要组织器官的分布情况:设置实验分组:mab-dir@hcnps脓毒症组、mab-dir@hcnps健康组、isotype igg-dir@hcnps脓毒症组、游离dir脓毒症组。其中,dir给药剂量为2mg/kg体重。以8mg/kg lps腹腔注射入小鼠体内诱导脓毒症ali模型,12h后分别将含等量dir的mab-dir@hcnps、isotype igg-dir@hcnps和游离dir分别经尾静脉注入模型小鼠体内,并将mab-dir@hcnps注入健康小鼠体内,12h后麻醉并解剖小鼠,取出心、肝、脾、肺、肾等脏器,用生理盐水漂洗以冲去表面的血迹,吸水纸吸干表面水渍,最后通过小动物成像仪检测其荧光强度,并做定量分析(dir:ex/em:748/780nm)。
[0154]
(2)通过组织免疫荧光检测纳米粒在肺脏的分布情况:设置实验分组:mab-c6@hcnps脓毒症组、mab-c6@hcnps健康组、isotype igg-c6@hcnps脓毒症组、游离c6脓毒症组。其中,c6给药剂量为2mg/kg体重。以8mg/kg lps腹腔注射入小鼠体内诱导脓毒症ali模型,12h后分别将含等量c6的mab-c6@hcnps、isotype igg-c6@hcnps和游离c6分别经尾静脉注入模型小鼠体内,并将mab-c6@hcnps注入健康小鼠体内,12h后麻醉并解剖小鼠,取出肺脏,用生理盐水漂洗以冲去表面的血迹,吸干水渍并固定,通过组织免疫荧光检测肺组织中的巨噬细胞,同时显微镜下观察纳米粒在炎症肺脏中的分布情况,组织免疫荧光实验步骤同1.1.4.6-(3),其中一抗为anti-cd68抗体。
[0155]
体内疗效研究
[0156]
设置实验分组:健康组、lps+pbs组、lps+hcnps组、lps+tpca-1组、lps+isotype igg-tpca-1@hcnps组、lps+mab-tpca-1@hcnps组,每组5只小鼠。其中,tpca-1给药剂量为1mg/kg。
[0157]
以8mg/kg lps腹腔注射入小鼠体内诱导脓毒症ali模型,健康组小鼠腹腔注入等量pbs,随后即通过尾静脉将相应药物注入各组小鼠体内。12h后通过摘眼球法取小鼠外周血,4℃离心(1000
×
g,10min),取血浆。解剖小鼠,取出其肺组织,以冰冷的pbs漂洗冲去表面残留血迹或杂质,并用吸水纸擦干。从肺脏中剪出一组织块,称重,记录后剪碎,使得碎块尽量的小,便于充分匀浆。将组织放入研磨钵中并加入液氮,快速反复研磨肺组织,再加入
一定量的裂解液(cocktail:pmsf:ripa:=1:1:100),随后放入匀浆机中匀浆(3000rpm,间隔3~4s,重复5次),将肺组织匀浆于4℃离心(13000rpm,10min),取上清。
[0158]
(1)肺组织h&e染色实验步骤同1.2.4-(2),并进行肺组织损伤评分,随机抽取每组小鼠3张肺组织切片,每张切片随机选取3个视野,观察肺泡出血、淤血、肺泡壁增厚和白细胞浸润4种损伤表现,根据损伤程度评分,其中无异常记为0分,轻度记为1分,中度记为2分,重度记为3分,极重度记为4分,所得3次分数的平均值作为该组肺损伤最终评分。
[0159]
(2)流式细胞术检测肺组织炎症细胞浸润情况:
[0160]
1)预先配备组织消化液:每管3ml体系消化液(2.7ml rmpi 1640细胞培养基,0.3ml fbs),加入16mgⅰ型胶原酶和0.25mgdna酶,涡旋振荡以充分溶解。
[0161]
2)取米粒大小肺组织,充分剪碎后置于组织消化液中,随后放入37℃台式恒温振荡器中孵育2h,用40μm滤网过滤3次,得到均匀的单细胞悬液,紧接着加入3倍红细胞裂解液,冰上放置40min,随后离心(450
×
g,10min)弃上清,pbs重悬后每管加入1μl fcr阻断剂,4℃冰箱中孵育10min,随后加入fixable viability stain 780(活死细胞染料),室温避光孵育10min,离心后以pbs洗涤3次。对于巨噬细胞流式检测,分别加入以下流式抗体各1μl:fitc-anti-cd45、pe-anti-cd11b、apc-anti-f4/80;对于t细胞流式检测,分别加入以下流式抗体各1μl:fitc-anti-cd45、apc-anti-cd3。室温下避光孵育30min,随后离心并以pbs洗涤3次,用4%多聚甲醛固定,最后经流式细胞仪上机检测。
[0162]
(3)组织ros荧光试验步骤:
[0163]
1)组织包埋:取在4%多聚甲醛溶液中固定后的小鼠肺脏,以超纯水充分冲洗表面血迹,依次将不同浓度的乙醇(75%乙醇30min、85%乙醇30min、95%乙醇60min、100%乙醇60min 2次)作为脱水剂,脱去组织中的水分,随后将肺脏放在二甲苯中包埋。将组织于60℃温度条件下浸蜡2小时,其后于室温条件下等蜡液表面层凝固,再快速放到冷水中过夜;
[0164]
2)石蜡切片:用切片机将组织蜡块切成薄片,然后将切好后的组织片放入温水中展开烫平,滤纸充分吸干水分后转移到防脱片载玻片中央,置入60℃烘箱中烘干4h;
[0165]
3)脱蜡至水:依次将切片放入二甲苯ⅰ15分钟—二甲苯ⅱ15分钟—二甲苯iii 15分钟—99.57%酒精ⅰ5分钟—99.57%酒精ⅱ5分钟—5%乙醇5分钟—85%乙醇5分钟,蒸馏水冲洗;
[0166]
4)画圈:组化笔在组织周围画圈,并加入dhe染液在37℃避光条件下于孵育40min,甩掉dhe染液,pbs洗涤3次。
[0167]
5)染核:玻片置于pbs中在摇床上振荡5min,重复此洗涤过程3次。切片稍甩干后滴入dapi室温条件下避光孵育一定时间。
[0168]
6)封片:玻片置于pbs中在摇床上振荡5min,重复此洗涤过程3次。加入抗淬灭剂于切片中,从而封片。
[0169]
7)荧光显微镜下观察并扫描采集图像。
[0170]
生物安全性评估
[0171]
设置实验分组:pbs组、纳米材料组,每组各5只小鼠。将200μl 1mg/ml mab-tpca-1@hcnps溶液经尾静脉注入正常bal/bc小鼠体内,对照组注入等量pbs。
[0172]
(1)每隔2天测量一次小鼠体重,连续监测其14天内的体重变化;
[0173]
(2)经摘眼球法取小鼠外周血。对于血常规检测,全血标本取样后置于抗凝管中,
上下颠倒振荡几次使血液与抗凝剂充分混匀,随后经血常规分析仪检测rbc、wbc、plt、hgb、hct等指标。对于血生化检测,全血标本取样后置于促进管中,室温放置2h后离心(3000rpm,15min),取上清,随后经生化分析仪检测alt、ast、alb、bun、crea、urea等指标;
[0174]
(3)解剖小鼠主要脏器做h&e染色,实验步骤同1.2.4-(2),检测有无脏器实质性损伤。
[0175]
实验结果
[0176]
mab-tpca-1@hcnps的表征
[0177]
hes-ch聚合物系hes-nh2和ch-cooh的偶联物,一方面携带有亲水基团hes,另一方面携带疏水亲脂基团ch,在超声充分振荡的氯仿和水混合溶液内的油水(o/w)界面中可发生自组装,形成球形纳米粒。如图2a显示tpca-1@hcnps为相对规则的球形纳米粒,纳米粒粒径在110nm左右,边界清晰,表面光滑。在表面修饰上mab后,其粒径稍微增大,大小在120nm左右,形态为类球形,表面变得相对粗糙,如图2b所示。经激光粒度仪进一步检测,hcnps粒径为99.68
±
2.449nm,pdi为0.2947
±
0.0163,zeta电位值为27.70
±
1.570mv;经包载tpca-1后,粒径为112
±
0.7521nm,pdi值为0.2955
±
0.004324,zeta电位为27.83
±
0.8452mv;进一步在纳米粒表面修饰mab后可见粒径为123.3
±
1.301nm,pdi是0.2902
±
0.004568,zeta电位为19.37
±
0.2186mv,如图2c~e所示。上述结果说明未包载药物的hcnps空载体纳米粒粒径较小,由于hes基团上还有大量氨基残留,所以纳米粒带正电,而在通过pickering乳挥发法包载tpca-1后,其粒径有所增大,纳米粒依旧带正电,zeta电位数值与hcnps相近,表明疏水性药物的包载并不影响其表面电位,最后在表面修饰上mab后,其粒径进一步增大,此时其zeta电位下降幅度较大,与前二者有较显著差异,这是因为dsc在纳米粒表面与部分氨基发生了反应,使得表面氨基数量减少,且mab作为一种蛋白质,所带负电荷对正电荷也有部分中和作用。此外,一般认为多分散系数pdi《3的体系具有均匀的分布,上述三种纳米粒水溶液pdi尚可,说明分布较为均匀一致。纳米粒作为一种载药系统,其稳定性至关重要,紧接着对mab-tpca-1@hcnps分别在pbs、rmpi 1640和10%fbs连续进行稳定性监测,发现在pbs和fbs中在7天内其粒径均未超过130nm,在10%fbs即便有血浆蛋白的吸附中和,粒径仍未超过160nm,这证明该纳米载药系统不易解聚和团聚,具有较好的稳定性,如图2f~h所示。以上通过tem、粒径分布和zeta电位间接证明mab在纳米粒表面的存在,接下来本研究通过xps分别对tpca-1@hcnps、tpca-1@hcnps+mab、tpca-1@hcnps+dsc+mab做全谱xps分析,如图2i~k。抗体作为一种蛋白质,含有较多的n元素。xps全谱图发现相较于tpca-1@hcnps和tpca-1@hcnps+mab,mab-tpca-1@hcnps在n1s处的峰相对较高,证明mab成功偶联到纳米粒表面,而tpca-1@hcnps组未加入抗体,tpca-1@hcnps+mab未加入dsc链桥,故mab均不能偶联上去。此外,如图2l~n,对mab-tpca-1@hcnps中c1s、o1s和n1s做了xps精细谱分析,这验证了mab-tpca-1@hcnps中c、o和n元素的存在。
[0178]
mab-tpca-1@hcnps的具有药物缓释效应和良好的血液相容性
[0179]
本研究通过透析法研究mab-tpca-1@hcnps纳米载药系统的药物释放行为,如图3中a所示,游离tpca-1在24h内累积药物释放率超过80%,而mab-tpca-1@hcnps不到35%,充分证明了纳米载药系统的缓释效应。tpca-1系小分子药物,可以轻易通过透析袋的孔隙,而纳米粒因较大的粒径和分子量不能通过透析袋的孔隙,其中包载的tpca-1只能缓慢释放出来。构建一个有效的纳米载药系统,其生物相容性也是不能忽视的。纳米粒进入外周血后,
与其直接接触的是各类血细胞,故其血液相容性是必须要考察的。如图3b,梯度浓度mab-tpca-1@hcnps与红细胞悬液共孵育2h后,肉眼观察上清依旧很澄清,其颜色接近于pbs阴性对照组,与1%triton x-100最大阳性组形成巨大的反差。同时检测各浓度溶血率,发现即便在500μg/ml的浓度下,其溶血率也不到1%(0.65
±
0.063%),进一步在普通光学显微镜下观察各组红细胞沉淀的形态(如图3中c、d示),可见1%triton x-100最大阳性组的红细胞已破裂殆尽,不见任何红细胞,而hcnps组、mab-tpca-1@hcnps组和pbs组的红细胞依旧具有完整的形态。以上说明,mab-tpca-1@hcnps具有较低的血细胞毒性,有较好的血液相容性。
[0180]
体外细胞实验
[0181]
(1)mab-tpca-1@hcnps具有较好的细胞相容性:如图4中a~b所示,随着纳米药物的浓度增大,内皮细胞系huvec和巨噬细胞系raw264.7细胞活性下降,但即使在最高浓度250μg/ml的条件下,huvec的相对细胞活性为71.23
±
1.388%,raw264.7为77.02
±
3.956%,二者均保持较高的活力,表明该纳米载药系统具有较低的细胞毒性和较好的细胞相容性。
[0182]
(2)mab-tpca-1@hcnps有良好的抗氧化作用:如图5中a、d示,对照组的相对ros产生量为18.77
±
1.255%,经lps刺激后增加至51.13
±
6.709%(p《0.0001),
[0183]
lps+hcnps组为48.63
±
2.170%(p=0.9640),与lps组无明显差异,表明作为纳米载体的hcnps无抗氧化作用。然而在炎症刺激下同时分别经tpca-1、tpca-1@hcnps和mab-tpca-1@hcnps干预后,相对ros产生量分别降低至23.93
±
1.576%(p《0.001)、23.73
±
0.6119(p《0.001)和11.87
±
1.257%(p《0.0001),这说明与游离tpca-1相比,经纳米载体包载后依旧保留有强大的抗氧化作用,而且经过mab表面修饰的纳米药物有更强的效果,这可能与pecam-1胞外段断裂点的结合更有利于促进纳米粒入胞有关。
[0184]
(3)mab-tpca-1@hcnps能有效抑制炎症刺激下巨噬细胞m1极化:如图5中b、e所示,对照组巨噬细胞m1型极化比例仅为49.27
±
1.317%,而经lps刺激后增至91.30
±
1.457%,lps+hcnps组m1型占比为85.73
±
1.417%(p=0.2070),与
±
而加入tpca-1、tpca-1@hcnps和mab-tpca-1@hcnps干预后m1型占比明显降低,分别降低达59.17
±
2.034%、57.03
±
3.309%和60.20
±
0.6658%,p值均《0.0001,与lps组相比具有显著性差异。因此,游离tpca-1和经纳米载体包载后均能强烈抑制巨噬细胞在炎症刺激下的m1极化。
[0185]
(4)mab-tpca-@hcnps能抑制炎症刺激下巨噬细胞产生no:如图5中c、f所示,对照组的相对no产生量仅为6.240
±
0.5327%,而经lps刺激后升高达20.37
±
4.161,同样经hcnps干预并无疗效(19.97
±
2.038%),在经过tpca-1、tpca-1@hcnps和mab-tpca-1@hcnps处理后分别降至11.24
±
1.335%、11.10
±
1.429%和10.77
±
1.886%,p值均《0.05。以上结果表明mab-tpca-1@hcnps具有抑制炎症刺激下巨噬细胞生成no的效果。
[0186]
(5)mab-tpca-@hcnps能有效抑制炎症刺激下巨噬细胞分泌il-6和tnf-α:如图6中a、b示,对照组的il-6和tnf-α分泌量分别为48.65
±
4.772pg/ml和504.20
±
18.60pg/ml,经lps刺激后明显升高达153.30
±
6.143pg/ml和1038
±
73.68pg/ml,而lps+hcnps组没有疗效(170.40
±
9.383pg/ml和1014
±
51.86pg/ml,p值分别为0.4136和0.9988),通过tpca-1、tpca-1@hcnps和mab-tpca-1@hcnps干预后il-6和tnf-α浓度降低,分别是68.04
±
8.303pg/ml(p《0.0001)和685.70
±
38.34pg/ml(p《0.01)、64.17
±
9.334pg/ml(p《0.0001)和662.20
±
66.45pg/ml(p《0.001)、54.27
±
6.913pg/ml(p《0.0001)和611.10
±
18.15(p《0.001)。因此,mab-tpca-1@hcnps能有效抑制巨噬细胞在炎症刺激下分泌促炎型细胞因子。
[0187]
(6)mab-tpca-1@hcnps能有效结合炎症刺激后的内皮细胞:如图7中a~b,在两种内皮细胞系huvec和maec中,与对照组相比,经lps刺激后,mab-c6@hcnps与细胞结合明显增强,发出强烈的绿色荧光,且经足量4g6 mab阻断后显示绿色荧光减弱。以上充分证明了mab-tpca-1@hcnps的内皮靶向能力。而对照组和阻断组也有一定程度的绿色荧光,可能系pecam-1胞外段自发断裂导致结合位点的暴露以及内皮细胞内吞作用引起的低剂量摄取。
[0188]
(7)mab-tpca-1@hcnps呈时间和剂量依赖性入胞,且在8h开始发生溶酶体逃逸:如图7中c示,在lps刺激后,随着时间推移,细胞绿色荧光逐渐增强,显示巨噬细胞对mab-c6@hcnps的摄取逐渐增多,其摄取具有时间依赖性。此外,绿色荧光与溶酶体探针的红色荧光具有较大的重叠程度(pearson相关系数均》0),说明细胞通过经典的内体途径摄取mab-c6@hcnps。利用image j分析绿色和红色荧光的共定位,发现在8h前pearson相关系数逐渐增大至0.8356,随后又逐渐减小,提示mab-c6@hcnps经细胞摄取在8h与溶酶体存在最大的共定位程度,随后纳米粒又从溶酶体中逐渐迁移转出,即巨噬细胞在8h开始发生溶酶体逃逸。进一步地,在相同孵育时间内,随着纳米药物浓度的增多,细胞绿色荧光不断增强,提示其摄取具有剂量依赖性,如图8a示。最后通过流式细胞术定量巨噬细胞对纳米药物的时间和剂量依赖性摄取,其趋势与上述共聚焦图片一致,如图8中b~c。
[0189]
mab-tpca-1@hcnps在体内具有长循环效应
[0190]
如图9中a~b所示,随着时间推移,dir@hcnps的荧光强度逐渐减弱,到达48h时几乎消失殆尽。在表面修饰mab后,mab-dir@hcnps具有与dir@hcnps相似的药代动力学效应,如图9中c~d示。该纳米载药系统在正常小鼠体内能够循环48h,2天后其外周血还残留极少量药物,说明其在外周血具有良好的长循环效应。
[0191]
mab-tpca-1@hcnps在脓毒症ali小鼠体内具有良好的肺脏靶向性
[0192]
mab-tpca-1@hcnps作为一个药物递送系统,其病灶靶向性极其重要。如图10中a~b所示,与健康小鼠相比,mab-dir@hcnps在肺脏中有明显程度的富集(p《0.0001),发出强烈的荧光,此外肝脏和脾脏中的荧光也有所增强,而缺乏炎症内皮细胞靶向性的isotype igg-dir@hcnps在脓毒症肺脏中只有轻微积聚(p《0.05)。游离dir既无mab的靶向性,又无纳米载体的递送,因而在炎症肺脏中的荧光程度较弱(p《0.01)。以上各组中,心脏和肾脏的荧光均较弱,这可能系其组织致密,在炎症刺激下内皮损伤和渗漏较轻有关。组织免疫荧光与以上体内分布的结果类似,如图10中c。综上可知,mab-tpca-1@hcnps具有优异的炎症肺脏靶向性。
[0193]
mab-tpca-1@hcnps能有效减轻脓毒症ali小鼠的肺脏炎症和损伤
[0194]
纳米粒在靶向病灶的同时,也能作为载体进行药物递送,发挥疗效。如图11-12中a、f所示,与lps组相比,lps+mab-tpca-1@hcnps组肺脏血栓形成和淤血明显改善、炎症细胞的浸润明显减少、小鼠肺泡壁和肺泡间隔变薄,肺间质肿胀程度减轻,肺损伤评分显著降低(lps.vs lps+mab-tpca-1@hcnps15.00
±
0.5477.vs.5.20
±
0.3742)。游离tpca-1和igg-tpca-1@hcnps也能改善炎症和损伤程度,但效果有限(肺损伤评分:lps.vs.tpca-1:15.00
±
0.5477.vs.10.60
±
0.5099,lps.vs.igg-tpca-1@hcnps:15.00
±
0.5477.vs.8.20
±
0.3742)。在主动靶向效应的加持下,mab-tpca-1@hcnps干预的效果较igg-tpca-1@hcnps和
tpca-1更佳(mab-tpca-1@hcnps.vs.igg-tpca-1@hcnps:5.20
±
0.3742.vs.8.20
±
0.3742,mab-tpca-1@hcnps.vs.tpca-1:5.20
±
0.3742.vs.10.60
±
0.5099)。
[0195]
进一步通过流式细胞术定量研究肺组织中t细胞和巨噬细胞的浸润情况,如图11中b~e、图12中g~h所示。本研究发现,与lps组相比,经干预后,mab-tpca-1@hcnps能显著减少脓毒症ali小鼠肺组织t细胞和巨噬细胞的浸润(t细胞:lps.vs.lps+mab-tpca-1@hcnps:32.67
±
2.356%.vs.7.933
±
0.2612%,巨噬细胞:lps+mab-tpca-1@hcnps:53.27
±
2.817%.vs.21.53%
±
0.8762%)。而游离tpca-1和igg-tpca-1@hcnps也有所改善,但效果不及mab-tpca-1@hcnps(t细胞:lps.vs.tpca-1:32.67
±
2.356%.vs.18.33
±
0.7219%,lps.vs.igg-tpca-1@hcnps:tpca-1:32.67
±
2.356%.vs.14.37
±
0.2603%,巨噬细胞:lps.vs.tpca-1:53.27
±
2.817%.vs.42.70
±
0.4509%,lps.vs.igg-tpca-1@hcnps:tpca-1:53.27
±
2.817%.vs.32.17
±
1.288%)。此外,如图12中i示,不同处理组肺组织切片ros荧光表明,经mab-tpca-1@hcnps处理后,与lps组相比,其荧光强度明显降低,证明ros生成显著减少,tpca-1组和igg-tpca-1@hcnps有所降低,但效果一般。
[0196]
mab-tpca-1@hcnps具有良好的生物相容性和安全性
[0197]
本研究对mab-tpca-1@hcnps的体内生物安全性也做了系统性评估。如图13中a所示,纳米粒注入正常小鼠体内14内的体重变化曲线与pbs对照组基本上无差异,14天后二者体重均有略微增加,说明该纳米药物对正常小鼠没有系统性毒性。此外,血常规(rbc、wbc、plt、hgb和hct)和血生化(ast、alt、alb、bun、crea和urea)等检测指标也都在正常范围内,提示mab-tpca-1@hcnps不存在毒副作用,如图13中b、c示。同样,对两组小鼠的主要脏器(心、肝、脾、肺和肾)做了h&e染色以研究其潜在毒性,结果显示各脏器均表现为正常形态,显微镜下没有发现任何实质性损伤,如图13中d。总之,这些初步数据提示mab-tpca-1@hcnps对正常小鼠并无毒性反应,具有优异的生物相容性。
[0198]
本领域的技术人员可以明确,在不脱离本发明的总体精神以及构思的情形下,可以做出对于以上实施例的各种变型。其均落入本发明的保护范围之内。本发明的保护方案以本发明所附的权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1