一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒及其制备方法和应用
1.本发明属于心血管疾病治疗技术领域,具体涉及一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒及其制备方法和应用。
背景技术:
2.免疫细胞治疗是治疗肿瘤的新兴技术之一,其在心血管疾病治疗上也有所建树。动脉粥样硬化是导致心血管疾病发生的根本原因,它是一个复杂的慢性炎症反应,其中巨噬细胞在整个粥样斑块的形成、发展和破裂阶段发挥着中心作用,被认为是治疗动脉粥样硬化、促进血管组织修复的关键靶点。
3.透明质酸(ha)是一种聚阴离子酸性粘多糖,同样也具有较好的生物相容性,在医药领域中具有治疗关节炎症、促进伤口愈合等功能。壳聚糖(cs)是一种具有较好抗菌性和生物相容性的天然阳离子多糖,目前已广泛应用在生物医学领域,如手术缝合线、药物控释载体等。但是天然的壳聚糖在中性水溶液中溶解性较差,仅在酸性环境下才能达到完全溶解,此外透明质酸和壳聚糖结合后的稳定性也有待提高。
4.微图案加工技术在推动光学、生物医学、微电子等领域的发展发挥着关键作用,光刻是微图案加工技术中常用的一种方法,其构建的图案精度可达纳米级别。但是,光刻存在成本高、无法在非平面的表面进行图案构建以及对感光材料光刻胶的依赖性等缺点,因此对于构建精度不是特别高的微米级图案来说,需要一种使用光刻原理的技术。
技术实现要素:
5.针对上述现有技术,本发明提供一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒及其制备方法和应用,以提供一种粘附性、抗氧化性和稳定性强的可合理调控血管病变部位巨噬细胞来控制动脉粥样硬化的进程,进而治疗动脉粥样硬化、促进血管组织的修复和重塑的载药材料。
6.为了达到上述目的,本发明所采用的技术方案是:提供一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒的制备方法,包括以下步骤:将邻苯二酚改性透明质酸和邻苯二酚改性壳聚糖依次层层组装在pdms模版上,再通过微接触印刷法获取圆盘颗粒,其后与spm共培养,即得。
7.天然的壳聚糖在中性水溶液中溶解性较差,仅在酸性环境下才能达到完全溶解,邻苯二酚基团接枝在壳聚糖上可显著提高壳聚糖的在中性ph下的水溶性。邻苯二酚基团接枝后材料的粘附性和抗氧化性得到提高,使材料结合稳定性提高。
8.透明质酸为阴离子聚合物,而壳聚糖为阳离子聚合物,二者可通过分子间静电作用结合,加之二者良好的生物相容性,因此可作为在pdms模板上层层自组装构建圆盘颗粒的材料。对透明质酸和壳聚糖进行邻苯二酚基团接枝改性,可提高接枝后材料的粘附性和抗氧化性。利用改性后的透明质酸和壳聚糖通过光刻技术、层层自组装技术和微接触印刷
技术制成圆盘颗粒,载药spm(促炎症消退介质)后可合理调控血管病变部位巨噬细胞来控制动脉粥样硬化的进程,进而治疗动脉粥样硬化、促进血管组织的修复和重塑。
9.在上述技术方案的基础上,本发明还可以做如下改进。
10.进一步,邻苯二酚改性透明质酸由以下步骤制得:
11.(1)将一水吗啉乙磺酸溶于水中,再加入透明质酸,其后调节ph至4~6,得混合液一;
12.(2)将碳二亚胺加入水与无水乙醇混合液中,再将所得溶液和n-羟基琥珀酰亚胺加入混合液一中反应25~35min,得混合液二;
13.(3)将多巴胺加入混合液二中,再调节溶液ph至4~6,其后搅拌反应4h以上,得混合液三;
14.(4)将混合液三装入分子量为12000da的透析袋中,在ph为5~6的水中透析70~75h,其后冷冻干燥,即得。
15.进一步,邻苯二酚改性壳聚糖由以下步骤制得:
16.(1)将壳聚糖加入水中,再加入浓盐酸搅拌至完全溶解,其后调节ph至4~6,再加入二羟丙酰苷的水溶液,得混合液一;
17.(2)将水与无水乙醇按体积比1:1混合后,将碳二亚胺加入其中,再将所得溶液加入混合液一中,再于室温下搅拌4h以上,期间调节ph至4~6,得混合液二;
18.(3)将混合液二装入分子量为12000da的透析袋中,在ph为5~6的水中透析70~75h,其后冷冻干燥,即得。
19.进一步,层层组装包括以下步骤:将pdms模板切成1cm
×
1cm的小块,放入邻苯二酚改性透明质酸的水溶液中,其后取出放入水中浸泡,再放入邻苯二酚改性壳聚糖的水溶液中,其后取出放入水中浸泡,重复以上操作流程5次,得组装了5层邻苯二酚改性透明质酸/邻苯二酚改性壳聚糖结构的pdms模板,其后置于稳定气流下8~12min,再于35~40℃干燥08~1.2h。
20.进一步,pdms模版由以下步骤制得:
21.(1)将晶圆旋涂上光刻胶,再将掩模板放置在晶圆上方,其后曝光10s,再用naoh溶液显影,得图案化晶圆;
22.(2)将pdms与交联剂混合后,倒入图案化晶圆上固化1.5~2.5h,待恢复至室温时剥离pdms模版,再将pdms模版置于氧等离子系统中进行亲疏水改性,功率调节为300~400w,真空度调节为150~250mpa,改性时间为4~6min,即得。
23.进一步,微接触印刷法包括以下步骤:将盖玻片带有pva薄膜的一面放在45~65℃的ro水上方2厘米处,随后拿下并迅速将pdms模板图案面放置在pva薄膜上,施加10~40g/cm2压强10~40s后,将pdms模板从pva薄膜上方揭下,得圆盘颗粒。
24.进一步,spm浓度为50~100nmol/l。
25.本发明还提供了上述制备方法制得的具有粘附及调控巨噬细胞功能的载药圆盘颗粒。
26.进一步,载药圆盘颗粒直径和厚度分别为10μm和200-300nm。
27.本发明还提供了上述具有粘附及调控巨噬细胞功能的载药圆盘颗粒在制备促进血管组织修复和重塑药物中的应用。
ha),分别用50ml ro水溶解,在24孔细胞孔板中分别加入c-ha溶液、c-cs溶液和ro水;pdms模板切成1cm
×
1cm的小块,在每个装有c-ha溶液的孔中放入1个pdms模板,并于15min后取出,并放入ro水中1min以除去沉积不牢固的c-ha,再将pdms模板放入c-cs溶液中15min,然后在ro水中浸泡1min,重复以上操作流程5次,得组装了5层c-ha/c-cs结构pdms模板,其后置于稳定气流下10min,再放入37℃烘箱中1h除去表面的水分;
46.(4)在盖玻片表面涂抹一层3wt%的pva水溶液,并于70℃烘干15min,得带有pva薄膜的盖玻片,将盖玻片带有pva薄膜的一面放在55℃ro水上方2厘米处,随后拿下并迅速将pdms模板图案面放置在pva薄膜上,并施加20g/cm2压强20s后,将pdms模板从pva薄膜上方揭下,得圆盘颗粒,其后与75nmol/l spm共培养,即得;
47.其中,c-ha由以下步骤制得:
48.(1)将0.97g一水吗啉乙磺酸(mes)溶于ro水中,再加入1g透明质酸(ha),其后调节ph至5,得混合液一;
49.(2)将10ml ro水与10ml无水乙醇混合后,将0.39g碳二亚胺(edc)加入其中,再将所得溶液和0.29g n-羟基琥珀酰亚胺(nhs)加入混合液一中反应30min,得混合液二;
50.(3)将0.47g多巴胺(dopa)加入混合液二中,再调节溶液ph至5,其后搅拌反应4h,得混合液三;
51.(4)将混合液三装入分子量为12000da的透析袋中,在ph为5.5的ro水中透析72h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
52.其中,c-cs由以下步骤制得:
53.(1)将0.5g壳聚糖加入25ml ro水中,再以每次20μl的剂量加入浓盐酸并搅拌至壳聚糖完全溶解,其后将1mol/l的naoh溶液逐滴加入其中至ph为5,再加入二羟丙酰苷(dhpa)的水溶液(将0.59g dhpa溶于3ml ro水中),得混合液一;
54.(2)将10ml水与10ml无水乙醇混合后,将0.623g碳二亚胺(edc)加入其中,12min后,再将所得溶液逐滴加入混合液一中,再于室温下搅拌4h,期间用1mol/l的hcl和1mol/l的naoh调节ph至5,得混合液二;
55.(3)将混合液二装入分子量为12000da的透析袋中,在ph为5.5的ro水中透析72h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
56.其中,3wt%的pva水溶液由以下步骤制得:将3g pva颗粒加入100ml ro水中,再置于70℃油浴加热磁力搅拌器中溶解,温度达70℃后反应2小时使pva完全溶解,即得。
57.实施例2
58.一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒的制备,其制备方法包括以下步骤:
59.(1)将晶圆依次用丙酮、无水乙醇和ro水超声清洗5min,其后于120℃干燥2h,再放置在匀胶机上,抽真空并打开吸附按钮将晶圆固定在台面上;用吸管吸取光刻胶并均匀滴加在晶圆中心处,打开匀胶机并将转速调至500r/min,于500r/min运行18s后,将台式匀胶机的转速调节至2000r/min,并在此转速下运行60s,其后于90℃干燥20min,再打开光刻机的汞灯并预热10min,再将晶圆放置光刻机托盘处,并打开“吸片”功能,将掩模板放置在晶圆上方,光刻机设置曝光时间为10s,完成曝光后使用5g/l的naoh溶液显影,再用ro水清洗后,于120℃干燥20min进行坚膜,制得图案化晶圆;
60.(2)将pdms与交联剂2-(二甲氨基丙基)-乙基碳二亚胺盐酸盐按体积比1:1搅拌混合后,倒入底部放有图案化晶圆的培养皿中固化1.5h,待恢复至室温时用小刀剥离pdms模版,再将pdms模板置于氧等离子系统中进行亲疏水改性,功率调节为300w,真空度调节为150mpa,改性时间为6min;
61.(3)称取100mg邻苯二酚改性壳聚糖(c-cs)和100mg邻苯二酚改性透明质酸(c-ha),分别用50ml ro水溶解,在24孔细胞孔板中分别加入c-ha溶液、c-cs溶液和ro水;pdms模板切成1cm
×
1cm的小块,在每个装有c-ha溶液的孔中放入1个pdms模板,并于15min后取出,并放入ro水中1min以除去沉积不牢固的c-ha,再将pdms模板放入c-cs溶液中15min,然后在ro水中浸泡1min,重复以上操作流程5次,得组装了5层c-ha/c-cs结构pdms模板,其后置于稳定气流下8min,再放入35℃烘箱中1.2h除去表面的水分;
62.(4)在盖玻片表面涂抹一层3wt%的pva水溶液,并于70℃烘干15min,得带有pva薄膜的盖玻片,将盖玻片带有pva薄膜的一面放在45℃ro水上方2厘米处,随后拿下并迅速将pdms模板图案面放置在pva薄膜上,并施加10g/cm2压强40s后,将pdms模板从pva薄膜上方揭下,得圆盘颗粒,其后与50nmol/l spm共培养,即得;
63.其中,c-ha由以下步骤制得:
64.(1)将0.97g一水吗啉乙磺酸(mes)溶于ro水中,再加入1g透明质酸(ha),其后调节ph至4,得混合液一;
65.(2)将10ml ro水与10ml无水乙醇混合后,将0.39g碳二亚胺(edc)加入其中,再将所得溶液和0.29g n-羟基琥珀酰亚胺(nhs)加入混合液一中反应25min,得混合液二;
66.(3)将0.47g多巴胺(dopa)加入混合液二中,再调节溶液ph至4,其后搅拌反应4.2h,得混合液三;
67.(4)将混合液三装入分子量为12000da的透析袋中,在ph为5的ro水中透析75h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
68.其中,c-cs由以下步骤制得:
69.(1)将0.5g壳聚糖加入25ml ro水中,再以每次20μl的剂量加入浓盐酸并搅拌至壳聚糖完全溶解,其后将1mol/l的naoh溶液逐滴加入其中至ph为4,再加入二羟丙酰苷(dhpa)的水溶液(将0.59g dhpa溶于3ml ro水中),得混合液一;
70.(2)将10ml水与10ml无水乙醇混合后,将0.623g碳二亚胺(edc)加入其中,10min后,再将所得溶液逐滴加入混合液一中,再于室温下搅拌4.2h,期间用1mol/l的hcl和1mol/l的naoh调节ph至4,得混合液二;
71.(3)将混合液二装入分子量为12000da的透析袋中,在ph为5的ro水中透析75h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
72.其中,3wt%的pva水溶液由以下步骤制得:将3g pva颗粒加入100ml ro水中,再置于70℃油浴加热磁力搅拌器中溶解,温度达70℃后反应2小时使pva完全溶解,即得。
73.实施例3
74.一种具有粘附及调控巨噬细胞功能的载药圆盘颗粒的制备,其制备方法包括以下步骤:
75.(1)将晶圆依次用丙酮、无水乙醇和ro水超声清洗5min,其后于120℃干燥2h,再放置在匀胶机上,抽真空并打开吸附按钮将晶圆固定在台面上;用吸管吸取光刻胶并均匀滴
加在晶圆中心处,打开匀胶机并将转速调至500r/min,于500r/min运行18s后,将台式匀胶机的转速调节至2000r/min,并在此转速下运行60s,其后于90℃干燥20min,再打开光刻机的汞灯并预热10min,再将晶圆放置光刻机托盘处,并打开“吸片”功能,将掩模板放置在晶圆上方,光刻机设置曝光时间为10s,完成曝光后使用5g/l的naoh溶液显影,再用ro水清洗后,于120℃干燥20min进行坚膜,制得图案化晶圆;
76.(2)将pdms与交联剂2-(二甲氨基丙基)-乙基碳二亚胺盐酸盐按体积比1:1搅拌混合后,倒入底部放有图案化晶圆的培养皿中固化2.5h,待恢复至室温时用小刀剥离pdms模版,再将pdms模板置于氧等离子系统中进行亲疏水改性,功率调节为400w,真空度调节为250mpa,改性时间为4min;
77.(3)称取100mg邻苯二酚改性壳聚糖(c-cs)和100mg邻苯二酚改性透明质酸(c-ha),分别用50ml ro水溶解,在24孔细胞孔板中分别加入c-ha溶液、c-cs溶液和ro水;pdms模板切成1cm
×
1cm的小块,在每个装有c-ha溶液的孔中放入1个pdms模板,并于15min后取出,并放入ro水中1min以除去沉积不牢固的c-ha,再将pdms模板放入c-cs溶液中15min,然后在ro水中浸泡1min,重复以上操作流程5次,得组装了5层c-ha/c-cs结构pdms模板,其后置于稳定气流下12min,再放入40℃烘箱中0.8h除去表面的水分;
78.(4)在盖玻片表面涂抹一层3wt%的pva水溶液,并于70℃烘干15min,得带有pva薄膜的盖玻片,将盖玻片带有pva薄膜的一面放在65℃ro水上方2厘米处,随后拿下并迅速将pdms模板图案面放置在pva薄膜上,并施加40g/cm2压强10s后,将pdms模板从pva薄膜上方揭下,得圆盘颗粒,其后与100nmol/l spm共培养,即得;
79.其中,c-ha由以下步骤制得:
80.(1)将0.97g一水吗啉乙磺酸(mes)溶于ro水中,再加入1g透明质酸(ha),其后调节ph至6,得混合液一;
81.(2)将10ml ro水与10ml无水乙醇混合后,将0.39g碳二亚胺(edc)加入其中,再将所得溶液和0.29g n-羟基琥珀酰亚胺(nhs)加入混合液一中反应35min,得混合液二;
82.(3)将0.47g多巴胺(dopa)加入混合液二中,再调节溶液ph至6,其后搅拌反应4.5h,得混合液三;
83.(4)将混合液三装入分子量为12000da的透析袋中,在ph为6的ro水中透析70h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
84.其中,c-cs由以下步骤制得:
85.(1)将0.5g壳聚糖加入25ml ro水中,再以每次20μl的剂量加入浓盐酸并搅拌至壳聚糖完全溶解,其后将1mol/l的naoh溶液逐滴加入其中至ph为6,再加入二羟丙酰苷(dhpa)的水溶液(将0.59g dhpa溶于3ml ro水中),得混合液一;
86.(2)将10ml水与10ml无水乙醇混合后,将0.623g碳二亚胺(edc)加入其中,10min后,再将所得溶液逐滴加入混合液一中,再于室温下搅拌4.5h,期间用1mol/l的hcl和1mol/l的naoh调节ph至6,得混合液二;
87.(3)将混合液二装入分子量为12000da的透析袋中,在ph为6的ro水中透析70h,期间每隔8h更换水溶液一次,其后冷冻干燥,即得;
88.其中,3wt%的pva水溶液由以下步骤制得:将3g pva颗粒加入100ml ro水中,再置于70℃油浴加热磁力搅拌器中溶解,温度达70℃后反应2小时使pva完全溶解,即得。
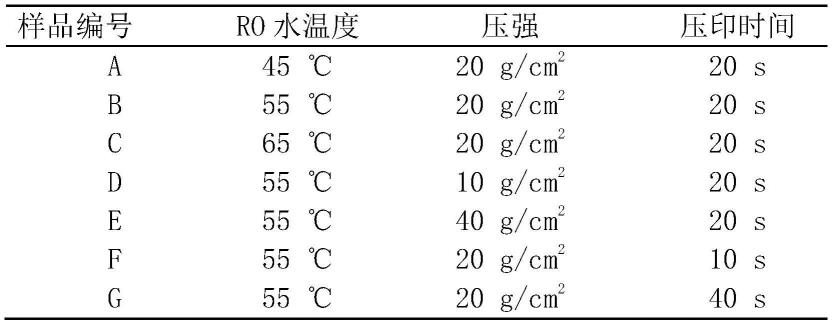
89.微接触印刷的效果由穿过pva薄膜水蒸气的温度、微接触印刷时的压强以及压印的时间共同决定,为了保证圆盘颗粒的完整性因此需要对微接触印刷最佳工艺进行探索,具体探索方案如表1所示,效果见图1。
90.表1微接触印刷最佳工艺探索方案
[0091][0092]
图2为改性壳聚糖的核磁共振氢谱图,图中位于4.79ppm的特征峰为溶剂重水(d2o),b点(3.1ppm)的峰为壳聚糖c-2的质子特征峰,c点(2.1ppm)为未完成脱乙酰化甲基(-o=ch3)的氢质子特征峰,a点(6.6-6.8ppm)为苯环上的氢质子特征峰;未进行邻苯二酚基团接枝改性的壳聚糖在6.6-6.8ppm处是不存在特征峰。
[0093]
图3为改性透明质酸的核磁共振氢谱图,图中位于4.79ppm的特征峰为溶剂重水(d2o),c点(3.3ppm)的峰为壳聚糖c-2的质子特征峰,位于2.1附近的峰为未完成脱乙酰化甲基(-o=ch3)的氢质子特征峰,a点(6.6-6.8ppm)为苯环上的氢质子特征峰,3.35ppm附近的峰为多巴胺上的烷基c上的氢质子特征峰。
[0094]
图4为圆盘颗粒在sem观察下的结果,由于冷冻干燥对圆盘颗粒结构中水分的流失影响造成其表面相对不平整。冷冻干燥过程中当圆盘颗粒以圆盘方向正面向上放置时,其形貌为较为规整的圆形,如图4(a)所示;但在冷冻干燥过程中,圆盘颗粒以其他方向的放置时,会导致圆盘颗粒发生折叠、卷曲的情况,其sem形貌为非规则圆形,如图4(b)所示。
[0095]
zeta电位是用来分析体系中粒子分散稳定性的重要指标,带电粒子对分散体系中带有相反电荷粒子具有一定的吸引作用,zeta电位对这种相互排斥或者吸引力进行测量;本实验通过malvern zen3690测量圆盘颗粒分散溶液的zeta电位,评价圆盘颗粒在ro水溶液中的分散稳定性。图5(a)为分散在ro水中的圆盘颗粒荧光显微镜及光学显微镜下的观察结果;从图中可观察到一些圆盘颗粒的尺寸小于10μm,推测第一种原因是由于圆盘颗粒在水溶液中由于形状呈现为圆盘状而出现的部分折叠、弯曲导致;第二种原因是圆盘颗粒在溶液中分散后圆盘面的方向不一,导致从光学显微镜观察方向看到的大小不同。图5(b)为圆盘颗粒分散体系的zeta电位结果,平均zeta电位的绝对值为13mv,表明分散体系相对稳定,由于圆盘颗粒外层为聚阴离子聚合物邻苯二酚改性透明质酸,因此zeta电位呈现为负值。
[0096]
本发明通过qcm-d实时监测c-cs和c-ha层层自组装的过程,通过f值和d值的变化评价组装结构的稳定性。耗散型石英晶体微天平分析仪(qcm-d)是一种可用于实时分析表面分子相互作用的高灵敏度仪器,它通过实时监测模块中石英金片表面振动频率产生的变化,经石英基体传感器获得共振频率δf和耗散值δd,从而对样品的质量和结构进行分析,
其中δf值与样品质量相关,δd值与样品硬度相关。具体实验方法如下:
[0097]
(1)石英金片使用前需进行清洗,清洗液以氨水、过氧化氢、ro水在体积比为1:1:5进行配置,将石英金片置于上述混合溶液中并升温至75℃,20分钟后取出并用ro水超声清洗5分钟。
[0098]
(2)将清洗完成的石英金片放入qcm-d模块中,将模块安装在模块载物台上并连接进出样导管,打开仪器和电脑,以ro水为溶剂开始跑平基线。
[0099]
(3)待基线跑平后,将进样管放入c-ha溶液中,待f值曲线稳定后将进样管放入ro水中,待f值曲线稳定后再将进样管放入c-cs溶液中,随后再将进样管放入ro水中;此过程重复5次,完成bps的自组装。
[0100]
f值与吸附层的质量相关,当石英金片上吸附层的质量增加时,f值会相应降低;从图6(a)中可以看出bps结构组装完成后,其f值稳定在-80hz左右,在经8小时ro水的冲洗下,f值未产生变化,表明未出现聚电解质的脱离,组装结构呈现出较强的层与层之间的作用力及较高的稳定性。
[0101]
d值与吸附层的粘弹性相关,通常吸附层分为刚性和柔性两种,当吸附层是刚性薄膜时,它会和传感器表面的振荡运动wm耦合,而当吸附层是柔性膜时,振荡所引起的粘弹性剪切波在薄膜中传播时会产生延迟运动。从图6(b)中d值的变化幅度来看,层层组装的bps结构为一种柔性结构。
[0102]
图7为负载圆盘颗粒的巨噬细胞cd86的表达情况,使用dapi对细胞核进行染色,激发后呈蓝色;使用带有fitc标记的二抗,与一抗特异性结合后在荧光显微镜下呈绿色。从图中分析可知,相对于空白组来说,圆盘颗粒导致巨噬细胞表面cd86表达明显减弱,阳性率明显降低,cd86是m2型巨噬细胞的标志物,该结果说明在圆盘颗粒负载下抑制了巨噬细胞向m1型极化。
[0103]
图8为负载圆盘颗粒的巨噬细胞cd206的表达情况,为了与cd86荧光标记产生区别,使用在荧光显微镜下呈红色的二抗。从图中分析可知,相对于空白组来说,圆盘颗粒导致巨噬细胞表面cd206表达明显增强,阳性率明显提高,cd206是m2型巨噬细胞的标志物,该结果说明在圆盘颗粒负载下促进了巨噬细胞向m2型极化。
[0104]
虽然结合附图对本发明的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1