骆驼刺提取物中单体化合物tortosideA在制备防治癌症药物或保健品中的应用的制作方法
骆驼刺提取物中单体化合物tortosidea在制备防治癌症药物或保健品中的应用
技术领域
1.本发明专利申请是分案申请,原案的申请号是2018102103072,申请日是2018年3 月14日,发明名称是:骆驼刺提取物及骆驼刺提取物中分离单体化合物的方法和应用。本发明涉及骆驼刺提取物技术领域,是一种骆驼刺提取物中单体化合物tortosidea在制备防治癌症药物或保健品中的应用。
背景技术:
2.骆驼刺(alhagi sparsifolia shap)是新疆干旱沙漠地区特有的一种落叶灌木,它也是沙漠戈壁“三宝”之一,具有开通阻滞、止咳祛痰、消除异常黏液质等功效,用于腹痛腹胀、痢疾腹泻、风湿病、滋补强壮、平衡体液和异常胆液质的常见药方。课题组对乌鲁木齐周边的骆驼刺与吐鲁番地区骆驼刺进行了比较,近年来由于乌鲁木齐周边等地气候较温和适宜的地区,其骆驼刺已不产生刺糖。因此本发明采用吐鲁番地区含刺糖骆驼刺作为研究对象。本发明借鉴前期发现的骆驼刺提取物抗肿瘤和增强免疫的研究基础,为了深入探讨骆驼刺提取物对宫颈癌的影响,本发明通过体外培养人宫颈癌hela细胞,观察骆驼刺提取物中单体化合物对宫颈癌hela细胞、结肠癌ht-29细胞、胃癌bgc823细胞、肝癌 hepg2细胞、口腔癌kb细胞增殖、凋亡的影响,并初步探讨其发生机制,明确骆驼刺中具有抗肿瘤活性的单体化合物的种类,为利用骆驼刺活性成分治疗宫颈癌提供实验依据,同时对寻找新的抗癌药物和充分挖掘利用新疆药资源无疑是一项非常有意义的工作。
技术实现要素:
3.本发明提供了一种骆驼刺提取物及骆驼刺提取物中分离单体化合物的方法和应用,本发明骆驼刺提取物作为制备防治肿瘤药物或/和保健品以及抑制或/和杀灭宫颈癌hela细胞药物中的应用,本发明首次公开了tortoside a和4-乙烯基-3-甲氧基苯酚对结肠癌 ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞具有显著抑制作用。
4.本发明的技术方案之一是通过以下措施来实现的:一种骆驼刺提取物,包括单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3-甲氧基苯酚,骆驼刺提取物按照下述步骤得到:取骆驼刺地上部分,用纯净水浸泡0.5h至1h后,用体积百分比浓度为70%的乙醇溶液回流提取三次,每次1.5h至2h,合并提取液后,过滤、浓缩提取液得到乙醇提取物,乙醇提取物即为骆驼刺提取物。
5.本发明的技术方案之二是通过以下措施来实现的:一种骆驼刺提取物中分离单体化合物的方法,按照下述方法进行:
6.取所需量乙醇提取物与等体积的水均匀混合,得到乙醇提取物稀释液,再量取所需量乙醇提取物稀释液,依次用与乙醇提取物稀释液等体积的石油醚、乙酸乙酯、正丁醇进行萃取,得到石油醚萃取粗提取物、乙酸乙酯萃取粗提取物、正丁醇萃取粗提取物;
7.取所需量乙酸乙酯萃取粗提取物,采用硅胶吸附柱色谱,用石油醚或/和乙酸乙酯
进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到乙酸乙酯萃取粗提取物的8个馏分,将乙酸乙酯萃取粗提取物第3馏分通过硅胶吸附柱色谱进行梯度洗脱时,采用体积比为42:56的二氯甲烷和甲醇作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第3馏分的第1组分通过sephadex lh-20凝胶柱色谱洗脱时,采用二氯甲烷和甲醇作洗脱剂,得到单体化合物4-乙烯基-3-甲氧基苯酚,将乙酸乙酯萃取粗提取物第8馏分通过开放ods柱色谱进行梯度洗脱时,采用甲醇和水作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第8馏分的第2组分采用制备型高效液相色谱进行分离,得到单体化合物tortoside a;
8.取所需量正丁醇萃取粗提取物,采用hpd100大孔吸附树脂进行粗分后,依次用体积百分比浓度为30%的乙醇、水、体积百分比浓度为90%的乙醇、水梯度洗脱,得到正丁醇萃取洗脱物,取所需量正丁醇萃取洗脱物,采用硅胶吸附柱色谱,用二氯甲烷或/和甲醇进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到的正丁醇萃取粗提取物的5个馏分,将正丁醇萃取粗提取物第1馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,得到2 个组分,将正丁醇萃取粗提取物第1馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物紫铆素,将正丁醇萃取粗提取物第4馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,得到3个组分,将正丁醇萃取粗提取物第4馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物原儿茶醛。
9.下面是对上述发明技术方案之二的进一步优化或/和改进:
10.上述乙酸乙酯萃取粗提取物,用石油醚或/和乙酸乙酯进行梯度洗脱,石油醚与乙酸乙酯的体积比为0至100:0至100,石油醚由100递减至0,乙酸乙酯由0递增至100或/ 和,正丁醇萃取洗脱物,用二氯甲烷或/和甲醇进行梯度洗脱,二氯甲烷与甲醇体积比为 0至100:0至100,二氯甲烷由100递减至0,甲醇由0递增至100。
11.上述乙酸乙酯萃取粗提取物第3馏分的第1组分通过sephadex lh-20凝胶柱色谱洗脱时,采用二氯甲烷和甲醇作洗脱剂,二氯甲烷与甲醇的体积比为1:1;或/和,乙酸乙酯萃取粗提取物第8馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,甲醇与水的体积比为1:1;或/和,正丁醇萃取粗提取物第1馏分通过开放ods柱色谱洗脱时,采用的甲醇和水作洗脱剂,甲醇与水的体积比为1:1;或/和,正丁醇萃取粗提取物第4馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,甲醇与水的体积比为1:1。
12.本发明的技术方案之三是通过以下措施来实现的:一种骆驼刺提取物作为制备防治肿瘤药物或/和保健品中的应用。
13.本发明的技术方案之四是通过以下措施来实现的:一种骆骆驼刺提取物作为制备抑制或/和杀灭宫颈癌hela细胞药物中的应用。
14.本发明的技术方案之五是通过以下措施来实现的:一种骆驼刺提取物中单体化合物4-乙烯基-3-甲氧基苯酚作为制备防治结肠癌或/和胃癌或/和肝癌或/和口腔癌的药物或/ 和保健品中的应用。
15.本发明的技术方案之六是通过以下措施来实现的:一种骆驼刺提取物中单体化合物 4-乙烯基-3-甲氧基苯酚作为制备抑制或/和杀灭结肠癌ht-29细胞或/和胃癌bgc823细胞或/和肝癌hepg2细胞或/和口腔癌kb细胞的药物或/和保健品中的应用。
16.本发明的技术方案之七是通过以下措施来实现的:一种骆驼刺提取物中单体化合物 tortoside a作为制备防治结肠癌或/和胃癌或/和肝癌或/和口腔癌的药物或/和保健
品中的应用。
17.本发明的技术方案之八是通过以下措施来实现的:一种骆驼刺提取物中单体化合物 tortoside a作为制备抑制或/和杀灭结肠癌ht-29细胞或/和胃癌bgc823细胞或/和肝癌 hepg2细胞或/和口腔癌kb细胞的药物或/和保健品中的应用。
18.本发明首次从骆驼刺提取物中,分离出单体化合物紫铆素、原儿茶醛、tortoside a、4-乙烯基-3-甲氧基苯酚,本发明骆驼刺提取物作为制备防治肿瘤药物或/和保健品以及抑制或/和杀灭宫颈癌hela细胞药物中的应用,本发明首次公开了tortoside a和4-乙烯基-3-甲氧基苯酚对结肠癌ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb 细胞具有显著抑制作用,从而使本发明tortoside a和4-乙烯基-3-甲氧基苯酚可以用于制备防治结肠癌、胃癌、肝癌、口腔癌的药物或/和保健品。
具体实施方式
19.本发明不受下述实施例的限制,可根据本发明的技术方案与实际情况来确定具体的实施方式。本发明中所提到各种化学试剂和化学用品如无特殊说明,均为现有技术中公知公用的化学试剂和化学用品;本发明中的百分数如没有特殊说明,均为质量百分数;本发明中的溶液若没有特殊说明,均为溶剂为水的水溶液,例如,盐酸溶液即为盐酸水溶液;本发明中的常温、室温一般指15℃到25℃的温度,一般定义为25℃。
20.下面结合实施例对本发明作进一步描述:
21.实施例1:该骆驼刺提取物,包括单体化合物紫铆素、原儿茶醛、tortoside a和4
‑ꢀ
乙烯基-3-甲氧基苯酚,骆驼刺提取物按照下述步骤得到:取骆驼刺地上部分,用纯净水浸泡0.5h至1h后,用体积百分比浓度为70%的乙醇溶液回流提取三次,每次1.5h至2 h,合并提取液后,过滤、浓缩提取液得到乙醇提取物,乙醇提取物即为骆驼刺提取物。
22.实施例2:该骆驼刺提取物,包括单体化合物紫铆素、原儿茶醛、tortoside a和4
‑ꢀ
乙烯基-3-甲氧基苯酚,骆驼刺提取物按照下述步骤得到:取骆驼刺地上部分,用纯净水浸泡0.5h或1h后,用体积百分比浓度为70%的乙醇溶液回流提取三次,每次1.5h或2 h,合并提取液后,过滤、浓缩提取液得到乙醇提取物,乙醇提取物即为骆驼刺提取物。
23.实施例3:该骆驼刺提取物中分离单体化合物的方法,按照下述方法进行:
24.取所需量乙醇提取物与等体积的水均匀混合,得到乙醇提取物稀释液,再量取所需量乙醇提取物稀释液,依次用与乙醇提取物稀释液等体积的石油醚、乙酸乙酯、正丁醇进行萃取,得到石油醚萃取粗提取物、乙酸乙酯萃取粗提取物、正丁醇萃取粗提取物;
25.取所需量乙酸乙酯萃取粗提取物,采用硅胶吸附柱色谱,用石油醚或/和乙酸乙酯进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到乙酸乙酯萃取粗提取物的8个馏分,将乙酸乙酯萃取粗提取物第3馏分通过硅胶吸附柱色谱进行梯度洗脱时,采用体积比为42:56的二氯甲烷和甲醇作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第3馏分的第1组分通过sephadex lh-20凝胶柱色谱洗脱时,采用二氯甲烷和甲醇作洗脱剂,得到单体化合物4-乙烯基-3-甲氧基苯酚,将乙酸乙酯萃取粗提取物第8馏分通过开放ods柱色谱进行梯度洗脱时,采用甲醇和水作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第8馏分的第2组分采用制备型高效液相色谱进行分离,得到单体化合物tortoside a;
26.取所需量正丁醇萃取粗提取物,采用hpd100大孔吸附树脂进行粗分后,依次用体
积百分比浓度为30%的乙醇、水、体积百分比浓度为90%的乙醇、水梯度洗脱,得到正丁醇萃取洗脱物,取所需量正丁醇萃取洗脱物,采用硅胶吸附柱色谱,用二氯甲烷或/和甲醇进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到的正丁醇萃取粗提取物的5个馏分,将正丁醇萃取粗提取物第1馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,得到2 个组分,将正丁醇萃取粗提取物第1馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物紫铆素,将正丁醇萃取粗提取物第4馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,得到3个组分,将正丁醇萃取粗提取物第4馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物原儿茶醛。
27.用石油醚、乙酸乙酯、正丁醇进行萃取乙醇提取物稀释液时,得到的石油醚萃取粗提取物为极性较低的叶绿素和脂类,不需要进行进一步的分离。
28.实施例4:作为上述实施例2的优化,乙酸乙酯萃取粗提取物,用石油醚或/和乙酸乙酯进行梯度洗脱,石油醚与乙酸乙酯的体积比为0至100:0至100,石油醚由100递减至0,乙酸乙酯由0递增至100或/和,正丁醇萃取洗脱物,用二氯甲烷或/和甲醇进行梯度洗脱,二氯甲烷与甲醇体积比为0至100:0至100,二氯甲烷由100递减至0,甲醇由 0递增至100。
29.实施例5:作为上述实施例3至实施例4的优化,乙酸乙酯萃取粗提取物第3馏分的第1组分通过sephadex lh-20凝胶柱色谱洗脱时,采用二氯甲烷和甲醇作洗脱剂,二氯甲烷与甲醇的体积比为1:1;或/和,乙酸乙酯萃取粗提取物第8馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,甲醇与水的体积比为1:1;或/和,正丁醇萃取粗提取物第1馏分通过开放ods柱色谱洗脱时,采用的甲醇和水作洗脱剂,甲醇与水的体积比为1:1;或/和,正丁醇萃取粗提取物第4馏分通过开放ods柱色谱洗脱时,采用甲醇和水作洗脱剂,甲醇与水的体积比为1:1。
30.实施例6:该驼刺提取物作为制备防治肿瘤药物或/和保健品中的应用。
31.实施例7:该骆骆驼刺提取物作为制备抑制或/和杀灭宫颈癌hela细胞药物中的应用。
32.实施例8:该骆驼刺提取物中单体化合物4-乙烯基-3-甲氧基苯酚作为制备防治结肠癌或/和胃癌或/和肝癌或/和口腔癌的药物或/和保健品中的应用。
33.实施例9:该骆驼刺提取物中单体化合物4-乙烯基-3-甲氧基苯酚作为制备抑制或/ 和杀灭结肠癌ht-29细胞或/和胃癌bgc823细胞或/和肝癌hepg2细胞或/和口腔癌kb细胞的药物或/和保健品中的应用。
34.实施例10:该骆驼刺提取物中单体化合物tortoside a作为制备防治结肠癌或/和胃癌或/和肝癌或/和口腔癌的药物或/和保健品中的应用。
35.实施例11:该骆驼刺提取物中单体化合物tortoside a作为制备抑制或/和杀灭结肠癌ht-29细胞或/和胃癌bgc823细胞或/和肝癌hepg2细胞或/和口腔癌kb细胞的药物或/ 和保健品中的应用。
36.实施例12:该该骆驼刺提取物,包括单体化合物紫铆素、原儿茶醛、tortoside a和 4-乙烯基-3-甲氧基苯酚,按照下述步骤得到:第一步,取9000g骆驼刺地上部分,用纯净水浸泡1h后,用体积百分比浓度为70%的乙醇溶液回流提取三次,每次2h,合并提取液后,过滤、浓缩提取液得到乙醇提取物。
37.实施例13:该骆驼刺提取物中分离单体化合物的方法,按照下述方法进行:
38.取1550g乙醇提取物与等体积的水均匀混合,得到乙醇提取物稀释液,再量取9l乙醇提取物稀释液,依次用9l的石油醚、乙酸乙酯、正丁醇进行萃取,得到石油醚萃取粗提取物、乙酸乙酯萃取粗提取物、正丁醇萃取粗提取物;
39.取80g乙酸乙酯萃取粗提取物,采用硅胶吸附柱色谱,用体积比为50:50的石油醚和乙酸乙酯进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到乙酸乙酯萃取粗提取物的8个馏分,将乙酸乙酯萃取粗提取物第3馏分通过硅胶吸附柱色谱进行梯度洗脱时,采用体积比为42:56的二氯甲烷和甲醇作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第3馏分的第1组分通过sephadex lh-20凝胶柱色谱洗脱时,采用体积比为50:50的二氯甲烷和甲醇作洗脱剂,得到单体化合物4-乙烯基-3-甲氧基苯酚,将乙酸乙酯萃取粗提取物第8 馏分通过开放ods柱色谱进行梯度洗脱时,采用体积比为50:50的甲醇和水作洗脱剂,得到3个组分,将乙酸乙酯萃取粗提取物第8馏分的第2组分采用制备型高效液相色谱进行分离,得到单体化合物tortoside a;
40.取250g正丁醇萃取粗提取物,采用hpd100大孔吸附树脂进行粗分后,依次用体积百分比浓度为30%的乙醇、水、体积百分比浓度为90%的乙醇、水梯度洗脱,得到正丁醇萃取洗脱物,取70g正丁醇萃取洗脱物,采用硅胶吸附柱色谱,依次用体积比为50:50的二氯甲烷和甲醇进行梯度洗脱,洗脱液经硅胶薄层鉴别后,得到的正丁醇萃取粗提取物的5 个馏分,将正丁醇萃取粗提取物第1馏分通过开放ods柱色谱洗脱时,采用体积比为50:50 的甲醇和水作洗脱剂,得到2个组分,将正丁醇萃取粗提取物第1馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物紫铆素,将正丁醇萃取粗提取物第4馏分通过开放ods柱色谱洗脱时,采用体积比为50:50的甲醇和水作洗脱剂,得到3个组分,将正丁醇萃取粗提取物第4馏分的第1组分采用制备型高效液相色谱进行分离,得到单体化合物原儿茶醛。
41.骆驼刺提取物中单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3-甲氧基苯酚和tortoside a抗肿瘤药效学实验
42.1.试剂与仪器
43.1.1试剂与药材
44.dmem高糖培养基(hyclone公司);胎牛血清(gibco公司,fbs);0.25%胰酶(hyclone 公司);pbs缓冲溶液(thermo公司);双抗(青霉素-链霉素ps);四甲基偶氮盐(sigma 公司,mtt)和5-氟尿嘧啶(上海旭东海普药业有限公司,5-fu);硅胶g薄层板,硅胶 gf254薄层板(青岛海洋化工有限公司),c18柱色谱(大连江申分离科学技术公司),ods 制备型色谱柱(ymc公司),葡聚糖凝胶色谱柱(sephadex lh-20,ge healthcarebio-science ab公司),色谱甲醇(美国fisher scientific,色谱纯);石油醚,甲醇,乙醇,乙酸乙酯,正丁醇,浓硫酸,二甲基亚砜(dmso)等试剂均为分析纯(天津市致远化学试剂有限公司)。骆驼刺采自新疆吐鲁番地区,经新疆中药民族药研究所王果平副研究员鉴定其为豆科骆驼刺属植物骆驼刺(alhagi sparsifolia shap.)。
45.1.2细胞株
46.人宫颈癌hela细胞,购自中国科学院典型培养物保藏委员会细胞库(中国科学院上海生命科学研究院细胞资源中心)。
47.1.3仪器
48.电热真空干燥箱dzf-2b(北京永光明医疗仪器厂)、旋转蒸发仪v-100(上海爱朗仪
器有限公司)、冷却水循环装置cca-1111(上海爱朗仪器有限公司)、循环水式多用真空泵shb-iii(郑州长城科工贸有限公司)、二氧化碳培养箱bc-j80s(上海博迅实业有限公司医疗设备厂)、洁净工作台sw-cj-2f(苏州尚田洁净技术有限公司)、冷冻离心机mikro 220r(德国hettich)、酶标仪biotek、gen5 biotek、优普超纯水机upt-i-5t/l(成都超纯科技有限公司)、液相色谱质谱联用仪、核磁共振光谱用brukerarx-300和av-600型核磁共振仪;高效液相色谱仪;循环水式多用真空泵(郑州长城科工贸有限公司);旋转蒸发仪(上海亚荣生化仪器厂)。
49.2.实验方法
50.2.1不同极性的骆驼刺提取物对hela细胞活性的筛选
51.2.1.1细胞培养
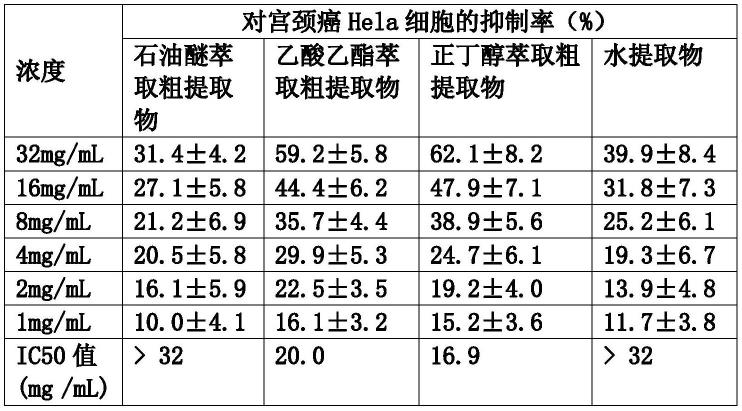
52.将细胞从液氮中取出,迅速置于37℃水浴锅中解冻,然后吸入离心管,加入3ml细胞培养液(10%胎牛血清dmem培养液),1 000r/min离心5min,弃去上清液,将细胞重悬于1ml细胞培养液,并转移至10cm细胞培养皿中,加入5ml细胞培养液,混匀后放入细胞培养箱进行培养(37℃、5%二氧化碳co2)。每两天更换1次培养液,观察细胞形态,维持细胞处于对数生长期备用。
53.2.1.2活性筛选
54.取对数生长期的hela细胞,用0.25%胰蛋白酶消化制成单细胞悬液后细胞计数,将细胞密度调整为6
×
104个/ml,铺板,培养24h后给药。空白对照组给予等体积的pbs;给药组分别加入不同浓度的石油醚萃取粗提取物、乙酸乙酯萃取粗提取物、正丁醇萃取粗提取物,其浓度依次为32,16,8,4,2,1mg/ml,阳性对照组加入不同浓度的5-fu,每个浓度设3个复孔,再培养48h后,加入5mg/ml的mtt液(10μl/孔)4h后,弃去上清加入dmso 100μl/孔。于摇床上震荡5至10min,使完全混匀溶解结晶,在酶标仪上于570nm处测吸光度,每个剂量设平行重复3孔,实验重复3次。按以下公式计算抑制率,拟合后求ic50值。抑制率=(1-a
实验组
/a
对照组
)
×
100%。
55.2.2骆驼刺中各单体化合物对hela细胞的活性筛选
56.2.2.1细胞培养同2.1.1
57.2.2.2活性筛选取对数生长期的hela细胞,用0.25%胰蛋白酶消化制成单细胞悬液后细胞计数,将细胞密度调整为6
×
104个/ml,铺板,培养24h后给药。空白对照组给予等体积的pbs;给药组分别加入不同浓度的化合物,其浓度依次为200,100,50,25, 12.5,6.25μg/ml。具体操作步骤见2.1.2
58.2.3骆驼刺提取物中单体化合物4-乙烯基-3-甲氧基苯酚和tortoside a对结肠癌 ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞的活性筛选
59.2.3.1细胞培养同2.1.1
60.2.3.2活性筛选取对数生长期的结肠癌ht-29细胞、胃癌bgc823细胞、肝癌hepg2 细胞、口腔癌kb细胞,分别用0.25%胰蛋白酶消化制成单细胞悬液后细胞计数,将细胞密度调整为6
×
104个/ml,铺板,培养24h后给药。空白对照组给予等体积的pbs;给药组分别加入不同浓度的化合物,其浓度依次为200,100,50,25,12.5,6.25μg/ml。
61.具体操作步骤见2.1.2
62.2.4统计学处理实验数据采用spss统计软件进行统计学分析,采用单因素方差
(oneway anove)分析,p《0.05为差异,有统计学意义。
63.3.结果
64.3.1活性筛选
65.3.1.1不同极性的骆驼刺提取物对hela细胞活性的筛选结果,如表1所示。表1为不同极性骆驼刺提取物对hela细胞的抑制率和ic50值的数据。由表1可知,乙酸乙酯萃取粗提取物和正丁醇萃取粗提取物的ic50值分别为:20.0mg/ml和16.9mg/ml,石油醚萃取粗提取物和水提取物ic50值均为32.0mg/ml以上,乙酸乙酯萃取粗提取物和正丁醇萃取粗提取物对hela细胞有明显抑制作用,所以接下来我们对乙酸乙酯萃取粗提取物和正丁醇萃取粗提取物进行了单体化合物的分离和活性筛选。
66.3.1.2骆驼刺提取物中单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3
‑ꢀ
甲氧基苯酚对hela细胞的抑制作用
67.骆驼刺提取物中单体化合物对hela细胞活性筛选结果,如表2所示。由表2可知,骆驼刺提取物中化合物紫铆素、原儿茶醛、单体化合物tortoside a和4-乙烯基-3-甲氧基苯酚的ic50值分别为44.7μg/ml,23.1μg/ml,91.2μg/ml,41.2μg/ml,对骆驼刺提取物中所含其他单体化合物的ic50值测定,其ic50值为147.3μg/ml以上,可见骆驼刺提取物中单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3-甲氧基苯酚对hela细胞增单体殖有较强的抑制作用。
68.3.1.3骆驼刺提取物中单体化合物中4-乙烯基-3-甲氧基苯酚和tortoside a对结肠癌ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞的抑制作用
69.骆驼刺提取物中单体化合物中4-乙烯基-3-甲氧基苯酚和tortoside a对结肠癌 ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞的活性筛选结果,如表 3所示。由表3可知,骆驼刺提取物中单体化合物中4-乙烯基-3-甲氧基苯酚对结肠癌ht-29 细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞增殖具有显著的抑制作用。
70.因此,在活性筛选的研究中,首先利用mtt法检测各不同极性提取物对肿瘤细胞和正常细胞的增殖抑制能力,明确其中的乙酸乙酯萃取粗提取物和正丁醇萃取粗提取物对 hela细胞具有一定的抑制作用,进而对上述二种萃取粗提取物进行筛选,利用5-fu与骆驼刺提取物中的单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3-甲氧基苯酚进行比较,发现骆驼刺提取物中的单体化合物紫铆素、原儿茶醛、tortoside a和4-乙烯基-3-甲氧基苯酚对宫颈癌hela细胞增殖有较强的抑制作用(p《0.05),且呈现一定的剂量依赖性;tortoside a和4-乙烯基-3-甲氧基苯酚对结肠癌ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞增殖具有显著的抑制作用。
71.综上所述,本发明首次从骆驼刺提取物中,分离出单体化合物紫铆素、原儿茶醛、 tortoside a、4-乙烯基-3-甲氧基苯酚,本发明骆驼刺提取物作为制备防治肿瘤药物或/ 和保健品以及抑制或/和杀灭宫颈癌hela细胞药物中的应用,本发明首次公开了 tortoside a和4-乙烯基-3-甲氧基苯酚对结肠癌ht-29细胞、胃癌bgc823细胞、肝癌hepg2细胞、口腔癌kb细胞具有显著抑制作用,从而使本发明tortoside a和4-乙烯基
ꢀ‑
3-甲氧基苯酚可以用于制备防治结肠癌、胃癌、肝癌、口腔癌的药物或/和保健品。
72.以上技术特征构成了本发明的实施例,其具有较强的适应性和实施效果,可根据实际需要增减非必要的技术特征,来满足不同情况的需求。
73.表1
[0074][0075]
表2
[0076]
骆驼刺提取物中单体化合物种类ic50值(μg/ml)紫铆素44.7原儿茶醛23.1tortoside a91.24-乙烯基-3-甲氧基苯酚41.2
[0077]
表3
[0078]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1