一种抗PD-1纳米抗体制剂的制作方法
一种抗pd-1纳米抗体制剂
技术领域
1.本发明属于生物制药技术领域,具体涉及包含针对程序性死亡受体1(pd-1)的纳米抗体制剂。
背景技术:
2.程序性死亡受体1(pd-1)属于免疫球蛋白超家族cd28/b7,是由288个氨基酸组成的ⅰ型跨膜糖蛋白,为免疫抑制性受体。pd-1的主要配体为pd-l1,其又称b7-h1,是一种由人cd274基因编码的ⅰ型跨膜糖蛋白。pd-1与pd-l1结合时,通过发生磷脂酰肌醇-3-激酶的磷酸化、蛋白激酶b的进一步激活、刺激性t细胞信号通路的活化、葡萄糖代谢以及干扰素的分泌等,导致t细胞活化的下游信号受阻,进而有效抑制t细胞的转录,最终抑制t细胞的免疫功能,在免疫应答的负性调控方面发挥着重要作用。因此,阻断pd-1/pd-l1信号通路可使t细胞活化上调,激活内源性抗肿瘤免疫反应,从而发挥对肿瘤的治疗作用。
3.在单克隆抗体研发的生命周期中,包括在生物反应器中细胞代谢,纯化过程中溶液低ph值,冷冻-解冻过程,温度变化和运输分发都会对单克隆抗体的稳定性产生影响。单克隆抗体的降解途径包括蛋白质的部分解折叠、聚集、微粒化、沉淀和表面吸附,避免或者减少这些物理变性以提高稳定性是单克隆抗体开发的重要目的。单克隆抗体主要由静脉注射和皮下注射两种途径给药。静脉注射的单克隆抗体制剂主要用来治疗包括靶向肿瘤制剂在内的疾病。该类型的制剂需要大量稀释。皮下注射制剂常用来治疗自身免疫疾病和感染,并且往往由患者自身完成给药。为了克服半衰期和靶点结合能力的局限,蛋白质制剂总倾向于使用较大剂量以减少大量注射所带来的患者不适。但是高浓度蛋白制剂因为其在溶解度、稳定性及粘度方面的问题给处方开发带来了较大的难度。寻找合适的处方提升蛋白质制剂的溶解度、稳定性和降低其粘度成为了单克隆抗体开发的重要环节。
4.为靶向pd-1的单抗注射液,由百时美施贵宝公司研发生产,该单抗注射液1ml包含10mg纳武单抗、5.88mg二水合柠檬酸钠、30mg甘露醇、0.008mg喷替酸、0.02%(w/v)聚山梨酯80和2.92mg氯化钠,该单抗注射液用于静脉注射,单抗浓度较低,不适于皮下注射。
5.纳米抗体(nanobody,nb),即重链单域抗体vhh(variable domain of heavy chain of heavy-chain antibody),直径2.5nm,长4nm,是自然存在的可以和抗原结合的最小片段。纳米抗体由于其结构及分子大小和传统单克隆抗体存在较大差异,为了制备适于临床应用的药物制剂,须根据纳米抗体自身结构特点进行专门的制剂开发。
技术实现要素:
6.本发明的目的在于提供一种高溶解度、高稳定性、适于皮下注射的抗pd-1纳米抗体制剂。
7.一方面,本发明提供一种抗pd-1纳米抗体制剂,所述制剂包含抗pd-1纳米抗体,所述抗pd-1纳米抗体由vhh链与包含经修饰铰链区的igg4-fc组成,其中:
8.(i)所述抗pd-1纳米抗体vhh链包含seq id no.6所示的cdr1、seq id no.7所示的cdr2、seq id no.8所示的cdr3及seq id no.9所示的cdr1和cdr2之间的框架区fr2;和
9.(ii)所述抗pd-1纳米抗体中的经修饰铰链区包含seq id no.10所示氨基酸序列,或者由连接肽与seq id no.11所示的igg4-fc铰链区序列组成,所述连接肽包含seq id no.12、seq id no.13或seq id no.14所示氨基酸序列;
10.并且,所述制剂还包含缓冲液、渗透压调节剂、粘度调节剂和稳定剂中的一种或多种。
11.本发明提供的抗pd-1纳米抗体制剂中包含的抗pd-1纳米抗体公开于申请人在先中国专利申请cn202210337061.1,该申请的全部内容引入到本技术中,用于全部目的。
12.所述抗pd-1纳米抗体中的vhh链cdr1、cdr2和cdr3的氨基酸序列以及框架区fr2的氨基酸序列分别如下所示:
13.seq id no.6:gstylrfsmg
14.seq id no.7:iggdgrt
15.seq id no.8:aaavlldgsfsllaplvpykydy
16.seq id no.9:wfrqvpgkeregvaa
17.所述抗pd-1纳米抗体中的经修饰铰链区包含的氨基酸序列如下所示:seq id no.10:erkssvecppcp
18.或所述抗pd-1纳米抗体中的经修饰铰链区由连接肽与igg4-fc铰链区序列组成,igg4-fc铰链区序列如下所示:
19.seq id no.11:eskygppcppcp
20.连接肽序列分别如下所示:
21.seq id no.12:epkipqpqpkpqpqpqpqpkpqpkpepe
22.seq id no.13:epkipqpqpk
23.seq id no.14:epkipqpqpkpqpkpepe
24.在包含所述连接肽的情况下,连接肽连接至seq id no.11所示的氨基酸序列的n端。
25.优选地,所述抗pd-1纳米抗体为抗人pd-1纳米抗体。
26.根据本发明的具体实施方式,所述抗pd-1纳米抗体的vhh链包含seq id no.15所示氨基酸序列。
27.seq id no.15:
28.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvss
29.优选地,所述抗pd-1纳米抗体包含seq id no.16、seq id no.17、seq id no.18或seq id no.19所示氨基酸序列。
30.seq id no.16:
31.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvsserkssvecppcp
32.seq id no.17:
33.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrfti
200mg/ml,优选125-175mg/ml,更优选150mg/ml。
48.本发明提供的抗pd-1纳米抗体制剂为液体制剂,通过所包含的缓冲液,本发明提供的抗pd-1纳米抗体制剂形成缓冲体系,所述缓冲液为选自磷酸盐(磷酸二氢钠-磷酸氢二钠)、醋酸盐(醋酸-醋酸钠)、柠檬酸盐(柠檬酸-柠檬酸钠)、tris-hcl和组氨酸(组氨酸-组氨酸盐酸)缓冲液中的一种或多种,浓度为2-50mm,所述缓冲体系ph为5.0-7.5,优选6.0-7.5,更优选7.0
±
0.2;所述渗透压调节剂和/或粘度调节剂为氯化钠,浓度为0-150mm;所述稳定剂为选自蔗糖、海藻糖和甘露醇中的一种或多种,浓度为20-200mm。
49.本发明缓冲液如无特殊说明,磷酸盐均指的是磷酸二氢钠-磷酸氢二钠,醋酸盐均指的是醋酸-醋酸钠,柠檬酸盐均指的是柠檬酸-柠檬酸钠,组氨酸均指的是组氨酸-组氨酸盐酸。
50.进一步地,所述抗pd-1纳米抗体制剂还包含表面活性剂,例如非离子型聚合物。优选地,所述表面活性剂为聚山梨酯,浓度为0%-0.02%。
51.优选地,所述缓冲液为磷酸盐和/或醋酸盐缓冲液,浓度为10-20mm。优选地,所述渗透压调节剂和/或粘度调节剂为氯化钠,浓度为0-150mm,优选50-100mm。优选地,所述稳定剂为蔗糖,浓度为30-100mm,优选30-65mm。优选地,所述表面活性剂为聚山梨酯80,浓度0%-0.02%,更优选0.01%-0.02%。
52.根据本发明的具体实施方式,在本发明提供的抗pd-1纳米抗体制剂中,所述缓冲液为10mm磷酸盐缓冲液,ph 7.0;或者为20mm醋酸盐缓冲液,ph 5.0。
53.根据本发明的具体实施方式,所述制剂包括150mg/ml的所述抗pd-1纳米抗体及
54.(1)ph 5.0的20mm醋酸盐缓冲液、30mm蔗糖、100mm氯化钠和0.02%聚山梨酯80;或者
55.(2)ph 5.0的20mm醋酸盐缓冲液、65mm蔗糖、50mm氯化钠和0.01%聚山梨酯80;或者
56.(3)ph 5.0的20mm醋酸盐缓冲液、100mm蔗糖和100mm氯化钠;或者
57.(4)ph 7.0的10mm磷酸盐缓冲液、65mm蔗糖、50mm氯化钠和0.01%聚山梨酯80;或者
58.(5)ph 7.0的10mm磷酸盐缓冲液和30mm蔗糖;或者
59.(6)ph 7.0的10mm磷酸盐缓冲液、100mm蔗糖和100mm氯化钠;或者
60.(7)ph 7.0的10mm磷酸盐缓冲液、100mm蔗糖和0.02%聚山梨酯80;或者
61.(8)ph 7.0的10mm磷酸盐缓冲液、30mm蔗糖、100mm氯化钠和0.02%聚山梨酯80。
62.优选地,本发明提供的抗pd-1纳米抗体制剂为注射制剂,适用于皮下注射和静脉注射,优选为皮下注射制剂或静脉注射制剂,采用无菌注射用水配制得到。
63.另一方面,本发明还提供所述抗pd-1纳米抗体制剂在制备用于治疗pd-1或pd-l1相关疾病的药物中的用途。优选地,所述疾病为肿瘤(包括恶性肿瘤或癌症)或感染性疾病。进一步优选地,所述疾病为肺癌、胃癌、肝癌、黑色素瘤、宫颈癌、结直肠癌、膀胱癌、乳腺癌、白血病、淋巴瘤、肾细胞癌、盲肠癌、胰腺癌、胆管癌、头颈癌、梅克尔细胞癌、卵巢癌、鼻咽癌、胶质瘤、食管癌、骨癌或前列腺癌。优选地,所述疾病为结直肠癌。
64.因此相应地,本发明还提供一种治疗pd-1或pd-l1相关疾病的方法,所述方法包括给有此需要的受试者施用本发明提供的抗pd-1纳米抗体制剂。优选地,所述疾病为肿瘤(包
括恶性肿瘤或癌症)或感染性疾病。进一步优选地,所述疾病为肺癌、胃癌、肝癌、黑色素瘤、宫颈癌、结直肠癌、膀胱癌、乳腺癌、白血病、淋巴瘤、肾细胞癌、盲肠癌、胰腺癌、胆管癌、头颈癌、梅克尔细胞癌、卵巢癌、鼻咽癌、胶质瘤、食管癌、骨癌或前列腺癌。所述受试者是脊椎动物,优选是哺乳动物,例如人、家畜和农用动物以及动物园、运动或宠物动物,比如绵羊、狗、马、猫、牛、大鼠、猪、猕猴。根据本发明的具体实施方式,所述受试者是人。
65.还一方面,本发明提供其他相关产品。
66.例如,一种容器,其包含本发明提供的抗pd-1纳米抗体制剂。例如,所述容器为注射剂瓶,其中所述制剂的灌装体积为1ml/支。或者,例如,一种药盒,其包含本发明提供的容器;进一步地,所述药盒还包含说明书。
67.本发明以抗pd-1纳米抗体为活性成分,开发了一种抗pd-1纳米抗体制剂,所述制剂为澄清、无色至淡黄色液体。实验证明,本发明抗pd-1纳米抗体具有高亲和力、高抗原阻断效果和良好的抑瘤效果;同时,本发明的抗pd-1纳米抗体制剂在含高浓度抗体时仍保持抗体的良好的溶解度和稳定性,方便运输和储藏,提高了有效期。另外,本发明的抗pd-1纳米抗体制剂具有的高浓度纳米抗体和近人体等渗的特点使其适宜皮下注射,方便患者给药。
附图说明
68.以下,结合附图来详细说明本发明的实施方案,其中:
69.图1:给药后肿瘤体积增长趋势图。
70.图2:试验结束后小鼠肿瘤重。
具体实施方式
71.以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
72.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。
73.下述实施例中,采用优化前序列pr作为对照抗体(参见申请人在先中国专利cn107814845a),并采用如下氨基酸序列所示的抗pd-1纳米抗体(参见申请人在先中国专利申请cn202210337061.1):
74.pr(seq id no.1):
75.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkglegvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvsseskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
76.n7(seq id no.2):
77.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvsserkssvecppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqd
wlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
78.其中,vhh链cdr1、cdr2和cdr3依次示于seq id nos.6-8;框架区fr2示于seq id no.9;经修饰铰链区示于seq id no.10;vhh链示于seq id no.15。
79.n10(seq id no.3):
80.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvssepkipqpqpkpqpqpqpqpkpqpkpepeeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
81.其中,vhh链cdr1、cdr2和cdr3依次示于seq id nos.6-8;框架区fr2示于seq id no.9;igg4-fc铰链区示于seq id no.11;连接肽示于seq id no.12;vhh链示于seq id no.15。
82.n14(seq id no.4):
83.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvssepkipqpqpkeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
84.其中,vhh链cdr1、cdr2和cdr3依次示于seq id nos.6-8;框架区fr2示于seq id no.9;igg4-fc铰链区示于seq id no.11;连接肽示于seq id no.13;vhh链示于seq id no.15。
85.n15(seq id no.5):
86.qvqlqesggglvqpggslrlscaasgstylrfsmgwfrqvpgkeregvaaiggdgrtsyadsvkgrftiskdnskntlyldmnslraedtavyycaaavlldgsfsllaplvpykydywgqgtlvtvssepkipqpqpkpqpkpepeeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
87.其中,vhh链cdr1、cdr2和cdr3依次示于seq id nos.6-8;框架区fr2示于seq id no.9;igg4-fc铰链区示于seq id no.11;连接肽示于seq id no.14;vhh链示于seq id no.15。
88.下述实施例中,采用以下实验程序:
89.(一)样品检测方法
90.1.外观
91.根据2020版中国药典0901溶液颜色检查法和0902澄清度检查法目测确定每个批次的颜色和清晰度。原液样品、浊度标准液和对照品(wfi)在黑色背景下检测以确定澄清度。将检测的样品与比色液(黄色系)在白色背景下进行比较,以确定色系。
92.2.可见异物
93.根据2020版中国药典0904轻轻旋转或倒置每个容器,以确保没有气泡产生,每个样品对照背景依次进行检查。记录下检测到的可见异物。
94.3.蛋白浓度
95.蛋白浓度使用单光束二极管阵列分光光度计与10毫米的石英比色皿进行测定。测试样品在超纯水中稀释至0.5mg/ml,在280nm和340nm处测定吸光度。样品中蛋白的浓度由280nm和340nm处的吸光度、消光系数1.50(mg/ml)-1
cm-1
和稀释倍数计算得出,公式如下:
96.蛋白浓度(mg/ml)=(a280-a340)
×
1/ε
×d97.式中a=吸光度,ε=消光系数,d=样品稀释倍数。
98.3.sec
99.分子排阻色谱(sec)用于测定样品的纯度和高分子量(hmw)和低分子量(lmw)峰面积百分比,根据凝胶颗粒的孔径大小与被分离组分分子尺寸之间的关系进行分离。
100.sec采用thermo scientific ultimate 3000系统,通过可变波长紫外检测器进行检测。样品稀释后,置于自动进样器进行等度洗脱,样品组分在280nm波长下检测并积分。高分子量、单体(主峰)和低分子量的峰面积百分比由各组分的峰面积相对于总综合峰面积确定百分含量。
101.4.iec
102.离子交换色谱法(iec)用于测定样品蛋白电荷变异的纯度和百分比。
103.iec采用带有紫外线检测的thermo scientific ultimate 3000系统。样品稀释,进样,然后用盐梯度洗脱,色谱柱保持在35℃。在280nm波长下进行检测。将色谱图中的峰进行积分,计算酸性峰、主峰、碱性峰各组分峰的峰面积百分比。
104.5.ce-sds
105.a.溶液制备:分别配制稀释缓冲液,dtt,nem,染色凝胶和脱色液,分子量标准品和变性剂;
106.b.样品处理:在样品中加入超纯水和还原试剂(蛋白230试剂盒提供的样品缓冲液,与1m dtt混合)稀释后变性;非还原条件下,样品加入120mm n乙基马来酰亚胺(nem)溶液和非还原试剂(样品溶液与超纯水混合);将还原和非还原条件下的ladder(阶梯式标记物)和样品加热后加到芯片上;样品在充满聚合物溶液的微通道中进行电泳分离;
107.c.检测:基于一种荧光染料的激光诱导荧光,样品添加到聚合物溶液中,并以非共价结合到蛋白质-sds胶束上;
108.d.结果分析:生物分析仪软件根据ladder(阶梯式标记物)自动确定大小,并计算电泳图中每个分离峰的百分比。
109.6.svp
110.根据2020版《中华人民共和国药典》四部0903使用光阻法测定样品的不溶性微粒。每个样品准备四份,依次检测;放弃第一份的检测结果,其余三份取结果的平均值,记录下检测到大于10μm和大于25μm的微粒数。
111.7.渗透压
112.根据2020版《中华人民共和国药典》四部0632确定样品的渗透压摩尔浓度。使用渗透压计(210型,advanced instruments,norwood,ma 02062)测量成品的冰点下降值来间接测定其渗透压。
113.实施例1抗体制备
114.根据上文提供的抗pd-1纳米抗体的氨基酸序列,通过如下步骤制备相应的纳米抗体。
115.a.合成编码纳米抗体序列的基因序列;
116.b.将合成的基因序列构建到pcdna3.1载体上,转化至大肠杆菌dh5α菌株中,大摇并用omega质粒大提试剂盒提取pcdna3.1质粒,并过滤除菌;
117.c.将cho-s细胞培养至5
×
106个/ml;
118.d.将步骤b得到的pcdna3.1质粒与转染试剂pei以1:3的比例在转染培养基expicho
tm expression medium中混合均匀并静置20min,然后加入到步骤c的cho-s细胞中,于37℃、6%co2、115rpm培养5天;
119.e.培养产物离心,0.2μm滤膜过滤,得到离心上清;
120.f.采用proa亲和层析法纯化离心上清,使用ph7.0的tris体系缓冲液清洗掉杂蛋白和其他杂质;
121.g.使用24mm醋酸洗脱;
122.h.将得到的洗脱液用tris base回调ph至5.0,再用0.2μm滤膜过滤,得到抗体。
123.实施例2抗体生物学活性的检测
124.2.1抗原结合(elisa)
125.通过elisa检测纳米抗体对抗原pd-1蛋白的结合能力。方法如下:
126.a.抗原包被:取100μl/孔浓度为20ng/ml的人pd-1蛋白(acro pd1-hb2f2)于96孔板中,室温孵育2小时后,洗板5次;
127.b.参比品及供试品准备:参比品和供试品稀释至1000ng/ml后,进行梯度稀释;
128.c.反应:将梯度稀释后的样品按100μl/孔加入到步骤a中预先包被的96孔板中,盖上板盖,室温孵育2小时后,洗板5次;
129.d.加入检测抗体:按100μl/孔将稀释后的检测抗体转移至步骤c中样品板中,盖上盖板,室温孵育1小时后,洗板5次;
130.e.加入显色底物:在样品板中加入tmb显色底物,盖上盖板,室温孵育10-15分钟;
131.f.终止显色反应:在样品板中加入2m硫酸,终止显色反应;
132.g.读板:将样品板放置于酶标仪中,进行读板。
133.结果见表1。
134.表1.纳米抗体的抗原结合检测结果
135.样品idec50(ng/ml)pr15.89n79.98n1014.89n1415.12n1511.07
136.2.2抗原活性的阻断
137.检测纳米抗体对抗原pd-1蛋白活性的阻断作用。方法如下:
138.a.在1l的dmem/f12基础培养基中加入fbs 100ml、neaa 10ml、青链霉素溶液10ml、
hygromycin b(50mg/l)4ml和puromycin(10mg/l)800μl,配制cho-pd-l1-cd3l细胞完全培养基;将cho-pd-l1-cd3l细胞接种到培养基中,每2天进行细胞传代培养至对数生长期;
139.在1640基础培养基1l中加入fbs 100ml、neaa 10ml、青链霉素溶液10ml、hygromycin b(50mg/l)8ml和puromycin(10mg/l)400μl,配制jurkat-pd-1-nfat细胞完全培养基;将jurkat-pd-1-nfat细胞接种到培养基中,每2天进行细胞传代培养至对数生长期;
140.b.消化并离心cho-pd-l1-cd3l细胞,用dmem/f12完全培养基重悬细胞至5
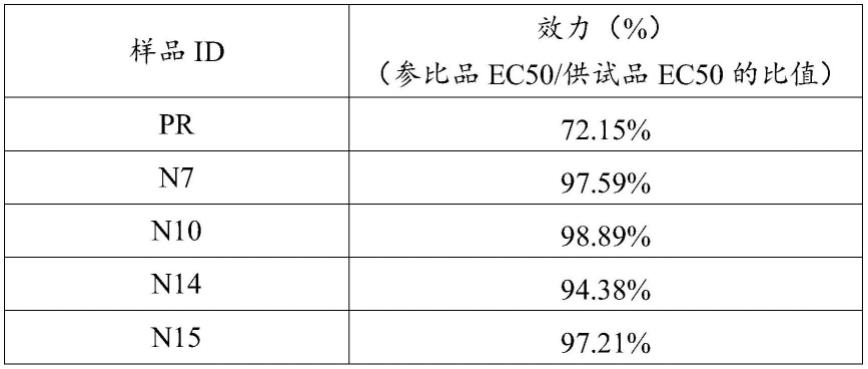
×
105个/ml,每孔100μl加入到白底96孔板中,于37
±
2℃、(5
±
1)%co2培养箱中孵育16
±
2h;
141.c.将供试品、参比品及质控品预稀释至100μg/ml,再用分析培养基(rpmi1640基础培养基+2%fbs)进行梯度稀释;
142.d.将步骤b的细胞培养板取出,吸取上清液弃掉,加入稀释后的供试品、参比品及质控品,每孔50μl;
143.e.取出jurkat-pd-1-nfat细胞,用分析培养基重悬细胞至2
×
106个/ml;以每孔50μl将该jurkat细胞悬液加入到步骤d的培养板中,于培养箱中孵育6h;
144.f.提前1h取出bio-glo luciferase assay system试剂,室温放置,每孔100μl加入到细胞板;室温避光孵育2~3min后用酶标仪进行读数。
145.结果见表2。
146.表2.纳米抗体对抗原活性的阻断作用的检测结果
[0147][0148]
2.3结合亲和力(fortebio)
[0149]
检测纳米抗体对抗原pd-1蛋白的结合亲和力(fortebio)。方法如下:
[0150]
检测仪器:octet k2,pall-fortebio
[0151]
芯片:protein a(厂家:pall fortebio,货号:18-5010)
[0152]
缓冲液:ph 7.4pbst(ph 7.4pbs,tween20 0.05%v/v)
[0153]
软件版本:fortebio data analysis 10.0
[0154]
通过protein a芯片特异性捕获待测抗体(pr,n7,n10,n12,n13,n14,n15),信号达到3nm,与梯度稀释的不同浓度pd-1蛋白进行结合。
[0155]
其中,待测样品蛋白用pbst缓冲液稀释至终浓度为5ug/ml。将冻干pd-1蛋白用ddh2o稀释为250ug/ml,然后用pbst稀释,最高浓度为50nm,2倍浓度梯度稀释,共7个浓度。
[0156]
结果见表3。
[0157]
表3.纳米抗体对抗原的结合亲和力
[0158]
样品idkon(1/ms)koff(1/s)kd(m)pr2.39e+051.13e-034.72e-09n72.74e+051.67e-046.10e-10n102.77e+055.73e-042.07e-09n142.49e+056.13e-042.46e-09n153.16e+052.76e-048.73e-10
[0159]
实施例3纳米抗体的抑瘤作用检测
[0160]
在c57bl/6hpd1人源化小鼠中检测纳米抗体对皮下肿瘤的治疗作用。
[0161]
在c57bl/6j-hpd1人源化小鼠皮下移植mc38-hpd-l1肿瘤细胞(结肠癌细胞),建立mc38-hpd-l1移植瘤模型。方法如下:
[0162]
1.试验处理前小鼠进行隔离与适应性饲养一周;
[0163]
2.将mc38-hpd-l1细胞在37℃、5%co2的培养箱中培养扩增,收取对数生长期细胞重悬于pbs中,加入基质胶,调整细胞浓度到1
×
107个细胞/ml;
[0164]
3.用1ml注射器将细胞悬液注入c57bl/6j-hpd1人源化小鼠右侧皮下,每只小鼠注射100μl;
[0165]
4.待平均肿瘤体积约为112mm3时,淘汰体积过大、过小或者肿瘤形状不规则的小鼠。
[0166]
采用随机区组法将小鼠分为5组,分别为对照组(组1)、keytruda(组2)、pr抗体组(组3)、纳米抗体n7组(组4)、纳米抗体n15组(组5),每组8只。按照表4中的方案给药,各组均采用腹腔给药,各组给药体积均为10ml/kg,连续给药3周,每周给药2次,共给药6次。其中各组抗体配制成1mg/ml的使用浓度,对照组采用生理盐水,分组当天开始给药。
[0167]
表4.给药方案
[0168][0169]
每周测量2次瘤径、称量小鼠体重,观察小鼠生活状态,对异常情况进行记录。采用以下计算公式:
[0170]
1.肿瘤体积(tumor volume,tv)
[0171]
tv=1/2
×a×
b2[0172]
其中:a表示肿瘤长径;b表示肿瘤短径。
[0173]
2.相对肿瘤体积(relative tumor volume,rtv)
[0174]
rtv=v
t
/v
initial
×
100(%)
[0175]
其中,v
initial
为分组给药时(即d
initial
)测量所得肿瘤体积,v
t
为每次测量时的肿瘤体积。
[0176]
3.相对肿瘤增殖率t/c(%)
[0177]
t/c(%)=(t
rtv
/c
rtv
)
×
100%
[0178]
其中,t
rtv
表示治疗组的相对肿瘤体积,c
rtv
表示溶剂组的相对肿瘤体积。
[0179]
4.肿瘤体积抑瘤率(tgi)
[0180]
tgi=[1-(tv
t-tv
initial
)/(cv
t-cv
initial
)]
×
100%
[0181]
其中,tv
t
表示治疗组每次测量时的肿瘤体积;tv
initial
表示分组给药时治疗组的肿瘤体积;cv
t
表示对照组每次测量时的肿瘤体积;cv
initial
表示分组给药时对照组的肿瘤体积。
[0182]
结果用平均数和标准误(mean
±
sem)表示,使用t-test分析对照组和给药组的肿瘤体积差异,p《0.05表示存在统计学差异。
[0183]
一、小鼠肿瘤体积变化见表5和图1。
[0184]
表5.小鼠肿瘤体积(mm3)
[0185][0186]
注:数据用mean
±
sem表示
[0187]
“‑”
:动物安乐死
[0188]
给药开始后第14天,对照组平均肿瘤体积为4057.43
±
288.73mm3。组2、组3、组4和组5肿瘤体积分别为884.86
±
194.57mm3、1584.55
±
186.82mm3、672.45
±
101.01mm3和815.51
±
131.88mm3,肿瘤抑制率分别为80.42%、62.69%、85.79%和82.16%。组2、组3、组4和组5与对照组肿瘤体积比较,有显著性差异(p《0.01)。
[0189]
以第14天测得的肿瘤体积为基础,计算抗体对移植hpd-l1肿瘤的雌性人源化小鼠的肿瘤生长抑制能力。结果见表6和表7。
[0190]
表6.肿瘤生长抑瘤率分析
[0191][0192][0193]
表7.各组之间肿瘤体积比较
[0194][0195]
注:数据用mean
±
sem表示
[0196]
采用t-test分析比较vehicle组和治疗组之间的肿瘤体积,****表示p《0.0001,*表示p《0.05。
[0197]
二、小鼠肿瘤重
[0198]
试验结束时,对动物实施安乐死,剥取瘤块称重,小鼠瘤重情况见图2,具体的,对照组平均肿瘤重为7.0907
±
0.8349g,受试样品keytruda、pr、n7和n15平均肿瘤重分别为3.0556
±
0.9384g、5.1787
±
0.3078g、2.4394
±
0.7359g和3.0210
±
0.8778g。
[0199]
表5至表7及图1和图2的实验结果表明,除受试物pr外,受试物n7、n15和keytruda抗体单独治疗在hpd-l1-mc38肿瘤模型上均相对对照组取得了优异的抗肿瘤效果。n7、n15、keytruda在抗肿瘤效果上显著优于pr抗体,n7、n15相较keytruda在hpd-l1-mc38肿瘤模型上显示相当的抗肿瘤效果。
[0200]
以下实施例提供了纳米抗体n7(seq id no.3)制剂组成的建立与制备。
[0201]
实施例4制剂的缓冲体系筛选
[0202]
根据蛋白纯化工艺过程,本发明的制剂组成的开发过程分成缓冲液1和缓冲液2的开发,其中缓冲液1(uf/df buffer)用于超滤渗滤,缓冲液2(condition buffer)用于将超滤渗滤后的蛋白稀释至原液所需浓度。
[0203]
(1)制剂缓冲体系筛选:
[0204]
综合本发明纳米抗体自身结构特性,缓冲体系选择了磷酸盐、醋酸盐、柠檬酸盐、tris-hcl或组氨酸,浓度在2-50mm之间;ph的筛选范围为5.0-7.5。
[0205]
此外,渗透压调节剂和粘度调节剂选择nacl,浓度范围为0-150mm;稳定剂选择蔗糖、海藻糖或甘露醇,浓度范围为30-200mm。
[0206]
得到74种不同溶液,考察本发明纳米抗体以100mg/ml的浓度在74种溶液中先25℃/60%rh放置7天,随后40℃/75%rh放置3天后的理化性质,包括检测分子排阻色谱(sec),非还原十二烷基硫酸钠毛细管凝胶电泳(ce-sds),不溶性微粒(svp)等理化性质。检测项目及时间点如下表8所示。
[0207]
表8. 74种制剂的检测项目及时间点
[0208][0209]
74种制剂及其检测结果如下表9所示。
[0210]
表9. 74种制剂及其检测结果
[0211]
[0212]
[0213][0214]
[0215]
其中,第10天,当sec单体峰面积占比小于97.5%,则不进行后续ce-sds及svp检测,当ce-sds主峰面积占比小于97%,则不进行svp检测。svp标准,含10μm及以上微粒:不超过6000粒/ml;含25μm及以上微粒:不超过600粒/ml。
[0216]
根据预设的sec、ce-sds及svp检测标准,筛选出28种满足预设标准的制剂样品,汇总结果如下表10所示。
[0217]
表10. 28种满足预设标准的制剂
[0218][0219]
[0220]
表9、表10检测结果显示,磷酸盐、醋酸盐、组氨酸、tris-hcl缓冲体系均可用于本发明纳米抗体制剂,而柠檬酸盐缓冲体系制备的纳米抗体制剂稳定性相对较差。
[0221]
综合各检测结果,10.0mm磷酸盐、ph7.0和20mm醋酸盐、ph5.0的缓冲体系整体相对更优;蔗糖作为稳定剂相对甘露醇、海藻糖效果更优。根据上述结果,缓冲液1(uf/df buffer)选择10.0mm磷酸盐、ph7.0或20mm醋酸盐,ph5.0;对应的缓冲液2(condition buffer)选择10.0mm磷酸盐、氯化钠、蔗糖,ph7.0或20mm醋酸盐、氯化钠、蔗糖,ph5.0。
[0222]
(2)制剂配方筛选:
[0223]
进一步对制剂配方进行筛选,通过延长放置时间及40
±
5℃加速以进行制剂稳定性试验。根据制剂缓冲液筛选结果,选取10mm磷酸盐、ph7.0,20mm醋酸盐、ph5.0,氯化钠为0-100mm,蔗糖为30-100mm,聚山梨酯80为0%-0.02%,设计得到10组方案,具体方案如表11所示。
[0224]
表11. 10种制剂方案
[0225][0226][0227]
获得两种超滤渗滤蛋白:浓度为190.7mg/ml(uf/df buffer为10mm磷酸ph7.0);和浓度为203.8mg/ml(uf/df buffer为20mm醋酸盐、ph5.0),按照表11的制剂方案进行制剂制备,达到预设150mg/ml纳米抗体的制剂样品。
[0228]
将10种制剂样品放置于40
±
5℃/75%rh条件下进行稳定性研究,取样时间为t0,3天,7天和14天,分别进行外观、蛋白浓度、离子交换色谱(iec)、分子排阻色谱(sec)、非还原十二烷基硫酸钠毛细管电泳(非还原ce-sds)、不溶性微粒(svp)和渗透压的检测。检测项目及时间点如表12所示。
[0229]
表12.样品检测项目及时间点
[0230][0231][0232]
其中7a号样品处理时受到污染,只体现部分数据,其余试验结果见表13至表19所示。
[0233]
表13.样品高温稳定性研究外观结果
[0234][0235]
从表13结果可以看出,10种样品经40
±
5℃高温加速放置14天后,除7a号样品外,其余均澄清,颜色为淡黄色,未见浑浊及可见异物,表明本发明制剂缓冲液在纳米抗体150mg/ml的高浓度条件下,仍能保证纳米抗体良好的溶解度。
[0236]
表14.样品高温稳定性研究浓度结果(mg/ml)
[0237]
[0238]
从表14结果可以看出,各样品经高温加速放置14天后,蛋白浓度基本稳定。
[0239]
表15.样品高温稳定性研究离子交换色谱结果(%)
[0240][0241]
*7a号样品发生污染,在14天取样时出现浑浊,无法检测
[0242]
表15中iec检测结果显示,醋酸盐缓冲液随着时间推移,酸性峰与主峰减少、碱性峰增加;磷酸盐缓冲液,随着时间酸性峰有增加趋势,碱性峰和主峰略有减少。整体看,磷酸盐缓冲液均优于醋酸盐缓冲液。
[0243]
表16.样品高温稳定性研究分子排阻色谱结果(%)
[0244][0245]
*7a号样品发生污染,在14天取样时出现浑浊,无法检测
[0246]
由表16中的sec检测结果可以看出,10种样品经高温加速放置14天后,单体、聚体和碎片整体变化幅度较小,且磷酸盐缓冲液均稍优于醋酸盐缓冲液。
[0247]
表17.样品高温稳定性研究非还原ce-sds(单体)结果(%)
[0248][0249]
*未安排检测
[0250]
表17中非还原ce-sds检测结果显示,经过14天的高温放置,各样品抗体单体虽有小幅下降,但整体相对稳定。
[0251]
表18.样品高温稳定性研究不溶性微粒结果
[0252][0253]
表18中的不溶性微粒检测结果显示,大于25μm和大于10μm的不溶性微粒数量有所增加,但其数量仍远小于标准限定的数量(svp标准,含10μm及以上微粒:不超过6000/ml;含25μm及以上微粒:不超过600/ml)。
[0254]
考虑皮下注射的给药方式,制剂渗透压与人体血液渗透压等渗有利于皮下注射给药,对5种磷酸盐制剂样品进行渗透压检测,检测结果见表19。
[0255]
表19. 5种磷酸盐制剂样品渗透压结果
[0256][0257]
样品40
±
5℃放置14天后,根据表19中5种磷酸盐缓冲液制剂样品的渗透压检测结果,参见正常人体血液的渗透压摩尔浓度范围280-310mosm/kg,10a号样品的渗透压更接近人体等渗。
[0258]
(3)纳米抗体浓度筛选
[0259]
设置本发明纳米抗体100mg/ml、125mg/ml、150mg/ml和175mg/ml 4个浓度,分别采用本发明上述10a制剂配方和opdivo制剂配方按表20和表21提供的方案制备制剂样品1b-8b。
[0260]
表20.本发明10a制剂配方
[0261]
样品序号纳米抗体缓冲液ph蔗糖氯化钠聚山梨酯801b100mg/ml10mm磷酸盐7.030mm100mm0.02%2b125mg/ml10mm磷酸盐7.030mm100mm0.02%3b150mg/ml10mm磷酸盐7.030mm100mm0.02%4b175mg/ml10mm磷酸盐7.030mm100mm0.02%
[0262]
表21.opdivo制剂配方
[0263][0264]
将上述1b-8b共8种样品放置于40
±
5℃/75%rh条件下进行稳定性研究,取样时间为t0、7天和14天,分别进行外观、离子交换色谱(iec)、分子排阻色谱(sec)和不溶性微粒(svp)检测。检测项目及时间点如表22所示。
[0265]
表22.样品检测项目及时间点
[0266][0267]
表23.样品高温稳定性研究外观结果
[0268][0269][0270]
由表23检测结果可以看出,经40
±
5℃高温加速放置14天后,样品1b-3b呈淡黄色澄清,4b呈淡黄色微乳光,未见浑浊及可见异物,而样品5b-8b在第7天检测时均出现明显浑浊,可见本发明制剂组成相较opdivo制剂组成,在纳米抗体100-175mg/ml的高浓度条件下,能更好地保证纳米抗体制剂良好的溶解度。
[0271]
表24样品高温稳定性研究离子交换色谱结果(%)
[0272][0273]
*5b-8b号样品在第7天取样时浑浊严重,无法检测
[0274]
表25.样品高温稳定性研究分子排阻色谱结果(%)
[0275][0276][0277]
*5b-8b号样品在第7天取样时浑浊严重,无法检测
[0278]
表26.样品高温稳定性研究不溶性微粒结果
[0279][0280]
*5b-8b号样品在第7天取样时出现浑浊,未检测
[0281]
由表23至26检测结果可以看出,本发明的不同浓度的纳米抗体制剂在40
±
5℃放置14天后,iec、sec、svp整体较稳定,未出现明显异常变化,而采用opdivo制剂配方制备的4个浓度的纳米抗体制剂样品,第7天均出现了明显的浑浊,该结果显示,本发明制剂组成相较opdivo制剂组成更好地保证高浓度纳米抗体制剂的稳定性和溶解度。
[0282]
综合上述结果表明,本发明抗pd-1纳米抗体具有高亲和力、高抗原阻断效果和良好的抑瘤效果;同时,以本发明制剂组成制备的100-175mg/ml高浓度的纳米抗体制剂在40
±
5℃下放置14天后,样品外观、蛋白浓度、iec、sec、非还原ce-sds及不溶性微粒未见异常变化,各检测指标均符合现行产品质量标准。本发明纳米抗体制剂在高浓度的纳米抗体条件下保持良好的溶解度和稳定性,使其方便运输和储藏,提高了有效期;另外,本发明纳米抗体制剂具有的高浓度纳米抗体和近人体等渗的特点使其适宜皮下注射,方便患者给药。
[0283]
实施例5本发明的最优制剂
[0284]
5.1制剂规格
[0285]
采用每支1ml的规格,抗体浓度为150mg/ml,每瓶抗pd-1纳米抗体150mg。
[0286]
5.2原液(原液按制剂规格进行灌装即得成品)
[0287]
本发明注射液原液为澄清,无色至淡黄色液体。以抗pd-1纳米抗体150mg/ml、磷酸氢二钠1.2mg/ml、二水合磷酸二氢钠0.2mg/ml、氯化钠5.8mg/ml、蔗糖10.3mg/ml、聚山梨酯80 0.0002mg/ml为目标浓度,ph为7。
[0288]
5.3辅料
[0289]
生产中不使用辅料。原液制剂中使用的所有辅料均为药典级,列于表27。这些辅料之间不存在不相容性。
[0290]
表27.成品组成
[0291]
成分理论浓度(mg/ml)作用执行标准磷酸氢二钠1.2缓冲液中国药典2020版二水合磷酸二氢钠0.2缓冲液中国药典2020版氯化钠5.8调节渗透压和粘度中国药典2020版蔗糖10.3稳定剂中国药典2020版聚山梨酯800.0002稳定剂中国药典2020版
[0292]
磷酸盐缓冲液,ph 7.0
[0293]
作用:维持溶液ph
[0294]
浓度:在原液和成品中均为10mm磷酸盐缓冲液
[0295]
磷酸盐缓冲液在ph 7.0时具有良好的缓冲能力。10mm的磷酸盐缓冲液浓度在超滤和渗滤的配方工艺和贮存过程中足以维持原液和成品的ph值。
[0296]
蔗糖
[0297]
作用:稳定剂
[0298]
浓度:在原液和成品中均为30mm蔗糖
[0299]
蔗糖被用作一种稳定剂。浓度为30mm的蔗糖足以满足稳定原液和成品的长期贮存。
[0300]
氯化钠
[0301]
作用:渗透压调节剂和粘度调节剂
[0302]
浓度:在原液和成品中均为100mm氯化钠
[0303]
氯化钠作为一种渗透压和粘度调节剂,浓度为100mm的氯化钠能够满足皮下注射药品对渗透压和粘度的要求。
[0304]
聚山梨酯80
[0305]
作用:表面活性剂,防止聚集体和不溶性微粒的形成
[0306]
浓度:在原液和成品中均为0.02%
[0307]
聚山梨酯80为一种表面活性剂。浓度为0.02%的聚山梨酯80足以维持成品和原液在生产、运输和贮存期间的稳定性。
[0308]
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1