一种抗皮肤光老化的铁皮石斛提取物的制备方法及其应用
1.本发明涉及天然药物化学技术领域,具体涉及一种抗皮肤光老化的石斛提取物的制备方法及其应用。
背景技术:
2.皮肤是人体最大的器官,主要由表皮、真皮及皮下组织构成,并暴露于包括紫外线辐射在内的各种有害环境因素。皮肤老化包括光老化和内在老化,大约80%的皮肤老化主要是由光老化引起的。角质形成细胞位于人体最外层,又称上皮细胞,占表皮细胞的95%。角质形成细胞不仅是保护机体免受环境损害的重要皮肤屏障,也是对紫外线辐射的主要敏感细胞。紫外线照射可以导致皮肤屏障的损伤,活性氧(ros)的过量积累,从而使细胞产生炎症因子,最终导致皮肤炎症。细胞中的大量炎症因子上调基质金属蛋白酶(mmp)的表达,特别是基质金属蛋白酶-1(mmp-1)的上调导致胶原合成的下调以及细胞外胶原纤维的降解。随后导致真皮结构完整性受损。造成皮肤拉伸强度的损失并产生皱纹,造成皮肤衰老。
3.铁皮石斛(dendrobium officinale kimura et migo)为兰科(orchidaceae)石斛属多年生草本植物,又称黑节草,载于各版药典,是铁皮石斛药材的重要来源,主要分布于云南、浙江、安徽和广东等省份,在缅甸、越南也有分布。铁皮石斛主要含有菲类、多酚、多糖等化学成分,具有抗氧化,降糖,调节免疫和抗炎等活性。具有生津养胃;滋阴清热;润肺益肾;明目强腰等功效。铁皮石斛的茎作为传统中药可以用于肌肤润泽和消渴症。
4.以铁皮石斛为原料的化妆品在近年来大幅度增加,普遍认为铁皮石斛提取物,具有良好的保湿、修护抗氧化和抗炎的功效。现有技术中制备石斛多糖用于手工皂,具有去除皱纹和防止肌肤老化的作用。现有技术中制备方法得到的石斛提取物活性物质较为单一,且对抗皮肤光老化研究相对薄弱,因此需要开发一种简单且制得活性物质较多的铁皮石斛提取物的制备方法并应用于抗皮肤光老化。
技术实现要素:
5.本发明针对现有技术存在的问题,提供了一种抗皮肤光老化的铁皮石斛提取物的制备方法,所述方法制得的铁皮石斛提取物中活性物质含量较高且种类较多具有更好的抗皮肤光老化效果。
6.本发明的另一目的是提供一种抗皮肤光老化的铁皮石斛提取物。
7.本发明的又一目的是提供所述抗皮肤光老化的铁皮石斛提取物在作为化妆品原料中的应用。
8.为实现上述目的,本发明通过以下技术方案来实现的:
9.s1.将铁皮石斛进行前处理得到铁皮石斛粉末;
10.s2.将步骤s1.中的铁皮石斛粉末采用乙醇溶液进行提取、分离,得到残渣和乙醇提取液;所述乙醇溶液的质量分数为70%~80%,乙醇溶液中含有ph调节剂使其ph为2~3;
11.s3.将步骤s2.中的残渣加水搅拌提取,得到水提取液;
12.s4.将步骤s3.中的水提取液经超滤膜处理,收集分子量大于10kda的成分;
13.s5.将步骤s2.中的乙醇提取液和步骤s4.中分子量大于10kda的成分混合再进行浓缩、干燥得到铁皮石斛组合物。
14.发明人发现,将铁皮石斛在合适的乙醇浓度和ph下提取,可以有效的将铁皮石斛中的活性物质更多的提取出来,残渣再进行水提取,将乙醇提取液和水提取的相结合得到的铁皮石斛提取物,可以更有效降低细胞内ros的产生,抑制mmp-1和白细胞介素(il-1β)的mrna的表达水平,对抗皮肤光老化具有更显著作用。
15.优选地,步骤s1.中,所述前处理为冷冻干燥、粉碎、过筛。
16.优选地,所述过筛筛网目数为80~100目。
17.通过乙醇浓度和ph的调节可以将铁皮石斛中更多的活性物质进行提取。所述ph调节剂可以是常用的无机酸,例如是盐酸、硫酸、硝酸等。优选地,采用盐酸调节乙醇ph。
18.优选地,步骤s2.中,所述乙醇溶液的ph为2.5~3。
19.更优选地,步骤s2.中,所述乙醇溶液的质量分数为75%;ph为3。
20.优选地,步骤s2.中,提取方式为浸渍。
21.本发明中,可以参考现有的铁皮石斛提取物制备方法选用常用的固液比。优选地,步骤s2.中,铁皮石斛粉末和乙醇用量质量比为1:10~1:20。
22.更优选地,步骤s2.中,铁皮石斛粉末和乙醇用量质量比为1:15。
23.本发明中,可以参考现有的铁皮石斛提取物制备方法选用常用的提取时间。优选地,步骤s2.中,所述提取的时间为10~12h。
24.本发明中,可以参考现有的铁皮石斛提取物制备方法选用常用的提取温度。优选地,步骤s2.中,所述提取的温度为40~50℃。
25.优选地,步骤s3.中,残渣和水用量质量比为1:20~1:40。
26.更优选地,步骤s3.中,残渣和水用量质量比为1:30。
27.优选地,步骤s3.中,所述提取的温度为80~90℃。
28.优选地,步骤s3.中,提取的次数为3次,每次4h。
29.更优选地,步骤s4.中,所述超滤膜为10kda超滤膜。
30.优选地,步骤s5.中,浓缩条件为:真空度0.08~0.09mpa,转速为45~55r/min,温度为55~65℃。
31.优选地,步骤s5.中,所述干燥方式为冷冻干燥。
32.更优选地,步骤s5.中,冷冻干燥温度为-60~-80℃。
33.相比于现有技术,本发明实现了如下有益效果:
34.本发明提供了一种抗皮肤光老化的铁皮石斛提取物的制备方法,所述制备方法采用乙醇提取和水提取法相结合,在合适的乙醇浓度和ph下提取,可以有效的将铁皮石斛中的活性物质更多的提取出来,制备过程简单,成本低,毒性小,产业化程度高,制得的铁皮石斛提取物中活性物质较多,且含量高,各活性物质之间相互协同,对抗皮肤光老化具有显著作用,可以降低皮肤炎症产生和胶原蛋白的降解。
附图说明
35.图1为本发明提出的一种抗皮肤光老化的铁皮石斛提取物制备方法的流程示意
图;
36.图2实施例1~10和对比例1~6制得的铁皮石斛提取物和对照提取物对hacat细胞活力影响图;
37.图3为实施例1~10和对比例1~6制得的铁皮石斛提取物和对照提取物对hacat细胞ros含量变化图;
38.图4为实施例1~10和对比例1~6制得的铁皮石斛提取物和对照提取物对hacat细胞中相关屏障修复基因aqp-3、flg和involucrin的mrna的表达影响效果示意图;
39.图5为实施例1~10和对比例1~6制得的铁皮石斛提取物和对照提取物对hacat细胞中相关基因il-1β和mmp-1的mrna的表达影响效果示意图。
具体实施方式
40.下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
41.实施例中铁皮石斛提取物的制备流程图如图1所示。
42.实施例1
43.一种铁皮石斛提取物的制备方法,包括以下步骤:
44.s1.将铁皮石斛茎干燥、粉碎,过80目筛得铁皮石斛粉末;
45.s2.称取步骤s1.中铁皮石斛粉末100.2g,再加入1503g乙醇溶液在50℃搅拌提取12h,过滤得到残渣和乙醇提取液;所述乙醇溶液的质量分数75%,所述乙醇溶液中加入了盐酸调节其ph至3;
46.s3.在步骤s2.的残渣中,加入30倍质量比的80℃水中提取3次,每次4h;然后再8000r/min离心20min,过滤得到水提取液;
47.s4.将步骤s3.中的水提取液经10kda超滤膜处理,收集分子量大于10kda的成分;
48.s5.将步骤s2.中的乙醇提取液和步骤s4.中分子量大于10kda的成分混合再进行浓缩,浓缩条件为:真空度0.08~0.09mpa,转速为45~55r/min,温度为55~65℃,得到铁皮石斛提取物1。
49.实施例2
50.步骤和具体参数同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数70%,所述乙醇溶液中加入了盐酸调节其ph至2;制备得到铁皮石斛提取物2。
51.实施例3
52.步骤和具体参数同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数70%,所述乙醇溶液中加入了盐酸调节其ph至3;制备得到铁皮石斛提取物3。
53.实施例4
54.步骤和具体参数同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数75%,所述乙醇溶液中加入了盐酸调节其ph至2;制备得到铁皮石斛提取物4。
55.实施例5
56.步骤和具体参数同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数80%,所述乙醇溶液中加入了盐酸调节其ph至2;制备得到铁皮石斛提取物5。
57.实施例6
58.步骤和具体参数同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数80%,所述乙醇溶液中加入了盐酸调节其ph至3;制备得到铁皮石斛提取物6。
59.实施例7
60.步骤和具体参数同实施例1,区别在于,步骤s2.中,乙醇溶液的用量为1002g;得到铁皮石斛提取物7。
61.实施例8
62.步骤和具体参数同实施例1,区别在于,步骤s2.中,乙醇溶液的用量为2004g;得到铁皮石斛提取物8。
63.实施例9
64.步骤和具体参数同实施例1,区别在于,步骤s3.中,加入20倍质量比水;得到铁皮石斛提取物9。
65.实施例10
66.步骤和具体参数同实施例1,区别在于,步骤s3.中,加入40倍质量比水;得到铁皮石斛提取物10。
67.对比例1(仅采用乙醇提取液)
68.一种铁皮石斛提取物的制备方法,包括以下步骤:
69.s1.将铁皮石斛茎干燥、粉碎,过80目筛得铁皮石斛粉末;
70.s2.称取步骤s1.中铁皮石斛粉末100.2g,再加入1503g乙醇溶液在50℃搅拌提取12h,过滤得到残渣和乙醇提取液;所述乙醇溶液的质量分数75%,所述乙醇溶液中加入了盐酸调节其ph至3;
71.s3.将步骤s2.中的乙醇提取液浓缩,浓缩条件为:真空度0.08~0.09mpa,转速为45~55r/min,温度为55~65℃,得到对照提取物1。
72.对比例2(仅采用水提取液)
73.一种铁皮石斛提取物的制备方法,包括以下步骤:
74.s1.将铁皮石斛茎干燥、粉碎,过80目筛得铁皮石斛粉末;
75.s2.称取步骤s1.中铁皮石斛粉末100.2g,再加入1503g乙醇溶液在50℃搅拌提取12h,过滤得到残渣和乙醇提取液;所述乙醇溶液的质量分数75%,所述乙醇溶液中加入了盐酸调节其ph至3;
76.s3.在步骤s2.的残渣中,加入30倍质量比的80℃水中提取3次,每次4h;然后再8000r/min离心20min,过滤得到水提取液;
77.s4.将步骤s3.中的水提取液经10kda超滤膜处理,收集分子量大于10kda的成分;
78.s5.将步骤s4.中的分子量大于10kda的成分浓缩,浓缩条件为:真空度0.08~0.09mpa,转速为45~55r/min,温度为55~65℃,得到对照提取物2。
79.对比例3(s2.中乙醇溶液的ph为4)
80.步骤同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数75%,所述乙醇溶液中加入了盐酸调节其ph至4,得到对照提取物3。
81.对比例4(s2.中乙醇溶液的ph为1)
82.步骤同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数75%,所述乙醇
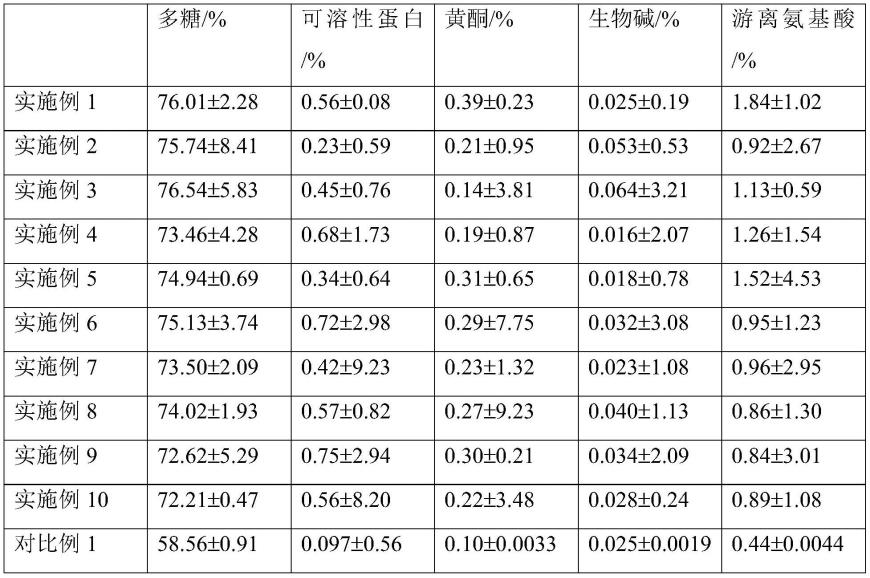
溶液中加入了盐酸调节其ph至1,得到对照提取物4。
83.对比例5(s2.中乙醇溶液的质量分数为65%)
84.步骤同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数65%,所述乙醇溶液中加入了盐酸调节其ph至3得到对照提取物5。
85.对比例6(s2.中乙醇溶液的质量分数为90%)
86.步骤同实施例1,区别在于,步骤s2.中,所述乙醇溶液的质量分数90%,所述乙醇溶液中加入了盐酸调节其ph至3,得到对照提取物5。
87.试验1活性物质含量测定
88.采用生物显色法检测上述制备的铁皮石斛提取物1~10和对照提取物1~6中多糖、可溶性蛋白、黄酮、生物碱和游离氨基酸进行测定,结果如表1所示。
89.表1
[0090][0091][0092]
从表1中可以看出,采用本技术制备方法制得的铁皮石斛提取物中各活性物质含量均较高。对比例1仅采用乙醇提取得到的对照提取物和对比例2仅采用水提取得到的对照提取物中多糖含量和游离氨基酸含量明显降低;从对比例3~6可以看出,当乙醇的ph过高或过低时,制得的对照提取物的多糖含量和游离氨基酸含量均明显下降;当乙醇的浓度过低时制得的对照提取物的多糖含量下降;当乙醇的浓度过高时制得的对照提取物的多糖含量和游离氨基酸含量均明显下降。
[0093]
试验2 uvb辐射和hacat细胞活力的测定
[0094]
hacat细胞为永生化人角质形成细胞,将hacat细胞培养在37℃,5%co2的细胞培养箱中,培养基为含15%胎牛血清(fbs)和1%链霉素-青霉素的dmem培养基。待细胞融合80%~90%时,用0.25%胰酶消化,制成细胞悬液,将细胞接种在96孔板中(5
×
104个/孔)。待细胞完全贴壁后,弃去培养基,pbs洗涤2-3次,少量pbs覆盖底部。将96孔板置于uvb紫外灯下(15w,主峰波长在280-380nm,波峰值在313nm,孔板距紫外灯10cm),照射剂量为60mj/cm2,结束后吸去pbs,加入不同浓度(10、20、50、100、200、400μg/ml)的各个实施例的铁皮石斛提取物1~10和对比例制备的对照提取物1~6各100ml,作为实验组。对照组为不经过紫外灯照射,并加入相同体积的新鲜培养基;模型组为经过相同紫外灯照射处理,但不加入提取物,加入相同体积的新鲜培养基。12h后,采用cck-8试剂盒测定细胞活力,结果如图2所示,其中##、###、####、*、**、***、****分别代表模型组vs对照组,p<0.01,p<0.001,p<0.0001;实验组vs模型组,p<0.05,p<0.01,p<0.001,p<0.0001;图2中任一样品浓度下从左至右依次为对照组、模型组、实施例1~10和对比例1~6。
[0095]
细胞相对活力计算:
[0096]
细胞相对活力(%)=(样品孔-调零孔)/(空白对照孔-调零孔)*100%。
[0097]
从图2可以看出,和对照组相比较,模型组的细胞活力显著下降(p<0.005),细胞活力仅对照组的61.84
±
6%左右。采用对比例2制备的铁皮石斛提取物处理对于uvb辐射后的hacat细胞的细胞活力没有明显恢复细胞活力效果。采用本发明方法制备的铁皮石斛提取物在50μg/ml的浓度下就已经可以将uvb防辐射后的hacat细胞活力提高至88.96
±
8.12%(实施例1)、86.73
±
2.61%(实施例2)、94.98
±
0.59%(实施例3)、84.21
±
9.42%(实施例4)、88.96
±
3.76%(实施例5)、85.38
±
0.51%(实施例6)、84.21
±
0.30%(实施例7)、83.96
±
2.09%(实施例8)、82.04
±
2.66%(实施例9)和81.93
±
0.42%(实施例10),且随着浓度升高呈现出明显的浓度依赖性;而采用对比例1~6制备的对照提取物在50μg/ml的浓度只能提高至72.59
±
6.95%(对比例1)、71.93
±
6.95%(对比例2)、73.57
±
4.23%(对比例3)、75.38
±
4.52%(对比例4)、69.37
±
0.38%(对比例5)和74.58
±
4.02%(对比例6)。从cck-8实验结果中可知:在uvb损伤hacat细胞光老化模型中,本发明的铁皮石斛提取物表现出较好的抗uvb诱导的光老化活性,具有更明显的抗皮肤光老化活性。
[0098]
试验3细胞内ros表达的测定
[0099]
用活性氧试剂盒检测hacat细胞内ros的生成。将对数期hacat细胞接种至6孔板中(7.5
×
105个/孔),待细胞完全贴壁后,弃去培养基,pbs洗涤2-3次,少量pbs覆盖底部。将96孔板置于uvb紫外灯下(15w,主峰波长在280-380nm,波峰值在313nm,孔板距紫外灯10cm),照射剂量为60mj/cm2,结束后吸去pbs,加入不同浓度(50、200、400μg/ml)的各个实施例的铁皮石斛提取物1~6和对比例制备的对照提取物1~6各100μl,作为实验组;对照组为不经过紫外灯照射,并加入相同体积的新鲜培养基;模型组为经过相同紫外灯照射处理,但不加入提取物,加入相同体积的新鲜培养基。阳性对照组为经过相同紫外灯照射处理,再加入5μg/ml的维甲酸100μl 12小时后,弃去培养基,pbs洗涤3次,参照活性氧检测试剂盒说明书,收集细胞,加入新鲜无血清含10μmol/l dcfh-da培养基,37℃避光孵育20分钟,随后pbs清洗3次。采用流式细胞仪检测细胞内ros含量,结果如图3所示,其中##、###、####、*、**、***、****分别代表模型组vs对照组,p<0.01,p<0.001,p<0.0001;
实验组vs模型组,p<0.05,p<0.01,p<0.001,p<0.0001;图3中任一样品浓度下从左至右依次为对照组、模型组、实施例1~10和对比例1~6。
[0100]
从图3可以看出,经过uvb辐射后,hacat细胞内产生大量的ros(p<0.005),采用本发明制备方法制得的铁皮石斛提取物可以显著抑制细胞内ros产生,对照组合物虽然相比于uvb辐射后的ros水平有一定下降但是效果明显比本发明制备方法得到的铁皮石斛提取物抑制效果差。
[0101]
试验4细胞内基质金属蛋白酶1(mmp-1)、白细胞介素(il-1β)、水通道蛋白(aqp-3)、内皮蛋白(involucrin)和flaggrin(flg)的mrna水平表达测定
[0102]
aqp-3、flg、involucrin、il-1β和mmp-1在hacat细胞内的mrna水平表达测定,采用实时荧光定量pcr技术。首先在在6孔板中接种hacat细胞(7.5
×
105个/孔),待细胞完全贴壁后,弃去培养基,pbs洗涤2-3次,少量pbs覆盖底部。将96孔板置于uvb紫外灯下(15w,主峰波长在280-380nm,波峰值在313nm,孔板距紫外灯10cm),照射剂量为60mj/cm2,结束后吸去pbs,加入不同浓度(50、200、400μg/ml)的各个实施例的铁皮石斛提取物1~6和对比例制备的对照提取物1~6各100μl,作为实验组;对照组为不经过紫外灯照射,并加入相同体积的新鲜培养基;模型组为经过相同紫外灯照射处理,但不加入提取物,加入相同体积的新鲜培养基。阳性对照组为经过相同紫外灯照射处理,再加入5μg/ml的维甲酸100μl。12小时后,收集细胞,提取rna,参照试剂盒进行反转测定,测定结果如图4和图5所示,其中##、###、####、*、**、***、****分别代表型组vs对照组,p<0.01,p<0.001,p<0.0001;实验组vs模型组,p<0.05,p<0.01,p<0.001,p<0.0001;图4中aqp-3、flg、involucrin的mrna水平从左至右依次为对照组、模型组、实施例1~10和对比例1~6;图5中il-1β、mmp-1的mrna水平从左至右依次为对照组、模型组、实施例1~10和对比例1~6。
[0103]
从图4可以看出,uvb辐射后会降低屏障修复基因flg、aop-3和involucrin的mrna表达。与模型组相比,本发明制备的铁皮石斛提取物可以显著提高flg、aqp-3和involucrin的mrna表达水平。而对比例1~6制备的对照石斛提取物虽然对flg的mrna表达水平有一定提高,但是仍显著低于本发明制备的铁皮石斛提取物。说明本发明制备方法制得的铁皮石斛提取物对于皮肤屏障紫外线损伤的修复作用有较好的效果。
[0104]
真皮中的胶原蛋白可以使皮肤保持结实而有弹性,紫外诱导细胞分泌的基质金属蛋白酶1(mmp-1)可以导致真皮中的基质过度降解,通过裂解i型和iii型纤维胶原蛋白进而导致皮肤的光老化。从图5可以看出,与模型组相比,对比例1~6制备的对照提取物也可以降低mmp-1的mrna水平表达,但没有显著性差异。采用本发明制备的铁皮石斛提取物对mmp-1的mrna水平表达降低效果显著,可以降低至模型组的50.31%,效果显著明显优于对比例1~6。
[0105]
il-1β能够激活角质形成细胞的表皮生长因子受体,诱导erk途径的磷酸化,从而增加mmp-1的表达,继而加速真皮中胶原蛋白的降解。与模型组相比,对比例1~6制备的铁皮石斛提取物也可以降低il-1βmrna水平表达,但是效果并不明显。实施例制备的铁皮石斛提取物可以显著降低hacat细胞的il-1β的mrna的表达,铁皮石斛提取物组分在不同浓度条件下均能有效抑制il-1β的产生,且抑制效果优于对比例1~6制备的对照提取物。
[0106]
综合来看,本发明制备方法制得的铁皮石斛提取物中的活性物质可以有效发挥修复皮肤屏障功能,降低皮肤炎症产生和胶原蛋白的降解,抵抗紫外线对皮肤产生皮肤光老
化。
[0107]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1