一种羟基红花黄色素A在调控缺血性脑卒中中的应用
一种羟基红花黄色素a在调控缺血性脑卒中中的应用
技术领域
1.本发明涉及医药技术领域,尤其是涉及一种羟基红花黄色素a在调控缺血性脑卒中中的应用。
背景技术:
2.中风被认为是全球死亡和残疾的主要原因,每年影响全球约1500万人,给家庭和社会造成沉重的经济负担。根据脑血管的病理变化,中风可以是缺血性中风(is)或出血性中风(脑出血和蛛网膜下腔出血)。缺血性中风是由脑血管闭塞引起的,导致流向脑组织的血流量减少。因此,重组组织纤溶酶原激活剂通过阻断血栓形成来恢复血流,是目前治疗脑梗死的主要方法。受到严格时间窗的限制,导致接受溶栓治疗的患者数量有限。虽然,近年来血管内治疗-取栓也增加了阻塞血管的再通率,但再灌注造成的损伤仍未解决。
3.自噬是指细胞自身的细胞质蛋白或细胞器被吞噬并包裹成囊泡,与溶酶体融合形成自噬溶酶体,然后将包裹的内容物降解,是一种自然的、受调节的过程。自噬可帮助细胞消除不必要的或功能失调的成分,包括长寿命蛋白质、不溶性蛋白质,甚至整个细胞器。
4.在饥饿、缺氧、营养缺乏和感染等应激条件下,可以激活自噬为细胞提供营养和能量。根据向溶酶体输送货物的方式,自噬由微自噬、巨自噬和分子伴侣介导的自噬(cma)组成。此外,自噬还可以去除受损的细胞内细胞器和异常折叠的蛋白质。由于自噬的这些影响,研究人员开始关注它与疾病的联系。许多研究发现自噬在心脑血管疾病、神经退行性疾病、感染和免疫中具有重要作用。
5.神经元是长寿命的有丝分裂后细胞,所以它们的大部分突触需要在有机体的整个生命周期内维持。为了防止神经元和突触功能障碍,神经元可以通过消除有毒或有缺陷的蛋白质和细胞器的机制,如自噬,以维持受调节的神经传递及其功能蛋白质组的完整性。同时,小胶质细胞作为中枢神经系统(cns)的固有免疫细胞,在缺血性脑卒中的过程中与自噬、炎症、氧化应激等反应密切相关。卒中后神经细胞恢复过程中的组织重塑和修复,小胶质细胞的自噬-炎症机制在其中发挥着重要作用。了解缺血再灌注后自噬与炎症对神经系统的影响,将为脑卒中的治疗提供新的方向。
6.鉴于此,探索缺血后神经组织中自噬的发生和调控,可能有助于脑卒中的诊断、预后和治疗以及脑卒中神经保护策略的发展。
技术实现要素:
7.本发明的目的是提供一种可调控缺血性脑卒中后细胞自噬功能的药物,并进一步提供羟基红花黄色素a在调控细胞自噬方面的新用途。
8.为实现上述目的,本发明提供了一种羟基红花黄色素a在制备治疗缺血性脑卒中药物中的应用。
9.一种羟基红花黄色素a在制备靶向调控细胞自噬药物中的应用。
10.一种羟基红花黄色素a在制备促进ogd/r损伤后细胞自噬药物中的应用。
11.一种羟基红花黄色素a在制备促进ogd/r损伤后神经保护药物中的应用。
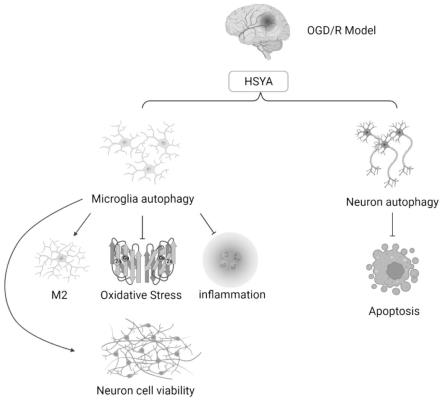
12.因此,本发明采用上述一种羟基红花黄色素a在调控缺血性脑卒中中的应用,通过构建体外糖氧剥夺/复糖复氧(ogd/r)模型模拟缺血性脑卒中,验证羟基红花黄色素a靶向细胞通过自噬产生神经保护的作用机制,并能调控细胞自噬的功能,促进自噬的小胶质细胞m2型表达增多,减轻ogd/r损伤下的炎症和氧化应激损伤,并减轻神经元的损伤。同样,羟基红花黄色素a对靶向神经元的自噬激活也产生着神经保护作用。本发明在制备由羟基红花黄色素a促进细胞自噬治疗缺血性脑血管疾病的药物中具有积极意义。
13.总体来说,羟基红花黄色素a(hydroxysafflor yellow a,hsya)促进小胶质细胞向抗炎m2表型转化。羟基红花黄色素a在如下方面也具有作用:
14.(1)调控神经元及小胶质细胞自噬功能;
15.(2)促进神经元表现出高水平的自噬和稳定的自噬流;
16.(3)促进神经元自噬可减轻卒中后细胞的凋亡水平;
17.(4)促进小胶质细胞自噬具有减轻炎症、抗氧化应激及减轻神经元凋亡的作用。
18.下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
19.图1为本发明所述的羟基红花黄色素a调控的流程图;
20.图2为本发明所述的羟基红花黄色素a促进小胶质细胞在ogd/r损伤下自噬激活的结果图;
21.图3为本发明所述的羟基红花黄色素a促进ogd/r损伤下小胶质细胞自噬对极化、炎症和氧化应激影响的结果图;
22.图4为本发明所述的羟基红花黄色素a促进小胶质细胞自噬产生神经保护作用的结果图;
23.图5为本发明所述的羟基红花黄色素a调控ogd/r损伤下神经元自噬的结果图;
24.图6为本发明所述的羟基红花黄色素a通过对神经元的自噬激活减轻ogd/r环境下细胞凋亡的结果图;
25.图7为本发明所述的羟基红花黄色素a促进神经元自噬相关机制的结果图。
具体实施方式
26.以下通过附图和实施例对本发明的技术方案作进一步说明。
27.除非另外定义,本发明使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
28.对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的主旨或基本特征的情况下,能够以其它的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
29.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当
将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其它实施方式。这些其它实施方式也涵盖在本发明的保护范围内。
30.还应当理解,以上所述的具体实施例仅用于解释本发明,本发明的保护范围并不限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明/发明的保护范围之内。
31.本发明中使用的“包括”或者“包含”等类似的词语意指在该词前的要素涵盖在该词后列举的要素,并不排除也涵盖其它要素的可能。本发明中使用的术语“约”具有本领域技术人员公知的含义,优选指该术语所修饰的数值在其
±
50%,
±
40%,
±
30%,
±
20%,
±
10%,
±
5%或
±
1%范围内。
32.本公开使用的所有术语(包括技术术语或者科学术语)与本公开所属领域的普通技术人员理解的含义相同,除非另外特别定义。还应当理解,在诸如通用词典中定义的术语应当被理解为具有与它们在相关技术的上下文中的含义相一致的含义,而不应用理想化或极度形式化的意义来解释,除非本文有明确地这样定义。
33.对于相关领域普通技术人员已知的技术、方法和设备可能不作为详细讨论,但在适当情况下,所述技术、方法和设备应当被视为说明书的一部分。
34.本发明说明书中引用的现有技术文献所公开的内容整体均通过引用并入本发明中,并且因此是本发明公开内容的一部分。本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
35.本发明中使用的部分试剂和仪器如下所示:
36.羟基红花黄色素a(上海诗丹德标准技术服务有限公司),mtt检测试剂盒(solarbio公司),ldh检测试剂盒(solarbio公司),抗lc3b抗体(美国abcam公司),抗beclin-1抗体(美国abcam公司),抗p62抗体(美国abcam公司),抗hif-1α抗体(美国abcam公司),抗inos抗体(美国abcam公司),抗arg-1抗体(美国cell signaling technology公司),抗β-actin多克隆抗体(美国cell signaling technology公司),抗gapdh多克隆抗体(德国millipore公司),抗bnip3抗体(美国cell signaling technology公司),自噬抑制剂3-ma(美国sigma公司),免疫荧光二抗(美国abcam公司),elisa il-1β(美国elabsccience公司),elisa tnf-α(美国elabsccience公司),elisa il-10(美国elabsccience公司),mcherry-gfp-lc3b腺病毒(中国汉恒生物科技有限公司),annexin/pi染色试剂盒(中国solarbio公司),超氧化物歧化酶活性检测试剂盒(sod)(solarbio公司),活性氧检测试剂盒(ros)(solarbio公司),tunel染色(中国碧云天生物科技有限公司)。
37.流式细胞仪(美国bd公司),超速离心机(日本日立公司),荧光显微镜(德国莱卡公司),电泳仪(美国伯乐公司),多功能酶标仪(美国md公司),厌氧培养箱(美国bax公司),化学发光仪(美国ge healthcare life sciences公司)。
38.本发明中涉及到的试验数据以means
±
sem表示,两组之间采用student t检验,三组之间采用one-way anova检验(m-w法)对组间差异进行比较。统计学分析结果p《0.05认为有显著性差异,p《0.01认为有极显著性差异。
39.实施例一
40.羟基红花黄色素a调控小胶质细胞自噬功能,进而保护神经元的体外验证试验
41.一、细胞培养
42.永生的bv-2小鼠小胶质细胞细胞系(中国北纳生物科技有限公司)在完全培养基培养,dmem和10%胎牛血清(美国gibco公司),100u/ml青霉素和100μg/ml链霉素(北京索莱宝科技有限公司),在37℃,5%co2培养箱培养。
43.将培养的小胶质细胞以1
×
104/cm2的细胞密度接种于培养板(12/24/48孔)或6cm培养皿中,待完全贴壁后进行ogd/r造模,在复糖氧阶段采用最佳hsya浓度干预一定时间,并用于之后的实验。
44.二、模型分组及药物干预
45.实验以ogd1.5h/r12h建立缺血性脑卒中模型。
46.实验分组:正常组;ogd/r组;ogd/r+hsya组;ogd/r+3ma组;ogd/r+3ma+hsya组。
47.实验分为不同浓度干预组,不同浓度hsya干预分五组:1μg/ml,5μg/ml,25μg/ml,75μg/ml和150μg/ml于复糖复氧阶段进行干预。
48.三、检测方法
49.细胞实验样本:ogd/r造模及药物干预12h后,吸取细胞上清液,mtt、ldh法检测细胞活性;elisa法检测细胞因子;细胞上清液干预神经元细胞系ht22,通过ldh、tunel法观察神经保护作用;收集细胞离心,提取蛋白用western blot检测lc3b、beclin-1、p62、arg-1、inos水平表达;收集细胞爬片,pbs洗涤,免疫荧光染色观察arg-1、inos表达。
50.免疫荧光染色:细胞爬片用pbs洗涤3次,1%bsa封闭30分钟,pbs浸洗,用1%bsa联合0.3%triton稀释一抗,置于湿盒孵育12-18小时,弃去一抗,pbs重复浸洗3次,荧光二抗(1:1000)孵育2小时,重复pbs浸洗,dapi(1:1000)复染细胞核,重复pbs浸洗,50%甘油封片,荧光显微镜下检测。
51.elisa检测相关细胞因子:
52.a)包板:每孔加入包被抗体工作液100μl,4℃过夜;
53.b)洗板:用wash buffer洗涤96孔板3次,滤纸控干;
54.c)封闭:每孔各加入1%bsa100μl,室温封闭l小时;
55.d)洗板:用洗涤液将反应板充分洗涤3次,滤纸控干;
56.e)加样和建立标准曲线:设标准孔8孔,每孔中各加入标准品稀释液100μl,第一孔中加入标准品100μl,混匀后用加样器吸出100μl,移至第二孔,如此反复作对倍稀释至第七孔,最后从第七孔中吸出100μl弃去,使之体积均为100μl,第八孔为空白对照。待测样品每孔分别加入100μl,室温反应2h;
57.f)洗板:用洗涤液将反应板充分洗涤6次,滤纸控干;
58.g)每孔中加入检测抗体工作液100μl,室温反应lh;
59.h)洗板:用洗涤液将反应板充分洗涤3次,滤纸控干;
60.i)每孔中加入hrp标记的亲和素工作液100μl,室温l小时;
61.j)洗板:用洗涤液将反应板充分洗涤3次,滤纸控干;
62.k)每孔加入100μl底物工作液,室温避光反应5-30分钟;
63.l)每孔加入100μl终止液终止反应;
64.m)酶标仪450nm处测定吸光值,根据标准曲线计算样品中各因子浓度。
65.western blot蛋白检测:细胞加入裂解液,超声破碎匀浆,4℃低温裂解30分钟后12000rpm离心30分钟。留取上清bca法检测样品蛋白浓度,-80℃冷冻样品备用,避免反复冻
融。定量蛋白样品(约30μg)与等体积的loading buffer上样缓冲液混匀,100℃水浴5分钟,用10%sds-page不连续凝胶电泳分离蛋白。电泳完毕后,200ma低温湿式电转移2小时转膜。随后将pvdf膜用5%脱脂牛奶室温封闭1小时。用tbst分别稀释抗lc3b(1:1000)、beclin-1(1:1000)、p62(1:1000)、arg-1(1:1000)、inos(1:1000)和抗gapdh(1:1000)等抗体,4℃孵育过夜。次日稀释相应hrp偶联的二抗(1:1000),室温孵育1小时。洗膜后使用扫描仪检测染色条带强度,通过检测蛋白条带光密度与内参gapdh的光密度比值来观察两组间的差异。
66.结果发现,如图2,与ogd/r组相比,hsya干预后的bv2细胞的自噬水平明显提高(**p《0.01);3ma能拮抗这种自噬激活。由此说明,本发明所述的hsya能够促进小胶质细胞ogd/r损伤后的自噬功能。
67.如图3,hsya干预治疗可有效调控ogd/r损伤小胶质细胞arg-1、inos的表达。western blot结果表明,与ogd/r组相比,hsya干预可显著上调arg-1的表达并减少inos的表达(**p《0.01和***p《0.001);同样elisa结果显示,hsya干预下炎性因子il-1β、tnf-α表达降低,抗炎因子il-10表达升高(**p《0.01、**p《0.01和***p《0.001),超氧化物歧化酶sod在hsya的干预下较ogd/r组表达提升(**p《0.01),但这些作用均可被3ma所逆转甚至抵消。由此说明,hsya促进小胶质细胞的自噬可促进m2型转化,减轻炎症表达并发挥抗氧化应激的作用。
68.如图4,hsya可以减轻神经元细胞损伤水平。结果表明,hsya干预降低了神经元细胞ldh的释放,但随着自噬被抑制,神经元细胞的损伤明显提高(**p《0.01),hsya促进小胶质细胞自噬可以保护神经元细胞免受损伤。
69.实施例二
70.羟基红花黄色素a调控ogd/r损伤神经元自噬对神经保护作用的体外验证试验
71.一、细胞培养
72.永生的sh-sy5y人神经母细胞瘤细胞(上海申科生物科技有限公司)在完全培养基培养,dmem和10%胎牛血清(美国gibco公司),100u/ml青霉素和100μg/ml链霉素(北京索莱宝科技有限公司),在37℃,5%co2培养箱培养。
73.将培养的sh-sy5y细胞以1
×
105/cm2的细胞密度接种于培养板(12/24/48孔)或6cm培养皿中,待完全贴壁后进行ogd/r造模,在复糖氧阶段采用最佳hsya浓度干预一定时间,并用于之后的实验。
74.二、模型分组及药物干预
75.实验以ogd6h/r12h建立缺血性脑卒中模型。
76.实验分组:正常组;ogd/r组;ogd/r+hsya组;ogd/r+3ma组;ogd/r+3ma+hsya组。
77.实验分为不同浓度干预组,不同浓度hsya干预分五组:1μg/ml,5μg/ml,25μg/ml,75μg/ml和150μg/ml于复糖复氧阶段进行干预。
78.三、检测方法
79.细胞实验样本:ogd/r造模及药物干预12h后,吸取细胞上清液,mtt、ldh法检测细胞活性;tunel法观察神经保护作用;收集细胞离心,提取蛋白用western blot检测lc3b、beclin-1、p62、hif-1α、bnip3水平表达;收集细胞离心,pbs洗涤,流式细胞术观察annexinv/pi凋亡水平;mcherry-gfp-lc3b腺病毒转染,收集细胞爬片,pbs洗涤,免疫荧光染色观察自噬流水平表达。
80.tunel免疫荧光染色:将sh-sy5y细胞以5
×
105个/孔的密度接种于含载玻片pdl包被的6孔板中,置于5%co2、37℃的细胞培养箱中培养。12h后,细胞进行ogd/r处理。随后4%多聚甲醛于4℃固定40min,pbs洗3次,每个样品加入100μl蛋白酶k溶液(浓度为20μg/ml),室温透膜5min。然后滴加100μl 1
×
equilibration buffer覆盖玻片,室温平衡处理30min。吸掉多余液体后,每个样本中加入50μl tunel染液,然后将样品于湿盒内37℃避光孵育1h。pbs漂洗3次,接着用抗荧光淬灭剂封片,倒置荧光显微镜(发射波长525nm)观察拍照。
81.western blot蛋白检测:细胞加入裂解液,超声破碎匀浆,4℃低温裂解30分钟后12000rpm离心30分钟。留取上清bca法检测样品蛋白浓度,-80℃冷冻样品备用,避免反复冻融。定量蛋白样品(约30μg)与等体积的loading buffer上样缓冲液混匀,100℃水浴5分钟,用10%sds-page不连续凝胶电泳分离蛋白。电泳完毕后,200ma低温湿式电转移2小时转膜。随后将pvdf膜用5%脱脂牛奶室温封闭1h。用tbst分别稀释抗lc3b(1:1000)、beclin-1(1:1000)、p62(1:1000)、hif-1α(1:1000)、bnip3(1:1000)和抗gapdh(1:1000)等抗体,4℃孵育过夜。次日稀释相应hrp偶联的二抗(1:1000),室温孵育1小时。洗膜后使用扫描仪检测染色条带强度,通过检测蛋白条带光密度与内参β-actin、gapdh的光密度比值来观察两组间的差异。
82.annexinv/pi双染流式细胞术分析细胞凋亡:在6孔板中以1.7*105每孔的密度种入sh-sy5y细胞,培养过夜使之充分贴壁。孔板中,阴性对照组仅以dmem培养基混合10%fbs和4%双抗培养48h,阳性对照组加入40mg/ml的pa培养48h。其他各个孔依照实验设计给予不同处理。处理完成后,取出培养基,以pbs洗涤细胞2次,加入无edta的胰酶消化并收集细胞,最后再用pbs洗涤一次。将上述培养基、pbs洗涤液和胰酶消化后的细胞悬液混合收集在15ml离心管中。在室温下离心1000rpm/5min。弃去所有上清,使用binding buffer(bd)将所有细胞分组重悬,浓度不超过1*106每100μl。然后使用5μl annexin v-fitc(annexin vfluorescein isothiocyanate)和5μl pi(propidium iodide)染色标记各类细胞,将细胞在室温下避光孵育15分钟后,即可再向各管加入400μl binding buffer稀释细胞。处理完成后即可使用流式细胞仪观测细胞荧光信号。
83.本测试根据细胞fitc-pi荧光信号的强度统计细胞死亡类型。以fitc强度为x轴,pi强度为y轴,将fitc(-)且pi(-)的信号视为存活细胞,将fitc(-)且pi(+)的信号视为死亡细胞碎屑、细胞残片和杂质,将fitc(+)且pi(-)的信号视为早期凋亡的细胞,将fitc(+)且pi(+)的信号视为晚期凋亡和坏死细胞。
84.mcherry-gfp-lc3b腺病毒转染:感染ad-mcherry-gfp-lc3b的sh-sy5y细胞以5
×
105/孔的密度接种于含载玻片pdl包被的6孔板中,置于5%co2、37℃细胞培养箱中培养。次日,进行ogd/r等处理。移去培养基,用无血清dmem漂洗3次后,加入4μg/ml的dapi染液,避光常温孵育10min。再用无血清dmem漂洗3次,用抗荧光淬灭剂封片,在倒置荧光显微镜观察拍摄。
85.mcherry-gfp-lc3b串联荧光蛋白是专门用于检测自噬流水平的融合蛋白,自噬活化时gfp荧光信号在进入溶酶体后由于ph值的下降会出现淬灭,但是mrfp或mcherry荧光基团的ph值稳定性比gfp高,在进入自噬溶酶体后仍能发出荧光。因此,在使用mrfp/mcherry-gfp-lc3b融合蛋白进行细胞实验时,同时观察红色荧光和绿色荧光的强度变化可以准确判断细胞自噬活性。若细胞内出现绿色荧光和红色荧光共定位,即出现黄色荧光时表明mrfp/
mcherry-gfp-lc3b融合蛋白并未与溶酶体发生融合或自噬溶酶体中的ph值较高,进而代表了自噬流的阻断。当细胞内仅出现红色荧光而无绿色荧光时,代表mrfp/mcherry-gfp-lc3b融合蛋白定位于溶酶体或自噬溶酶体内,即自噬流活化。
86.透射电镜观察细胞形态:
87.a)收集经过处理的细胞,离心后待细胞贴壁用pbs清洗。
88.b)第一次固定:使用2.5%戊二醛固定组织样本。固定液用量一般应为组织块体积的50倍。在戊二醛中固定的标本体积可以稍大,每个标本用2ml。
89.c)第二次固定:第一次固定完成后使用0.2m的磷酸缓冲液漂洗两次,30min/次。然后再用1%锇酸(0.1m磷酸缓冲)固定液固定2h。在俄酸中固定的组织块很小,1mm3以下的组织块一般用0.5ml固定液即可。
90.d)丙酮梯度脱水:用蒸馏水短暂冲洗,洗去表面固定液。然后用丙酮梯度脱水。
91.e)醋酸异戊酯置换:将100%丙酮脱水后标本放在醋酸异戊酯中,以置换丙酮。
92.f)临界点干燥:将标本转移到临界点干燥装置中,充以液态co2,临界点干燥。
93.g)将干燥后的组织块用导电胶粘在样品托上,待导电胶干后镀膜。
94.h)包埋:用离子镀膜仪给样品镀上金膜,环氧树脂包埋。
95.i)定位切片:使用半薄切片定位,超薄切片,乙酸双氧铀染,柠檬酸铅染。
96.j)透射电子显微镜观察。
97.结果发现,如图5,western blot结果表明,hsya可有效促进ogd/r损伤急性期sh-sy5y细胞lc3、beclin-1的表达以及降低p62的水平(**p《0.01);透射电镜观察到hsya的干预可增加自噬体的形成并减轻ogd/r对线粒体的损害;mcherry-gfp-lc3b腺病毒转染后,免疫荧光结果显示,hsya处理过的sh-sy5y细胞的自噬流稳定增多(**p《0.01)。由此说明,hsya能够促进sh-sy5y细胞在ogd/r损伤后的自噬作用。
98.如图6,hsya干预治疗可有效降低sh-sy5y细胞在ogd/r损伤下的凋亡水平。western blot结果表明,与ogd/r组相比,hsya干预可明显降低细胞cleaved-caspase3和bax的表达并上调bcl-2水平(**p《0.01、**p《0.01和***p《0.001);流式细胞术的凋亡水平分析与tunel结果相近(**p《0.01)。由此说明,hsya处理可减轻sh-sy5y细胞的凋亡水平,产生神经保护作用。
99.如图7,western blot结果表明,hsya能够促进ogd/r损伤sh-sy5y细胞中hif-1α、bnip3表达(**p《0.01和*p《0.05)并且hif-1α通路抑制剂yc1的干预可抵抗这一作用(**p《0.01);tunel结果显示,hsya可抵抗ogd/r对sh-sy5y细胞凋亡水平的增加,但这一结果被yc1所逆转(**p《0.01)。可见hsya调控ogd/r损伤sh-sy5y细胞的自噬与hif-1α/bnip3信号通路相关。
100.经过药物干预的小胶质细胞表现出更多的自噬表达,含hsya的小胶质细胞条件培养液减轻ogd/r对神经元细胞的损害程度。另外,hsya激活ogd/r条件下小胶质细胞自噬可减轻炎症、氧化应激损伤并调控其m2型表达。同样的,hsya对神经元的自噬激活也可发挥ogd/r损伤下的神经保护作用。
101.调控卒中后细胞自噬功能对于减轻凋亡、改善脑内炎性微环境,发挥神经保护起到至关重要的作用。在缺血性脑卒中的早期促进细胞的自噬功能,可上调自噬相关信号通路;降低脑内的炎性反应,减少细胞凋亡水平,减轻氧化损伤;促进小胶质细胞的抗炎表型
转化。
102.因此,本发明采用上述一种羟基红花黄色素a在调控缺血性脑卒中中的应用,对缺血性脑卒中的治疗及预后具有重要作用。
103.最后应说明的是:以上实施例仅用以说明本发明的技术方案而非对其进行限制,尽管参照较佳实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对本发明的技术方案进行修改或者等同替换,而这些修改或者等同替换亦不能使修改后的技术方案脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1