一种改善胰岛素抵抗症状的药物组合物
1.本发明涉及一种改善胰岛素抵抗症状的药物组合物。
背景技术:
2.胰岛素抵抗是2型糖尿病的显著特征和发病机制的重要环节之一,也是心血管疾病等慢性代谢综合征的一个重要危险因素。一般认为,2型糖尿病是难以治愈的终身性疾病,而胰岛素抵抗是可治愈的。通过早期干预治疗,严格控制饮食、加强锻炼等生活方式干预后,可治疗胰岛素抵抗,从而降低其向2型糖尿病的转变率。
3.免疫系统是人体抵御微生物、化学、物理和心理损伤的第一道防线,通过各种反应修复损伤,避免或隔离威胁,恢复体内平衡。自身免疫和慢性炎症与胰岛素抵抗和2型糖尿病密切相关,淋巴细胞、炎症因子和自身抗体都参与了2型糖尿病患者胰岛细胞损伤的过程。因此,提高免疫对胰岛素抵抗和/或糖尿病患者而言是获益的。
4.黄芪多糖是从黄芪的茎或干根中提取的一种具有生物活性的水溶性杂多糖,其具有多种药理作用,包括调节免疫功能、抗衰老、抗肿瘤、降低血脂、抗纤维化、抗菌、辐射防护和抗病毒作用等[a review of the pharmacological action of astragalus polysaccharide. front pharmacol. 2020; 11: 349]。研究发现黄芪多糖在预防糖尿病肾病、糖尿病性肝损伤等方面具有显著优势。中国专利cn103285113b公开了山楂黄酮与黄芪多糖组合具有显著降低糖尿病空腹及餐后血糖、改善胰岛素敏感性方面的新用途。而山楂黄酮及黄芪多糖单独给药,均未显示理想的抗糖尿病效应。
[0005]
二甲双胍被国内外糖尿病诊治指南推荐为2型糖尿病临床治疗的首选药。然而,临床上约30%的2型糖尿病患者使用二甲双胍疗效欠佳甚至无效,且二甲双胍临床疗效随着用药时间延长有效率降低[glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. n engl j med, 2006; 355(23): 2427-2443.]。因此,亟待探索二甲双胍辅助治疗的药物。既往研究采用大剂量的二甲双胍(500 mg/kg)与黄芪多糖(1500 mg/kg)联合治疗衰老2型糖尿病小鼠,结果表明黄芪多糖与二甲双胍联合治疗对衰老糖尿病肝脏组织损伤、肾脏病变、肝组织细胞线粒体及内质网具有保护作用,改善衰老糖尿病小鼠肝脏糖脂代谢[黄芪多糖联合二甲双胍对衰老2型糖尿病小鼠肾组织糖原代谢及超微结构的影响.时珍国医国药, 2019; 30(4): 827-829; 黄芪多糖联合二甲双胍对衰老2型糖尿病模型小鼠肝脏糖脂代谢的影响.中国中医药信息杂志, 2019; 26(2): 47-51; 黄芪多糖联合二甲双胍对衰老糖尿病小鼠肝脏mrna表达谱的影响及功能分析.时珍国医国药, 2020; 31(5): 1043-1046]. 但上述研究并未明确黄芪多糖的物质内涵,即仍然处于黄芪多糖粗提物阶段,未阐明其药效部位(分子量及单糖组成特征),然而这却是影响黄芪多糖药理作用发挥的重要因素。
[0006]
鉴于此,特提出此发明,旨在明确精制黄芪多糖化学组成特征及其与二甲双胍形成可改善胰岛素抵抗症状的药物组合物。
技术实现要素:
[0007]
本发明提供了一种改善胰岛素抵抗症状的药物组合物,所述药物组合物包含一种水溶性杂多糖和二甲双胍。
[0008]
优选的,所述水溶性杂多糖为一种黄芪多糖,进一步的,是一种精制黄芪多糖。
[0009]
具体地,所述精制黄芪多糖是黄芪多糖的高压液相色谱谱图中的4个峰中,以保留时间从小到大排列的第二个峰所代表的黄芪多糖,在本文中将其命名为精制黄芪多糖。所述的高压液相色谱方法为称取黄芪多糖样品50.0 mg于10 ml容量瓶中,用0.1 mol/l硝酸钠溶解,定容。采用waters的1525高效液相色谱仪以ultrahydrogel
™ꢀ
linear色谱柱对样品进行分离分析,分析时间为30 min。
[0010]
所述水溶性杂多糖或精制黄芪多糖的分子量为mw 12503 da。
[0011]
进一步的,所述水溶性杂多糖或精制黄芪多糖中包含7种单糖,所述7种单糖分别是甘露糖、氨基葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,且甘露糖:氨基葡萄糖:鼠李糖:半乳糖醛酸:葡萄糖:半乳糖:阿拉伯糖的含量比为0.34:0.29:0.14:0.61:94.19:1.17:3.26。在一个具体实施例中,所述精制黄芪多糖由如上所述的7种单糖组成,所述7种单糖的比例也如上述比例所示。
[0012]
在一些实施方式中,所述水溶性杂多糖或精制黄芪多糖与二甲双胍的质量比为6~9: 2~5,优选的,所述水溶性杂多糖或精制黄芪多糖或与二甲双胍的质量比为7:3。
[0013]
容易被理解的,上述改善胰岛素抵抗症状的药物组合物还含有一种或者多种药学上可接受的载体或辅料。在另一些实施方式中,所述药物组合物由所述水溶性杂多糖和二甲双胍组成;在另一些实施方式中,所述药物组合物由所述精制黄芪多糖和二甲双胍组成。
[0014]
在一些实施方式中,所述药物组合物中的水溶性杂多糖或精制黄芪多糖与二甲双胍分开使用,在另一些实施方式中,它们一起使用;在一些实施方式中,所述药物组合物中的水溶性杂多糖或精制黄芪多糖与二甲双胍同时使用,在另一些实施方式中,它们不同时使用。
[0015]
进一步的,所述药物组合物的药物剂型选自但不限于口服剂型、注射给药剂型、呼吸道给药剂型、黏膜给药剂型或腔道给药剂型中的一种。在一个具体实施例中,所述药物组合物的药物剂型为口服剂型。
[0016]
本发明还提供了一种能够促进二甲双胍改善胰岛素抵抗症状的水溶性杂多糖,所述水溶性杂多糖包含7种单糖,所述单糖分别是甘露糖、氨基葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,且甘露糖:氨基葡萄糖:鼠李糖:半乳糖醛酸:葡萄糖:半乳糖:阿拉伯糖为0.34:0.29:0.14:0.61:94.19:1.17:3.26。在一个具体实施例中,所述水溶性杂多糖由如上所述的7种单糖组成,所述7种单糖的比例也如上述比例所示。在一些具体实施方式中,所述水溶性杂多糖是如上所述的精制黄芪多糖。
[0017]
进一步的,所述水溶性杂多糖的分子量为mw 12503 da。
[0018]
本发明还提供了一种如上所述的水溶性杂多糖在促进二甲双胍改善胰岛素抵抗症状中的应用。在一些具体实施方式中,所述水溶性杂多糖是如上所述的精制黄芪多糖。
[0019]
与现有技术相比,本发明的有益效果:本发明公开了一种改善胰岛素抵抗症状的药物组合物,所述药物组合物包含一种水溶性杂多糖水溶性杂多糖与二甲双胍,在一些具体实施方式中,所述水溶性杂多糖水溶
性杂多糖的分子量为mw 12503 da,其中,所述水溶性杂多糖由7种单糖组成,且甘露糖:氨基葡萄糖:鼠李糖:半乳糖醛酸:葡萄糖:半乳糖:阿拉伯糖为0.34:0.29:0.14:0.61:94.19:1.17:3.26。所述水溶性杂多糖与二甲双胍质量比为6~9:2~5,优选质量比为7:3。经实验证明:所述水溶性杂多糖辅助二甲双胍治疗时通过调节脂代谢、增强体液免疫、增强细胞免疫、减少炎症等途径提高二甲双胍降糖的敏感性。本发明发现所述水溶性杂多糖辅助二甲双胍治疗胰岛素抵抗病症,未发现明显的不良反应,安全性好,具有推广为改善胰岛素抵抗症状的有效药物的价值,为二甲双胍或二甲双胍无效的辅助治疗提供了新选择。在一些具体的实施方案中,所述水溶性杂多糖为如上所述的精制黄芪多糖。
附图说明
[0020]
图1是高效凝胶过滤色谱法检测的黄芪多糖分子量谱图;图2是高效液相色谱法检测的精制黄芪多糖色谱图;图3是高效液相色谱法检测的单糖混合标准品色谱图;图4是正常小鼠和胰岛素抵抗模型小鼠的体重;图5是正常小鼠和胰岛素抵抗模型小鼠口服葡萄糖耐量试验(ogtt)结果图;图6正常小鼠和胰岛素抵抗模型小鼠ogtt曲线下面积(auc)对血糖反应累积变化的量化结果;图7是正常小鼠和胰岛素抵抗模型小鼠的空腹血糖浓度;图8是本发明处理组小鼠的体重;图9是本发明处理组小鼠的空腹血糖浓度;图10是本发明处理组小鼠胰岛素耐量试验(itt)结果图;图11是本发明处理组小鼠itt曲线下面积(auc)对血糖反应累积变化的量化结果;图12是本发明处理组小鼠胰岛素抵抗的homa-ir指数;图13是本发明处理组小鼠的总胆固醇浓度;图14是本发明处理组小鼠的甘油三酯浓度;图15是本发明处理组小鼠的低密度脂蛋白胆固醇浓度;图16是本发明处理组小鼠的高密度脂蛋白胆固醇浓度;图17是本发明处理组小鼠胰腺组织的苏木精-伊红(h&e)染色图;图18是本发明处理组小鼠的谷丙转氨酶浓度;图19是本发明处理组小鼠的谷草转氨酶浓度;图20是本发明处理组小鼠肝脏组织的苏木精-伊红(h&e)染色图;图21是本发明处理组小鼠肝脏组织的油红o染色图;图22是正常小鼠和胰岛素抵抗模型小鼠的免疫球蛋白a浓度;图23是正常小鼠和胰岛素抵抗模型小鼠的血清γ-干扰素浓度;图24是正常小鼠和胰岛素抵抗模型小鼠的血清il-1β浓度;图25是本发明处理组小鼠的免疫球蛋白a浓度;图26是本发明处理组小鼠的免疫球蛋白g浓度;图27是本发明处理组小鼠的免疫球蛋白m浓度;图28是本发明处理组小鼠的cd3
+ t细胞水平;
(rt = 15.100)、mw 12503 da (rt = 18.567)、mw 1388 da (rt 19.220)、mw 310 da (rt = 20.470),依据检测条件与调研文献推测黄芪多糖样品中含有mw 855109 da和mw 12503 da的黄芪多糖。进一步通过凝胶色谱法将mw 855109 da和mw 12503 da的黄芪多糖进行分离,纯化mw 12503 da的精制黄芪多糖,用于后续的检测和药理活性的考察。
[0024]
实施例2:精制黄芪多糖单糖组成单糖混合标准品配制:称取葡萄糖、甘露糖、半乳糖、氨基半乳糖、核糖、阿拉伯糖、鼠李糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸、木糖以及氨基葡萄糖标准品各72.0 mg于10 ml容量瓶中,用超纯水溶解,定容,配制为各标准品浓度均为7.2 mg/ml的母液。取各母液配制为各单糖浓度均为0.36 mg/ml的混合单糖标准品溶液。
[0025]
单糖混合标准品溶液的衍生:分别取100 μl的混合单糖标准品溶液与100 μl的0.6 mol/l naoh溶液,置于1 ml的具塞试管中混合均匀。再取50 μl的混合液于5 ml的具塞试管中,加50 μl 0.5 mol/l的1-苯基-3-甲基-5-吡唑啉酮甲醇溶液,漩涡混匀。在70
º
c烘箱中反应100 min,取出放置10 min冷却至室温,加50 μl 0.3 mol/l的盐酸中和;加水至1 ml,再加等体积的氯仿,振摇,静置,弃去氯仿相,重复操作萃取3次。将水相用0.45 μm微孔膜过滤后供高效液相色谱仪进样分析。
[0026]
精制黄芪多糖样品的衍生:称取精制黄芪多糖 50.0 mg于10 ml容量瓶中,用超纯水溶解,定容,配制为浓度5 mg/ml的精制黄芪多糖样品溶液。吸取100 μl精制黄芪多糖样品溶液于5 ml的具塞刻度试管中,加入100 μl 4 mol/l的三氟乙酸,充n2封管,110
º
c烘箱中水解2小时。冷却后打开盖,加200 μl甲醇后用n2吹干,如此重复操作加甲醇并用n2吹3次,去除三氟乙酸。加入50 μl 0.3 mol/l naoh溶液充分溶解残渣,再加50 μl 0.5 mol/l的1-苯基-3-甲基-5-吡唑啉酮甲醇溶液,漩涡混匀,在70
º
c烘箱中反应100 min,冷却后按“单糖混合标准品溶液的衍生”项下同种方法进行中和、萃取,并用微孔膜过滤,待进样。
[0027]
检测条件:采用agilent配备g1315b dad检测器和agilent1100化学工作站的1100高效液相色谱仪对衍生的样品和混合单糖对照品进行分离。色谱柱为agilent的zorbax eclipse xdb-c18 (4.6
ꢀ×ꢀ
250 mm, 5μm),柱温设置为30
º
c。流动相为0.1 mol/l磷酸盐(ph = 6.7)缓冲液
−
乙腈(体积比为83:17),流速设置为1.0 ml/min,进样体积为20 μl。检测波长为250 nm,分析时间为60 min。
[0028]
检测结果表明精制黄芪多糖中含有7种单糖(图2)。12个单糖混合标准品色谱峰如图3所示,图中根据保留时间(rt)由小到大依次是甘露糖(rt = 18.252)、氨基葡萄糖(rt = 23.093)、核糖(rt = 23.851)、鼠李糖(rt = 25.598)、葡萄糖醛酸(rt = 28.028)、半乳糖醛酸(rt = 31.948)、氨基半乳糖(rt = 35.759)、葡萄糖(rt = 38.754)、半乳糖(rt = 44.214)、木糖(rt = 47.015)、阿拉伯糖(rt = 48.751)和岩藻糖(rt = 57.231)。对比保留时间,精制黄芪多糖中含有的7种单糖应该是甘露糖(rt = 18.190)、氨基葡萄糖(rt = 23.023)、鼠李糖(rt = 25.533)、半乳糖醛酸(rt = 31.888)、葡萄糖(rt = 38.013)、半乳糖(rt = 44.147)和阿拉伯糖(rt = 48.743),且含量比甘露糖:氨基葡萄糖:鼠李糖:半乳糖醛酸:葡萄糖:半乳糖:阿拉伯糖为0.34:0.29:0.14:0.61:94.19:1.17:3.26。
[0029]
实施例3:胰岛素抵抗小鼠模型建立雄性c57bl/6j小鼠40只,spf级,6周龄(20 g左右,实验动物许可证号:scxk(京)2019-0009)购自北京维通利华实验动物技术有限公司。饲养条件:spf级洁净度,室温20~
22
º
c,湿度60
ꢀ±ꢀ
5%,12小时明暗交替,自由饮食饮水。本实验中所有动物方案经北京维通利华实验动物技术有限公司机构实验动物管理和使用委员会批准,并在实验动物保护协会规定的指导下进行动物实验操作。
[0030]
小鼠适应性喂养1周后称重,采用随机分组设计按体重将小鼠分为正常饮食组(normal chow diet, ncd)和高脂饮食组(high-fat diet, hfd)。ncd组(n = 8)以普通饲料喂养,hfd组(n = 32)以高脂饲料喂养,期间进行体重、血糖监测。饲养7周后进行口服葡萄糖耐量试验(ogtt)评估胰岛素抵抗模型。
[0031]
由图4的结果可知,高脂饲料喂养7周后,hfd组小鼠体重为30.11
ꢀ±ꢀ
2.87 g,而ncd组小鼠体重为24.23
ꢀ±ꢀ
1.36 g,即hfd组小鼠平均体重比ncd组高24.27%(p《 0.0001),结果表明hfd诱导了小鼠的肥胖。ogtt结果如图5所示,小鼠空腹均正常(ncd组,5.01
ꢀ±ꢀ
0.39 mmol/l;hfd组,5.96
ꢀ±ꢀ
0.92 mmol/l);hfd组餐后血糖为10.64
ꢀ±ꢀ
1.92 mmol/l,而ncd组小鼠餐后血糖为7.44
ꢀ±ꢀ
0.47 mmol/l,且hfd组与ncd组的曲线下面积(auc)存在明显差异(p《 0.0001)(图6)。如图7所示,hfd未引起小鼠空腹血糖受损。上述表明hfd诱导小鼠胰岛素抵抗模型成功,且小鼠存在明显糖耐量异常。
[0032]
实施例4:小鼠分组给药及实验取材情况饲养7周后,各组小鼠禁食不禁水12小时,眼眶静脉丛取血(不进行麻醉),收集的血液在室温下静置30-60 min,4
º
c、16,200 g离心10 min,收集上清并分装至ep管,
−
80
º
c保存,用于免疫炎症指标的检测。
[0033]
模型建立后将hfd组按体重随机分为4组:hfd组、二甲双胍单用组(met组)、精制黄芪多糖单用组(aps组)、二甲双胍与精制黄芪多糖合用组(met+aps组),每组8只小鼠。ncd组继续以普通饲料喂养,hfd组、met组、aps组、met+aps组以高脂饲料喂养,共6周,期间每日灌胃药物或生理盐水1次,各组剂量如下:1)ncd组按10 ml/kg/d剂量给予生理盐水;2)hfd组按10 ml/kg/d剂量给予生理盐水;3)met组按二甲双胍剂量为300 mg/kg/d灌胃给药;4)aps组按精制黄芪多糖剂量为700 mg/kg/d灌胃给药;5)met+aps组按二甲双胍剂量为300 mg/kg/d、精制黄芪多糖剂量为700 mg/kg/d灌胃给药。
[0034]
给药第6周收集小鼠粪便。将每只小鼠置于单独的干净笼中,将其排出的粪便立即转入2.0 ml无菌冻存管,然后转移至
−
80
º
c冰箱储存,用于后续肠道菌群分析。
[0035]
实验终点,各组小鼠禁食不禁水12小时后,co2处死,进行心脏采血。收集的血液取100 μl全血肝素钠抗凝,用于t细胞亚群(cd3
+ t细胞、cd4
+ t细胞、cd8
+ t细胞)的检测,剩余血液在室温下静置30 min,4
º
c、16,200 g离心10 min,收集上清并分装至ep管,
−
80
º
c保存,用于后续分析。
[0036]
心脏采血后,迅速剖腹,取小肠、胰腺、肝脏、盲肠内容物、附睾脂肪组织。将胰腺分为两份,一份4%多聚甲醛固定用于石蜡切片及苏木精-伊红(h&e)染色;将肝脏分三份,一份4%多聚甲醛固定用于石蜡切片及h&e染色,一份4%多聚甲醛固定用于冰冻切片及油红o染色;其余组织均使用液氮速冻后转移至
−
80
º
c冰箱冷冻保存用于后续分析。
[0037]
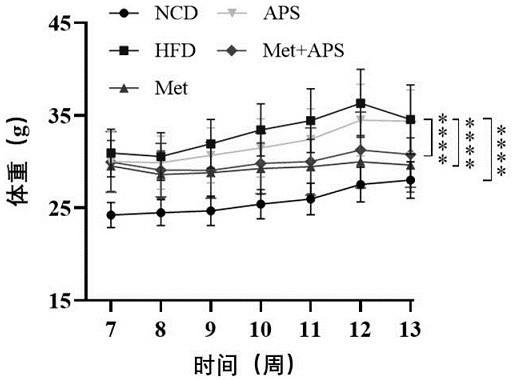
实施例5:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠体重的影响监测精制黄芪多糖辅助二甲双胍治疗过程小鼠体重的变化,结果如图8所示,hfd诱导小鼠体重增长明显,给药5周后,胰岛素抵抗小鼠体重达到最高值,即hfd组小鼠体重为36.33
ꢀ±ꢀ
3.70 g,而ncd组小鼠体重为 27.54
ꢀ±ꢀ
1.89 g,即hfd组小鼠平均体重比ncd组
高了31.92%(p《 0.0001)。met组小鼠平均体重对比hfd组下降了17.48%(p《 0.0001),aps组小鼠体重平均体重与hfd组小鼠体重差异无统计学意义,met+aps组小鼠平均体重对比hfd组下降了13.96%(p《 0.0001)。上述结果说明单独给予二甲双胍、二甲双胍联合精制黄芪多糖治疗胰岛素抵抗均能降低hfd诱导的胰岛素抵抗小鼠体重增长。
[0038]
实施例6:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠血糖与胰岛素耐量的影响建立胰岛素抵抗模型周期为7周,并未引起小鼠空腹血糖的明显上升,而是导致小鼠糖耐量异常,但治疗6周后结果显示hfd长时间诱导促使小鼠空腹血糖受损,即hfd组小鼠空腹血糖明显高于ncd组(p《 0.05)。如图9所示,met组小鼠空腹血糖对比hfd组明显降低(p《 0.0001)。aps组小鼠空腹血糖与hfd组相比差异无统计学意义。met+aps组小鼠空腹血糖为7.04
ꢀ±ꢀ
1.01 mmol/l,对比hfd组明显降低(p《 0.05)。表明二甲双胍单用或者二甲双胍联合精制黄芪多糖治疗胰岛素抵抗均能降低hfd引起的血糖升高。
[0039]
进行胰岛素耐量试验(itt)考察精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠胰岛素耐量的影响。给药后第6周,各组小鼠禁食不禁水6小时,称重、尾部滴血测量初始空腹血糖值(胰岛素注射前),腹腔注射胰岛素(0.5 u/kg)。然后于30、60、90和120 min(胰岛素注射后),用血糖试纸和血糖仪检测实验小鼠尾尖血、检测血糖。
[0040]
结果如图10-图11所示,ncd组小鼠itt的auc明显低于hfd组(p《 0.01),即hfd诱导了小鼠胰岛素耐量。met组和met+aps组小鼠itt的auc明显低于hfd组(p《 0.05),表明二甲双胍单用或者二甲双胍联合精制黄芪多糖治疗胰岛素抵抗均能改善小鼠胰岛素耐量。
[0041]
实施例7:精制黄芪多糖辅助二甲双胍治疗改善hfd诱导小鼠的胰岛素抵抗稳态模型的胰岛素抵抗指数(homa-ir)是用来评估个体的胰岛素抵抗程度的一个指标。其计算方法为:homa-ir = 空腹血糖(mmol/l)
×
胰岛素(miu/l)/22.5。采用elisa试剂盒检测各组小鼠血清胰岛素浓度,采用葡萄糖试剂盒检测各组小鼠血清葡萄糖浓度。
[0042]
结果如图12所示,hfd组小鼠homa-ir明显比ncd组高(p《 0.01),即hfd组小鼠homa-ir为3.64
ꢀ±ꢀ
0.55,ncd组小鼠homa-ir为2.42
ꢀ±ꢀ
0.59,表明hfd组小鼠明显存在胰岛素抵抗。met组和met+aps组小鼠homa-ir均比hfd组低(p《 0.05),表明二甲双胍单用或者二甲双胍联合精制黄芪多糖治疗可改善胰岛素抵抗。
[0043]
实施例8:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠血脂的影响糖尿病患者常伴有脂代谢紊乱,因此在给予药物治疗后进行了胰岛素抵抗小鼠脂代谢情况的考察。根据检测试剂盒步骤检测小鼠血清总胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白胆固醇(ldl-c)、高密度脂蛋白胆固醇(hdl-c)浓度。结果如图13-图16所示,hfd诱导的胰岛素抵抗小鼠tc、ldl-c和hdl-c浓度均高于ncd组,说明hfd诱导的胰岛素抵抗小鼠机体脂代谢紊乱。二甲双胍单独治疗胰岛素抵抗并不能调节小鼠的脂代谢紊乱。而给予二甲双胍联合精制黄芪多糖治疗后,met+aps组tc和ldl-c血清浓度对比hfd组明显降低,说明精制黄芪多糖可以促进二甲双胍改善胰岛素抵抗小鼠脂代谢紊乱。
[0044]
实施例9:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠胰腺组织的影响小鼠给药6周后,禁食不禁水12小时,心脏取血后,迅速剖腹取出胰腺组织,剪取部分胰腺组织放入4%多聚甲醛固定;经过脱水-透明-浸蜡-包埋-切片等过程制作石蜡切片。
经脱蜡与水化-染色-脱水、透明、封片等过程进行h&e染色,将切片进行数字切片扫描,然后采用caseviewer 2.4软件观察胰腺组织形态。
[0045]
结果如图17,与ncd组比较,胰岛素抵抗即hfd组小鼠胰腺组织损伤明显。具体体现在胰岛萎缩、紊乱,胰岛与腺泡之间界限不清晰,胰岛分布散乱、大小不同、形态不规则。与hfd组相比较,给予药物治疗后对胰岛素抵抗小鼠胰腺组织损伤均有所改善。aps组小鼠胰岛萎缩、形状稍有不规则,胰岛体积也较小,这与精制黄芪多糖并非治疗糖尿病药物有关。met组小鼠胰岛有轻度萎缩,胰岛体积有所增加,胰岛与腺泡之间界限较清晰但有少数扩散,表明二甲双胍单独治疗胰岛素抵抗具有疗效。met+aps组小鼠胰岛形状较为完整,体积增大,胰岛细胞排列较整齐,胰岛与腺泡之间界限清晰。上述结果表明二甲双胍联合精制黄芪多糖治疗胰岛素抵抗小鼠时,精制黄芪多糖促可进二甲双胍改善hfd对小鼠胰腺组织的损伤。
[0046]
实施例10:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠肝脏组织的影响肝脏是胰岛素代谢和胰岛素作用的主要部位,所以肝脏功能与糖脂肪和蛋白质代谢的关系密切。此外,2型糖尿病也很容易造成脂肪代谢紊乱和脂肪肝,影响肝脏功能,甚至导致肝硬化。因此,给予药物治疗胰岛素抵抗小鼠后取其血清进行肝功能指标的检测,取肝脏组织进行切片、h&e染色与油红o染色,观察hfd以及药物治疗对胰腺组织的影响。
[0047]
以试剂盒检测各组小鼠血清谷丙转氨酶与谷草转氨酶浓度。结果如图18-图19所示,ncd组小鼠谷丙转氨酶浓度与hfd组小鼠的差异不具有统计学意义。虽然对比hfd组,met组、aps组与met+aps组谷丙转氨酶浓度均下降,但均在正常范围内。ncd组、hfd组、met组、aps组与met+aps组谷草转氨酶浓度的差异不具有统计学意义。上述结果提示二甲双胍单用或者二甲双胍联合精制黄芪多糖治疗可改调节肝脏功能。
[0048]
肝脏切片h&e染色结果如图20所示,ncd组小鼠肝小叶结构清晰,肝细胞大小正常,呈放射状排列,未见明显病变。hfd诱导胰岛素抵抗后小鼠肝小叶结构不太完整,肝细胞浆内出现大小不一的空泡,表明肝脏受损,发生脂肪变性。与hfd组相比,二甲双胍单用、精制黄芪多糖单用与二甲双胍联合精制黄芪多糖治疗能不同程度减轻并改善小鼠肝脏病理情况,特别是met+aps组,可明显改善大鼠肝细胞损伤状态。上述结果表明给予二甲双胍、二甲双胍联合精制黄芪多糖均可改善hfd诱导胰岛素抵抗小鼠的肝损伤。
[0049]
肝脏切片油红o染色结果如图21所示,与ncd组比较,hfd组小鼠脂滴(油红o染色结果中红色部分)明显增多,而二甲双胍单用、精制黄芪多糖单用与二甲双胍联合精制黄芪多糖治疗后小鼠脂滴明显不同程度的少于hfd组,表明hfd诱导胰岛素抵抗引起小鼠肝脏受损、肝脂肪堆积,且二甲双胍、精制黄芪多糖、二甲双胍联合精制黄芪多糖治疗均可以改善hfd引起的肝脂肪堆积。
[0050]
通过对肝功能指标的检测、肝脏组织切片、h&e染色和油红o染色,结果表明精制黄芪多糖可以促进二甲双胍改善胰岛素抵抗小鼠肝组织损伤。
[0051]
实施例11:hfd诱导胰岛素抵抗小鼠免疫炎症系统紊乱hfd喂养7周后建立了胰岛素抵抗模型,进行小鼠眼眶采血,离心取血清,采用elisa试剂盒进行免疫炎症指标(免疫球蛋白a、γ-干扰素、il-1β)的检测。结果如图22-图24所示,ncd组小鼠的免疫球蛋白a浓度明显比hfd组高(p《 0.05),表明hfd可以抑制小鼠体
液免疫中免疫球蛋白a的分泌。hfd组小鼠的γ-干扰素血清浓度明显低于ncd组(p《 0.05),表明hfd可以抑制小鼠细胞免疫中γ-干扰素的分泌。ncd组小鼠的il-1β浓度明显低于hfd组(p《 0.001),表明hfd可以促进炎性因子il-1β的释放。上述结果表明hfd诱导胰岛素抵抗小鼠免疫炎症系统紊乱。
[0052]
实施例12:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠体液免疫的影响采用elisa试剂盒进行小鼠免疫球蛋白a、免疫球蛋白g、免疫球蛋白m的检测,以考察精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠体液免疫的影响。结果如图25-图27所示,二甲双胍单用或者二甲双胍联合精制黄芪多糖治疗胰岛素抵抗小鼠6周后,观察到小鼠免疫球蛋白a与免疫球蛋白m均发生了明显变化,而免疫球蛋白g在各组间的差异不具有统计学意义。对比hfd组,met组、met+aps组小鼠的免疫球蛋白a血清浓度明显升高(p《 0.01),表明二甲双胍单用或者二甲双胍联合精制黄芪多糖可以促进胰岛素抵抗小鼠免疫球蛋白a分泌。ncd组、hfd组、met组和aps组小鼠的免疫球蛋白不具有差异。与hfd组相比较,met+aps组小鼠的免疫球蛋白m血清浓度明显升高(p《 0.01),表明二甲双胍联合精制黄芪多糖治疗胰岛素抵抗小鼠,精制黄芪多糖可以促进二甲双胍增加免疫球蛋白m的分泌。上述结果表明精制黄芪多糖可以促进二甲双胍增强胰岛素抵抗小鼠体液免疫。
[0053]
实施例13:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠细胞免疫的影响采用流式细胞术检测小鼠t细胞亚群(cd3
+ t细胞、cd4
+ t细胞、cd8
+ t细胞),以考察精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠体液免疫的影响。结果如图28-图31所示,met组、aps组与met+aps组的小鼠的cd3
+ t细胞量相比较hfd组明显增加(p《 0.05)。met组与met+aps组小鼠的cd4
+ t细胞量相比较hfd组明显增加(p《 0.05),且精制黄芪多糖促进了二甲双胍增加cd4
+ t细胞的量。且精制黄芪多糖促进了二甲双胍抑制cd8
+ t细胞的量(p《 0.001)。hfd组小鼠的cd4
+
/cd8
+
比例为1.77
ꢀ±ꢀ
0.26,met组小鼠的cd4
+
/cd8
+
比例2.03
ꢀ±ꢀ
0.20,met+aps组小鼠的cd4
+
/cd8
+
比例为2.47
ꢀ±ꢀ
0.28,met组与met+aps组小鼠的cd4
+
/cd8
+
相比较hfd组明显增加(p《 0.05),且精制黄芪多糖促进了二甲双胍增加cd4
+
/cd8
+
比例(p《 0.001)。上述结果表明精制黄芪多糖可以促进二甲双胍增强hfd诱导胰岛素抵抗小鼠的细胞免疫。
[0054]
实施例14:精制黄芪多糖辅助二甲双胍治疗对hfd诱导胰岛素抵抗小鼠炎症的影响采用elisa试剂盒检测小鼠血清小鼠il-1b、tnf-α、γ-干扰素、脂多糖和il-10浓度。结果如图32-图36所示,hfd组小鼠血清il-1β浓度明显比ncd组高,met组、met+aps组小鼠il-1β浓度均下降,表明给予二甲双胍、二甲双胍联合精制黄芪多糖治疗均能抑制胰岛素抵抗小鼠释放炎性因子il-1β。根据tnf-α结果显示,hfd组小鼠tnf-α浓度明显比ncd组高(p《 0.01),给予二甲双胍联合aps治疗后,小鼠tnf-α浓度明显下降(p《 0.01),表明hfd诱导了胰岛素抵抗小鼠tnf-α释放,二甲双胍和精制黄芪多糖单用治疗胰岛素抵抗小鼠均未能抑制小鼠tnf-α释放,而二甲双胍和精制黄芪多糖合用后能有效抑制小鼠tnf-α释放。hfd组小鼠ifn-γ显著低于ncd组(p《 0.01),表明hfd抑制胰岛素抵抗小鼠γ-干扰素释放。met组、aps组、met+aps组小鼠ifn-γ浓度明显比hfd组高,表明二甲双胍单用、精制黄芪多糖单
用、二甲双胍合用精制黄芪多糖均能促进hfd诱导小鼠γ-干扰素生成。根据检测小鼠脂多糖结果显示,hfd组小鼠脂多糖浓度对比ncd组显著升高,而met组、aps组、met+aps组小鼠脂多糖浓度比hfd低,表明hfd诱导小鼠脂多糖生成,而二甲双胍单用、aps单用、二甲双胍合用aps治疗均能抑制hfd诱导小鼠脂多糖生成。ncd组小鼠抗炎因子il-10浓度明显比hfd组高,表明hfd抑制小鼠抗炎因子il-10产生(p《 0.01)。而met组、met+aps组小鼠il-10浓度相比hfd组明显升高(p《 0.001),表明二甲双胍可以增加小鼠抗炎因子il-10产生,二甲双胍联合精制黄芪多糖治疗后,精制黄芪多糖可以促进二甲双胍增加小鼠抗炎因子il-10产生。上述结果表明精制黄芪多糖可以促进二甲双胍改善hfd诱导胰岛素抵抗小鼠的炎症系统。
[0055]
综上实验,精制黄芪多糖辅助二甲双胍治疗胰岛素抵抗小鼠可显著降低体重、降低空腹血糖、改善胰岛素抵抗、改善胰腺组织损伤及肝组织损伤。此外,精制黄芪多糖辅助二甲双胍治疗时通过调节脂代谢、增强体液免疫、增强细胞免疫、减少炎症等途径提高二甲双胍的敏感性。本发明发现精制黄芪多糖辅助二甲双胍治疗胰岛素抵抗病症,未发现明显的不良反应,安全性好,具有推广为改善胰岛素抵抗症状的有效药物的价值,为二甲双胍或二甲双胍无效的辅助治疗提供了新选择。
[0056]
上述技术方案仅体现了本发明技术方案的优选技术方案,本技术领域的技术人员对其中某些部分所可能做出的一些变动均体现了本发明的原理,属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1