miR-4769-3p抑制剂的应用
mir-4769-3p抑制剂的应用
1.本技术要求于2021年5月20日提交中国专利局、申请号为202110551015.7、发明名称为“mir-4769-3p抑制剂的应用”的中国专利申请的优先权,其全部内容通过引用结合在本技术中。
技术领域
2.本发明涉及生物医药工程技术领域,具体涉及mir-4769-3p抑制剂的应用。
背景技术:
3.microrna(mirna/mir)是一类内生的、长度约为20-24个核苷酸的小rna,广泛存在于真核生物中,其在细胞内具有多种重要的调节作用。一个mirna可以调控多个靶基因,而几个mirna也可以调节同一个基因。有研究表明大约70%的哺乳动物mirna是位于tus区,且其中大部分是位于内含子区;一些内含子mirna的位置在不同的物种中是高度保守的。mirna不仅在基因位置上保守,序列上也呈现出高度的同源性。mirna高度的保守性与其功能的重要性有着密切的关系。现有的研究表明mirna可以通过诱发蛋白质翻译抑制,进而抑制蛋白质合成;或参与在细胞分化和组织发育过程中起重要作用的基因的转录后调控。目前越来越多的研究表明mirna参与生命过程中一系列的重要进程,包括生物体早期发育、细胞增殖、细胞程序性凋亡及坏死、脂肪代谢和细胞分化等。
4.皮下脂肪组织是一类几乎遍及全身且对生命活动具有重要意义的器官,位于真皮下方与深部筋膜之间,主要由大量群集的成熟脂肪细胞和脂肪前体细胞组成。皮下脂肪组织疾病主要分为两大类:皮下脂肪炎症性疾病(称脂膜炎)、皮下脂肪营养不良和萎缩。皮下脂肪营养不良和萎缩是一组少见且病因不明的疾病,可能与遗传、内分泌、代谢因素有关,组织病理上共同表现为脂肪的萎缩和消失,炎症反应较轻或缺如。
5.脂肪前体细胞是一类具有增殖潜能和定向分化为成熟脂肪细胞的特殊细胞。现有的研究表明皮下脂肪组织肥大主要是脂肪前体细胞募集进入成脂途径、分化为成熟脂肪细胞的结果。脂肪前体细胞分化为成熟脂肪细胞的一个重要标志是细胞内合成甘油三酯增加,并以脂肪小滴的形式储存在细胞内,细胞内脂质含量的多少可间接反映脂肪前体细胞的分化程度。利用体外培养脂肪前体细胞、并诱导脂肪前体细胞分化为成熟脂肪细胞是近年来科研人员用于研究脂肪组织的一个常用体外研究模型,对于探讨脂肪组织肥大或萎缩的相关疾病具有重要价值。3t3-l1细胞(小鼠胚胎成纤维细胞),也称为3t3-l1脂肪前体细胞,该细胞有接触性抑制生长特征且能定向分化为脂肪细胞,是目前科研人员常用于研究的脂肪前体细胞之一。
6.mirna作为一类重要的内源性调控分子,近年来,不断有mirna被发现和确认可以影响脂肪细胞的分化及功能,例如mir-148a高表达能够显著促进脂肪细胞分化,而mir-27高表达则能够显著抑制脂肪细胞分化,mir-143和let-7则被认为是脂肪细胞分化调控的关键因子。但目前尚无mir-4769-3p在脂肪细胞中的功能报道。
4769-3p抑制剂对细胞内成脂分化标志基因pparγ的表达水平改变情况:inhibitor为加入mir-4769-3p抑制剂药物组,nc为对照组;
18.图4:利用油红o染色检测在脂肪前体细胞诱导分化为成熟脂肪细胞第8d时mir-4769-3p抑制剂对细胞内脂肪含量的影响:inhibitor为加入mir-4769-3p抑制剂药物组,nc为对照组;
19.图5:利用masson染色检测mirna-4769-3p抑制剂对小鼠皮下脂肪的影响:antagomir为加入mir-4769-3p抑制剂药物组,pbs为对照组。
具体实施方式
20.本发明公开了mir-4769-3p抑制剂的应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述应用盒已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
技术实现要素:
、精神和范围内对本文所述应用进行改动或适当变更与组合,来实现和应用本发明技术。
21.在本发明具体实施方式中,以3t3-l1细胞(小鼠胚胎成纤维细胞/3t3-l1脂肪前体细胞)为实验对象验证mir-4769-3p及其抑制剂对脂肪前体细胞分化为成熟脂肪细胞的影响。
22.本发明具体实施例中,mir-4769-3p的inhibitor委托广州市锐博生物科技有限公司制备,其序列为:3
’‑
agacgguaggagggaggggaug-5’:无修饰,标准纯化。mir-4769-3p的antagomir委托广州市锐博生物科技有限公司制备,其序列为:3
’‑
agacgguaggagggaggggaug-5’,2’ome(甲氧基)修饰+5’chol(胆固醇)修饰,in vivo纯化。
23.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
24.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
25.以下就本发明所提供的mir-4769-3p抑制剂的应用做进一步说明。
26.实施例1:qrt-pcr检测在脂肪前体细胞诱导分化为成熟脂肪细胞过程中细胞内mir-4769-3p的表达水平改变情况
27.1、细胞实验
28.1)实验细胞:3t3-l1细胞(小鼠胚胎成纤维细胞/3t3-l1脂肪前体细胞)源自atcc细胞库。用含有10%fbs的dmem/f12培养基(gibco)在37℃、5%co2条件下培养。
29.2)脂肪前体细胞诱导分化为成熟脂肪细胞(经典鸡尾酒诱导分化法):
30.将3t3-l1细胞用含有10%fbs的dmem/f12培养基传代培养,待其生长至单层融合后继续接触性抑制生长2天,(0d)更换为脂肪细胞分化诱导培养基培养2天,(2d)再次更换为脂肪细胞分化维持培养基培养2天,(4d)再次更换为含有10%fbs的dmem/f12培养基继续培养至第8d,以后每2天更换一次培养基。
31.脂肪细胞分化诱导培养基:以含有10%fbs的dmem/f12培养基为基液,向其中加入配制好的胰岛素(insulin)、地塞米松(dex)、3-异丁基-1-甲基黄嘌呤(ibmx)储存液至终浓度分别为5ug/ml、1umol/l、0.5mmol/l。
32.脂肪细胞分化维持培养基:以含有10%fbs的dmem/f12培养基为基液,向其中加入配制好的胰岛素(insulin)储存液至终浓度分别为5ug/ml。
33.2、细胞总rna提取
34.具体步骤如下:
35.1)使用0.25%胰酶消化法收取细胞样本;
36.2)样本中加入适量trirzol,冰上静置5分钟;
37.3)每500ultrirzol中加入氯仿100ul,盖紧后震荡15s形成乳浊液,冰上静置5分钟;
38.4)混合物置于离心机4℃,12,000g,离心15分钟,离心后,混合物分成三层,rna存在于上层无色液体中;
39.5)把上层无色液体转至新的ep管中,加入等量异丙醇沉淀rna并颠倒几次混匀,冰上静置10分钟;
40.6)混合物置于离心机4℃,12,000g,离心10分钟,rna沉于管底,形成白色絮状物;
41.7)弃上清,加入75%乙醇1ml洗涤rna并轻轻混匀(75%乙醇由无水乙醇和无酶水按比例混合,临用前配制);
42.8)rna悬浮液置于离心机4℃,10,000g离心5分钟,若rna沉淀位于管壁或者处于漂浮状态,继续在12,000g速度下离心;
43.9)弃乙醇漂洗液,并于室温倒置放于滤纸上约5分钟使rna干燥,加无酶ddh2o使rna充分溶解。
44.3、rna样品的质量分析
45.用nandrop2000分光光度计检测所得totalrna的浓度,rna样品要求:od260/od280为1.8-2.0。
46.将上述提取的rna进行琼脂糖凝胶电泳,agilenttechnologies2100bioanalyzer检测rna样品质量,在凝胶成像仪上观测、拍照,保存图像,一般认为28s:18s≥1.5可以初步判定总rna质量较好。
47.4、逆转录
48.使用茎环法,具体步骤参照ribobio(广州市锐博生物科技有限公司)bulge-loop
tm
mirnaqrt-pcrstarterkit说明书。
49.冰上制备反应体系,加入1ugtotalrna、1ulbulge-loop
tm
mirnartprimer、2ul5
×
reversetranscriptionbuffer、2ulrtasemix,用无酶水补至总体积10ul;混匀上述反应体系,瞬时离心后在pcr仪中42℃反应60分钟
→
70℃孵育10分钟,反应完成后所得cdna产物快速置于冰上冷却备用。
50.5、qpcr反应
51.1)引物设计
52.扩增mirna-4769-3p的引物
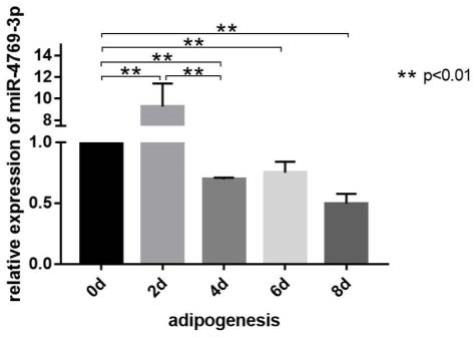
53.正向引物:gggtctgccatcctccct(seqidno.2)
54.反向引物:gtgcagggtccgaggt(seqidno.3)
55.扩增u6snrna的引物
56.正向引物:ctcgcttcggcagcaca(seqidno.4)
57.反向引物:aacgcttcacgaatttgcgt(seqidno.5)
58.2)利用定量pcr仪light96进行实时荧光pcr反应,具体步骤可参照
ribobio(广州市锐博生物科技有限公司)bulge-loop
tm mirna qrt-pcr starter kit说明书。
59.所有反应均做两个复孔,如两个ct值差异较大(》0.5),则重复做一次。冰上制备反应体系:10ul 2
×
sybr green mix、0.8ul bulge-loop
tm mirna forward primer(5μm)、0.8ul bulge-loop
tm reverse primer(5μm)、2ul cdna,加无酶水补足总体积至20ul;轻轻混匀上述反应体系(避免剧烈涡旋振荡),瞬时离心后在定量pcr仪light96中进行反应:预变性(95℃)10分钟
→
扩增反应(95℃2秒
→
60℃20秒
→
70℃10秒)40个循环
→
熔解曲线分析。
60.6、结果
61.如图1所示,脂肪前体细胞诱导分化为成熟脂肪细胞过程中3t3-l1细胞内mir-4769-3p在第2d显著升高(p《0.01),随后显著降低(p《0.01)。
62.实施例2:qrt-pcr检测mir-4769-3p抑制剂在脂肪前体细胞中转染后细胞内mir-4769-3p的表达水平改变情况
63.1、细胞实验
64.转染mirna-4769-3p inhibitor及对照至3t3-l1细胞内24小时,具体步骤参照广州锐博生物技术有限公司mirna转染试剂说明书。
65.2、细胞总rna提取步骤同实施例1。
66.3、逆转录步骤同实施例1。
67.4、qpcr反应步骤同实施例1。
68.5、结果
69.如图2所示,与对照相比,转染mirna-4769-3p inhibitor 24小时的3t3-l1细胞中mirna-4769-3p的表达显著降低(p《0.01)。
70.实施例3:qrt-pcr检测脂肪前体细胞诱导分化为成熟脂肪细胞第8d时mir-4769-3p抑制剂对细胞内成脂分化标志基因pparγ的表达影响
71.1、细胞实验
72.转染mirna-4769-3p inhibitor及对照至3t3-l1细胞内24小时后,开始对3t3-l1细胞进行脂肪细胞分化诱导(经典鸡尾酒诱导分化法),第8d收取细胞进行后续实验操作,具体步骤参照广州锐博生物技术有限公司mirna转染试剂说明书及实施例1。
73.2、细胞总rna提取步骤同实施例1。
74.3、逆转录
75.具体步骤参照tiangen fastking gdna dispelling rt supermix说明书。
76.冰上制备反应体系,加入1ug totalrna、4ul 5
×
fastking-rt supermix,用无酶水补至总体积20ul;混匀上述反应体系,瞬时离心后在pcr仪中42℃反应15分钟
→
95℃孵育3分钟,反应完成后所得cdna产物快速置于冰上冷却备用。
77.4、qpcr反应
78.1)引物设计
79.扩增pparγ的引物
80.正向引物:gacgcggaagaagagacctg(seq id no.6)
81.反向引物:tcaccttgtcgtcacactcg(seq id no.7)
82.扩增gapdh的引物
83.正向引物:aggtcggtgtgaacggatttg(seq id no.8)
84.反向引物:tgtagaccatgtagttgaggtca(seq id no.9)
85.2)利用定量pcr仪light96进行实时荧光pcr反应,具体步骤可参照tiangen superreal premix plus(sybr green)说明书。
86.所有反应均做两个复孔,如两个ct值差异较大(》0.5),则重复做一次。冰上制备反应体系:10ul 2
×
sybr superreal premix plus、0.6ul forward primer(10μm)、0.6ul reverse primer(10μm)、2ul cdna,加无酶水补足总体积至20ul;轻轻混匀上述反应体系(避免剧烈涡旋振荡),瞬时离心后在定量pcr仪light96中进行反应:预变性(95℃)15分钟
→
扩增反应(95℃10秒
→
60℃20秒)40个循环
→
熔解曲线分析。
87.5、结果
88.如图3所示,与对照相比,转染mirna-4769-3p inhibitor的3t3-l1细胞中pparγ的表达显著升高(p《0.01)。
89.实施例4:油红o染色检测在脂肪前体细胞诱导分化为成熟脂肪细胞第8d时mir-4769-3p抑制剂对细胞内脂肪含量的影响
90.1、细胞实验
91.转染mirna-4769-3p inhibitor及对照至12孔板中的3t3-l1细胞24小时后,开始对3t3-l1细胞进行脂肪细胞分化诱导(经典鸡尾酒诱导分化法),第8d进行油红o染色,具体步骤参照广州锐博生物技术有限公司mirna转染试剂说明书及实施例1。
92.2、油红o染色
93.具体步骤如下:
94.1)小心吸弃培养基,pbs轻缓浸洗细胞1-2次;
95.2)每孔加入适量4%多聚甲醛浸没细胞,室温固定1小时后,pbs轻缓浸洗细胞1-2次;
96.3)每孔加入适量油红o染液浸没细胞,室温染色1小时(油红o染液由0.5%油红o储存液与蒸馏水按3:2比例混合后过滤、静置10分钟再使用,临用前配制);
97.4)小心吸弃油红o染液,pbs轻缓浸洗细胞1-2次;
98.5)加入适量pbs浸没细胞,于倒置显微镜下观察,并拍摄染色后的细胞图片;
99.6)小心吸弃pbs,每孔加入适量异丙醇洗涤液轻缓漂洗细胞10秒(异丙醇洗涤液由异丙醇与蒸馏水按3:2比例混合,临用前配制);
100.7)小心吸弃异丙醇洗涤液,每孔加入适量异丙醇,室温振荡5分钟后利用酶标仪测量各孔510nm处的od值。
101.3、结果
102.如图4所示,与对照相比,转染mirna-4769-3p inhibitor的3t3-l1细胞内脂肪含量明显增加(p《0.01)。
103.实施例5:动物实验验证mirna-4769-3p抑制剂对小鼠皮下脂肪的影响
104.1、6周龄小鼠分为实验组及对照组,分别注射mirna-4769-3p antagomir和pbs,每周注射一次。
105.2、两周后处死小鼠,取小鼠注射部位周围皮肤固定。
106.3、masson染色观察小鼠皮肤变化:
107.1)石蜡切片脱蜡至水:依次将切片放入二甲苯i 20分钟、二甲苯ii 20分钟、无水乙醇i 10分钟、无水乙醇ii 10分钟、95%乙醇5分钟、90%乙醇5分钟、80%乙醇5分钟、70%乙醇5分钟、蒸馏水洗。
108.2)苏木素染细胞核:weigert氏铁苏木素染5分钟,自来水洗,1%的盐酸乙醇分化数秒,自来水冲洗,流水冲洗数分钟返蓝。
109.3)丽春红染色:丽春红酸性品红液染5-10分钟,蒸馏水快速漂洗。
110.4)磷钼酸处理:内磷钼酸水溶液处理约3-5分钟。
111.5)苯胺蓝染色:不用水洗,直接用苯胺蓝液复染5分钟。
112.6)分化:1%冰醋酸处理1分钟。
113.7)脱水封片:将切片依次放入95%乙醇i 5分钟、95%乙醇ii 5分钟、无水乙醇i 5分钟、无水乙醇ii 5分钟、二甲苯i 5分钟、二甲苯ii 5分钟中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。
114.5、结果
115.如图5所示,与正常对照小鼠皮肤相比,使用mirna-4769-3p antagomir的小鼠皮下脂肪组织明显肥大,脂肪细胞分化明显增强。
116.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1