一种肺动脉高压非人灵长类动物模型及其构建方法与流程
1.本发明涉及医药领域,特别是涉及一种肺动脉高压非人灵长类动物模型及其构建方法。
背景技术:
2.肺动脉高压(pah)是一种多病因、发病机制复杂、以肺血管阻力进行性增高并最终发生不可逆性病理改变为特征的慢性肺循环疾病,患者病程持续、预后差,重度pah是导致死亡的危险因素之一,如不进行有效治疗,部分患者最终疾病将进展至右心衰竭而死亡。
3.由于pah的发病机制并不完全清楚,相关动物模型开发成为人们探索其发病机制等的主要手段。目前国内外pah动物模型的应用研究以啮齿类小动物为主,但由于啮齿类动物与人类基因差异较大,许多在啮齿类动物模型中试验有效的试剂,在临床试验中往往不理想。因此,开发非人灵长类pah动物模型对于深入研究pah病理生理改变及其分子生物学机制以及恰当地开展临床药理学和治疗学研究,具有重要的临床意义。
4.现有技术中有公开了一种小型猪慢性肺动脉高压动物模型,是将野百合碱溶液注射到健康的1~5月龄、雄性或雌性﹑体重3~15kg小型猪腹腔中,在注射野百合碱第4~9周后得到小型猪慢性肺动脉高压动物模型。野百合碱在啮齿类小动物、小型猪类动物均有比较多的成功建立肺动脉高压动物模型报道,而非人灵长类动物由于种系不同,应用野百合碱注射方法很难建立非人灵长类肺动脉高压动物模型。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种肺动脉高压非人灵长类动物模型及其构建方法,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明提供一种肺动脉高压动物模型的构建方法,所述构建方法包括如下步骤:以seldinger技术穿刺股静脉建立右心导管通路,经右心导管将可降解栓塞颗粒或可降解栓塞颗粒制剂注射至实验动物体右心房,通过血液循环可降解栓塞颗粒阻塞肺动脉分支并诱发自体血栓形成,从而得到肺动脉高压动物模型。
7.所述可降解栓塞颗粒的制备方法包括以下步骤:
8.1)将血液离心后取上清液层、血小板层及部分红细胞层;
9.2)再次离心,弃掉部分上清液;
10.3)向剩余体系中加入凝血酶后将其注入硅胶管中,静置使其形成血栓条;
11.4)静置结束后将血栓条取出,经透膜过滤后即获得可降解栓塞颗粒。
12.所述可降解栓塞颗粒制剂包括所述可降解栓塞颗粒和药学上可接受的载体或辅料。
13.本发明还提供所述可降解栓塞颗粒或所述可降解栓塞颗粒制剂在制备肺动脉高压动物模型中的用途。
14.本发明还提供所述肺动脉高压动物模型的构建方法得到的肺动脉高压动物模型。
15.本发明还提供所述肺动脉高压模型在筛选治疗肺动脉高压药物中的用途。
16.如上所述,本发明的可降解栓塞颗粒及其制备方法和用途,具有以下有益效果:
17.1)可降解生物相容栓塞颗粒由动物自体血液成分制备而成,不仅具有良好的生物相容性、而且在动物体内可以随时间推移降解、吸收,溶栓药能够明显加速这一进程,其诱导建立的pah食蟹猴动物模型适合溶栓药治疗,适合开展溶栓药疗效评价实验研究。
18.2)避免了pva栓塞颗粒在体内不可降解,也不能通过溶栓药降解吸收,其诱导建立的pah食蟹猴动物模型不适合溶栓药治疗,不适合开展溶栓药疗效评价实验研究的缺点。
附图说明
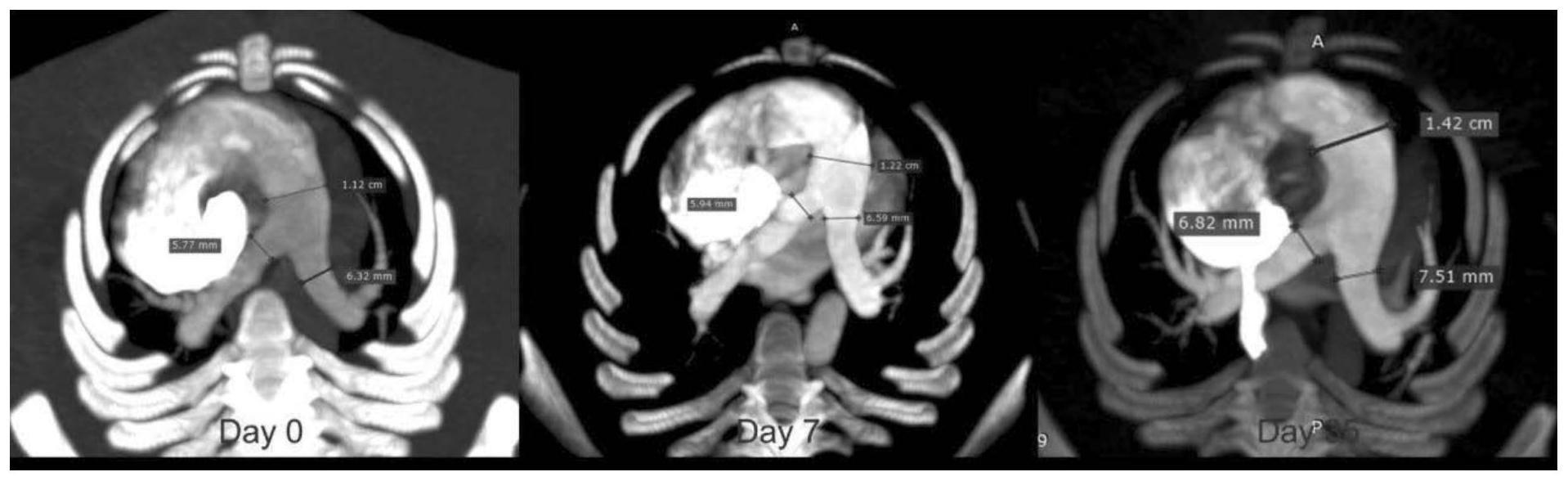
19.图1为增强ct肺动脉3d多平面重建示意图;
20.图2为建模后胸部ct检查肺栓塞表现示意图,左图示左肺上叶尖后段片状高密影(箭头),右图示右肺下叶基底段圆形空洞影(箭头),左肺下叶基底段大片状高密度影(箭头);
21.图3为增强ct肺动脉3d vr重建示意图,左图为前后位、右图为左后斜位;
22.图4为心脏彩色多普勒超声心动图;day0正常时肺动脉瓣口收缩期血流频谱呈倒三角型(等腰)空窗。
23.图5为心脏彩色多普勒超声心动图,day15肺动脉高压,肺动脉瓣口收缩期血流频谱呈不对称三角形,甚至匕首型,显著前移。
24.图6为心脏彩色多普勒超声心动图,day36肺动脉高压,肺动脉瓣口收缩期血流频谱呈不对称三角形,显著前移,其内高信号范围增大。
25.图7为凝血指标实验室检查结果截图;
26.图8为心导管右室造影示两侧肺动脉显影;
27.图9为右心导管有创血压监测压力波形图;
28.图10为高分辨ct肺解剖示意图;;
29.图11为实施例2死亡动物心脏及肺大体解剖,左图箭头示较大肺动脉分支自体血栓栓子栓塞;右图肺动脉分支内取出的自体血栓栓子。
具体实施方式
30.本发明提供一种可降解栓塞颗粒的制备方法,所述制备方法包括以下步骤:
31.1)将血液离心后取上清液层、血小板层及部分红细胞层;
32.2)再次离心,弃掉部分上清液;
33.3)向剩余体系中加入凝血酶后将其注入硅胶管中,静置使其形成血栓条;
34.4)静置结束后将血栓条取出,经透膜过滤后即获得可降解栓塞颗粒。
35.在一种实施方式中,所述血液选自静脉血或动脉血。
36.所述血液来源于实验动物的自体血液。自体血液可以避免发生凝血。本发明中,所述实验动物为在符合法律、行政法规的规定下获取的实验动物。所述实验动物例如为小鼠、大鼠、豚鼠、家兔、猫、狗、小型猪、蟾蜍、普通棉耳狨猴、普通猕猴、食蟹猴、短尾猴、豚尾猴、熊猴、树鼩。所述实验动物优选为灵长类动物。
37.在一种实施方式中,步骤1)和步骤2)中离心力为500~1000xg,和/或,离心时间为
8~12min。
38.在一种实施方式中,红细胞层的取用量按照如下比例:血液体积为4ml时,离心后取0.4~0.6ml红细胞层。红细胞层纤维蛋白原成分含量很少,因此若取用过多红细胞层可能导致形成的血栓稳定性差。
39.在一种实施方式中,弃掉上清液(上清液即血浆层)的体积比例为上清液总体积的5%~10%。
40.弃掉上半部上清液的目的或好处是:目的是增加血小板层的比例,进而提高血栓的稳定性及其制备的可降解栓塞颗粒的稳定性。
41.凝血酶是凝血酶原(凝血因子ii)激活后形成的蛋白质水解酶,其催化纤维蛋白原(fibrinogen)水解掉a肽和b肽,由此形成纤维蛋白单体,单体进一步聚合,在血小板、红细胞和白细胞等参与下形成血凝块。
42.在一种实施方式中,凝血酶的加入量为20~40u。
43.在一种实施方式中,步骤3)中加入凝血酶后迅速将含凝血酶的体系注入至硅胶管中。加入凝血酶后若不及时转移至硅胶管中,可能会在原来的容器中发生血凝。
44.所述硅胶管可以市购,例如购自常州嵘牌橡塑制品有限公司的微小流量型硅胶管。
45.所述硅胶管的内径为3~6mm。
46.在一种实施方式中,步骤3)中静置温度为0~10℃,和/或,静置时间为12~72hr。
47.在一种实施方式中,步骤4)中将血栓条取出的方法如下:注射器中吸取生理盐水,将注射器的乳头放入硅胶管中,推动活塞可将硅胶管中的血栓条冲出。
48.在一种实施方式中,在经过透膜之前还包括将冲出后的血栓条震荡为颗粒状。
49.在一种实施方式中,步骤4)中透膜的孔径为600~1000μm。
50.所述可降解栓塞颗粒具有生物相容性,因此也可称为可降解生物相容栓塞颗粒。
51.本发明还提供所述制备方法获得的可降解栓塞颗粒。所述可降解栓塞颗粒的直径为600~1000μm。
52.所述栓塞颗粒的直径大于末梢肺动脉及毛细血管网直径。在一种实施方式中,所述可降解栓塞颗粒的直径为600~1000μm。这个大小范围的栓塞颗粒,经右心导管注入动物右心房后可以均匀分布于两侧肺动脉分支远端,栓塞程度均匀、栓塞范围广泛。所述可降解栓塞颗粒的直径明显大于高分辨ct可辨识的最细16级肺动脉300μm直径(图10),因此可以满足胸部增强ct检查对栓塞肺动脉分支进行影像评估,为模型建立提供影像学佐证。而且如果可降解栓塞颗粒过小,会栓塞16级以下肺动脉分支,不易成膜,也无法进行ct影像评估。而如果栓塞颗粒过大会导致较大肺动脉分支急性栓塞,降低成模前动物预期生存率。
53.本发明还提供一种可降解栓塞颗粒制剂,所述可降解栓塞颗粒制剂包括所述可降解栓塞颗粒和药学上可接受的载体或辅料。
[0054]“药学上可接受的”是指当药物适当地给予动物时,它们不会产生不利的、过敏的或其它不良反应。
[0055]“药学上可接受的载体或辅料”应当与有效成分相容,即能与其共混而不会在通常情况下大幅度降低药物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基
纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
[0056]
在一种实施方式中,所述可降解栓塞颗粒制剂为悬浮剂。
[0057]
以混悬剂的总质量为基准,所述混悬剂中可降解栓塞颗粒的质量百分比为20%~40%。
[0058]
在一种实施方式中,所述药学上可接受的载体为生理盐水。
[0059]
本发明还提供所述可降解栓塞颗粒或所述可降解栓塞颗粒制剂在制备肺动脉高压动物模型中的用途。
[0060]
本发明还提供一种肺动脉高压动物模型的构建方法,所述构建方法包括如下步骤:以seldinger技术穿刺股静脉建立右心导管通路,经右心导管将所述可降解栓塞颗粒或所述可降解栓塞颗粒制剂注射至实验动物体右心房内,经血液循环可降解栓塞颗粒阻塞肺动脉分支并诱发自体血栓形成,从而得到肺动脉高压动物模型。
[0061]
在一种实施方式中,所述实验动物选自灵长类动物。所述灵长类动物选自普通棉耳狨猴、普通猕猴、食蟹猴、短尾猴、豚尾猴、熊猴、树鼩。较佳的,制备可降解栓塞颗粒的血液与构建动物模型的实验动物为同种。更佳的,制备可降解栓塞颗粒的血液为构建动物模型的实验动物的自体血液。
[0062]
注射入实验动物体内的所述可降解栓塞颗粒制剂中含有可降解栓塞颗粒的量为500mg~1500mg。通过调整注入动物右心房内的颗粒总剂量来调整肺动脉栓塞程度,从而做到肺动脉栓塞程度可控,这一点不仅保证动物的存高活率,还满足不同肺动脉高压程度实验要求动物模型制备。
[0063]
在一种实施方式中,将所述可降解栓塞颗粒或所述可降解栓塞颗粒制剂经以seldinger技术穿刺股静脉建立的右心导管通道注射至实验动物右心房内。
[0064]
所述肺动脉高压动物模型的构建原理如下:以seldinger技术穿刺非人灵长类动物股静脉建立右心导管通路,通过右心导管注射可降解栓塞颗粒至右心房,经血液循环到达肺动脉主干、肺动脉分支(包括末梢肺动脉),由于可降解栓塞颗粒直径大于肺动脉分支处的末梢肺动脉及肺动脉与肺静脉连接处的毛细血管网的直径,因此末梢肺动脉及毛细血管网是可降解栓塞颗粒循环过程中遇到的第一道屏障,可降解栓塞颗粒在此处通过机械阻塞肺动脉分支诱发自体血栓形成,进而导致肺动脉高压。通过这种方式本发明构建的肺动脉高压模型稳定性好,可广泛应用于医学领域。
[0065]
本发明还提供所述构建方法得到的肺动脉高压动物模型。
[0066]
本发明还提供所述肺动脉高压模型在筛选治疗肺动脉高压药物中的用途。
[0067]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0068]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0069]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0070]
实施例1采用可降解栓塞颗粒构建肺动脉高压非人灵长类动物模型
[0071]
1.可降解栓塞颗粒诱导肺动脉高压机理:
[0072]
以seldinger技术穿刺非人灵长类动物股静脉,建立右心导管通路,经右心导管注射可降解生物相容栓塞颗粒至右心房,通过血液循环到达肺动脉主干、肺动脉分支,末梢肺动脉及毛细血管网是其循环过程中遇到的第一道屏障,可降解生物相容栓塞颗粒的直径大于末梢肺动脉及毛细血管网直径,通过机械阻塞肺动脉分支及诱发自体血栓形成,进而导致肺动脉高压。
[0073]
2.诱导材料:可降解生物相容栓塞颗粒。
[0074]
可降解生物相容栓塞颗粒悬浮液制备方法如下:
[0075]
1)抽取食蟹猴的静脉血4ml,离心力500~1000xg,10min,取上清液、血小板及0.5ml红细胞,再离心10min,弃去上半部上清液,余下部分加凝血酶20μl,迅速注入直径5mm硅胶管中静置,4℃冷藏48hr。
[0076]
2)5ml注射器抽取5ml生理盐水,注射器抵住硅胶管端口推注,将硅胶管中的混合血栓条推出,置于试管中速震荡5min,分别经600μm、1000μm过滤器(科润明600μm、1000μm)过滤,获得600μm~1000μm大小栓塞颗粒物。
[0077]
3)将600μm~1000μm的上述栓塞颗粒物制备成悬浮液:按照5ml生理盐水加入1g颗粒物的比例,制备成特定质量百分比20%浓度的混悬液,制备好的混悬液定容,并调整ph为7.4。
[0078]
4)室温下低速震荡悬浮液10min,充分混合。
[0079]
3.模型构建步骤:
[0080]
可降解栓塞颗粒悬浮液活体注射:
[0081]
1)动物经舒泰50诱导镇静、肌松后10min,保定于大动物手术台,配以异氟烷吸入麻醉和氧气吸入,用于术中深度麻醉维持。
[0082]
2)将多功能生理监护仪和动物链接,用于实时监测动物的心率、呼吸、血氧饱和度、血压等生理指标,注射前维持20min的生理监护,直至动物的各项生理指标保持平稳,无明显波动。
[0083]
3)在生理监护仪监护下,以seldinger技术穿刺股静脉建立右心导管通路,穿刺成功后右心导管连接三联三通,分别用以接:a)20%可降解栓塞颗粒悬浮液10ml;b)生理盐水。
[0084]
4)利用微量注射泵,经右心导管以一定速度缓慢推注混悬液进入右心房,期间始终观察并严格记录生理监护仪各项指标。
[0085]
5)所有混悬液需在10min内注射完成,注射完成停止异氟烷麻醉,同时连接医用氧气,使动物保持吸氧20min。
[0086]
6)动物苏醒后,移送动物至动物房,进行单笼养护和观察。
[0087]
造模主要观测指标和标准
[0088]
1.血液指标检测:每3天一次,确保每周2次检测
[0089]
1)凝血四项检测:aptt,pt,tt,fib
[0090]
2)d-二聚体检测
[0091]
2.临床影像学检测:
[0092]
1)心脏彩超:心内结构、肺动脉结构、瓣膜反流和压差
[0093]
2)胸部ct检查:胸部ct平扫和ctpa扫描
[0094]
3)如观察到任何临床症状,则立即安排一次上述检查
[0095]
3.右心房压(rvsp)检测:临床影像学检测确诊后
[0096]
1)右心房的收缩压反映右心房排空时的肺动脉压力
[0097]
2)通过生理监护仪有创血压模块进行,直接对rvsp进行测量
[0098]
3)确诊pah后每2周进行一次检测,观测疾病发展进程
[0099]
模型构建结果
[0100]
本研究从诱导造模当天(这天设为第0天-day0)开始实验研究,持续6个月。第一阶段基础数据采集开始设为负第几天。
[0101]
分析总结模型肺动脉主干直径、左右肺动脉干直径等资料(图1-图7),适时开展有创肺动脉压检查,获得pah疾病诊断金标准数据,监测到右心房收缩压37mmhg、平均压21mmhg、舒张压2mmhg(图8、图9),达到诊断标准,成功建立pah非人灵长类动物模型。
[0102]
其中:图1为增强ct肺动脉3d多平面重建,day0至day35示肺动脉干及左、右肺动脉直径逐渐增大。
[0103]
图2为建模后胸部ct检查肺栓塞表现,左图示左肺上叶尖后段片状高密影(箭头),右图示右肺下叶基底段圆形空洞影(箭头),左肺下叶基底段大片状高密度影(箭头)。
[0104]
图3为增强ct肺动脉3d vr重建,左图为前后位、右图左后斜位,示左下肺动脉分支充盈缺损(箭头),提示肺动脉分支栓塞。
[0105]
图4为心脏彩色多普勒超声心动图,day0正常时肺动脉瓣口收缩期血流频谱呈倒三角型(等腰)空窗。峰值速度在收缩中期。
[0106]
图5为心脏彩色多普勒超声心动图,day15肺动脉高压,肺动脉瓣口收缩期血流频谱呈不对称三角形,甚至匕首型,显著前移。
[0107]
图6为心脏彩色多普勒超声心动图,day36肺动脉高压,肺动脉瓣口收缩期血流频谱呈不对称三角形,显著前移,其内高信号范围增大。
[0108]
图7为凝血指标实验室检查结果截图,d-二聚体day0为0.03mg/l,day8至day49值均较day0值升高,提示建模后模型肺动脉出现凝血,从而启动体内纤溶系统,导致d-二聚体值升高。
[0109]
图8为右心导管检查示意图,肺动脉造影示肺动脉高压引起肺动脉主干及1、2级分
支扩张,远端分支变细。
[0110]
图9为右心导管检查示意图,右心房压力参数:收缩压37mmhg、平均压21mmhg、舒张压2mmhg。
[0111]
实施例2、采用自体血栓构建肺动脉高压非人灵长类动物模型
[0112]
1.自体血栓诱导肺动脉高压机理:
[0113]
以seldinger技术穿刺股静脉,建立右心导管通路,经右心导管注射一定大小、一定长度的自体血栓栓子到右心房,通过血液循环到达肺动脉主干、肺动脉分支,末梢肺动脉及毛细血管网是其循环过程中遇到的第一道屏障,其直径大于末梢肺动脉直径,通过机械阻塞较大肺动脉分支及诱发自体血栓形成,进而导致肺动脉高压。
[0114]
2.栓塞材料:自体血栓栓子
[0115]
自体血栓制备:将动物自体全血5ml加凝血酶20ul,迅速注入直径0.5mm硅胶管中静置,4℃冷藏48hr。5ml注射器抽取5ml生理盐水,注射器抵住硅胶管端口推注,将硅胶管中的血栓条推出。其直径0.5mm,将其切割成长10mm的栓子。
[0116]
3.实验组别
[0117] 栓子成分、大小1组1只自体栓子10mm*0.5mm
[0118]
4.自体血栓注射模型构建步骤:
[0119]
1)动物经舒泰50诱导镇静、肌松后10min,保定于大动物手术台,配以异氟烷吸入麻醉和氧气吸入,用于术中深度麻醉维持;
[0120]
2)将多功能生理监护仪和动物链接,用于实时监测动物的心率、呼吸、血氧饱和度、血压等生理指标,注射前维持20min的生理监护,直至动物的各项生理指标保持平稳,无明显波动;
[0121]
3)右心导管通路建立:在生理监护仪监护下,以seldinger技术穿刺股静脉,建立右心导管通路。
[0122]
4)栓塞剂注射
[0123]
经右心导管每次注射生理盐水5ml+自体血栓栓子10mm*0.5mm注入右心房,期间始终观察并严格记录生理监护仪各项指标,重复操作至血氧饱和度降低。
[0124]
5)注射完成停止异氟烷麻醉,同时连接医用氧气,使动物保持吸氧20min;
[0125]
6)动物苏醒后,移送动物至动物房,进行单笼养护和观察。
[0126]
7)每周1次重复上述实验。
[0127]
5.结果与总结:
[0128]
在前三次重复造模过程中,超声及对比增强ct检查均未发现动物肺动脉高压改变,为缩短建模周期,第四次重复实验时注射的自体血栓栓子数量增加一倍,结果动物出现意外死亡。解剖发现由于注射的自体血栓栓子大小为10mm*0.5mm,相对于动物心脏瓣口栓子比较大,栓子进入后有的停留在瓣口,较多栓子进入后阻塞动物较大肺动脉分支,导致动物死亡。采用自体血栓建立肺动脉高压非人灵长类动物模型的死亡动物肺大体解剖如图11所示,左图箭头示较大肺动脉分支自体血栓栓子栓塞。右图肺动脉分支内取出的自体血栓栓子。本发明可降解栓塞颗粒构建肺动脉高压非人灵长类动物模型可避免上述情形。
[0129]
本发明中,可降解生物相容栓塞颗粒可成功诱导建立pah食蟹猴动物模型。在模型
开发初期申请人应用了常规制备自体血栓的方法(实施例2),制备成10mm*0.5mm的栓子,分次注入动物静脉后每次栓塞于近端较大的一支肺动脉分支,注入栓子少、栓塞范围不足,不容易诱发肺动脉高压,注入栓子量较多时,容易积聚在较大肺动脉分支易于造成动物死亡(图11)。本发明制备的可降解生物相容栓塞颗粒是自体血栓经过震荡粉碎、透膜过滤筛选出颗粒大小在600~1000μm范围。这个大小范围的栓塞颗粒,注入动物右心房后可以均匀分布于两侧肺动脉分支远端,栓塞程度均匀、栓塞范围广泛。
[0130]
综上,可降解生物相容栓塞颗粒由动物自体血液成分制备而成,不仅具有良好的生物相容性、而且在动物体内可以随时间推移降解、吸收,溶栓药能够明显加速这一进程,其诱导建立的pah食蟹猴动物模型适合溶栓药治疗,适合开展溶栓药疗效评价实验研究,同时,自体血可降解生物相容栓塞颗粒造成的是急性/慢性模型,剂量可调整(根据疾病发展进程),长期模拟急性发生,慢性进展,治疗,愈合整体疾病进程(和人类似pah),从长期来讲对动物健康和生存无影响,提高了动物的生存福利。
[0131]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1