一种血管介入载药凝胶栓塞剂及其制备方法与流程
1.本发明涉及医疗技术领域,具体涉及一种血管介入载药凝胶栓塞剂及其制备方法。
背景技术:
2.血管介入技术是指在医学影像设备的导引下,利用穿刺针,导丝,导管等器械经血管途径进行诊断与治疗的操作技术。临床上基于血管介入的栓塞剂主要用于癌症的介入治疗。
3.临床上基于血管介入的栓塞剂主要用于癌症的介入治疗,以肝癌为例,血管性介入中采用栓塞剂的治疗方式主要包括经导管肝动脉栓塞(transcatheter hepatic-arterial embolization)、经导管肝动脉栓塞化疗(transcatheter hepatic-arterial embolization)、门静脉栓塞(pprtal vein embolization);其中,经导管肝动脉栓塞化疗目前被认为时肝癌非手术治疗的首选方案,经导管肝动脉栓塞化疗技术操作可以概括为使用微导管超选至肿瘤供血动脉,后经微导管以缓慢而稳定的流率间断、缓慢地将碘化油乳化剂或载药微球及化疗药和对比剂的混悬液注入肿瘤供血动脉,根据肿瘤供血情况逐支栓塞,待达到栓塞终点时停止推注,当注射入碘化油乳剂引起血流减慢后,可注入适当颗粒栓塞剂(空白微球或明胶海绵)达到栓塞终点。现有临床上常用的明胶海绵、微球等固体材料作为主要的栓塞材料,栓塞时固体材料在接触血管时,对病人造成的疼痛感较强,且化疗药液扩散过快,对药物的长期释放效果不理想。
技术实现要素:
4.本发明的主要目的是提出一种血管介入载药凝胶栓塞剂及其制备方法,旨在提供对病人造成的疼痛感较弱的,且能够提高治疗药物释放能力的血管介入载药凝胶栓塞剂。
5.为实现上述目的,本发明提出的一种血管介入载药凝胶栓塞剂,所述血管介入载药凝胶栓塞剂包括以下成分:混合溶液和ph调节剂,所述混合溶液包括聚电解质溶液和化疗药液,所述聚电解质溶液包括阴离子水溶液和阳离子水溶液;
6.其中,所述混合溶液在ph值为5~7时,能够从液态转化为凝胶态。
7.可选地,所述阴离子水溶液的质量浓度为1~4%;和/或,
8.所述阳离子水溶液的质量浓度为1~4%。
9.可选地,在所述聚电解质溶液中,所述阴离子水溶液和所述阳离子水溶液的体积比为1:(0.1~10)。
10.可选地,所述阴离子水溶液包括聚丙烯酸水溶液、聚甲基丙烯酸水溶液、聚苯乙烯磺酸水溶液、聚乙烯磺酸水溶液、聚乙烯磷酸水溶液、透明质酸水溶液、聚赖氨酸水溶液、甘油磷酸水溶液、羧甲基纤维素水溶液、海藻酸水溶液、卡波姆水溶液、聚丙烯酸金属盐水溶液、聚甲基丙烯酸金属盐水溶液、聚苯乙烯磺酸金属盐水溶液、聚乙烯磺酸金属盐水溶液、聚乙烯磷酸金属盐水溶液、透明质酸金属盐水溶液、聚赖氨酸金属盐水溶液、甘油磷酸金属
盐水溶液、羧甲基纤维素金属盐水溶液、羧甲基淀粉钠水溶液和海藻酸金属盐水溶液中的至少一种;和/或,
11.所述阳离子水溶液包括聚乙烯亚胺、聚乙烯胺、聚乙烯吡啶、聚丙烯酰胺、壳寡糖、羧甲基壳聚糖、壳聚糖季铵盐、羟乙基甲壳素、羟丁基壳聚糖和丁二酰壳聚糖的水溶液中的至少一种。
12.可选地,在所述混合溶液中,所述化疗药液与所述聚电解质溶液的体积比为1:(0.1~10)。
13.可选地,所述混合溶液与所述ph调节剂的体积比为1:(0.01~1)。
14.可选地,所述ph调节剂包括柠檬酸、乳酸、酒石酸、偏酒石酸、苹果酸、磷酸、葡萄糖酸、葡萄糖酸内酯、氢氧化钠、碳酸钠、碳酸氢钠、乙醇胺、乙二胺、碱性氨基酸、磷酸二氢钠、磷酸二氢钾、碳酸、醋酸、巴比妥酸和三羟甲基氨基甲烷中的至少一种。
15.此外,本发明还提供了一种血管介入载药凝胶栓塞剂的制备方法,所述血管介入载药凝胶栓塞剂的制备方法包括混合溶液的制备方法,所述混合溶液的制备方法包括以下制备步骤:
16.将阴离子水溶液和阳离子水溶液混合,搅拌均匀,获得聚电解质溶液;
17.在搅拌的条件下,将化疗药液加入所述聚电解质溶液中,获得混合溶液。
18.可选地,将阴离子水溶液和阳离子水溶液混合,搅拌均匀,获得聚电解质溶液的步骤中,搅拌时间为0.5~2h。
19.可选地,在搅拌的条件下,将化疗药液加入所述聚电解质溶液中,获得混合溶液的步骤中,搅拌时间为1~2h。
20.本发明的技术方案中,利用聚电解质凝胶体系的成胶原理,将阴离子水溶液和阳离子水溶液制备成聚电解质溶液,将聚电解质溶液与化疗药液混合,加入ph调节剂,使得混合溶液整体ph值逐渐调控至阳离子高分子和阴离子高分子的pka之间,混合溶液通过聚电解质溶液的静电相互作用使得带有化疗药液的混合溶液由液态转变成凝胶态,从而将传统的固体栓塞剂接触血管改变成液态栓塞剂接触血管,降低病人的疼痛感,同时化疗药液充分的分散在混合溶液中,在混合溶液变成凝胶时,化疗药液充分分散在凝胶中,减缓化疗药液的扩散速度,从而提高化疗药液的缓释能力,此外,本发明提供的血管介入载药凝胶栓塞剂在血管中呈现凝胶状,如此一来,凝胶在血管的某些特殊部位的栓塞封闭效果更加好。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
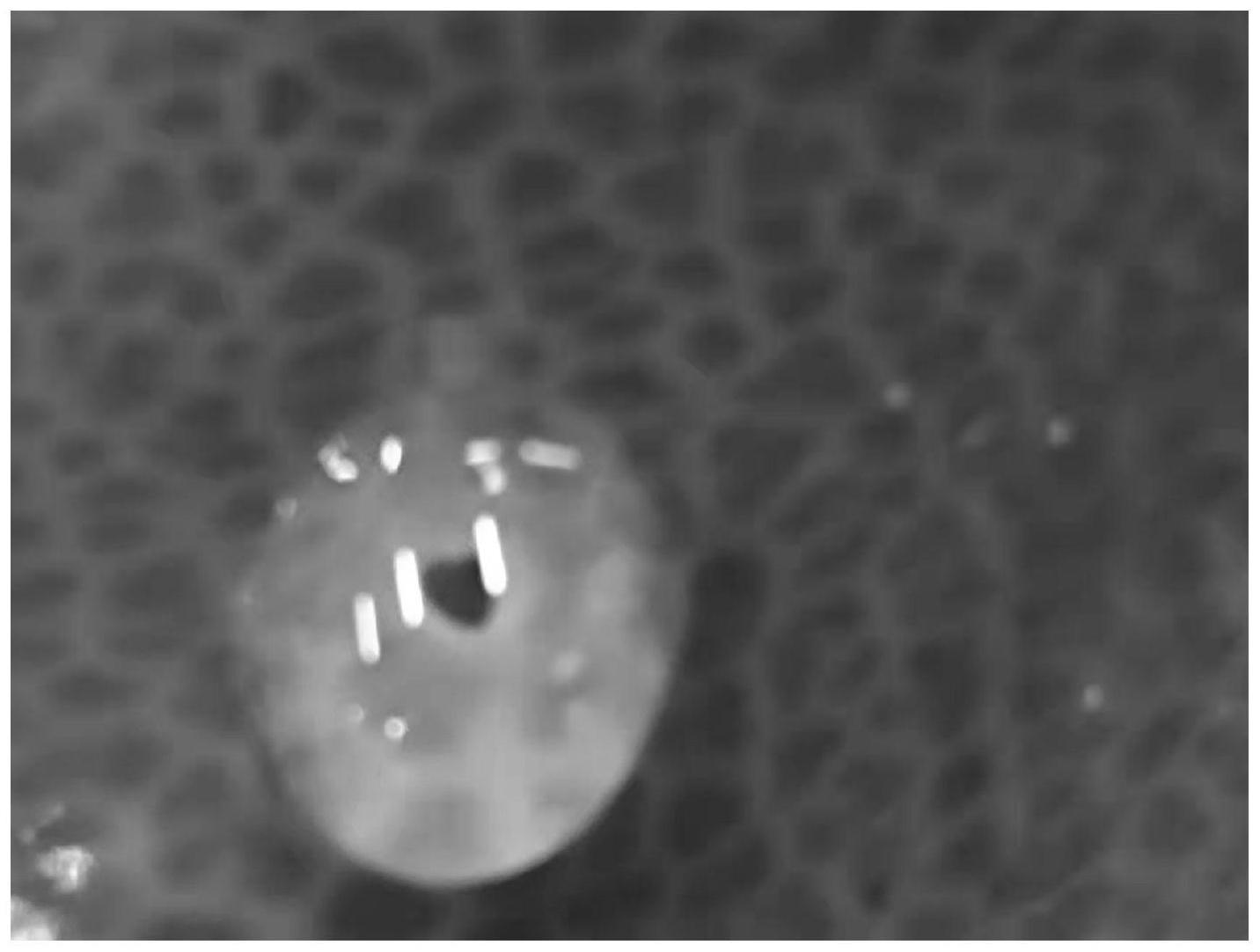
22.图1为本发明实施例1制备的血管介入载药凝胶栓塞剂示意图;
23.图2为本发明提供的血管介入载药凝胶栓塞剂的制备方法的一实施例的流程示意图;
24.图3为本发明实施例1制备的血管介入载药凝胶栓塞剂的流变性能测试曲线图;
25.图4为本发明实施例11制备的血管介入载药凝胶栓塞剂的体外药物释放测试曲线
图。
26.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
27.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。另外,全文中出现的“和/或”的含义,包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
28.临床上基于血管介入的栓塞剂主要用于癌症的介入治疗,以肝癌为例,血管性介入中采用栓塞剂的治疗方式主要包括经导管肝动脉栓塞(transcatheter hepatic-arterial embolization)、经导管肝动脉栓塞化疗(transcatheter hepatic-arterial embolization)、门静脉栓塞(pprtal vein embolization);其中,经导管肝动脉栓塞化疗目前被认为时肝癌非手术治疗的首选方案,经导管肝动脉栓塞化疗技术操作可以概括为使用微导管超选至肿瘤供血动脉,后经微导管以缓慢而稳定的流率间断、缓慢地将碘化油乳化剂或载药微球及化疗药和对比剂的混悬液注入肿瘤供血动脉,根据肿瘤供血情况逐支栓塞,待达到栓塞终点时停止推注,当注射入碘化油乳剂引起血流减慢后,可注入适当颗粒栓塞剂(空白微球或明胶海绵)达到栓塞终点。现有临床上常用的明胶海绵、微球等固体材料作为主要的栓塞材料,栓塞时固体材料在接触血管时,对病人造成的疼痛感较强,且化疗药液扩散过快,对药物的长期释放效果不理想。
29.鉴于此,本发明提供一种血管介入载药凝胶栓塞剂,该血管介入载药凝胶栓塞剂使用时,对病人造成的疼痛感较弱,且能够提高化疗药液的缓释能力;结合图1所示的血管介入载药凝胶栓塞剂的一实施例的示意图,所述血管介入载药凝胶栓塞剂,包括以下成分:
30.混合溶液和ph调节剂,所述混合溶液包括聚电解质溶液和化疗药液,所述聚电解质溶液包括阴离子水溶液和阳离子水溶液;其中,所述混合溶液在ph值为5~7时,能够从液态转化为凝胶态。
31.本发明的技术方案中,利用聚电解质凝胶体系的成胶原理,将阴离子水溶液和阳离子水溶液制备成聚电解质溶液,将聚电解质溶液与化疗药液混合,加入ph调节剂,使得混合溶液整体ph值逐渐调控至阳离子高分子和阴离子高分子的pka之间,混合溶液通过聚电解质溶液的静电相互作用使得带有化疗药液的混合溶液由液态转变成凝胶态,从而将传统的固体栓塞剂接触血管改变成液态栓塞剂接触血管,降低病人的疼痛感,同时化疗药液充分的分散在混合溶液中,在混合溶液变成凝胶时,化疗药液充分分散在凝胶中,减缓化疗药液的扩散速度,从而提高化疗药液的缓释能力,此外,本发明提供的血管介入载药凝胶栓塞剂在血管中呈现凝胶状,如此一来,凝胶在血管的某些特殊部位的栓塞封闭效果更加好。
32.在一些实施例中,化疗药液为吡柔比星。
33.在一些实施例中,在阴离子水溶液中,存在大量的羧基基团,羧基基团能够提供大量的带负电的阴离子;在阳离子水溶液中,存在大量的氨基等基团,而氨基等基团电离后能够提供大量的带正电的阳离子,在合适的ph条件下,通过静电相互作用,带正电的阳离子和带负电的阴离子能够相互结合,从而使得聚电解质溶液整体从液态转变成聚电解质凝胶,如此一来,在实际治疗过程中,往病人的血管内注入的是液体状态的混合溶液,而进入血管后,混合溶液在特定ph环境下,转变成凝胶状的,从而进行栓塞,因此,在实际使用时,往病人的血管内注入的是液体栓塞剂,相较于传统的固体栓塞剂,能够有效的减小对病人造成的疼痛感,使得整个治疗过程更加舒缓。
34.阴离子水溶液和阳离子水溶液的浓度也会影响最终混合溶液凝胶化的时间和凝胶的强度,需要说明的是,在实际治疗的过程中需要严格控制凝胶成型的时间和凝胶的强度,在实际治疗过程中,如果凝胶成型的时间过快,则会导致治疗药物还未进入血管中就凝胶化,导致病人治疗过程中的疼痛感增强,如果凝胶成型的速度过慢,则会导致混合溶液被血管中的血液冲散,无法栓塞;同时凝胶的强度也会对治疗效果造成影响,凝胶的强度过弱,则会导致血管中的血液将凝胶冲散,同样无法形成栓塞,故,在一些实施例中,所述阴离子水溶液的质量浓度为1~4%;同时,阳离子水溶液的质量浓度为1~4%。具体地,在实际治疗过程中,阴离子水溶液的质量浓度可以是1%、可以是1.5%、可以是2%、可以是2.5%、可以是3%、还可以是4%;阳离子水溶液的质量浓度可以是1%、可以是1.5%、可以是2%、可以是2.5%、可以是3%、还可以是4%;作为本实施例的一个优选实施例,阴离子水溶液的质量浓度为2%,阳离子水溶液的质量浓度为2%。
35.进一步地,阴离子水溶液和阳离子水溶液的体积也会影响最终混合溶液凝胶化的强度,同时需要调整阴离子水溶液和阳离子水溶液的体积比,从而实现调整载药量,在一些实施例中,所述阴离子水溶液与所述阳离子水溶液的体积比为1:(0.1~10),即每1l的阴离子水溶液中,需要对应添加0.1~10l的阳离子水溶液;具体地,阴离子水容易让和阳离子水溶液的体积比为1:0.1、1:0.2、1:0.5、1:1、1:2、1:4、1:5、1:7、1:8、1:10等,作为本实施例的一个优选实施例,阴离子水溶液与阳离子水溶液的体积比为1:1。
36.在选择阴离子水溶液和阳离子水溶液时,需要考虑到本身不具备毒性,本身不会对病人造成伤害,同时本身不能够与治疗药物产生反应;此外,考虑到安全环保稳定性的问题,在一些实施例中,阳离子水溶液和阴离子水溶液选择为天然生物材料,具体地,阴离子水溶液包括包括聚丙烯酸水溶液、聚甲基丙烯酸水溶液、聚苯乙烯磺酸水溶液、聚乙烯磺酸水溶液、聚乙烯磷酸水溶液、透明质酸水溶液、聚赖氨酸水溶液、甘油磷酸水溶液、羧甲基纤维素水溶液、海藻酸水溶液、卡波姆水溶液、聚丙烯酸金属盐水溶液、聚甲基丙烯酸金属盐水溶液、聚苯乙烯磺酸金属盐水溶液、聚乙烯磺酸金属盐水溶液、聚乙烯磷酸金属盐水溶液、透明质酸金属盐水溶液、聚赖氨酸金属盐水溶液、甘油磷酸金属盐水溶液、羧甲基纤维素金属盐水溶液、羧甲基淀粉钠水溶液和海藻酸金属盐水溶液中的至少一种,在实际应用时,阴离子水溶液可以是海藻酸钠水溶液,可以是羧甲基淀粉钠水溶液,可以是羧甲基纤维素钠水溶液,还可以是羧甲基淀粉钠水溶液和羧甲基纤维素钠水溶液的混合溶液。
37.同时,阳离子水溶液包括聚乙烯亚胺、聚乙烯胺、聚乙烯吡啶、聚丙烯酰胺、壳寡糖、羧甲基壳聚糖、壳聚糖季铵盐、羟乙基甲壳素、羟丁基壳聚糖和丁二酰壳聚糖的水溶液中的至少一种。具体地,添加的阳离子水溶液可以是羧甲基壳聚糖水溶液,可以是壳聚糖季
铵盐水溶液,可以是壳寡糖水溶液,还可以是羧甲基壳聚糖水溶液和壳寡糖水溶液的混合溶液。
38.进一步地,在实际操作时,阴离子水溶液和阳离子水溶液的具体类型,需要根据化疗药液的具体种类进行适应性的选择。
39.此外,化疗药液和聚电解质溶液的体积也会对化疗药液的缓释性能造成影响,在一些实施例中,化疗药液与聚电解质溶液的体积比为1:(0.1~10),即每1l的化疗药液对应的需要分散在0.1~10l的聚电解质溶液,需要说明的是,化疗药液和聚电解质溶液的体积比大于上述范围,则会导致后续步骤中,聚电解质溶液在凝胶时,导致部分化疗药液无法分散在凝胶内,直接分散在血液中;化疗药液和聚电解质溶液的体积比小于上述范围,则会导致化疗药液的量不足,无法达到治疗的作用。具体地,在实际操作是,化疗药液与聚电解质药液的体积比可以是1:1、可以是1:0.1,可以是1:0.3,可以是1:0.5,还可以是1:10;作为本实施例的一个优选实施例,化疗药液与聚电解质药液的体积比为1:1。
40.在一些实施例,通过构建由聚电解质凝胶网络来作为血管介入中的液体栓塞剂与载药凝胶,随着在混合溶液中加入ph调节剂,混合溶液体系中的ph值可以被定向调控并缓慢变化,从而实现载有化疗药液的粘性混合溶液向凝胶态逐步转变,最终实现血管栓塞并在血管内部形成载药凝胶。随着混合溶液体系中ph调节剂的加入,在形貌上最初为粘性液态最终为凝胶态。需要说明的是,与其他凝胶体系最大的不同是聚电解质凝胶体系只有混合溶液ph值在阳离子高分子与阴离子高分子的pka值之间时才会通过静电作用转变成凝胶态;当混合溶液整体ph值不在这一范围内时,则无法由液态向凝胶态转变,因此在实际操作时,需要严格控制混合溶液的ph值,通过控制ph至5~7,实现混合溶液凝胶化。
41.需要说明的是,混合溶液凝胶化是需要一定的时间的;向混合溶液中加入ph调节剂后,由于溶液整体ph变化尚需一定时间,因此混合溶液整体短时间内依然呈现液体特性(依然具有流动性)并不会立刻形成凝胶,此时具有可注射性,可作为栓塞剂以及载药凝胶通微导管用于血管介入,待注入血管完毕后,等待混合溶液整体ph移动至阳离子高分子与阴离子高分子的pka值之间即可最终形成化疗药物的载药栓塞凝胶。药物会通过扩散所用缓慢释放到患处,起到长效治疗的作用,同时通过局部血管栓塞使得癌症部位萎缩达到治疗目的。
42.此外,ph调节剂的加入的量也会影响混合溶液的凝胶时间,在一些实施例中,混合溶液与ph调节剂的体积比为1:(0.01~1),即每1l的混合溶液中,对应添加0.01~1l的ph调节剂。作为本实施例的一个优选实施例,混合溶液与ph调节剂的体积比为1:0.2。
43.进一步地,ph调节剂的种类也会对凝胶形成的时间造成影响,同时还需要考虑到ph调节剂本身不能够对血管造成腐蚀损伤,还需要考虑到血管中血液的渗透压,在一些实施例中,ph调节剂包括柠檬酸、乳酸、酒石酸、偏酒石酸、苹果酸、磷酸、葡萄糖酸、葡萄糖酸内酯、氢氧化钠、碳酸钠、碳酸氢钠、乙醇胺、乙二胺、碱性氨基酸、磷酸二氢钠、磷酸二氢钾、碳酸、醋酸、巴比妥酸和三羟甲基氨基甲烷中的至少一种。具体地,ph调节剂可以是柠檬酸、可以是酒石酸、可以是苹果酸、还可以是柠檬酸和苹果酸的混合液。
44.此外,本发明体提供了一种血管介入载药凝胶栓塞剂的制备方法,请参阅图2,所述血管介入载药凝胶栓塞剂的制备方法包括混合溶液的制备方法,所述混合溶液的制备方法包括以下制备步骤:
45.s10、将阴离子水溶液和阳离子水溶液混合,搅拌均匀,获得聚电解质溶液;
46.具体地,在进行步骤s10时,可以通过以下步骤进行:在25~30℃的条件下,将阴离子水溶液和阳离子水溶液,搅拌0.5~2h,使得阴离子水溶液和阳离子水溶液充分混合均匀,获得聚电解质溶液。
47.步骤s10中,搅拌时间以各原料充分混合均匀为准,实际应用时,搅拌时间为0.5~2h,进一步地,搅拌时间优选为2h。
48.s20、在搅拌的条件下,将化疗药液加入所述聚电解质溶液中,获得混合溶液。
49.在步骤s10中,将化疗药液加入聚电解质溶液中的目的是为了实现最终制备的血管介入载药凝胶栓塞剂既能够实现栓塞功能,又能够实现载药功能;将化疗药物分散在聚电解质溶液中,聚电解质溶液在后续的步骤中进行凝胶化时,能够将分散在聚电解质溶液中的化疗药液同时凝胶化,从而改善化疗药液的缓释性能,延长化疗药液的扩散速度,从而实现长效治疗。
50.在进行步骤s20时,为了保证化疗药液充分地分散在聚电解质溶液中,需要控制搅拌速度和搅拌时间,在实际操作时,一边搅拌聚电解质溶液,一边往聚电解质溶液中滴加化疗药液,同时控制搅拌时间在1~2h之间,确保化疗药液充分地分散在聚电解质溶液中,作为本实施例的一个优选实施例,搅拌时间为2h。
51.需要说明的是,本发明制备的血管介入载药凝胶栓塞剂主要是用于临床治疗中,故,在治疗过程中需要将混合溶液和ph调节剂注射到人体的血管中,因此在临床治疗中可以通过以下步骤进行:获得双针筒单针头注射器,将混合溶液置于其中一个针筒中,将ph调节剂置于另外一个针筒中,推动活塞,将混合溶液和ph调节剂同时注射进人体的血管中,待注入血管完毕后,等待混合溶液整体ph移动至阳离子高分子与阴离子高分子的pka值之间即可最终形成在血管中形成血管介入载药凝胶栓塞剂。
52.在一些实施例中,可以通过提高混合溶液的温度加快混合溶液整体ph的改变速度,以加快混合溶液的凝胶化速度。在实际应用时,由于化疗药液的具体种类不同,化疗药液的使用温度也不同,因此需要根据化疗药液的具体类型控制混合药液的温度,在一些实施例中,混合药液和ph调节剂的混合的温度控制在0~30℃之间。
53.因此,在实际应用过程中可以选择性的控制混合溶液的温度,从而加快其凝胶形成的时间。
54.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
55.实施例1
56.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入16ml的葡萄糖酸内脂水溶液(浓度为0.015g/ml),充分搅拌后静置10min,获得血管介入载药凝胶栓塞剂。
57.实施例2
58.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至10℃,往混合溶液中注入16ml的葡萄糖酸内脂
水溶液(浓度为0.015g/ml),充分搅拌后静置7min,获得血管介入载药凝胶栓塞剂。
59.实施例3
60.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至20℃,往混合溶液中注入16ml的葡萄糖酸内脂水溶液(浓度为0.015g/ml),充分搅拌后静置4min,获得血管介入载药凝胶栓塞剂。
61.实施例4
62.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至30℃,往混合溶液中注入16ml的葡萄糖酸内脂水溶液(浓度为0.015g/ml),充分搅拌后静置1min,获得血管介入载药凝胶栓塞剂。
63.实施例5
64.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入16ml的葡萄糖酸内脂水溶液(浓度为0.03g/ml),充分搅拌后静置2min,获得血管介入载药凝胶栓塞剂。
65.实施例6
66.将20ml的海藻酸钠水溶液(质量浓度为2%)和20ml的羧甲基壳聚糖水溶液(质量浓度为2%)混合,搅拌2h,获得聚电解质溶液,向聚电解质溶液中加入40ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入8ml的葡萄糖酸内脂水溶液(浓度为0.03g/ml),充分搅拌后静置14min,获得血管介入载药凝胶栓塞剂。
67.实施例7
68.将4ml的羧甲基淀粉纳水溶液(质量浓度为1%)和1ml的壳聚糖季铵盐水溶液(质量浓度为1%)混合,搅拌1.5h,获得聚电解质溶液,向聚电解质溶液中加入5ml的吡柔比星,搅拌2h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入2ml的葡萄糖酸内脂水溶液(浓度为0.03g/ml),静置20min,获得血管介入载药凝胶栓塞剂。
69.实施例8
70.将2ml的羧甲基纤维素钠水溶液(质量浓度为1%)和1ml的壳寡糖水溶液(质量浓度为1%)混合,搅拌1.5h,获得聚电解质溶液,向聚电解质溶液中加入3ml的吡柔比星,搅拌1.5h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入4ml的磷酸二氢钾水溶液(浓度为0.03g/ml),静置30min,获得血管介入载药凝胶栓塞剂。
71.实施例9
72.将0.67ml的羧甲基纤维素钠水溶液(质量浓度为4%)和1ml的壳寡糖水溶液(质量浓度为4%)混合,搅拌1.5h,获得聚电解质溶液,向聚电解质溶液中加入1.67ml的吡柔比星,搅拌1.5h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入0.668ml的磷酸二氢钠水溶液(浓度为0.03g/ml),静置40min,获得血管介入载药凝胶栓塞剂。
73.实施例10
74.将0.25ml的羧甲基纤维素钠水溶液(质量浓度为4%)和1ml的壳寡糖水溶液(质量浓度为1%)混合,搅拌1.5h,获得聚电解质溶液,向聚电解质溶液中加入1.25ml的吡柔比
星,搅拌1.5h,获得混合溶液,调节混合溶液的温度至0℃,往混合溶液中注入0.5ml的葡萄糖酸内脂水溶液(浓度为0.03g/ml),静置60min,获得血管介入载药凝胶栓塞剂。
75.性能测试
76.(1)流变性测试
77.利用旋转流变仪(德国haake mars40)对本发明实施例1制备的血管介入载药凝胶栓塞剂的流变特性进行了研究。
78.将实施例1制备的血管介入载药凝胶栓塞剂剪成直径为10mm的圆柱形,置于铝合金平行板样品座(直径10mm)上,首先对应变振幅进行优化,确保所有的测试都是在线性粘弹性区域(lvr)中进行,此时储能模量(g')和耗能模量(g")不受应变的影响,然后将动态储能模量(g')和损耗模量(g")作为时间函数在选定的应变振幅和振荡频率条件下进行测量,以确保测量条件不会破坏凝胶过程(请参阅图3),实验使用的振荡频率为1hz,应变为0.001。
79.其中,流变仪测试中的g'是指储能模量,代表粘弹性行为的弹性部分,描述的是样品的固态特性。g"是指损耗模量,描述的是粘弹性行为的黏性部分,也可以看作是样品的液态特性
80.由图3可以得出:g'大于g",说明实施例1制备的血管介入载药凝胶栓塞剂能有效固定液体,起到栓塞作用。
81.(2)体外药物释放测试
82.选用盐酸小檗碱作为模型药物。以ph=7.4的磷酸盐缓冲液为接受介质,以紫外分光光度计测定药物的释放量,评价凝胶栓塞剂的药物释放性能。
83.取实施例1制备的血管介入载药凝胶栓塞剂为样品进行取样,获得高度为1cm、直径为1.2cm的凝胶样品,将将凝胶样品放入50mlpbs缓冲液中研究药物释放规律。每隔12小时吸取pbs缓冲液2ml并留样,后补加2ml维持液体总量不变,请参阅图4,图4为连续检测48h,取样4次红外线光谱测试结果。
84.由图4可以得出,本发明制备的血管介入载药凝胶栓塞剂对药物成分具有良好的扩散性能。
85.(3)模拟注射测试
86.获得双针筒单针头注射器,将实施例1制备的混合溶液置于其中一个针筒中,将实施例1提供的葡萄糖酸内脂水溶液置于另外一个针筒中,推动活塞,将混合溶液和ph调节剂同时注射进市售猪肝组织中,注射完成后发现针孔孔道即刻完全被凝胶栓塞(请参阅图1)。
87.综上所述,本发明提供的血管介入载药凝胶栓塞剂能有效固定液体,起到栓塞作用,且对药物成分具有良好的扩散性能。由实施例1至4可以得出,温度越高,凝胶形成的时间越快,由实施例1、5、6可以得出,随着ph调节剂的体积增加,凝胶形成的时间越快,由实施例1、7、8、9、10可以得出,随着阴离子水溶液体积的减小,凝胶形成的时间越长。
88.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1