一种润肠通便的动物双歧杆菌及其应用与制剂的制作方法
一种润肠通便的动物双歧杆菌及其应用与制剂
1.本技术是申请号为202010075484.1,申请日为2020.01.22,发明名称为“一种润肠通便的动物双歧杆菌及其应用与制剂”的分案申请。
技术领域
2.本发明属于生物技术领域,具体涉及一种润肠通便的动物双歧杆菌及其应用与制剂。
背景技术:
3.近些年来酸奶市场发展迅猛,以两位数的增长率持续增长,在2018年酸奶增速整体放缓。但是在酸奶的细分市场发展趋势中可以看到,功能性酸奶在受到越来越多的消费者追捧。而且,在分析发达国家酸奶市场发展时可以看到在日本市场中功能性酸奶是整个日本酸奶市场保持持续增长的一个重要原因。因此,功能性酸奶是未来酸奶市场发展的一个重要细分品类。
4.随着现代生活节奏的不断加快,人们的饮食已经从营养贫乏阶段进入了营养过程阶段,而且以精细粮以及肉类为主,缺少水果蔬菜的摄入。再加上工作压力较大,缺少运动等因素,致使便秘等肠道健康问题凸显。便秘患者一般排便次数较少,排便时伴有排便费力、排便疼痛、排便不尽等感受,严重影响着人们的生活质量和情绪。缓解便秘或排便不畅的方法一般是使用通便剂或泻药。但这种方法会导致肠神经敏感性降低并形成依赖性而被人们排斥。目前还没有有效的日常饮食方式来改善排便不畅。在日益增加的肠道健康问题以及缺少有效日常缓解方式之间形成了巨大的市场空间。因此开发具有润肠通便功能的酸奶是功能性酸奶细分市场一个很好的切入点。
5.近年来,益生菌产业发展迅猛。已有研究表明益生菌具有促进消化、调节肠道菌群、促进排便、缓解便秘等功能。通过将益生菌与酸奶结合,开发益生菌发酵乳来强化酸奶润肠通便的作用。而且,随着消费者认知的提高,益生菌已经成为了酸奶重要的产品利益点,可以拉高产品溢价空间。然而,我国的益生菌研究起步较晚,成熟稳定的益生菌工业制剂基本被国外的菌种公司垄断,造成了益生菌酸奶的成本较高以及产品过渡依赖菌种供应商的局面。为了更好的开发润肠通便等功能性酸奶,降低益生菌酸奶开发成本,因此亟需开发一种新的具有润肠通便功能的功能性益生菌菌株。
技术实现要素:
6.为此,本发明旨在提供一种新的具有润肠通便的动物双歧杆菌及其应用与制剂。
7.为解决上述技术问题,本发明采用的技术方案如下:本发明所提供的动物双歧杆菌(bifidobacterium animalis)mn-gup,其保藏号为cgmcc no.15578,已于2018年4月10日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101。
8.本发明中通过菌株分离和菌株的航天诱变来得到动物双歧杆菌mn-gup,具体地,(1)菌株的分离为:采集广西巴马健康长寿老人肠道内容物,也即粪便,使用稀释液对广西巴马健康长寿老人肠道粪便样品进行梯度稀释,其中,稀释液的配制方法:磷酸二氢钠 4.5g,磷酸氢二钠 6.0g,l-半胱氨酸 0.5g,琼脂0.5g,吐温80 0.5ml,蒸馏水1000ml,加热溶解,调ph至7.4-7.6,121℃下灭菌15min,备用,使用npnl-x-gal选择性培养基(含硫酸新霉素、硫酸巴龙霉素、丙酸钠、氯化锂)厌氧分离双歧杆菌(可采用杨海莺. 长寿老人源双歧杆菌的筛选、免疫功能及肠道免疫机理的研究[d].中国农业大学,2010),挑取蓝色不同形态菌落,镜检选取革兰氏阳性、形态不规则的杆菌,继续使用倾注平板法(也即挑取不容形态菌落接种到液体mrs培养基中培养12-16小时,取1ml菌液使用稀释液连续进行7次10倍梯度稀释,取1ml稀释液加入无菌平皿中,导入适量mrs固体培养基,待培养基凝固后,倒置放入37℃培养箱中厌氧培养48小时,挑取单菌落获得菌株的纯培养物)纯化菌株,直到分离得到菌株的纯培养物。经过这一分离过程,得到一株乳双歧杆菌,经16s rrna鉴定为乳双歧杆菌,命名为乳双歧杆菌bb-11,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.14056;(2)菌株的航天诱变:将乳双歧杆菌bb-11搭载于“神舟十一号”返回式飞船。飞船于2016年10月17日发射,2016年11月18日返回地面,飞行过程中样品置于飞船返回舱,返回地面后取出样品,4℃冰箱保存,而后进行诱变菌株筛选与鉴定。使用稀释液将样品进行梯度稀释,使用mrsc(内含半胱氨酸盐酸盐)培养基厌氧分离突变菌株。通过耐氧系数的筛选得到一耐氧能力显著高于乳双歧杆菌bb-11的突变株(王莹,孙健,牛天娇,等. 动物双歧杆菌耐氧航天诱变菌株mn-gup的筛选[j]. 中国奶牛,2018,6:1-6)。该菌株耐氧系数可达0.998,而野生株bb-11仅为0.331。并且,菌株在5%、10%、15%、21%氧气浓度下的存活率均高于野生株bb-11。将该菌株命名为动物双歧杆菌mn-gup,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15578。
[0009]
双歧杆菌是重要的益生菌,它是最早定植于婴儿肠道中的微生物。已有众多研究表明双歧杆菌具有调节肠道菌群、缓解便秘、增强免疫等功能。但是由于双歧杆菌为专性厌氧菌,而且多数双歧杆菌的耐受性不强,其在食品工业中的应用受到了限制。
[0010]
此外,本发明还提供了上述动物双歧杆菌mn-gup在制备润肠通便的药物和/或保健食品和/或食品中的应用。
[0011]
此外,本发明还提供了一种润肠通便的产品,包括动物双歧杆菌mn-gup。
[0012]
所述产品为药物和/或保健食品和/或食品。
[0013]
本发明中,药物可以根据给药途径不同而制备成不同形式,例如,可制备成散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂等形式;药物中还可包括药学上可接受的佐剂。食品包括任意类型的食品,例如固体饮料、豆制品、果汁、乳制品、冰淇淋、糖果、饼干等;食品中还可含有常规的添加剂、营养强化剂、原辅料,例如香精香料、稳定剂、增稠剂、防腐剂、矿物质、维生素、麦芽糊精等。
[0014]
进一步地,以每克润肠通便的药物和/或保健食品和/或食品为基准,所述动物双歧杆菌mn-gup含量为4
×
106cfu/g—4
×
108cfu/g。
[0015]
进一步地,以每克润肠通便的药物和/或保健食品和/或食品为基准,所述动物双歧杆菌mn-gup含量为4
×
107cfu/g—4
×
108cfu/g。
[0016]
此外,本发明还提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。
[0017]
进一步地,以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
106cfu/g—4
×
108cfu/g,所述菊粉的含量为10 mg/ g—50mg/ g。
[0018]
进一步地,以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
107cfu/g—4
×
108cfu/g,所述菊粉的含量为25 mg/ g—50mg/ g。
[0019]
本发明具有如下有益效果:本发明通过在广西巴马健康长寿老人肠道内容物中分离得到乳双歧杆菌bb-11,并将该菌株进行航天搭载,通过太空诱变最终筛选得到一株耐氧性能显著提高的动物双歧杆菌mn-gup,也即具有显著增强的耐氧能力,通过便秘模型小鼠评价证明该菌株具有良好的润肠通便功能,将其应用于润肠通便的药物、保健食品、食品中具有广阔的应用前景。
具体实施方式
[0020]
下面对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0021]
实施例1本实施例提供了一种动物双歧杆菌mn-gup,其保藏编号为cgmcc no.15578。
[0022]
本发明中通过菌株分离和菌株的航天诱变来得到动物双歧杆菌mn-gup,具体地,(1)菌株的分离为:采集广西巴马健康长寿老人肠道内容物,也即粪便,使用稀释液对广西巴马健康长寿老人肠道粪便样品进行梯度稀释,其中,稀释液的配制方法:磷酸二氢钠 4.5g,磷酸氢二钠 6.0g,l-半胱氨酸 0.5g,琼脂0.5g,吐温80 0.5ml,蒸馏水1000ml,加热溶解,调ph至7.4-7.6,121℃下灭菌15min,备用,使用npnl-x-gal选择性培养基(含硫酸新霉素、硫酸巴龙霉素、丙酸钠、氯化锂)厌氧分离双歧杆菌(可采用杨海莺. 长寿老人源双歧杆菌的筛选、免疫功能及肠道免疫机理的研究[d].中国农业大学,2010),挑取蓝色不同形态菌落,镜检选取革兰氏阳性、形态不规则的杆菌,继续使用倾注平板法(也即挑取不容形态菌落接种到液体mrs培养基中培养12-16小时,取1ml菌液使用稀释液连续进行7次10倍梯度稀释,取1ml稀释液加入无菌平皿中,导入适量mrs固体培养基,待培养基凝固后,倒置放入37℃培养箱中厌氧培养48小时,挑取单菌落获得菌株的纯培养物)纯化菌株,直到分离得到菌株的纯培养物。经过这一分离过程,得到一株乳双歧杆菌,经16s rrna鉴定为乳双歧杆菌,命名为乳双歧杆菌bb-11,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.14056;(2)菌株的航天诱变:将乳双歧杆菌bb-11搭载于“神舟十一号”返回式飞船。飞船于2016年10月17日发射,2016年11月18日返回地面,飞行过程中样品置于飞船返回舱,返回地面后取出样品,4℃冰箱保存,而后进行诱变菌株筛选与鉴定。使用稀释液将样品进行梯度稀释,使用mrsc(内含半胱氨酸盐酸盐)培养基厌氧分离突变菌株。通过耐氧系数的筛选得到一耐氧能力显著高于乳双歧杆菌bb-11的突变株(王莹,孙健,牛天娇,等. 动物双歧杆菌耐氧航天诱变菌株mn-gup的筛选[j]. 中国奶牛,2018,6:1-6)。该菌株耐氧系数可达0.998,而野生株bb-11仅为0.331。并且,菌株在5%、10%、15%、21%氧气浓度下的存活率均高于野生株bb-11。将该菌株命名为动物双歧杆菌mn-gup,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15578。
[0023]
实施例2本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
106cfu/g,所述菊粉的含量为10mg/ g;上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
106cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.2g溶解与10g的生理盐水中(20mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0024]
实施例3本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
106cfu/g,所述菊粉的含量为25 mg/ g。
[0025]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
106cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.5g溶解与10g的生理盐水中(50mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0026]
实施例4本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
106cfu/g,所述菊粉的含量为50 mg/ g。
[0027]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
106cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉1.0g溶解与10g的生理盐水中(100mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0028]
实施例5本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
107cfu/g,所述菊粉的含量为10mg/ g;上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
107cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.2g溶解与10 g的生理盐水中(20mg/g),得到菊粉溶液;
(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0029]
实施例6本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
107cfu/g,所述菊粉的含量为25 mg/ g。
[0030]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
107cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.5g溶解与10 g的生理盐水中(50mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0031]
实施例7本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
107cfu/g,所述菊粉的含量为50 mg/ g。
[0032]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
107cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉1.0g溶解与10 g的生理盐水中(100mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0033]
实施例8本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
108cfu/g,所述菊粉的含量为10mg/ g;上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
108cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.2g溶解与10 g的生理盐水中(20mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0034]
实施例9本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
108cfu/g,所述菊粉的含量为25 mg/ g。
[0035]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
108cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉0.5g溶解与10 g的生理盐水中(50mg/g),得到菊粉
溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0036]
实施例10本实施例提供了一种制剂,包括动物双歧杆菌mn-gup和菊粉。以每克所述制剂为基准,所述动物双歧杆菌mn-gup含量为4
×
108cfu/g,所述菊粉的含量为50 mg/ g。
[0037]
上述制剂的制备方法,包括如下步骤:(1)菌悬液的配制:将动物双歧杆菌mn-gup菌株,用mrs液体培养基于37℃培养12h,并于4500r/min离心15min,菌体沉淀重新悬于生理盐水中,配制成8
×
108cfu/g的菌悬液;(2)菊粉的配置:准确称取菊粉1.0g溶解与10 g的生理盐水中(100mg/g),得到菊粉溶液;(3)取等质量的菌悬液和菊粉溶液混合,得到制剂。
[0038]
下面通过使用便秘小鼠动物模型对动物双歧杆菌mn-gup的润肠通便功能进行评价。
[0039]
1动物双歧杆菌mn-gup润肠通便功能的评价:使用便秘小鼠动物模型对动物双歧杆菌mn-gup的润肠通便功能进行评价。
[0040]
1.1 试验动物及所用溶液:balb/c雄性小鼠,6~8周龄,体质量18~22g,spf级,购自北京维通利华实验动物技术有限公司。复方地芬诺酯片(批号1109026) 常州康普药业有限公司;活性炭粉巩义市嵩山滤材活性炭厂;阿拉伯树胶广东汕头市西陇化工厂;mrs培养基北京奥博星生物技术有限公司。
[0041]
菌悬液的配制:参照上述实施例2-10中的菌悬液的配制方法,配制不同浓度菌悬液。
[0042]
墨汁的配制:准确称取阿拉伯树胶100g,加水800ml,煮沸至溶液透明,称取活性碳(粉状)50g加至上述溶液中煮沸3次,待溶液凉后加水定容到1000ml,于冰箱中4℃保存,用前摇匀。
[0043]
复方地芬诺酯混悬液的配制:复方地芬诺酯片,每片含复方地芬诺酯2.5mg,分别取20片用研钵研碎呈粉末后加水至50ml,临用前配制。
[0044]
菊粉的配置:参照上述实施例2-10中的菊粉的配制方法,配制不同浓度的菊粉溶液,灭菌备用。
[0045]
1.2 试验动物分组及处理:实验菌株设17个处理组,分别为:空白组、模型组、阳性菌株对照组;mn-gup低剂量组(mn-gup-l)、mn-gup中剂量组(mn-gup-m)、mn-gup高剂量组(mn-gup-h)、菊粉低剂量组(菊粉-l)、菊粉高剂量组(菊粉-h);mn-gup-m+菊粉低剂量组(mn-gup-m +菊粉-l)、mn-gup-m +菊粉中剂量组(mn-gup-m +菊粉-m)、mn-gup-m +菊粉高剂量组(mn-gup-m +菊粉-h);mn-gup-l+菊粉-l、mn-gup-l+菊粉-m、mn-gup-l+菊粉-h;mn-gup-h+菊粉-l、mn-gup-h+菊粉-m、mn-gup-h+菊粉-h;空白组和模型组小鼠灌胃质量分数0.9%生理盐水。阳性菌株对照组灌胃已知具有润肠通便作用的菌株乳双歧杆菌bb-12 4
×
10
7 cfu/(只
·
d)。mn-gup低、mn-gup中、mn-gup
高剂量组小鼠灌胃mn-gup菌悬液,灌胃剂量分别为4
×
106、4
×
107、4
×
10
8 cfu/(只
·
d)。菊粉低、高剂量组小鼠灌胃菊粉溶液,灌胃剂量分别为10mg、50mg/(只
·
d)。mn-gup-m+菊粉低、中、高剂量组灌胃mn-gup和菊粉,mn-gup的灌胃剂量相同,都是4
×
107 cfu/(只
·
d),菊粉的灌胃剂量分别为10mg、25mg、50mg/(只
·
d)。mn-gup-l+菊粉-l、mn-gup-l+菊粉-m、mn-gup-l+菊粉-h组灌胃mn-gup和菊粉,mn-gup的灌胃剂量相同,都是4
×
106 cfu/(只
·
d),菊粉的灌胃剂量分别为10mg、25mg、50mg/(只
·
d)。mn-gup-h+菊粉-l、mn-gup-h+菊粉-m、mn-gup-h+菊粉-h组灌胃mn-gup和菊粉,mn-gup的灌胃剂量相同,都是4
×
10
8 cfu/(只
·
d),菊粉的灌胃剂量分别为10mg、25mg、50mg/(只
·
d)。每天灌胃一次,试验期间自由进食,记录各组小鼠体质量变化。
[0046]
1.3 小鼠排便试验:本实验便秘模型的造模药物为复方地芬诺酯。复方地芬诺酯是一种止泻剂,它可以直接作用于肠道平滑肌,抑制肠黏膜感受器,消除局部肠黏膜蠕动反射而使肠道蠕动减慢,使肠内容物通过延迟,从而导致小鼠排便困难,形成便秘模型。在建立了小鼠便秘模型后,灌胃墨汁可以标记灌胃物在小肠中的推进情况及在粪便中的排出情况,从而反映小鼠肠道的蠕动,进行评价受试物对小鼠便秘的缓解作用。
[0047]
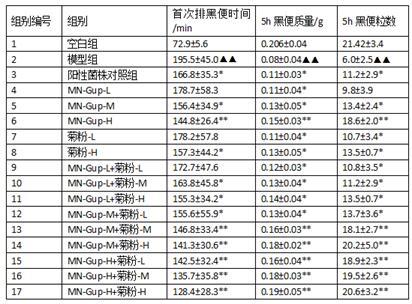
按试验分组对实验小鼠进行灌胃,连续灌胃7天后,各组小鼠禁食不禁水16h。各实验组给予复方地芬诺酯,空白组给予蒸馏水。将灌胃用生理盐水、菌悬液及菊粉溶液与墨汁混合,在给予复方地芬诺酯0.5h后,空白组和模型组小鼠灌胃生理盐水混合墨汁,阳性菌株对照组、mn-gup组、菊粉组、mn-gup+菊粉组给予含受试样品的混合墨汁,动物均单笼饲养,正常饮水进食。从灌胃墨汁开始,记录每只动物首次排黑便时间、5h内排黑便粒数、质量,结果见表1:表1. mn-gup和菊粉对便秘模型小鼠各排便指标的影响(n=10)n=10). 与空白组相比,有极显著性差异,p <0.01;* . 与模型组相比,有显著性差异,p <0.05;** . 与模型组相比,有极显著性差异,p <0.01;
与空白组比较,模型组小鼠首次排黑便时间、5h内排黑便粒数、排便质量均有极显著性差异(p <0.01),说明便秘小鼠模型成立。阳性菌株对照组的首次排黑便时间显著低于模型组,5h黑便质量以及5h黑便粒数显著高于对照组,说明阳性对照菌株能够改善便秘小鼠的便秘症状。mn-gup低、中、高剂量组与模型组相比,mn-gup低剂量组的排便时间有所降低但无显著差异,5h黑便质量显著高于模型组,5h黑便粒数与模型组相比有所提高但无显著差异。mn-gup中剂量组的首次排黑便时间与模型组相比显著降低,而且5h黑便质量和5h黑便粒数均显著高于模型组。mn-gup高剂量组的首次排黑便时间与模型组相比出现了极显著的降低,5h黑便质量和5h黑便粒数出现了极显著的升高。这说明不同剂量mn-gup的灌胃能够缓解便秘小鼠的便秘症状,其中mn-gup中、高剂量组效果显著。同时,同剂量的mn-gup与阳性对照菌株相比,mn-gup的作用强于阳性对照菌株。
[0048]
在菊粉组中可以看到,低剂量菊粉组的首次排黑便时间与模型组相比有所降低但无显著差异,其5h黑便质量及5h黑便粒数出现了显著的提高。高剂量菊粉组的首次排黑便时间与模型组相比有显著降低,而且其5h黑便质量及5h黑便粒数均出现了显著的提高。这说明不同剂量的菊粉对小鼠的便秘症状具有改善作用,高剂量菊粉效果更好。
[0049]
在mn-gup与菊粉的复配组中可以看到,低剂量与不同剂量菊粉复配时,mn-gup-l+菊粉-l组首次排黑便时间与模型组相比有所减少但无显著差异,5h排便质量与5h排便粒数显著提高。mn-gup中剂量与不同剂量菊粉复配组以及mn-gup高剂量与不同剂量菊粉复配组在首次排黑便时间显著低于模型组,5h排便质量、5h排便粒数显著高于模型组。这说明mn-gup与不同剂量菊粉复配对小鼠便秘有缓解作用,同时当mn-gup与中、高剂量的菊粉复配时比同剂量水平的mn-gup效果更好。
[0050]
1.4 小肠推进试验:按试验分组对实验小鼠进行灌胃,连续灌胃15天后,各组小鼠禁食不禁水16h。各实验组给予复方地芬诺酯,空白组给予蒸馏水。将灌胃用生理盐水、菌悬液及菊粉溶液与墨汁混合,在给予复方地芬诺酯0.5h后,空白组和模型组小鼠灌胃生理盐水混合墨汁,阳性菌株对照组、mn-gup组、菊粉组、mn-gup+菊粉组给予含受试样品的混合墨汁。25min后立即脱颈椎处死小鼠,打开腹腔分离肠系膜,剪取上端自幽门、下端至盲肠部的肠管,置于托盘上,轻轻将小肠拉成直线,测量肠管长度为“小肠总长度”,从幽门至墨汁前沿为“墨汁推进长度”。墨汁推进率/%=[墨汁推进长度(cm)/小肠总长度(cm)]
×
100。小肠推进率测定结果见表2:表2 mn-gup和菊粉对便秘小鼠小肠墨汁推进率的影响 (x
±
s, n=10)
.与空白组相比,有极显著性差异,p <0.01;* . 与模型组相比,有显著性差异,p <0.05;** . 与模型组相比,有极显著性差异,p <0.01;由表2可知,模型组墨汁推进率极显著的低于空白组,说明小鼠便秘模型造模成功。阳性对照菌株的小肠推进率显著高于模型组,说明阳性对照菌株可以显著促进便秘小鼠的肠道蠕动。mn-gup的三个剂量组与模型组相比,低剂量组与模型组相比,小肠推进率出现了升高,但无显著差异。mn-gup中剂量组小肠推进率显著高于模型组,mn-gup高剂量组小肠推进率极显著的高于模型组。这说明mn-gup对便秘小鼠的肠道蠕动有促进作用,中、高剂量组作用显著。同时,同剂量的mn-gup与阳性对照菌株相比,对于小肠推进率的提高更为明显。
[0051]
在菊粉组中,低剂量菊粉组小肠推进率与模型组相比有所提高但无显著差异,高剂量菊粉组与模型组相比显著提高。这说明菊粉对小肠的蠕动有促进作用,高剂量菊粉作用显著。
[0052]
在mn-gup与菊粉的复配组中可以看到,低剂量mn-gup与不同剂量菊粉复配时,mn-gup-l+菊粉-l小肠推进率与模型组相比有所提高但是无显著差异,mn-gup-l+菊粉-m和mn-gup-l+菊粉-h小肠推荐率显著提高。中高剂量mn-gup与不同剂量菊粉复配时小肠推进率均显著或极显著高于模型组说明mn-gup与菊粉的复配可以显著促进小肠的蠕动。同时,mn-gup与中、高剂量的菊粉复配对小肠推进率的提高大于同剂量的mn-gup组,说明当mn-gup与菊粉复配时可以增强mn-gup对小肠蠕动的促进作用。
[0053]
综上所述,在本实验中,中、高剂量的双歧杆菌mn-gup和高剂量的菊粉菌能够显著提高机体的肠道蠕动能力,促进排便,减轻便秘症状。mn-gup与中、高剂量的菊粉复配时,润肠通便的作用得到增强。在润肠通便功能中,动物双歧杆菌mn-gup的有效剂量为4
×
107cfu和4
×
108cfu,与菊粉复配使用时,mn-gup的剂量范围是4
×
106cfu~4
×
108cfu,菊粉的剂量范围是25mg~50mg。在利用小鼠便秘模型对菌株润肠通便作用的功能进行评价的试验中,组4-17用于说明菌株自身及与菊粉复配使用的情况下对小鼠便秘的缓解效果;组1(空白组)为对比例1,用于说明自然状态下小鼠的排便情况;组2(模型组)为对比例2,用于说明便秘状态下小鼠的排便情况;组3(阳性菌株对照组)为对比例3,用于说明已被证实具有便秘缓
解作用菌株的缓解效果。
[0054]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1