一种PIM1siRNA在制备治疗砷致细胞恶性转化的疾病药物中的应用
一种pim1 sirna在制备治疗砷致细胞恶性转化的疾病药物中的应用
技术领域
1.本发明属于生物医药技术领域,尤其是指一种pim1 sirna在制备治疗砷致细胞恶性转化的疾病药物中的应用。
背景技术:
2.无机砷及其化合物是世卫组织(who)列出的引起重大公共卫生关注的10种化学品之一,国际癌症研究机构(iarc)确定砷为第1类致癌物质(人类致癌物质),美国环保局(usepa)将其分类为a类致癌物质(具有高致癌危害的人类致癌物质)。但是,砷致癌的分子机制研究却长期滞后。对癌症疾病中改变的分子途径的日益识别和理解为探究致癌机制以及进一步治疗癌症铺平了道路。因此,砷致癌过程中分子途经的改变以及机制需要更深入的研究。
3.癌基因pim1位于17号染色体上,其广泛的参与多种生物活动。一些具有致癌特性的蛋白和途径,已被确定为癌基因pim1编码的蛋白激酶活性的靶标,如细胞周期的调节和细胞凋亡的控制。pim1可以在多种阶段促进细胞周期进程以及促进有丝分裂,如磷酸化cdc25a、cdc25c等。除了控制细胞生长途径外,pim1还能阻止细胞凋亡,因此可以作为致癌存活因子。pim1会影响不同转录因子的活性,例如c-myb、c-myc等。此外,pim1在缺氧诱导的化学抗性中起作用。在人类的各种肿瘤疾病中,pim1信号的改变被广泛发现。在血液系统恶性肿瘤中,pim1表达与各种白血病、结缔组织淋巴瘤和弥漫性大b细胞淋巴瘤的不良预后有关;在实体瘤中,已在膀胱癌和前列腺癌标本中检测到pim1的过度表达,其中还与不良预后以及治疗反应相关,食管癌与胃癌中也有类似的发现。在细胞培养模型以及患者胃上皮细胞中显示感染幽门螺旋杆菌后,pim1表达上调;在头颈癌中,pim1是呈高表达的。
技术实现要素:
4.为解决上述技术问题,本发明提供了一种pim1 sirna在制备治疗砷致细胞恶性转化的疾病药物中的应用。
5.本发明的第一个目的在于提供一种pim1 sirna在制备治疗砷致细胞恶性转化的疾病药物中的应用。所述pim1 sirna包括三种不同的sirna,其中三种sirna的序列如下:
6.sc-36225a:
7.正义链:5
′‑
cccauagauacucucuucutt-3
′
8.反义链:5
′‑
agaagagaguaucuaugggtt-3
′
9.sc-36225b:
10.正义链:5
′‑
guuggcaugguaguauacatt-3
′
11.反义链:5
′‑
uguauacuaccaugccaactt-3
′
12.sc-36225c:
13.正义链:5
′‑
uuggcaugguaguauacaatt-3
′
14.反义链:5
′‑
uuguauacuaccaugccaatt-3
′
15.在本发明的一个实施例中,所述细胞选自hacat。
16.在本发明的一个实施例中,所述疾病为皮肤基底细胞癌或皮肤鳞状细胞癌。
17.本发明的第二个目的在于提供一种重组载体,包括能够转录所述pim1sirna的序列,所述序列嵌入载体。
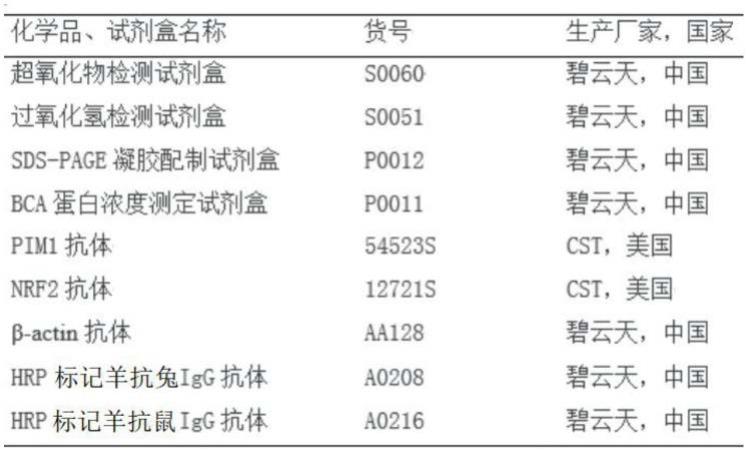
18.本发明的第三个目的在于提供一种药物组合物,包括所述的药物或所述的重组载体。
19.在本发明的一个实施例中,还包括药学上或药理上可接受的载体。
20.在本发明的一个实施例中,所述载体选自崩解剂、稀释剂、润滑剂、粘合剂、湿润剂、矫味剂、助悬剂、表面活性剂和防腐剂中的一种或多种。
21.在本发明的一个实施例中,所述药物组合物的剂型为片剂、胶囊剂、软胶囊剂、颗粒剂、丸剂、口服液、乳剂、干混悬剂、干浸膏剂或注射剂。
22.本发明的第四个目的在于提供一种试剂盒,包括所述的药物或所述的重组载体或所述的药物组合物。
23.本发明的第五个目的在于提供所述的试剂盒在制备治疗砷致细胞恶性转化的疾病药物中的应用。
24.本发明的上述技术方案相比现有技术具有以下优点:
25.本发明研究发现,在化学致癌过程中(砷致hacat细胞恶变过程中),癌基因pim1的蛋白从细胞连续染毒14代开始持续高表达,pim1 sirna可以通过抑制过氧化氢和超氧化物生成,进而延长细胞倍增时间,减少细胞迁移率和软琼脂克隆集落形成数而抑制砷致细胞恶性转化。
26.本发明通过对t-hacat转染pim1 sirna后发现,软琼脂克隆形成能力和细胞迁移能力降低,细胞倍增时间升高,细胞恶性转化指标被逆转,表明pim1的持续激活能够促进癌症的发生发展。
27.同时,本发明对t-hacat细胞转染pim1 sirna之后发现,nrf2表达水平降低,进一步检测过氧化氢与超氧化物水平发现,过氧化氢与超氧化物水平明显升高。pim1的激活能够促进nrf2的表达并且能够促进癌症的发生发展。随着对pim1作用的进一步研究发现,pim1可能调控氧化还原敏感的核转录因子nrf2的表达。nrf2通过增强细胞的抗氧化能力来维持细胞中的活性氧水平。
附图说明
28.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中
29.图1是本发明实施例1中naaso2所致hacat细胞发生恶转过程中pim1的表达变化;其中(a)pim1蛋白western结果图(b)pim1蛋白的定量分析结果;
30.图2是本发明实施例1中pim1 sirna对naaso2所致t-hacat细胞pim1蛋白的影响,其中(a)pim1蛋白western结果图;(b)pim1蛋白的定量分析结果;
31.图3是本发明实施例1中pim1 sirna对naaso2所致t-hacat细胞nrf2蛋白的影响,其中,(a)nrf2蛋白western结果图;(b)nrf2蛋白的定量分析结果;
32.图4是本发明实施例2中pim1 sirna对naaso2所致t-hacat细胞活性氧的影响,其中(a)过氧化氢水平实验结果图;(b)超氧化物水平实验结果图;
33.图5是本发明实施例4中pim1 sirna对naaso2所致恶性转化的hacat细胞倍增时间的影响;
34.图6是本发明实施例5中pim1 sirna对naaso2所致恶性转化的hacat细胞迁移能力的影响;其中,(a)细胞划痕实验结果图;(b)细胞相对迁移率;
35.图7是本发明实施例6中pim1 sirna对naaso2所致恶性转化的hacat细胞锚着独立生长的影响;其中,(a)细胞软琼脂克隆实验结果图;(b)细胞软琼脂克隆定量分析结果。
36.附图中,
*
p《0.05,与传代对照组细胞比较,差异具有统计学意义。
#
p《0.05,与con sirna比较,差异具有统计学意义。
具体实施方式
37.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
38.1,本发明所使用hacat细胞株购买于中国典型培养物保藏中心,武汉大学保藏中心。
39.2,0.1μm naaso2连续处理hacat细胞至35代后,细胞发生恶性转化,表现为细胞倍增时间明显缩短,细胞迁移率明显增加,软琼脂克隆形成能力明显增加。此时细胞定义为0.1μm naaso2恶性转化的细胞(t-hacat)。
40.3,本发明所用试剂:pim1 sirna(sc-36225,美国santa cruz),control sirna(sc-37007,美国santa cruz),sirnatransfection reagent(sc-29528,美国santa cruz),sirnatransfection medium(sc-36868,美国santa cruz)。其他试剂为常规试剂。
41.4,本发明所述的pim1 sirna包括三种不同的sirna,其中三种sirna的序列如下:
42.sc-36225a:
43.正义链:5
′‑
cccauagauacucucuucutt-3
′
44.反义链:5
′‑
agaagagaguaucuaugggtt-3
′
45.sc-36225b:
46.正义链:5
′‑
guuggcaugguaguauacatt-3
′
47.反义链:5
′‑
uguauacuaccaugccaactt-3
′
48.sc-36225c:
49.正义链:5
′‑
uuggcaugguaguauacaatt-3
′
50.反义链:5
′‑
uuguauacuaccaugccaatt-3
′
。
51.5,本发明所用试剂盒:
[0052][0053]
实施例1细胞培养及染砷
[0054]
培养细胞所用培养基为dmem完全培养基,培养条件为5%co2、37℃恒温培养箱中。在进行细胞传代时,倒去细胞培养皿中的培养基液体,使用pbs对细胞进行2次清洗,之后加入1.5ml含edta的胰酶消化液,于37℃加热板上消化6min,镜下观察细胞,当细胞形态发生变化并脱离培养皿呈漂浮状态时,加入2ml培养基终止消化。使用移液枪将细胞悬液移入无菌离心管中离心(1000g室温离心3min),弃去上清,留细胞沉淀于无菌离心管底部,使用移液器添加1ml培养基并缓缓吹散细胞使细胞重悬,再按1:2的比例传代培养。使用终浓度为0.1μm naaso2的dmem培养基培养至35代(约18周),同时设立未染砷的传代对照组细胞。
[0055]
实施例2pim1 sirna处理恶性转化的hacat细胞
[0056]
将恶性转化的hacat细胞与正常传代对照组细胞接种于6孔板中,待细胞贴壁后进行后续处理。首先配制pim1 sirna转染试剂,按每培养皿的量进行溶液的配制,每培养皿a液:12μl pim1 sirna或con sirna,加入988μl sirna转染介质;每培养皿b液:12μl sirna转染试剂,加入988μl sirna转染介质。充分混合a液b液混合后得到含有转染试剂和pim1 sirna或con sirna的混合物,避光孵育20min。之后进行细胞清洗,先用pbs清洗一次,再用2ml sirna转染介质清洗一次,吸去液体,每一培养皿加入2ml sirna转染试剂的混合物,置于5%co2、37℃恒温培养箱中孵育细胞6h。待6h后,吸去培养皿内的液体,加入适量的正常细胞培养基,于24-72h后检测相关指标。实验结果如图1-3所示。
[0057]
由图1可知,与传代对照组细胞(未经naaso2处理的细胞)相比,0.1μmnaaso2所致恶性转化的hacat(t-hacat)细胞pim1表达水平随着染毒时间的增加显著增高(p《0.05)。westernblot结果图及其定量分析图显示,随着0.1μm naaso2处理hacat细胞染毒代数的增加,pim1的蛋白表达水平呈持续上升趋势,具体表现为第14代pim1蛋白表达水平与0代对照组相比有统计学差异,第21、28、35代pim1蛋白表达水平与0代及正常传代对照组相比均有统计学差异。如图2所示,t-hacat细胞转染pim1 sirna后:与转染对照组(con sirna)细胞相比,pim1表达水平明显降低(p《0.05),表明转染成功,同时如图3所示,与传代对照组细胞(未经naaso2处理的细胞)相比,0.1μm naaso2所致恶性转化的hacat(t-hacat)细胞nrf2表达水平显著增高(p《0.05),t-hacat细胞转染pim1 sirna后,与转染对照组(con sirna)细胞相比,nrf2表达水平明显降低(p《0.05)。
[0058]
实施例3细胞中过氧化氢和超氧化物的检测
[0059]
过氧化氢水平检测步骤:
[0060]
(1)样品的准备:收集细胞培养液
[0061]
(2)标准品的准备:按照说明用细胞培养液稀释标准品。标准溶液稀释为1、2、5、10、20、50、100微摩尔/升。
[0062]
(3)用96孔板进行检测,各孔内加入50μl样品或标准品,随后加入两倍体积的过氧化氢检测试剂。
[0063]
(4)混匀后室温条件下静置30min,后用酶标仪检测560nm波长处的吸光度值。
[0064]
(5)根据标曲计算出样品中过氧化氢浓度。实验结果见图4。
[0065]
超氧化物水平检测步骤:
[0066]
(1)样品的准备:按照10,000个/孔的细胞密度接种细胞于96孔板中。
[0067]
(2)弃去孔内培养液,pbs洗涤1次。
[0068]
(3)按照每孔212μl配制工作液(包含200μl检测缓冲液,10μlwst-1,2μl catalase)。
[0069]
(4)每孔加入200μl配置好的检测工作液,37℃3min。
[0070]
(5)在预留的2个检测孔中加入2μl sod以验证整个体系。安排如下:
[0071][0072]
(6)450nm处检测吸光度值。实验结果见图4。
[0073]
如图4所示,对过氧化氢与超氧化氢水平进行检测,t-hacat细胞的过氧化氢、超氧化物水平与传代对照组细胞相比,无显著差异(p》0.05)。t-hacat转染pim1 sirna之后,检测过氧化氢与超氧化物水平发现二者均显著升高,且具有统计学差异(p《0.05)。表明,pim1 sirna能够逆转0.1μm naaso2所致t-hacat活性氧水平改变。
[0074]
实施例4细胞倍增时间检测
[0075]
细胞倍增时间检测的具体实验步骤:胰酶消化收集正常处理组、0.1μm naaso2处理组细胞,按照每孔10,000个接种于24孔板中。之后每隔24h,每组收取3孔细胞分别计数,按照公式计算细胞数量增加一倍所需要的时间:(t
×
lg2)/(lgnh-lgni)。t为培养时间,nh为培养t时间(h)后的细胞数,ni为初始接种细胞数。实验结果见图5。
[0076]
如图5所示,对倍增时间进行检测发现,t-hacat细胞倍增时间较传代对照组细胞倍增时间明显降低(p《0.05)。对t-hacat细胞转染pim1 sirna后,其细胞倍增时间相较于转染对照组细胞明显升高(p《0.05)。
[0077]
实施例5细胞划痕实验
[0078]
细胞划痕实验的具体步骤:
[0079]
1)消化收集细胞接种于六孔板中,置于细胞培养箱培养。
[0080]
2)待24h细胞长满后,用200μl枪头垂直于板孔划痕,尽可能使划痕宽度一致。
[0081]
3)吸去旧培养基,pbs冲洗细胞三次后,加入无血清培养基,拍照后继续置于细胞培养箱中进行培养。
[0082]
4)48h后再次拍照,拍照时每孔至少选取三个划痕视野,用image j软件进行定量分析,实验结果见图6。
[0083]
如图6所示,划痕实验发现,与传代对照组细胞相比,t-hacat细胞的细胞迁移能力明显增强(p《0.05),转染pim1 sirna后,与转染对照组细胞相比,细胞迁移能力显著降低(p《0.05)。
[0084]
实施例6软琼脂克隆形成实验
[0085]
1)琼脂糖溶液的配制:双蒸水中加入适量琼脂糖粉末配制为浓度1.4%的琼脂糖溶液,高压灭菌后42℃水浴2小时,与同体积2
×
dmem完全培养基混合,得到浓度为0.7%的琼脂糖溶液。
[0086]
2)加底层胶:移液枪吸取2ml 0.7%的琼脂糖溶液缓慢加入35mm培养皿中,待室温凝固后得到底层胶。
[0087]
3)加顶层胶:对细胞进行计数后,调整细胞浓度,将5,000个细胞置于dmem完全培养基中加入等体积的浓度为0.7%的琼脂糖溶液,得到琼脂糖为0.35%的细胞悬液,吸取1.5ml加到底层胶上成为顶层胶。
[0088]
4)培养:待顶层胶凝固后再加入1.0ml dmem完全培养基,于5%co2、37℃细胞培养箱中连续培养4周,每2至3天换液一次。
[0089]
5)计数:显微镜观察,选取细胞直径大于50μm的克隆集落进行计数。实验结果见图7。
[0090]
如图7所示,与传代对照组细胞相比,t-hacat细胞的锚着独立生长能力显著增强(p《0.05)。对t-hacat细胞转染pim1 sirna后,细胞锚着独立生长能力与转染对照组相比显著降低(p《0.05)。上述实验结果表明,pim1sirna能够逆转0.1μm naaso2所致t-hacat细胞恶性转化表型。
[0091]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1