一种防脱生发的脂质体及其制备方法与应用
1.本技术属于脱发治疗技术领域,尤其涉及一种防脱生发的脂质体及其制备方法与应用。
背景技术:
2.脱发主要分为瘢痕型及非瘢痕型脱发,而在常见的非瘢痕型脱发中,包括休止期脱发、雄激素源性脱发等。
3.虽然脱发不直接危害生命安全,但脱发患者会受到自我怀疑、丧失自信等精神压力,同时受到脱发问题困扰的人数众多,且患病人群日益年轻化。因此,脱发治疗的需求逐年增大。目前,脱发治疗包括药物治疗和毛发移植。对于毛发移植治疗脱发的方式,不仅价格昂贵、供区毛囊单位数量不足,且对于雄激素源性脱发而言,不从根本上消除毛囊区域的损伤源,移植后的毛囊依然会再次脱落。因此,毛发移植治疗脱发具有局限性。对于药物治疗脱发的方式,目前上市的治疗药物仅有米诺地尔和非那雄胺两种,米诺地尔长期外用,容易导致皮炎、皮疹和皮肤刺激性等副作用,而原人参二醇来源于人参、三七等五加科人参植物以及葫芦科绞股蓝属植物绞股蓝,是原人参二醇型皂苷的苷元,具有抗炎和促血管生成的能力,已有研究将其用于治疗糖尿病溃足及其他伤口,但原人参二醇受限于水溶性较差、游离药物难以经皮递送、不能形成药物贮库等,限制了其药效的发挥。
技术实现要素:
4.有鉴于此,本技术提供了一种防脱生发的脂质体及其制备方法与应用,用于解决原人参二醇水溶性较差、难以经皮递送,不能形成药物贮库的技术问题。
5.本技术第一方面提供了一种防脱生发的脂质体,所述脂质体的膜材包括磷脂和原人参二醇。
6.优选的,所述脂质体包载防脱药物。
7.需要说明的是,本技术的脂质体可针对脱发的发病机理,包载对应的一种或一种以上的防脱药物,实现多机制联合治疗脱发的效果,效果超过单一机制治疗脱发的效果,如通过促进促毛发生长相关基因的表达、促血管生成、抑制5α-还原酶三种机制联合治疗效果优于单一机制。
8.优选的,所述磷脂和所述原人参二醇的质量比为2.4~3.6:0.8~1.2。
9.优选的,所述脂质体的粒径小于300nm。
10.优选的,所述防脱药物包括度他雄胺、非那雄胺、米诺地尔、螺内酯、氟他胺、三七提取物、茶叶提取物、银杏提取物、何首乌提取物、锯叶棕提取物、生姜提取物、余甘子提取物、葡萄籽提取物、迷迭香提取物、黄芩提取物、醴肠提取物、植物甾醇、虎杖提取物中的任意一种、两种或多种。
11.优选的,所述磷脂包括大豆卵磷脂、蛋黄卵磷脂、羧基化卵磷脂、氢化卵磷脂、二硬脂酰磷脂酰胆碱、二月桂酰磷脂酰胆碱、神经酰胺和二肉豆蔻酰磷脂酰胆碱中的任意一种、
两种或多种。
12.优选的,所述脂质体的膜的成分还包括稳定剂,所述稳定剂包括聚氧乙烯氢化蓖麻油、维生素e聚乙二醇琥珀酸酯、胆酸、胆酸钠、聚甘油-10山嵛酸酯、聚氧乙烯鲸蜡脂醇聚醚-25、鲸蜡脂醇聚醚-25、硬脂醇聚醚-21和鲸蜡硬脂醇聚醚的任意一种、两种或多种。
13.优选的,以质量份计算,所述稳定剂为0~20份。
14.本技术第二方面提供了上述脂质体的制备方法,包括以下步骤:
15.将磷脂、原人参二醇溶于有机溶剂,减压蒸发除去有机溶剂,形成均匀脂膜。以水性介质水合处理,超声均质,过膜挤出得到脂质体;
16.所述减压旋干的温度为50℃~70℃;
17.所述水合处理的温度为50℃~70℃,时间为20min~40min。
18.优选的,还包括将稳定剂和/或防脱药物溶于有机溶剂。
19.需要说明的是,本技术提供的原人参二醇脂质体制备方法简单,成本低廉,避免了新材料合成可能涉及的复杂制备工艺,为大规模生产和质量均一性提供了保障,有利于实现产业化。制备得到的脂质体粒径小于300nm,有助于经皮给药在毛囊中积累,发挥长效作用。
20.本技术第三方面提供了上述脂质体在防脱生发产品中的应用。
21.本技术第四方面提供了原人参二醇在防脱生发产品中的应用。
22.需要说明的是,本技术中所要求保护的防脱生发产品是指包括原人参二醇或原人参二醇脂质体的,并利用原人参二醇或原人参二醇脂质体实现防脱生发功效的产品,如洗发水、育发剂等。
23.并且,与传统的口服或注射药物相比,本技术提供的脂质体的组成成分与毛囊皮脂和细胞膜中的脂质相似,从而可以通过经皮给药直接到达毛囊,形成药物贮库,克服了口服、注射给药可能带来的全身毒副作用。
24.同时,需要说明的是,本技术通过经皮给药可以是医用药物,也可以是化妆品或其他包含原人参二醇及原人参二醇脂质体的美容产品,如包含原人参二醇脂质体的睫毛增长液。
25.综上所述,本技术提供了一种防脱生发的脂质体及其制备方法与应用,其中,脂质体膜材包括磷脂以及原人参二醇,脂质体中的组成成分磷脂与毛囊皮脂和细胞膜中的脂质相似,具有一定的毛囊靶向特性和生物相容性,有利于毛囊靶向,克服了传统脂质体中胆固醇成分作为睾酮生物合成原料,在治疗脱发时可能损伤毛囊,改变毛发循环的潜在危害,ppd-lip可促进毛乳头细胞的增殖迁移,提高毛发相关正性调节因子mrna的表达,发挥促进毛发生长的效果;本技术提供的脂质体解决了原人参二醇水溶性较差、难以经皮递送,不能形成药物贮库的技术问题。
附图说明
26.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
27.图1为本实施例3中米诺地尔、ppd和ppd-lip对dpcs增殖、迁移和调控mrna表达的影响图;
28.图2为本实施例4中米诺地尔、ppd和ppd-lip体外促进小鼠触须毛囊的生长图;
29.图3为本实施例5中米诺地尔、ppd和ppd-lip体内促进休止期小鼠毛发再生的评价图;
30.图4为本实施例5中米诺地尔、ppd和ppd-lip体内促进休止期小鼠毛发再生的组织学分析图;
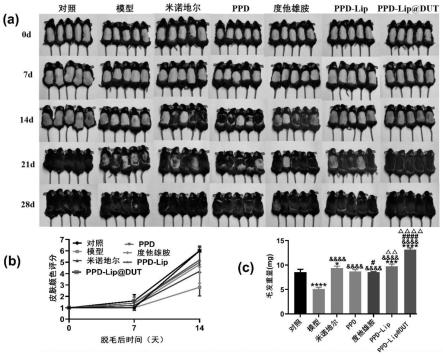
31.图5为本实施例6中米诺地尔、ppd、dut和ppd-lip以及ppd-lip@dut促进雄激素源性小鼠毛发再生的评价图;
32.图6为本实施例6中米诺地尔、ppd、dut和ppd-lip以及ppd-lip@dut促进雄激素源性小鼠毛发再生的组织学分析图;
33.图7为本实施例7中ppd-lip、ppd-lip@dut的结构表征以及dut、ppd-lip@dut皮肤滞留及药物释放情况测试图;
34.其中,图1-(a)为细胞增殖的影响,图1-(b)为imagej软件对迁移率的定量分析,图1-(c)为细胞迁移的代表性图像,图1-(d)为β-catenin表达水平;图1-(e)为vegf表达水平,图1-(f)为igf-1表达水平,图1-(g)为mmp3表达水平;*为与对照组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
35.图2-(a)为各组触须毛囊培养0、3、6、9和12天的照片,图2-(b)为第12天代表性毛囊的h&e染色图像,图2-(c)为通过imagej软件测量12天内毛干的累积伸长量,*为与对照组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
36.图3-(a)c57bl/6小鼠脱毛后分别用生理盐水、米诺地尔、ppd、ppd-lip处理的照片,图3-(b)小鼠皮肤颜色评分表,图3-(c)小鼠皮肤颜色评分,图3-(d)21天各组新生毛发的重量;*为与对照组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
37.图4-(a)各组小鼠背部皮肤的h&e染色图像,图4-(b)image j软件测量的皮肤厚度,图4-(c)毛球直径,图4-(d)各组毛发周期阶段(休止期、休止期-生长期和生长期)百分比;*为与对照组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
38.图5-(a)各实验组c57bl/6小鼠不同时间照片,图5-(b)小鼠皮肤颜色评分,图5-(c)28天各组新生毛发的重量;*为与对照组的显著性差异;$为与模型组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
39.图6-(a)各组小鼠背部皮肤的h&e染色图像,图6-(b)image j软件测量的皮肤厚度,图6-(c)毛球直径,图6-(d)各组毛发周期阶段(休止期、休止期-生长期和生长期)百分比;*为与对照组的显著性差异;$为与模型组的显著性差异;#为与米诺地尔组的显著性差异;
△
为与原人参二醇的显著性差异(p《0.05);
40.图7-(a)ppd-lip的粒径分布及形貌,图7-(b)ppd-lip@dut的粒径分布及形貌,大图比例尺为200nm,嵌入小图为50nm,图7-(c)ppd-lip@dut中dut的体外累积释放行为,图7-(d)不同配方透皮24小时后dut的皮肤滞留量。
具体实施方式
41.本技术提供了一种防脱生发的脂质体及其制备方法与应用,用于解决原人参二醇水溶性较差、难以经皮递送,不能形成药物贮库的技术问题。
42.下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本技术保护的范围。
43.其中,以下实施例所用试剂或原料均为市售或自制。
44.本专利实施例1-8中采用的术语解释如下:
45.1.ppd:原人参二醇;
46.2.dpcs:毛乳头细胞;
47.3.β-catenin:β-连环蛋白;
48.4.vegf:血管内皮生长因子;
49.5.igf-1:胰岛素样生长因子-1;
50.6.mmp3:基质金属蛋白酶3;
51.7.dut:度他雄胺;
52.8.sem:扫描电镜;
53.9.h&e染色:苏木精-伊红染色法;
54.10.aga:雄激素源性脱发。
55.实施例1
56.本实施例1提供了防脱生发的脂质体的制备方法,制备方法包括薄膜分散法和溶剂注入法。
57.1、薄膜分散法包括步骤:
58.将磷脂、原人参二醇溶于有机溶剂,减压蒸发除去有机溶剂,形成均匀脂膜。以水性介质水合处理,超声均质,过膜挤出得到脂质体。
59.2、溶剂注入法包括步骤:
60.将磷脂和原人参二醇均匀溶解于有机溶剂中,将脂质溶液缓慢注入50℃~60℃水相中,继续搅拌至除尽有机溶剂,得到脂质体;
61.本实施例中,磷脂和原人参二醇的质量比为3:1,如60质量份磷脂和20质量份原人参二醇。
62.实施例2
63.本实施例2提供了防脱生发的脂质体的制备方法,制备方法为薄膜分散法,制备方法与实施例1的区别在于,脂质体包载了度他雄胺;需要说明的是,还可以将稳定剂溶于乙醇,以改善脂质体结构的稳定性。
64.实施例3
65.本实施例3提供了米诺地尔、ppd溶液和ppd-lip溶液对dpcs的增殖、迁移以及β-catenin、vegf、igf-1及mmp3等毛发相关正性调节因子基因表达情况的影响。
66.1、对dpcs的增殖的影响采用cck8试剂盒测试,测试步骤包括:
67.将dpcs接种到96孔培养板,孵育过夜待细胞贴壁后,分别加入10μm的米诺地尔、
ppd溶液和ppd-lip(含10μm ppd,下同),以不加药物的组别作为对照组,培养48小时。
68.结果如图1(a)所示,与空白对照相比,ppd-lip、ppd和米诺地尔在4小时内分别促进dpcs增殖率达167.03
±
7.89%、139.26
±
6.38%和96.83
±
8.77%,说明ppd-lip溶液促进dpcs增殖的效果优于ppd溶液及米诺地尔溶液。
69.2、迁移实验是筛选和研究毛发生长促进分子时的重要指标,对dpcs的迁移的影响采用划痕实验测试,测试步骤包括:
70.将dpcs以2
×
105个/孔的密度接种于6孔板中,待细胞密度达到80-90%时,使用200μl无菌移液枪头在孔板中间垂直划一条划痕,洗涤悬浮细胞,分别加入由含5%血清的dmem培养基制备的10μmppd-lip、ppd和米诺地尔溶液,以不加药物的组别作为对照组,通过倒置显微镜观察24小时和48小时,细胞划痕愈合程度,使用image j量化划痕面积计算愈合率。
71.其结果如图1(a-c)所示,与空白对照相比,ppd组及ppd-lip组促进了dpcs的增殖与迁移;其中,24h后,ppd-lip组促进dpcs的相对迁移面积为40.73
±
4.49%,约为其他组的1.2倍,48h后,促迁移作用更显著,相对迁移面积达到94.78
±
3.70%,约为对照组的2.4倍,约为米诺地尔组的1.9倍,说明ppd-lip可显著促进dpcs迁移,这说明ppd与ppd-lip均能促进dpcs的增殖、迁移,并且ppd-lip效果优于ppd。
72.3、对dpcs毛发相关正性调节因子基因表达的影响通过实时定量pcr测试,测试步骤包括:
73.将dpcs接种于6孔板中,孵育过夜待细胞贴壁后,分别加入10μm的米诺地尔、ppd溶液和ppd-lip,处理24h后,提取各组细胞中总rna,pcr实验测定β-catenin、vegf、igf-1和mmp3的表达情况。
74.结果如图1(d-g)所示,从图1中可以看出,ppd与ppd-lip均能增加β-catenin、vegf、igf-1和mmp3的基因表达水平,且ppd-lip组效果最为显著,效果优于米诺地尔及ppd。
75.表1实时定量pcr的引物序列
76.目的基因正向引物反向引物gapdhtgaaggtcggagtcaacggtggaagatggtgatgggatβ-catenincatctacacagtttgatgctgctgcagttttgtcagttcagggavegfagggcagaatcatcacgaagtagggtctcgattggatggcaigf-1gctcttcagttcgtgtgtggagcctccttagatcacagctccmmp3agtcttccaatcctactgttgcttccccgtcacctccaatcc
77.从本实施例3可以看出,与不加药物的空白对照组相比,ppd-lip组、ppd组和米诺地尔组均能促进dpcs的增殖、迁移以及上调毛发相关正性调节因子的基因表达,从而促进毛发生长,并且ppd-lip组的效果优于米诺地尔组及ppd组。
78.实施例4
79.本实施例4提供了通过小鼠触须毛囊体外培养,考察米诺地尔、ppd溶液和ppd-lip溶液对促进小鼠体外触须毛囊增长的影响,测试步骤包括:
80.分离3周雄性c57bl/6小鼠胡须垫触须毛囊,于48孔板中培养,分别给予含有10μm米诺地尔、ppd或ppd-lip的培养基,以单纯培养基组作为对照,每三天更换一次培养基并拍照记录毛囊生长情况,使用image j测量触须毛囊长度,并计算各组触须毛囊第12天的累积
伸长长度,且对毛囊进行h&e染色以进行形态学观察。
81.结果如图2所示,12天后,ppd-lip组累积毛干伸长量为(396.25
±
11.76μm),长于ppd组(224.46
±
47.38μm)、米诺地尔组(164.70
±
44.30μm)以及对照组(60.48
±
1.03μm),说明ppd、ppd-lip均能体外促进毛发生长;
82.进一步的,组织切片结果显示,ppd-lip组毛乳头呈球形,具有较大的直径,且深深扎根于毛球中,毛囊状态最佳,这说明了ppd-lip体外促进毛发生长的有效性优于米诺地尔及ppd。
83.实施例5
84.本实施例5提供了通过模拟休止期脱发考察米诺地尔、ppd溶液和ppd-lip溶液对促进休止期小鼠毛发再生的影响,测试步骤包括:
85.将6周龄c57bl/6小鼠背部毛发剃除,并用脱毛膏脱毛,恢复1天后,将小鼠随机分为4组:对照组、米诺地尔组、ppd组和ppd-lip组(n=5);脱毛区每天分别涂抹0.2ml对应样品溶液(5mg/ml米诺地尔,ppd溶液及ppd-lip(含有5mg/mlppd),其中对照组涂抹生理盐水,持续治疗21天,于第0、7、14、19和21天拍照记录小鼠皮肤颜色及毛发再生情况;21天后将小鼠麻醉处死,收集各组新生毛发并称重;同时,收集各组小鼠背部皮肤进行h&e染色。分析各组小鼠皮肤厚度、毛球直径及毛发周期。
86.根据图3所示,脱毛后各组小鼠背部皮肤呈粉红色,表明毛囊均处于休止期,随着时间的推移,背部皮肤颜色逐渐变黑,表明毛囊从休止期转变为生长期,治疗期间各组小鼠皮肤没有红斑、水肿或坏死,表明药物的长期使用的安全性,根据图3的小鼠皮肤颜色评分表,评估脱毛后14天内小鼠背部的皮肤颜色,结果表明,在第7天,用ppd和ppd-lip治疗的小鼠的得分高于米诺地尔组的小鼠,说明ppd-lip可以促进毛发生长提前进入生长期。至第19天,ppd-lip组的毛发几乎完全覆盖,优于米诺地尔组和对照组;
87.对各组小鼠相同背部皮肤面积下新生毛发进行称重,结果显示ppd-lip组毛发重量显著重于其余各组,表明ppd-lip可促进毛发再生;
88.图4组织学结果显示ppd-lip治疗组的皮肤最厚,毛球直径最大,且深深扎根于真皮,毛发周期分析结果显示,ppd-lip组有效地促进了毛囊从休止期向生长期的转变,生长期比率高于米诺地尔组和对照组。
89.实施例6
90.本实施例6提供了米诺地尔(5mg/ml)、ppd溶液(5mg/ml)、度他雄胺溶液(含有100μg/ml的dut)、ppd-lip溶液(含有5mg/ml ppd和ppd-lip@dut(含有5mg/ml ppd及100μg/ml的dut)促进雄激素源性小鼠毛发再生的影响,其中,将度他雄胺载入ppd-lip得ppd-lip@dut,测试步骤包括:
91.将6周龄c57bl/6小鼠随机分为六组:对照组、模型组、米诺地尔组、ppd组、度他雄胺组、ppd-lip组和ppd-lip@dut组(n=5),除对照组外,其余各组均皮下注射0.2ml,5mg/ml睾酮玉米油溶液;
92.每天局部涂抹0.2ml样品溶液,其中对照组及模型组涂抹相同体积的生理盐水,持续涂抹28天。于第0、7、14、21和28天,拍照记录小鼠皮肤颜色及毛发再生情况;于28天处死小鼠,收集各组新生毛发并称重。
93.同时,收集各组小鼠背部皮肤进行h&e染色,分析各组小鼠皮肤厚度、毛球直径及
毛发周期。
94.其结果如图5所示,与对照组相比,其他睾酮处理组的背部皮肤颜色在第14天才加深,至第21天才再生毛发,ppd-lip@dut促进aga小鼠再生毛发的效果,且ppd-lip@dut组再生头发的重量最重,证实了ppd-lip作为载体可以共递送其他防脱药物联合发挥治疗脱发的作用。
95.图6所示组织学分析结果显示,模型组皮肤较薄,毛球直径较小,ppd-lip及ppd-lip@dut组皮肤加厚,毛球直径变大,毛发周期多处于生长期,说明ppd-lip及ppd-lip@dut在aga模型中的良好效果,且ppd-lip@dut效果优于ppd-lip,ppd和度他雄胺,进一步验证了ppd-lip@dut可以实现联合ppd及度他雄胺共同发挥治疗脱发的作用。
96.实施例7
97.本实施例7提供了薄膜分散法制备的ppd-lip、ppd-lip@dut的结构表征以及dut、ppd-lip@dut皮肤滞留及药物释放情况测试。
98.如图7所示,ppd-lip、ppd-lip@dut粒径分别为136.9
±
5.11nm,141.3
±
0.45nm,呈圆球形,且分散性良好。
99.将sd大鼠腹部皮肤固定于透皮扩散的池供给池和接收池之间,在供给池加入ppd-lip@dut,透皮24h后,取下大鼠皮肤,用水洗净表面,用甲醇除去残余的药物,剪碎皮肤,加入1ml乙腈,超声提取皮肤中滞留的药物,离心取上清液,0.22μm微孔滤膜过滤,采用高效液相色谱法测定皮肤中dut的含量,即为皮肤滞留量;
100.结果如图7表明,ppd-lip@dut组和dut溶液组,透皮24h后,dut在皮肤滞留量分别为3.43
±
0.28、2.66
±
0.40μg/cm2,说明纳米粒可较好的滞留于皮肤,有利于脱发的治疗。
101.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和优化,这些改进和优化也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1