包含腺苷衍生物的用于预防或治疗视网膜疾病或视神经疾病的药物组合物的制作方法
包含腺苷衍生物的用于预防或治疗视网膜疾病或视神经疾病的药物组合物
1.本技术是申请号为201880077439.0、申请日为2018年11月29日、发明名称为“包含腺苷衍生物的用于预防或治疗视网膜疾病或视神经疾病的药物组合物”的中国发明专利申请的分案申请。
技术领域
2.本发明是涉及一种包含腺苷衍生物的用于预防或治疗视网膜疾病(retinal disease)或视神经疾病(optic nerve disease)的组合物。
背景技术:
3.腺苷(adenosine)是一种通过特殊的细胞膜受体来执行多种生理学功能的物质,而存在于细胞外的腺苷在多种生理学体系中起到神经递质的作用,主要起到对特定器官的过度活动进行补偿的作用以及保护身体免受压力的有害效应的作用(jacobson,k.a.et al,j.med.chem.,35,407-422,1992)。这些作用是基于细胞内和细胞外的三磷酸腺苷(atp)分解生成的腺苷的欲减少细胞的能量需求和增加氧供应的一部分负反馈循环(negative feedback loop)来实现的。腺苷在维持重要器官(比如脑、心脏和肾脏)的内环境稳定中起重要作用。例如,当从外部将腺苷激动剂给药至脑部时,已证实具有神经保护作用,并且发现其也与疼痛、认知、运动或睡眠相关。
4.迄今,通过药理学研究和分子克隆研究揭示了两种类型的腺苷受体,即p1受体和p2受体。对于p1受体而言,腺苷作为底物发挥作用,而对于p2受体而言,三磷酸腺苷(atp)、二磷酸腺苷(adp)、尿苷三磷酸(utp)和尿苷二磷酸(udp)作为底物发挥作用,从而发挥生理活性。其中,已确认了p1受体具有四个不同亚型的腺苷受体,且可以根据对配体的亲和力、体内分布、作用途径将其分成a1、a2和a3,其中可将a2进一步分成a
2a
和a
2b
。这些腺苷受体是g蛋白-偶合受体(g-protein-coupled receptor)家族的一类,已经使用多种选择性配体揭示了腺苷a1、a
2a
和a
2b
受体的药理学特性。但就a3受体而言,其是在1992年首次发现的(zhou,q.y,et al,proc.natl.acad.sci.,u.s.a.,89,7432-7436,1992),而目前进行着大量为确认该受体的病理生理学功能的研究。
5.腺苷a1和a2受体激动剂,大多数是腺苷的衍生物,已经在应用于降血压剂、精神病治疗药、心律失常治疗药、脂类代谢抑制剂(糖尿病治疗药)和神经保护剂方面进行了大量研究。另一方面,a1和a2受体的拮抗剂为黄嘌呤(xanthine)衍生物或多个二环化合物稠合的形式,其被开发为平喘药、抗抑郁药、心律不齐治疗药、肾脏保护剂、帕金森病治疗药和智力增强剂等。尽管进行了广泛的研究,但是目前也只开发出了少数市售产品,包括用于治疗室上性心动过速(supraventricular tachycardia)的腺苷本身、以及腺苷转运抑制剂双嘧达莫(dipyridamole),其中,双嘧达莫为用于预防心脏手术后的血液凝固的华法林(warfarin)的辅助剂。商业化发展进程这样缓慢的原因是由于腺苷受体的分布遍及全身,因此受体被激活时会伴随多种药理作用,简言之,是由于不存在能够只激活期望组织的腺
苷受体的化合物。
6.在腺苷受体中,与众所周知的腺苷a1和a2相比,腺苷a3受体是最近才发现的,因此其被阐明的功能并不多,而为了开发腺苷a3受体的选择性受体调节剂正进行着大量的研究。目前,为了腺苷a3受体的药理学研究使用三种放射标记配体,即[
125
i]aba(n
6-(4-氨基-3-[
125
i]碘苄基)-腺苷(n
6-(4-amino-3-[
125
i]iodobenzyl)-adenosine))、[
125
i]apnea(n
6-2-(4-氨基-3-[
125
i]碘苯基)-乙基腺苷(n
6-2-(4-amino-3-[
125
i]iodobenzyl)-ethyladenosine))、或[
125
i]ab-meca(n
6-(4-氨基-3-[
125
i]碘苄基)-腺苷-5
’‑
n-甲基甲酰胺(n
6-(4-amino-3-[
125
i]iodobenzyl)-adenosine-5
’‑
n-methylcarboxamide))。通过利用放射标记配体的药理学研究发现,当在中国仓鼠卵巢(chinese hamster ovary,cho)细胞中表达腺苷a3受体时,a3受体具有抑制由atp生成环化一磷酸腺苷(camp)的腺苷酸环化酶(adenylyl cyclase)的作用,并且,当由激动剂激活a3受体时,证实了a3受体可激活鸟苷三磷酸-依赖性磷脂酶c(guanosine triphosphate-dependent phospholipase c)的现象,其中该酶为一种将脑中的磷脂酰肌醇(phosphatidyl inositol)分解成肌醇三磷酸(inositol phosphate)和二酰甘油(dag)的酶(ramkumar,v.et al,j.biol.chem.,268,168871-168890,1993;abbracchio,m.p.et al,mol.pharmacol.,48,1038-1045,1995)。这些发现显示了在脑缺血(brain ischemia)中,可能存在基于a3受体激活作用的反应途径的可能性,其理由在于该第二信使系统可意味着脑缺血中的神经损伤的反应途径。并且,已知a3受体激动剂可抑制炎症介质tnf-α(肿瘤坏死因子)的释放,还抑制同为炎症介质的mip-1α、白细胞介素-12(interleukin-12)和干扰素-γ(interferon-γ)的生成,同时不仅具有对于脑疾病(如癫痫)的保护效果,还对心脏具有保护效果。另一方面,腺苷a3受体的失活会引起炎症诱导因子(如从肥大细胞释放的组胺)的释放,起到使支气管收缩的作用,并会在免疫细胞引起细胞凋亡(apoptosis)。因此,腺苷a3拮抗剂具有可被开发为抗炎剂和平喘药的可能性。因此,如果能开发出具有药理选择性的化合物,可使得开发出用于治疗包括哮喘、炎症、脑缺血、心脏疾病、癌症等多种疾病的药物成为可能。
[0007]
目前所研究开发出的物质中,代表性的人类腺苷a3激动剂为核苷系列的n
6-(3-碘苄基)-5
’‑
(n-甲基氨基甲酰基)-腺苷(n
6-(3-iodobenzyl)-5
’‑
(n-methylcarbamoyl)-adenosine;ib-meca)和n
6-(3-碘苄基)-2-氯-5
’‑
(n-甲基氨基甲酰基)-腺苷(n
6-(3-iodobenzyl)-2-chloro-5
’‑
(n-methylcarbamoyl)-adenosine;ci-ib-meca),与对于腺苷a1和a2受体的亲和力和选择性相比,其对腺苷a3受体显示出更高的亲和力和选择性。另一方面,显示出高亲和力的和选择性的腺苷a3受体拮抗剂大部分不是核苷骨架,而是非-嘌呤系(nonpurine)的二环化合物(bicyclic compound),对此有人指出过:其虽然在人类受体中显示出高活性,但对于鼠的a3受体的活性较弱或几乎没有活性,因此存在无法进行开发可临床适用药物所必须的动物实验的缺点(baraldi,p.g.et al,curr.med.chem.,12,1319-1329,2005)。然而,与非-嘌呤系二环化合物相比,核苷系的化合物显示出与种间关系无关的高亲和力和选择性,具有易于进行动物实验的优点,据此开发出新药的可能性非常高,因此急需获得该系列的选择性a3拮抗剂。
[0008]
另一方面,视网膜是透明的薄膜,位于眼球内壁最里侧,并且与眼球内玻璃体(vitreous body)接触,其作为一级视觉信息机构将事物的光学信息转化为电信号并通过视觉神经传递至大脑中枢视觉区域。视网膜是我们体内最为精巧的组织,其由超过一亿个
光感知细胞(感光细胞,light-sensitive photoreceptor cells)、超过一百万个视觉神经细胞(即神经节细胞,ganglion cells)、以及将它们两个连接在一起并起到电线作用的众多神经细胞构成。黄斑部(macula lutea)是区分颜色和事物并体现视力的视网膜中心部分,其由圆锥状细胞组成的感光细胞层和神经节细胞层构成,视网膜的厚度较薄,在明亮的光线状态下,影像的电信号转换为化学信号并通过神经节细胞的轴突(即视觉神经,optic nerve)传递到大脑,黄斑部以外的视网膜用于辨识周围,光线较暗时起主要作用。另外,因老化或外部因素在视网膜中发生异常时,会发生逐渐导致视力及视野问题的视觉障碍,且最终可导致失明。
[0009]
视网膜疾病大致分为3种:视网膜周边组织发生异常导致神经视网膜从色素上皮层脱落时,视网膜在眼球后部分离导致视觉障碍的视网膜脱离(retinal detachment)、在视网膜周边组织引发异常的周边部视网膜变形、及在黄斑部发生异常的黄斑变性(macular degeneration)。视网膜与色素上皮层分离后无法接收有关影像的光学信息,并且无法获得脉络膜供应的营养,导致视神经细胞丧失机能,如放任这种状态会导致永久性视网膜萎缩,从而导致失明。视网膜疾病导致的视觉障碍是失明(blindness)的主要原因,是主要由老龄化引起的视网膜疾病,其可以由遗传性或高度近视、外伤等原因导致,是仅次于白内障的常见眼科疾病。视网膜疾病虽然不是致命的疾病,但是近年来随着老年人口的增加、以及产业化和饮食习惯的变化,发病率急剧增加,因此除手术治疗方法以外,有必要开发一种能够以我们以往摄入的生药材的形式提供的用于治疗视网膜的组合物,而不是通过人工方法合成的治疗剂的形式提供的药物。
技术实现要素:
[0010]
发明所要解决的问题
[0011]
本发明的目的在于,提供一种能够有效地预防或治疗视网膜疾病的药物组合物、口服剂或滴眼剂。
[0012]
本发明的另一个目的在于,提供一种能够有效地预防或治疗视神经疾病的药物组合物、口服剂或滴眼剂。
[0013]
用于解决问题的方案
[0014]
为实现上述目的,本发明提供一种用于预防或治疗视网膜疾病的药物组合物,其包含由化学式1表示的化合物或其药用盐作为有效成分。
[0015]
另外,本发明提供一种用于预防或治疗视网膜疾病的口服剂,其包含由化学式1表示的化合物或其药用盐。
[0016]
进一步,本发明提供一种用于预防或治疗视网膜疾病的滴眼剂,其包含由化学式1表示的化合物或其药用盐。
[0017]
为实现上述另一个目的,本发明提供一种用于预防或治疗视神经疾病的药物组合物,其包含由化学式1表示的化合物或其药用盐作为有效成分。
[0018]
另外,本发明提供一种用于预防或治疗视神经疾病的口服剂,其包含由化学式1表示的化合物或其药用盐。
[0019]
进一步,本发明提供一种用于预防或治疗视神经疾病的滴眼剂,其包含由化学式1表示的化合物或其药用盐。
[0020]
[化学式1]
[0021][0022]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或者支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1或2以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0023]
发明效果
[0024]
本发明涉及一种包含特定的腺苷衍生物作为有效成分的、用于预防或治疗视网膜疾病或视神经疾病的组合物,该腺苷衍生物可以通过抑制源自小鼠的视网膜的感光细胞中炎症相关蛋白、vegf及炎性细胞因子的表达来抑制炎症反应,并且可以抑制由谷氨酸诱导的细胞凋亡。包含其的滴眼剂在以小鼠为对象进行的实验中表现出有效保护视网膜神经节细胞的效果,可以有效地预防和治疗视网膜疾病或视神经疾病。
附图说明
[0025]
图1a和图1b是在本发明的一个实施例中,确认用化合物a处理时新生血管和炎症反应相关的蛋白表达变化的结果。
[0026]
图2是在图1a和图1b的实施例中,确认用化合物a处理时vegf和炎性细胞因子的表达变化的结果。
[0027]
图3a和图3b是在图1a和图1b的实施例中,确认用化合物a处理时新生血管和炎症反应相关mrna的表达变化的结果。
[0028]
图4是在本发明的另一个实施例中,确认用化合物a处理时对源自小鼠的视网膜感光细胞的细胞毒性的结果。
[0029]
图5确认了在图4的实施例中由谷氨酸诱导细胞凋亡时化合物a对细胞的保护效果((n=6),(ⅰ)化合物a预处理30分钟,(ⅱ)化合物a预处理1小时)。
[0030]
图6是在图4的实施例中,利用tunel检测和dapi染色并通过显微镜观察化合物a抑制细胞凋亡的结果。
[0031]
图7是在图4的实施例中,确认化合物a的线粒体保护效果的结果((ⅰ)jc-1聚集体,(ⅱ)正常组细胞的分布,(ⅲ)只用谷氨酸处理的实验组细胞的分布,(ⅳ)化合物a进行预处理后再用谷氨酸处理的实验组细胞的分布,(
ⅴ
)只用cccp处理的对照组细胞的分布)。
[0032]
图8是在图4实施例中,确认化合物a的半胱天冬酶的活性抑制效果的结果((ⅰ)半胱天冬酶3/7的活性,(ⅱ)半胱天冬酶8的活性)。
[0033]
图9及图10a~图10c是在图4的实施例中,确认化合物a对细胞凋亡相关蛋白质的表达变化的结果(图9的(ⅰ)蛋白质表达变化,(ⅱ)细胞核的aif蛋白质的表达变化,(ⅲ)细胞质的细胞色素c蛋白质的表达变化,(ⅳ)线粒体的aif蛋白质的表达变化,(
ⅴ
)线粒体的
细胞色素c蛋白质的表达变化;图10a的(ⅰ)蛋白质表达变化,(ⅱ)rip蛋白质的表达变化,(ⅲ)rip3蛋白质的表达变化;图10b的(ⅳ)pbcl2蛋白质的表达变化,(
ⅴ
)bcl2蛋白质的表达变化,(ⅵ)pbad蛋白质的表达变化,(ⅶ)bad蛋白质的表达变化;图10c的(
ⅷ
)bid蛋白质的表达变化,(
ⅸ
)半胱天冬酶8蛋白质的表达变化,(
ⅹ
)切割的半胱天冬酶(cleaved caspase)9蛋白质的表达变化,(
ⅺ
)切割的半胱天冬酶3蛋白质的表达变化)。
[0034]
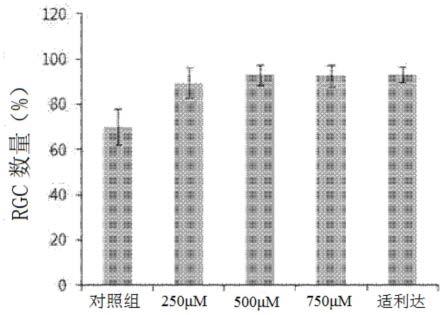
图11是示出根据本发明另一个实施例的测量小鼠的眼球中的视网膜神经节细胞数量的图形。
[0035]
图12是观察根据图11的实施例的小鼠的视网膜的组织变化的照片。
[0036]
具体优选实施方式
[0037]
以下,对本发明进行更详细地说明。
[0038]
本发明提供一种用于预防或治疗视网膜疾病的药物组合物,其包含由化学式1表示的化合物或其药用盐作为有效成分。
[0039]
[化学式1]
[0040][0041]
在化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0042]
此时,上述视网膜疾病可以是糖尿病性视网膜病变(diabetic retinopathy)或者年龄相关性黄斑病变(age-related macular disease),但不仅限于此。
[0043]
优选地,上述化学式1中,a是o或者s;上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0044]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0045]
根据本发明的由上述化学式1表示的腺苷衍生物的优选例如下:
[0046]
1)(2r,3r,4s)-2-(2-氯-6-(3-氟苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0047]
2)(2r,3r,4s)-2-(2-氯-6-(3-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0048]
3)(2r,3r,4s)-2-(6-(3-溴苄基氨基)-2-氯-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0049]
4)(2r,3r,4s)-2-(2-氯-6-(2-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0050]
5)(2r,3r,4s)-2-(2-氯-6-(5-氯-2-甲氧基苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0051]
6)(2r,3r,4s)-2-(2-氯-6-(2-甲氧基苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0052]
7)(2r,3r,4s)-2-(2-氯-6-(萘-1-基甲基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0053]
8)3-((2-氯-9-((2r,3r,4s)-3,4-二羟基四氢噻吩-2-基)-9h-嘌呤-6-基氨基)甲基)苯甲酸;
[0054]
9)2-(2-氯-6-甲基氨基-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0055]
10)(2r,3r,4s)-2-(6-(3-氟苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0056]
11)(2r,3r,4s)-2-(6-(3-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;
[0057]
12)(2r,3r,4s)-2-(6-(3-溴苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇;以及
[0058]
13)(2r,3r,4s)-2-(6-(3-溴苄基氨基)-2-氯-9h-嘌呤-9-基)四氢呋喃-3,4-二醇。
[0059]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0060]
[式2]
[0061][0062]
另外,本发明提供一种用于预防或治疗视网膜疾病的口服剂,其包含由化学式1表示的化合物或其药用盐。
[0063]
[化学式1]
[0064][0065]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0066]
此时,上述视网膜疾病可以是糖尿病性视网膜病变(diabetic retinopathy)或者年龄相关性黄斑病变(age-related macular disease),但不仅限于此。
[0067]
优选地,上述化学式1中,a是o或者s,上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0068]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0069]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0070]
[式2]
[0071][0072]
另外,本发明提供一种用于预防或治疗视网膜疾病的滴眼剂,其包含由化学式1表示的化合物或其药用盐。
[0073]
[化学式1]
[0074][0075]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0076]
此时,上述视网膜疾病可以是糖尿病性视网膜病变(diabetic retinopathy)或者年龄相关性黄斑病变(age-related macular disease),但不仅限于此。
[0077]
优选地,上述化学式1中,a是o或者s,上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0078]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0079]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0080]
[式2]
[0081]
[0082]
本发明提供一种用于预防或治疗视神经疾病的药物组合物,其包含由化学式1表示的化合物或其药用盐作为有效成分。
[0083]
[化学式1]
[0084][0085]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0086]
此时,上述视神经疾病可以选自缺血性视神经病变、外伤性视神经病变以及压迫性视神经病变,但不限于此。
[0087]
优选地,上述化学式1中,a是o或者s,上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0088]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0089]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0090]
[式2]
[0091][0092]
根据本发明的化学式1表示的腺苷衍生物可以以药用盐的形式被使用。作为如上所述的盐,可使用由多种药用有机酸或无机酸形成的酸加成盐。作为适合的有机酸的实例,包括羧酸(carboxylic acid)、膦酸、磺酸、乙酸、丙酸、辛酸、癸酸、乙醇酸、乳酸、富马酸、琥珀酸、己二酸、苹果酸、酒石酸、柠檬酸、谷氨酸、门冬氨酸、马来酸、苯甲酸、水杨酸、邻苯二甲酸、苯乙酸、苯磺酸、2-萘磺酸、甲基硫酸(methylsulfuric acid)、乙基硫酸(ethylsulfuric acid)和月桂基硫酸(dodecylsulfuric acid)等;而作为适合的无机酸可以使用例如盐酸、硫酸等氢卤酸和磷酸。
[0093]
根据本发明的由上述化学式1表示的腺苷衍生物不仅限于药用盐,还可以包含能够以常规的方法制备的所有盐、水合物及溶剂化物。
[0094]
并且,根据本发明的用于预防或治疗视网膜疾病或视神经疾病的药物组合物,除
了以上记载的有效成分外,还可以包含药用载体、赋形剂或稀释剂,以便给药。上述载体、赋形剂和稀释剂可以举例为乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油。
[0095]
本发明的药物组合物可以根据常规的方法以散剂、颗粒剂、片剂、胶囊剂、混悬液、乳剂、糖浆剂、气雾剂等口服型剂型、外用剂、栓剂或无菌注射液形态进行剂型化并使用。具体地,剂型化时可以使用常用的填充剂、增重剂、粘合剂、润湿剂、崩解剂、表面活性剂等稀释剂或赋形剂进行调制。用于口服给药的固态制剂包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,但不仅限于此。这样的固态制剂可以在由上述化学式1表示的化合物或药用盐中混合至少一个以上的赋形剂,例如淀粉、碳酸钙、蔗糖、乳糖、明胶等调制而成。并且,除了单纯的赋形剂以外还可以使用硬脂酸镁、滑石等润滑剂。用于口服的液状物,可以用液体石蜡以外添加多种赋形剂、润湿剂、甜味剂、芳香剂、防腐剂等调制而成。非口服制剂包含无菌水溶液、非水性溶剂、混悬剂、乳剂、冷冻干燥制剂及颗粒剂。作为非水性溶剂及混悬剂可以使用例如丙二醇、聚乙二醇、橄榄油等植物油,油酸乙酯等可注射的酯类。作为栓剂的主剂可以使用半合成脂肪酸酯(witepsol)、聚乙二醇(macrogol)、吐温61、可可豆脂、月桂酸甘油酯、甘油明胶等。
[0096]
本发明组合物的适宜剂量取决于患者的状态、体重、疾病的程度、药物形式以及时间,这些可以由专业人员适当地选择。
[0097]
另外,本发明提供一种用于预防或治疗视神经疾病的口服剂,其包含由化学式1表示的化合物或其药用盐。
[0098]
[化学式1]
[0099][0100]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0101]
此时,上述视神经疾病可以选自缺血性视神经病变、外伤性视神经病变以及压迫性视神经病变,但不限于此。
[0102]
优选地,上述化学式1中,a是o或者s,上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0103]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0104]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0105]
[式2]
[0106][0107]
上述用于预防或治疗视网膜疾病或视神经疾病的口服剂可以是剂型化为固体制剂或液体制剂的由上述化学式1表示的化合物及/或其药用盐。
[0108]
固体制剂可以是片剂、丸剂、粉剂、颗粒剂、胶囊剂等,液体制剂可以是混悬剂、内服液剂、乳剂、糖浆剂等,但不仅限于此。
[0109]
上述用于预防或治疗视网膜疾病或视神经疾病的口服剂还可以包含赋形剂,即可以包含选自甲基纤维素(methyl cellulose,mc)、蔗糖(sucrose)、乳糖(lactose)、二甲基亚砜(dimethylsulfoxide,dmso)、聚乙二醇(polyethylene glycol,peg)、硬脂酸镁(magnesium stearate)、碳酸钙、明胶、滑石(talc)、蒸馏水(distilled water,dw)、液体石蜡等中的一个以上,更优选地,可以包含选自甲基纤维素(methyl cellulose,mc)、二甲基亚砜(dimethyl sulfoxide,dmso)、聚乙二醇(polyethylene glycol,peg)及蒸馏水中的一个以上,更优选地,可以包含0.5wt%甲基纤维素。
[0110]
根据本发明一实施例的用于预防或治疗视网膜疾病或视神经疾病的口服剂中,可以将由上述化学式1表示的化合物或其药用盐以粉末状态或溶于上述赋形剂的溶液状态填充于胶囊等,但不限于此。
[0111]
另外,本发明提供一种用于预防或治疗视神经疾病的滴眼剂,其包含由化学式1表示的化合物或其药用盐。
[0112]
[化学式1]
[0113][0114]
上述化学式1中,a是o或s;r是a)未取代或者独立地或选择性地被1个或2个以上的c6~c
10
的芳基取代的直链或支链的c1~c5的烷基,b)未取代或者独立地或选择性地被氟、氯、溴、或直链或支链的c1~c4的烷氧基中的1个或2个以上取代的苄基,或者c)被羟基羰基取代的苄基;y是h或卤素元素。
[0115]
此时,上述视神经疾病可以选自缺血性视神经病变、外伤性视神经病变以及压迫性视神经病变,但不限于此。
[0116]
优选地,上述化学式1中,a是o或者s,上述r是甲基、乙基、丙基、萘甲基、苄基,独立地或选择性地被选自氟、氯、溴或者c1~c3的烷氧基中的1个或2个以上的取代基取代的苄
基,或甲苯甲酸(toluic acid),上述y可以是h或者cl。
[0117]
更优选地,上述a是o或者s,上述r是甲基、乙基、1-萘甲基、苄基、2-氯苄基、3-氟苄基、3-氯苄基、3-溴苄基、2-甲氧基-5-氯苄基、2-甲氧基苄基或3-甲苯甲酸,上述y是h或cl。
[0118]
最优选地,由上述化学式1表示的化合物可以是由下述化学式2表示的化合物。
[0119]
[化学式2]
[0120][0121]
上述用于预防或治疗视网膜疾病或视神经疾病的滴眼剂可以包含由上述化学式1表示的化合物及/或其药用盐以及滴眼液。滴眼液可以包含选自增溶剂(solubilizer)、粘度增强剂(viscosity enhancer)、抗氧化剂(antioxidant)、防腐剂(preservative)以及缓冲溶液(buffer solution)中的一种以上。
[0122]
本发明一个实施例中的滴眼液可以是克列莫佛el(聚氧乙烯蓖麻油,cremophor el)、甘油(glycerin)、柠檬酸(citric acid)及对羟基苯甲酸甲酯(methylparaben)被溶解或被混合的ph6.8的缓冲溶液,但不仅限于此。
具体实施方式
[0123]
以下,用具体实施例进行详细说明以帮助理解本发明。但是,提供以下实施例是为了向本领域普通技术人员更充分地说明本发明,且仅是对本发明内容的说明,因此本发明的范围并不仅限于以下实施例。
[0124]
《准备例1》腺苷衍生物化合物的合成及滴眼剂的制备
[0125]
按照韩国授权专利第10-1396092号所公开的方法,合成腺苷衍生物。此时,合成的腺苷衍生物如下:(2r,3r,4s)-2-(2-氯-6-(3-氟苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(3-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(3-溴苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(2-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(5-氯-2-甲氧基苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(2-甲氧基苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(2-氯-6-(萘-1-基甲基苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,3-((2-氯-9-((2r,3r,4s)-3,4-二羟基四氢噻吩-2-基)-9h-嘌呤-6-基氨基)甲基)苯甲酸,2-(2-氯-6-甲基氨基-嘌呤-9-基)(2r,3r,4s)-四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(6-(3-氟苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(6-(3-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,(2r,3r,4s)-2-(6-(3-溴苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇,以及(2r,3r,4s)-2-(6-(3-溴苄基氨基)-2-氯基-9h-嘌呤-9-基)四氢呋喃-3,4-二醇。
[0126]
此后的试验中使用了(2r,3r,4s)-2-(2-氯-6-(3-氯苄基氨基)-9h-嘌呤-9-基)四氢噻吩-3,4-二醇(以下命名为“化合物a”),并为了动物实验,将溶解克列莫佛el、甘油、柠檬酸及对羟基苯甲酸甲酯的ph6.8的缓冲溶液与上述化合物a混合,并制备了分别以250μm,500μm及750μm的浓度含有上述化合物的滴眼剂。
[0127]
《实施例1》确认腺苷衍生物化合物对新生血管及炎症反应的抑制效果
[0128]
1.试验方法
[0129]
1)试验物质的制备及处理
[0130]
用作试验物质的化合物a为溶解于dmso而制成。制备的溶液在使用前为止保存在-20℃环境中。实验物质在不含血清的细胞培养基中以1:1000(v/v)稀释处理。对照组中将dmso以1:1000(v/v)稀释处理。
[0131]
2)试验物质处理时细胞内蛋白质表达量分析
[0132]
为了确认对于源自小鼠视网膜的感光细胞的新生血管形成相关反应及炎症反应的试验物质的效能,回收了在多种条件下培养24小时的细胞,并利用pro-prep蛋白质提取试剂盒(protein assay kit)提取了细胞内蛋白质。使用bca蛋白质检测试剂盒(protein assay kit)进行对提取的蛋白质定量测量。用10%的聚丙烯酰胺凝胶电泳(sds-page)分离40μg蛋白质后,将其转印于pvdf膜。将转印有蛋白质的膜与含有5%脱脂油的tbst缓冲液(tris-buffered saline with 0.1%tween-20)反应30分钟后,依次与第一抗体、第二抗体反应。利用弗森fx图像采集系统(fusion fx image acquisition system)拍摄并确认蛋白质表达量。蛋白质表达量的分析使用imagej以相对值的方式表示。另一方面,在以下《表1》中整理并示出了用于免疫印迹的抗体及实验条件。
[0133]
[表1]
[0134][0135]
3)试验物质处理时细胞内炎性细胞因子的定量分析
[0136]
为了确认对于源自小鼠视网膜的感光细胞的新生血管形成相关反应及炎症反应的试验物质的效能,回收了在多种条件下培养24小时的细胞,并利用pro-prep蛋白质提取
试剂盒提取了细胞内蛋白质。使用bca蛋白质检测试剂盒进行提取的蛋白质定量测定。分别用elisa试剂盒进行细胞内存在的炎性细胞因子(tnfα、il-1β、il-6)的定量分析。
[0137]
4)试验物质处理时培养基内vegf定量分析
[0138]
为了确认对于源自小鼠视网膜的感光细胞的新生血管形成相关反应的试验物质的效能,将在多种条件下培养24小时的细胞的培养基进行离心分离后回收。用小鼠血管内皮生长因子quantikine酶联免疫试剂盒(mouse vegf quantikine elisa kit)对培养基内存在的血管内皮生长因子(vegf)进行定量分析。
[0139]
5)试验物质处理时细胞内mrna表达量分析
[0140]
为了确认对于源自小鼠视网膜的感光细胞的新生血管形成相关反应及炎症反应的试验物质的效能,将在多种条件下培养6小时的细胞用trizol溶液处理后分离出细胞内的总rna。对分离出的总rna使用针对目标基因的特殊引物(表2)和逆转录酶合成cdna后,确认相关因子的表达。mrna表达量的分析使用imagej软件以相对值的方式进行表示。
[0141]
此时,在以下《表2》中整理并示出了用于分析pcr的引物及实验条件。
[0142]
[表2]
[0143][0144]
6)统计分析
[0145]
通过微软(microsoft)公司的excel(2007)对各实验组的测定值进行统计分析。通过计算四分位数确认每个实验组的结果值的离群值(outlier),通过单因素差分析法对每个数据进行方差分析,并将结果表示为均值和标准偏差。并且,通过f-检验及t-检验(等方差及异方差),在显著性水平0.05以下分析有效性。
[0146]
2.实验结果
[0147]
1)新生血管及炎症反应相关蛋白质的表达变化
[0148]
根据有关hmgb-1(high mobility group box 1)的报告,对来自小鼠视网膜感光细胞施压时hmgb-1的表达增加,对感光细胞处理hmgb-1时新生血管相关因子及炎症反应增加((波母等,实验室研究,96,409-427,2016)bohm m.r.et al.,lab invest,96,409-427,2016)。因此,本发明以上述参考文献为基础,验证了感光细胞受损时腺苷衍生物对新生血管反应及炎症反应的效能。
[0149]
在图1a及图1b中示出了,经过腺苷衍生物化合物a与hmgb-1处理后,新生血管反应相关因子(vegf、vegf受体1、vegf受体2、血管生成素1(angiopoietin 1)及血管生成素2(angiopoietin 2)酶),以及炎症反应相关因子(cox2、mmp2、mmp9、icam1及vcam1酶)的蛋白质表达变化的分析结果。
[0150]
即图1a及图1b示出,新生血管相关因子:vegf、vegfr1、vegfr2及ang2的表达基于hmgb-1(5μg/ml)而显著增加,通过化合物a的处理能够以浓度依赖性的方式减少增加的新生血管相关因子的蛋白质表达。化合物a的浓度在0.5μm以上时,vegf、vegfr2、cox2及mmp2蛋白质的表达显著减少,浓度在0.1μm以上时,vegfr1、ang2及mmp9的表达显著减少。浓度在2μm时,ang1蛋白质的表达显著增加,浓度在2μm以上时icam1及vcam1蛋白质的表达显著地减少。
[0151]
2)vegf及炎性细胞因子的表达变化
[0152]
为了确认化合物a对于因hmgb-1导致的小鼠视网膜感光细胞的新生血管形成相关反应及炎症反应的效能,通过elisa分析法进行定量分析的结果如图2所示,0.1μm以上的化合物a可显著减少因hmgb-1增加的vegf量。虽然细胞内炎性细胞因子(tnfα、il-1β及il-6)的量都因为hmgb-1而增加,但是0.1μm以上浓度的化合物a可显著减少tnfα,1μm以上浓度的化合物a可显著减少il-1β及il-6。
[0153]
3)新生血管及炎症反应相关mrna的表达变化
[0154]
如图3a及图3b所示,对经过化合物a处理后的新生血管形成相关因子(vegf、vegf受体1、vegf受体2酶),以及炎症反应相关因子(tnfα、il-6、cox2、mmp2、mmp9、icam1及vcam1酶)的mrna表达变化进行分析的结果,新生血管相关因子:vegf、vegfr1、vegfr2的mrna的表达通过hmgb-1显著增加。通过化合物a的处理能够以浓度依赖性的方式减少增加的新生血管相关因子的mrna表达。用0.1μm以上浓度的化合物a处理时,vegf及vegfr1的表达显著增加,用0.5μm以上浓度的化合物a处理时,vegfr2的表达显著减少。并且,在对照组中,通过hmgb-1的炎症反应相关因子(tnfα、il-6、cox2、mmp2、mmp9、icam1、及vcam1)的mrna表达也显著增加,但是在化合物a的处理下以浓度依赖性的方式减少。在0.1μm以上浓度的化合物a的处理下,cox2及il-6的表达被显著地抑制,在0.5μm以上浓度的化合物a的处理下,tnfα及mmp9的表达显著地减少。在1μm以上浓度的化合物a的处理下,mmp2、icam1及vcam1的表达显著地减少。
[0155]
《实施例2》腺苷衍生物对视网膜感光细胞的保护效果
[0156]
1.试验方法
[0157]
1)试验物质的制备及处理
[0158]
用作试验物质的化合物a为溶解于dmso而制成。制备的溶液在使用前为止保存在-20℃环境中。并且,将10mg的cccp溶解于dmso制备50mm的cccp溶液。制备的溶液在使用前为止保存在-20℃环境中。实验物质在不含血清的细胞培养基中以1:1000(v/v)稀释处理。对
照组中将dmso以1:1000(v/v)稀释处理。
[0159]
2)tunel分析
[0160]
通过deadend
tm
荧光法检测系统(fluorometric tunel system)对细胞凋亡(apoptosis)细胞进行定量分析。用1μm化合物a对细胞进行1小时的预处理后,用含有5mm谷氨酸的培养基培养8小时。用pbs清洗两次细胞后,用10%福尔马林固定15分钟。在0.1%曲拉通x-100(triton x-100)中将固定的细胞暴露10分钟。细胞与含有荧光的dutp反应后,对切割的dna部分染色,然后与含有dapi的缓冲溶液一起固定到载玻片上。通过荧光显微镜观察被染色的细胞。
[0161]
3)半胱天冬酶(caspase)3/7的活性分析
[0162]
通过caspase-glo 3/7分析系统分析细胞内半胱天冬酶3/7的活性。用1μm化合物a对细胞进行1小时的预处理后,用含有5mm谷氨酸的培养基培养24小时。加入与细胞培养基同等量的试剂盒溶液反应一个小时后,通过酶标仪(microplate reader)测定产生的发光强度(luminescence)并分析相对活性。
[0163]
4)半胱天冬酶8的活性分析
[0164]
通过caspase-glo 8分析系统(assay system)来分析细胞内半胱天冬酶8的活性。用1μm化合物a对细胞进行1小时的预处理后,用含有5mm谷氨酸的培养基培养24小时。加入与细胞培养基同等量的试剂盒溶液反应一个小时后,通过酶标仪测定产生的发光强度并分析相对活性。
[0165]
5)线粒体细胞膜的电位分析
[0166]
利用jc-1试剂分析细胞内线粒体细胞膜的电位。用1μm化合物a对细胞进行1小时的预处理后,用含有5mm谷氨酸的培养基培养6小时。之后,利用5mm的jc-1进行处理并培养30分钟。利用attune声波聚焦流式细胞仪(acoustic focusing cytometer)在激发波长(exitation wavelength)485
±
11nm、535
±
17.5nm和发射波长(emission wavelength)530
±
15、590
±
17.5nm下分析jc-1聚集体(aggregate)和jc-1单体(monomer)。
[0167]
6)细胞内蛋白质表达量分析
[0168]
为了确认对于源自小鼠视网膜的感光细胞的新生血管形成相关反应及炎症反应的试验物质的效能,回收了在多种条件下培养24小时的细胞,并利用pro-prep蛋白质提取试剂盒提取了细胞内蛋白质。使用bca蛋白质检测试剂盒进行提取的蛋白质定量检测。用10%的sds-page分离40μg蛋白质后,将其转印至pvdf膜。将转印有蛋白质的膜与含有5%脱脂油的tbst缓冲液(tris-buffered saline with 0.1%tween-20)反应30分钟后,依次与第一抗体、第二抗体反应。蛋白质表达量的分析使用imagej以相对值的方式表示。另一方面,在以下《表3》中整理并示出了用于免疫印迹的抗体及实验条件。
[0169]
[表3]
[0170][0171]
7)统计分析
[0172]
通过ibm公司的spss 23.0对各实验组的测定值进行统计分析。针对每个组是否等方差,同方差时通过单因素方差分析(one-way analysis of variance)和tukeys检验(tukeys test)对每个组进行分析,异方差时通过单因素方差分析和welchs t检验(welchs t-test)对每个组进行分析。相比于正常组具有显著的统计学差异的实验组表示为*p《0.05、**p《0.01、***p《0.001,相比于只经过谷氨酸处理的对照组具有显著的统计学差异的实验组表示为#p《0.05、##p《0.01、###p《0.001。
[0173]
2.实验结果
[0174]
1)谷氨酸的细胞毒性
[0175]
在培养基中稀释谷氨酸以0-9mm的浓度处理培养的细胞后,再培养24小时后用细胞增殖分析试剂(celltiter96 aq
ueous
单溶液细胞增殖检测试剂盒(one solution cell proliferation assay kit))处理,1小时后比较分析细胞的生存率,分析谷氨酸对来自小鼠的视网膜感光细胞的毒性,其结果如图4所示,浓度为3mm以上时,以浓度依赖性的方式诱导细胞生存率的显著减少。谷氨酸的ic
50
值确认为5.1
±
0.5mm。
[0176]
2)腺苷衍生物的细胞保护效果
[0177]
通过谷氨酸诱导细胞凋亡来确认化合物a的细胞保护效果,其结果如图5(n=6)所示,直至1μm的浓度,化合物a的预处理表现出浓度依赖性地抑制谷氨酸对细胞生存率的阻碍。这些实验结果意味着化合物a对谷氨酸诱导的细胞凋亡具有保护效果。预处理30分钟和1小时后的化合物a的ec
50
(50%有效浓度)值相似,分别为0.31
±
0.08μm和0.35+0.06μm。
[0178]
3)腺苷衍生物的细胞凋亡(apoptosis)抑制效果。
[0179]
为确认谷氨酸诱导的细胞凋亡及化合物a的抑制效果,利用tunel检测和dapi染色
并通过显微镜观察发生细胞凋亡的细胞,其结果如图6所示,只处理谷氨酸的细胞中的多数核被确认tunel-阳性反应,但是处理化合物a的细胞中其数量明显减少。这样的结果表示化合物a抑制谷氨酸诱导的细胞凋亡。
[0180]
4)腺苷衍生物对线粒体的保护效果
[0181]
据资料,谷氨酸引起的细胞凋亡与线粒体的损伤有关。对此,为确认化合物a对基于谷氨酸的线粒体损伤具有何种效果,通过流式细胞仪(flow cytometer)分析线粒体的膜电位差,其结果如图7及以下《表4》所示,可以确认只处理谷氨酸的细胞中jc-1聚集体减少。在诱发线粒体损伤的cccp的处理的细胞中,也可以确认类似的细胞分布。但是,进行化合物a预处理的实验组中,细胞分布与正常组相似。这些结果表明,化合物a抑制谷氨酸对细胞内线粒体的损伤。
[0182]
[表4]
[0183] 对照组谷氨酸谷氨酸+化合物acccpr186.22
±
1.1236.13
±
10.42**71.70
±
1.60
***,#
9.42
±
1.48
***
r213.78
±
1.1263.87
±
10.42
**
28.30
±
1.60
***,#
90.58
±
1.48
***
[0184]
5)确认半胱天冬酶的活性
[0185]
已知半胱天冬酶(caspase)可调节细胞凋亡。因此,在谷氨酸导致的细胞损伤及化合物a对其的细胞保护效果中,确认了caspase的作用,其结果如图8所示,可以确认只处理谷氨酸的细胞的caspase3/7(图8的(i))及caspase8(图8的(ⅱ))的活性显著增加,进行化合物a预处理后半胱天冬酶3/7及半胱天冬酶8的活性以浓度依赖性的方式被抑制。本结果表明化合物a抑制半胱天蛋白酶的激活导致的细胞的细胞凋亡。
[0186]
6)细胞凋亡相关蛋白质的表达变化
[0187]
为确认化合物a对谷氨酸导致的细胞凋亡的效能,分析细胞凋亡相关蛋白质aif及细胞色素c的变化,其结果如图9所示,可以确认只用谷氨酸处理的细胞中存在于线粒体中的aif及细胞色素c分别向细胞核和细胞质移动,进行化合物a预处理后,细胞核和细胞质中的aif及细胞色素c的表达显著减少。即可以确认化合物a显著地抑制这些蛋白质的移动变化。这些结果表明,化合物a通过抑制线粒体的损伤进而抑制细胞的损伤。
[0188]
另外,为确认谷氨酸导致的细胞凋亡机制及化合物a对其的效能,分析细胞凋亡相关蛋白质的变化,其结果如图10a至图10c所示,可以确认与细胞凋亡相关的rip的表达基于谷氨酸而显著地减少,但是在进行化合物a预处理的实验组中再次以浓度依赖性的方式增加。并且,可以确认虽然与线粒体损伤相关的pbcl2、bcl2、pbad、bad及bid蛋白质的表达基于谷氨酸而显著地变化,但是在进行化合物a预处理的实验组中恢复至与正常组相同的表达量。可以确认半胱天冬酶(caspase)8及剪切的半胱天冬酶(caspase)9、半胱天冬酶(caspase)3也基于谷氨酸而显著地增加,但是在进行化合物a预处理的实验组中则显著地减少。这些结果表明化合物a通过抑制谷氨酸导致的细胞凋亡,从而保护细胞。
[0189]
《实施例3》含有腺苷衍生物的滴眼剂的视神经保护效能实验
[0190]
为确认根据本发明衍生物的滴眼给药的滴眼剂的视神经保护效能,进行如下的体内(in vivo)动物实验。向3个月龄的正常dab 2j小鼠滴眼给药准备例1中制备的滴眼剂。作为阳性对照组以同样的方法给药用于青光眼治疗剂的滴眼剂适利达(xalatan),作为阴性对照组对实验动物未做其他处理。
[0191]
接着,4个月后测定实验动物的视网膜神经节细胞(retinal ganglion cell,rgc)的数量,观察其切面并分别在图11及图12中示出其结果。图11及图12中,对照组(control)表示阴性对照组,药物(drug)250、500及750分别表示含有250μm、500μm及750μm浓度的上述衍生物化合物(化合物a)的滴眼剂,适利达(xalatan)表示阳性对照组。
[0192]
参照图11及图12,可以确认给药含有本发明腺苷衍生物的滴眼剂的小鼠中,具有上述滴眼剂给药量依赖性的视神经保护效果。
[0193]
以上,详细描述了本发明内容的特定部分,对于本领域技术人员显而易见的是,这些具体描述仅仅是优选实施方式,本发明的范围不仅限于此。即本发明的实质范围由所附权利要求及其等同物定义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1