一种甲状腺乳头状癌患者基因四分型分类系统及其应用
1.本发明涉及生物医药技术领域,尤其是涉及一种甲状腺乳头状癌患者基因四分型分类系统及其应用。
背景技术:
2.甲状腺癌作为内分泌系统中最常见的恶性肿瘤,其发病率正在迅速增加。不同病理类型的甲状腺癌,在其发病机制、生物学行为、组织学形态、临床表现、治疗方法以及预后等方面均有明显不同。甲状腺乳头状癌(ptc)是一种分化型甲状腺癌,约占所有甲状腺癌病例的90%。ptc生长缓慢,预后一般良好。但是,其发病率和复发率较高(20%~40%),ptc的死亡率约为甲状腺癌总死亡率的50%。研究表明,一些信号通路可能参与到甲状腺癌的发生发展,包括mapk通路、pi3k-akt通路、nf-κb通路、rassf1-mst1-foxo3通路,而与这些信号通路相关的多种基因突变在甲状癌发生发展中起到重要作用,比如braf,hras,kras,nras,ret,tert等。ptc患者的基因异质性影响着患者的临床病理特征(比如年龄、分期、病灶直径、淋巴结)及生存预后,值得探索。
3.ptc作为一种mapk信号通路驱动的肿瘤,有两个相互排斥的驱动基因:braf-v600e和ras突变。braf-v600e突变发生在大约45%的ptc中,有研究表明braf-v600e与ptc的不良临床病理预后存在强相关性,包括病理侵袭性特征、复发增加、失去放射性碘亲和力和治疗失败,后续两项大型荟萃分析证实携带braf-v600e基因侵袭性更强,其原因在于与ras和rtk融合肿瘤相比,braf-v600e肿瘤中负责碘摄取和代谢基因表达大大降低,而包括hras、kras和nras三种亚型在内的ras突变率仅次于braf,在ptc中10%~20%。虽然ras是mapk和pi3k-akt通路的经典双激活因子,但ras突变似乎在甲状腺肿瘤发生中优先激活pi3k-akt通路。为了探索braf-v600e与ras的关系,研究者开发了braf-v600e-ras评分模型,以量化既定肿瘤表达谱倾向braf-v600e或ras基因突变谱,但这其中又忽略了braf-v600e与ras外的其他基因突变类型的患者。此外,ptc还存在一些其他基因突变或融合类型,如可能与侵袭、转移相关的ret突变/融合、tp53基因突变;与复发、预后不良、死亡率高等恶性程度潜在相关的braf/tert共突变、ras/tert共突变等。同时,有文献报道发现tp53和kras这两个基因对pd-l1表达、免疫系统t细胞的浸润、肿瘤免疫原性的增强具有显著影响。研究表明,braf基因突变与ptc患者的预后有关,如更高的肿瘤分期、局部侵袭以及颈部淋巴结转移等。但也有研究显示braf基因突变与ptc的年龄和侵袭性有关,但与淋巴结转移无关;ret重排提示年轻ptc患者淋巴结转移增多。此外,有研究显示ret、alk或ntrk1基因融合和染色体22q缺失与ptc的转移独立相关。
4.由此可知,ptc基因异质性对其临床表现、淋巴结转移及预后具有重要的调控作用,但目前尚未有系统的ptc基因分型系统提出,且针对特定基因的影响作用具有一定的争议。同时,目前较大规模的中国甲状腺癌突变谱与临床特征、预后相关性报道很少。
技术实现要素:
5.本发明的目的在于克服上述现有技术的不足之处而提供一种甲状腺乳头状癌患者基因四分型分类系统及其应用。
6.为实现上述目的,本发明采取的技术方案为:
7.第一目的,本发明提供了一种甲状腺乳头状癌患者基因四分型分类系统,包括:
8.1)数据收集模块,收集甲状腺乳头状癌患者sysmh-ptc队列数据及tcga-ptc队列多组学信息;
9.2)分型模块,根据甲状腺乳头状癌患者代表性突变基因(驱动基因之间的互斥关系)将甲状腺乳头状癌患者sysmh-ptc队列数据和tcga-ptc队列多组学信息分为braf突变、ret融合、ras突变及其他基因突变类型的新基因四分型;
10.3)分析模块,对不同基因型甲状腺乳头状癌患者的临床病理表现,肿瘤免疫细胞浸润情况、促炎因子表达情况、免疫检查点表达情况、淋巴结转移风险及预后进行分析。
11.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,所述sysmh-ptc队列数据包括临床病理信息与肿瘤组织基因测序数据;所述tcga-ptc队列多组学信息包括临床病理信息、肿瘤组织基因测序数据和预后信息。
12.该braf突变、ret融合、ras突变及其他基因突变类型的新基因四分型在tcga-ptc队列可得到验证。
13.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,所述临床病理表现包括各基因分型的年龄、病灶最大直径、中央淋巴结数量、性别、分期、肿瘤tpo、被膜侵犯、脉管癌栓、t-stage、n-stage、肿瘤ck19、galectin.3、淋巴ck19、淋巴tpo、cd56、ki37或ttf.1。
14.通过对不同基因型ptc患者间临床病理表现进行比较分析,证实ptc新基因四分型系统可显著区分ptc患者的临床病理表现情况。各基因分型的年龄,中央淋巴结数量,病灶最大直径存在显著差异,而tpo与ret和braf相关。
15.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,分析肿瘤免疫细胞浸润情况采用热图、xcells算法或cibersort算法。
16.通过对不同基因型ptc患者间免疫细胞浸润情况进行比较分析,证实在ptc新基因分型中,不同基因突变情况患者间肿瘤组织免疫细胞浸润情况不同,即ptc基因新四分型系统可显著区分ptc患者的肿瘤组织免疫细胞浸润情况。根据差异的time关键细胞含量进行无监督层次聚类,ras类患者间相似性较高,具有明显的群体性time差异(热图subtype红色区域);除了m2类巨噬细胞外,其他细胞在ras类患者中均低表达。通过xcells算法、cibersort算法均得到相同结论。
17.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,所述促炎因子包括il-1、il-2、il-6、il-12、il-17、il-18、ifn-γ或tnf-α。
18.在ptc新基因分型中,不同基因型患者间促炎因子表达情况表现具有显著差异。即ptc新基因四分型系统可显著区分ptc患者的促炎因子表达情况。
19.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,所述免疫检查点包括pdcd1、cd274和ctla4。通过分析,不同基因型患者间免疫检查点表达情况具有显著差异,获得的ptc新基因四分型系统可显著区分ptc患者的免疫检查点表达情况。
20.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,基于甲状腺乳头状癌患者sysmh-ptc队列数据进行甲状腺乳头状癌淋巴结转移调控关键基因筛选,确认基因四分型与甲状腺乳头状癌患者的淋巴结转移相关。
21.作为本发明所述甲状腺乳头状癌患者基因四分型分类系统的优选实施方式,所述分析模块中还包括对新基因四分型差异基因共表达网络分析。
22.优选地,分别选取ras突变型vs braf突变型,ras突变型vs ret融合型,braf突变型vs ret融合型排名靠前1000个差异基因取并集进行wcgna差异基因共表达网络分析。
23.第二目的,本发明提供了上述甲状腺乳头状癌患者基因四分型分类系统在诊断甲状腺乳头状癌患者中的应用。
24.在本发明中,数据分析均采用r软件(r software,http://www.r-project.org)、pythom软件(https://www.pythom.com/)进行统计学分析。具体统计学方法如下:
25.统计分析一般原则:除特殊说明外,所有的统计检验都采用α=0.05的双侧检验,置信区间均采用双侧95%的置信区间估计。定量指标采用例数、均数、标准差、中位数、上下四分位数、最小值和最大值进行统计描述,分类指标采用各类的例数和百分比进行统计描述等。两组基线均衡性的比较分析采用t检验、χ2检验、fisher精确检验或秩和检验等。
26.数据分析方法:差异性比较分析采用t检验、χ2检验、fisher精确检验或秩和检验等。采用kaplan-meier法评估患者预后生存时间的中位数及生存曲线,采用log-rank检验评估治疗效果。连续变量的最优截断值由r语言survminer软件包生成。通过r语言的complexheatmap软件包生成改变基因的频率绘制分割点。肿瘤微环境免疫浸润细胞情况分析采用xcells、cibersort算法分析,免疫微环境炎症因子、免疫检查点表达情况采用gsea分析。关键基因的细胞功能、通路富集采用基因共表达网络分析(wgcna)、go基因功能分析、kegg通路富集分析。预测因子采用单变量cox回归分析。通过校准曲线指数(c-index)进行对nomogram模型的预测效能进行了图形化和定量的一致性评估。
27.与现有技术相比,本发明具有以下有益效果:
28.本发明针对不同基因分型ptc患者的临床病理表现,肿瘤免疫细胞浸润情况、促炎因子表达情况、免疫检查点表达情况、淋巴结转移风险及预后等情况进行详细探索与分析,发现了本发明的甲状腺乳头状癌患者基因四分型分类系统。不同的淋巴结转移风险可有助于指导针对不同基因分型的ptc患者的手术方式,而其肿瘤免疫细胞浸润情况、促炎因子表达情况及免疫检查点表达情况有助于其药物治疗策略制定。该ptc新基因四分型系统对ptc患者的临床诊疗策略制定具有创新性、科学性指导意义。
附图说明
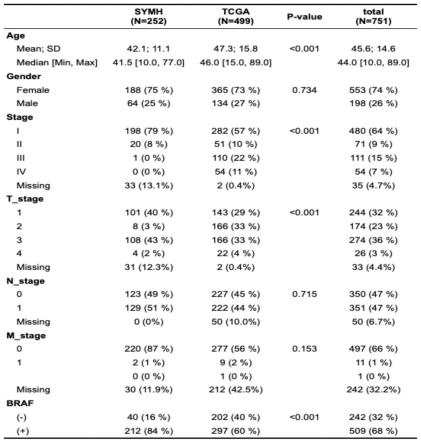
29.图1为入组队列基本信息图;
30.图2为symh-ptc队列患者基因突变频谱图;
31.图3为ptc新基因四分型的分布情况图;
32.图4为ptc新基因四分型的临床病理表现差异图;
33.图5为ptc新基因四分型肿瘤微环境细胞差异热图;
34.图6为ptc新基因四分型肿瘤微环境细胞差异图i(采用xcells算法,
*
p《0.05,
**
p《0.01,
***
p《0.001);
35.图7为ptc新基因四分型肿瘤微环境细胞差异图ii(采用cibersort算法,
*
p《0.05,
**
p《0.01,
***
p《0.001);
36.图8为ptc新基因四分型促炎因子表达差异图;
37.图9为ptc新基因四分型免疫检查点表达情况图;
38.图10为ptc新基因四分型与淋巴结转移相关性分析图(图10-a为不同基因型与淋巴结转移相关性结果图;图10-b为braf突变及braf野生型的淋巴结转移风险差异图;图10-c为ras突变及ras野生型的淋巴结转移风险差异图;图10-d为ret融合及ret野生型的淋巴结转移差异图,
**
p《0.01);
39.图11为不同ptc基因分型患者的淋巴结转移情况与dfs相关性分析图(图11-a为所有ptc患者是否出现淋巴结转移的dfs相关分析图;图11-b为braf突变型进行淋巴结转移与ptc患者的dfs相关性分析图;图11-c为ras突变型进行淋巴结转移与ptc患者的dfs相关性分析图;图11-d为ret融合型进行淋巴结转移与ptc患者的dfs相关性分析图);
40.图12为不同ptc基因分型差异基因共表达网络分析图;
41.图13为braf突变型与ras突变型患者差异基因模块通路图。
具体实施方式
42.为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
43.在以下实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
44.实施例1
45.本发明通过收集252例ptc患者sysmh-ptc队列数据(包括临床病理信息与肿瘤组织基因测序数据),并收集了499例tcga-ptc队列多组学信息(包括临床病理信息、肿瘤组织基因测序数据和预后信息等)(如图1)。
46.通过对sysmh-ptc队列肿瘤18基因测序数据分析中发现,可根据ptc患者代表性突变基因(驱动基因之间的互斥关系),将其分为braf突变、ret融合和ras突变及其他基因突变类型的基因四分型(如图2)。该braf突变、ret融合和ras突变及其他基因突变类型的基因四分型在tcga-ptc队列可得到验证(如图3)。
47.通过对不同基因型ptc患者间临床病理表现(包括各基因分型的年龄、病灶最大直径、中央淋巴结数量、性别、分期、肿瘤tpo、被膜侵犯、脉管癌栓、t-stage、n-stage、肿瘤ck19、galectin.3、淋巴ck19、淋巴tpo、cd56、ki37或ttf.1)进行比较分析,证实在ptc新基因分型中,不同基因突变情况患者间临床病理表现,即该新的ptc基因四分型系统可显著区分ptc患者的临床病理表现情况。各基因分型的年龄,中央淋巴结数量,病灶最大直径存在显著差异,而tpo与ret和braf相关(结果参考图4)。
48.通过对不同基因型ptc患者间免疫细胞浸润情况进行比较分析,证实在ptc新基因分型中,不同基因突变情况患者间肿瘤组织免疫细胞浸润情况不同,即该新的ptc基因四分型系统可显著区分ptc患者的肿瘤组织免疫细胞浸润情况。根据差异的time关键细胞含量进行无监督层次聚类,ras类患者间相似性较高,具有明显的群体性time差异(热图subtype红色区域);除了m2类巨噬细胞外,其他细胞在ras类患者中均低表达(结果参考图5)。通过
xcells算法、cibersort算法均得到相同结论(结果参考图6-7)。
49.通过对不同基因型ptc患者间促炎因子表达情况进行比较分析,包括il-1、il-2、il-12、il-17、il-18、ifn-γ和tnf-α,关键因子是il-1、il-6和tnf-α。经分析证实在ptc新基因分型中,不同基因型患者间促炎因子表达情况表现具有显著差异(结果参考图8),说明ptc新基因四分型系统可显著区分ptc患者的促炎因子表达情况。
50.通过对不同基因型ptc患者间免疫检查点表达情况进行比较分析,包括pdcd1、cd274和ctla4。经分析证实在ptc新基因分型中,不同基因型患者间免疫检查点表达情况具有显著差异(结果参考图9)。说明ptc新基因四分型系统可显著区分ptc患者的免疫检查点表达情况。
51.基于sysmh-ptc队列252例患者基因测序数据进行ptc淋巴结转移调控关键基因筛选(结果参考图10)。其中,braf突变、ras突变、ret融合与ptc患者的淋巴结转移显著相关(图10-a);以基因突变/融合为分组条件,发现患者淋巴结转移在组间存在显著差异,确认braf突变、ret融合和ras突变及其他基因突变类型的基因四分型与ptc患者的淋巴结转移相关(图10-b、图10-c和图10-d)。
52.不同基因型ptc患者是否出现淋巴结转移(结果参考图11),患者的无疾病生存期(dfs)存在显著差异(图11-a)。针对braf突变型、ras突变型、ret融合型进行淋巴结转移与ptc患者的dfs相关性分析,发现braf突变型(图11-b)、ras突变型(图11-c)、ret融合型(图11-d)是否淋巴结转移,患者的dfs有显著差异。
53.进一步地,分别选取ras突变型vs braf突变型,ras突变型vs ret融合型,braf突变型vs ret融合型排名靠前1000个差异基因取并集进行wcgna差异基因共表达网络分析(参考图12)。其各基因分型在通路表达模块中的差异主要体现在braf突变型vs ras突变型患者中,其中黑色,棕色,绿松石色,灰色4个基因集与ras突变型/braf突变型样本高度相关;绿松石色基因集与ras突变型患者中低表达,在braf突变型患者中高表达(参考图13)。对4个基因集合单独进行富集分析,确定ras突变型患者中影响免疫作用的2个关键基因集合,包括type ii interferon signaling(ifng)、cancer immunotherapy by ctla4 blockade。
54.综上,对不同基因分型ptc患者的临床病理表现,肿瘤免疫细胞浸润情况、促炎因子表达情况、免疫检查点表达情况、淋巴结转移风险及预后等情况进行详细探索与分析,发现了本发明甲状腺乳头状癌患者基因四分型分类系统。不同的淋巴结转移风险可有助于指导针对不同基因分型的ptc患者的手术方式,而其肿瘤免疫细胞浸润情况、促炎因子表达情况及免疫检查点表达情况有助于其药物治疗策略制定。该新ptc基因四分型对ptc患者的临床诊疗策略制定具有创新性、科学性指导意义。
55.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1