氢溴酸樟柳碱在用于治疗帕金森疾病的用途的制作方法
1.本发明属于药物新用途领域,具体的涉及氢溴酸樟柳碱在用于治疗帕金森疾病的用途。
背景技术:
2.帕金森病(pd)是一种常见的神经退行性疾病,其运动症状表现为急性或静止性震颤、运动迟缓、肌强直和姿势平衡障碍等,非运动症状一般表现为体重减轻、嗅觉减退、疲劳、便秘和精神萎靡等抑郁样症状。流行病学调查显示,目前全世界pd患者人数已高达600万,其中60岁以上人群患该病比例约为1%。据估计,至2030年我国pd患病人数可能达到500万人。氢溴酸樟柳碱为m胆碱受体拮抗剂,主要应用于血管性头痛、视网膜血管痉挛、缺血性视神经病变、急性瘫痪、震颤麻痹等,也可以应用于有机磷农药中毒的解毒。
3.目前临床治疗帕金森病以左旋多巴、多巴胺等药物治疗为主,但是随着用药时间的延长,出现了药物耐药性,直接影响治疗效果和康复。
4.目前急需其他药物,能够优于目前现有以左旋多巴、多巴胺等药物治疗为主的常规治疗方法,为帕金森病的长期治疗策略寻找有效治疗手段。
技术实现要素:
5.本发明为了解决上述背景技术中能够优于目前现有以左旋多巴、多巴胺等药物治疗为主的常规治疗方法的技术问题,提供了一种氢溴酸樟柳碱在用于治疗帕金森疾病的用途。
6.本发明采用的技术方案如下:
7.本发明一方面提供了一种氢溴酸樟柳碱在用于治疗帕金森疾病的用途,所述氢溴酸樟柳碱的药用剂型为注射剂和/或片剂。
8.本发明的有益效果是:氢溴酸樟柳碱可有效改善帕金森患者的运动功能和生活质量,还可有效预防帕金森患者治疗后并发症的发生,可作为帕金森病长期治疗策略的一种有效手段,值得临床进一步推广使用。
9.在上述技术方案的基础上,本发明还可以做如下改进。
10.进一步,所述氢溴酸樟柳碱的药用剂型为片剂,药用剂量为1mg/次且一天2~3次。
11.采用上述进一步方案的有益效果是,氢溴酸樟柳碱片可有效改善帕金森患者的日常生活能力、运动功能和生活质量,还可有效预防帕金森患者治疗后并发症的发生。
12.进一步,所述氢溴酸樟柳碱片剂采用连续口服的方式,至少服用6个月。
13.采用上述进一步方案的有益效果是,适宜的服药方式和治疗周期,能够让氢溴酸樟柳碱片在治疗帕金森疾病时发挥更好的效果。
14.进一步,所述氢溴酸樟柳碱的药用剂型为注射液,药用剂量为2mg/次且 1~2次/日,所述帕金森疾病为帕金森急性震颤。
15.采用上述进一步方案的有益效果是,氢溴酸樟柳碱注射液可有效缓解帕金森病的
急性震颤症状,是帕金森病的治疗策略中的一项有效措施,值得临床进一步推广使用。
16.进一步,所述氢溴酸樟柳碱注射液至少静脉滴注10天。
17.采用上述进一步方案的有益效果是,适应的治疗时间能够让治疗效果更好。
18.进一步,所述氢溴酸樟柳碱注射液采用200~250ml生理盐水稀释后静脉滴注。
19.采用上述进一步方案的有益效果是,稀释液提高了安全性和人体的耐受性。
20.进一步,所述氢溴酸樟柳碱注射液采用250ml生理盐水稀释后静脉滴注。
21.采用上述进一步方案的有益效果是,稀释液提高了安全性和人体的耐受性。
22.进一步,首先采用氢溴酸樟柳碱注射液连续静脉滴注8~12天,接着在氢溴酸樟柳碱注射液治疗10天后开始单独使用氢溴酸樟柳碱片连续治疗至少3个月,其中:
23.所述氢溴酸樟柳碱注射液的药用剂量为2mg/次且1~2次/日;
24.所述氢溴酸樟柳碱片的药用剂量为1mg/次且一天2~3次。
25.采用上述进一步方案的有益效果是,氢溴酸樟柳碱注射液与氢溴酸樟柳碱片序贯,可有效改善帕金森患者的运动功能和生活质量,还可有效预防帕金森患者治疗后并发症的发生,可作为帕金森病长期治疗策略的一种有效手段,值得临床进一步推广使用。
26.进一步,所述氢溴酸樟柳碱注射液的药用剂量为2mg/次且1次/日,采用250ml生理盐水稀释后静脉滴注;
27.所述氢溴酸樟柳碱片的药用剂量为1mg/次且一天2次。
28.采用上述进一步方案的有益效果是,适宜的用药剂量能够达到更好的治疗效果,提升治疗水平。
具体实施方式
29.以下对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
30.为了更好的说明
31.实施例1、氢溴酸樟柳碱片治疗帕金森病的临床疗效观察
32.1.1、实验准备
33.采用前瞻性随机对照临床试验方法,选取2020年3月~2021年3月在研究单位确诊为帕金森病的患者,符合中国帕金森病的诊断标准(2016版)及纳入排除标准的患者300例,其中男性163例,女性137例。按照随机数字表随机分为试验组和对照组,每组150例。试验组患者平均年龄58.79
±
3.31 岁,平均病程3.46
±
1.75年;对照组患者平均年龄59.45
±
3.02岁,平均病程3.38
±
1.64年。两组患者的年龄、病程比较,差异无统计学意义(p> 0.05),具有可比性。见表1。
34.表1两组患者一般资料比较
35.组别年龄(岁)病程(年)试验组(n=140)58.79
±
3.313.46
±
1.75对照组(n=140)59.45
±
3.023.38
±
1.64t值1.8040.409p值0.0720.683
36.诊断标准:参照中国帕金森病的诊断标准(2016版)[5-6]诊断标准关于帕金森病
的诊断标准:
①
运动减少:随意运动迟缓;
②
至少满足下列1项:肌肉僵直,静止性震颤,姿势不稳(排除原发性视觉、前庭、小脑及体感受器功能等病因);
③
左旋多巴制剂或多巴胺激动剂有显著疗效,或乙酰胆碱受体阻滞剂对静止震颤有效;
④
脑部ct或mri无异常改变,但有轻中度脑萎缩或轻度脑室扩大。
[0037]
纳入标准:
①
年龄18岁及以上,性别不限;
②
临床诊断为原发性帕金森病(符合《中国帕金森病的诊断标准2016版》中的相关诊断标准);
③
帕金森hoehn-yahr分级为1.5~3期;
④
能够理解病遵守研究流程,书面签署研究知情同意书并表示自愿参加试验的受试者(知情同意书由本人或法定代理人签署)。
[0038]
排除标准:
①
认知功能障碍者(mmse<27分);
②
有反复中风或既往颅脑损伤史者;
③
有严重心脏疾患、严重心律失常、心衰者;
④
肝肾功能严重异常者(肝功能实验室指标alt》1.5uln,肾功能实验室指标cr》1.5uln);
⑤
有精神疾病病史和(或)认知障碍的患者;
⑥
伴有任何器官或系统的恶性肿瘤,或正在进行抗肿瘤治疗,预计生存期<12个月;
⑦
显著的药物或酒精滥用;
⑧
病情严重,预计生存期不足3个月者;
⑨
过敏体质,以及对两种或以上药物或食物过敏;或已知对本药成分过敏;
⑩
已经妊娠、有妊娠计划或哺乳期的女性受试者;过去3个月参加其它临床试验;具有因使用药物(例如,甲氧氯普胺、氟桂利嗪)、神经系统遗传性代谢病(例如,威尔森氏病)、脑炎、脑血管疾病或退行性疾病(例如,进行性核上性麻痹)而导致的不典型的帕金森病症状;伴有其他情况,且经研究者评估认为参加研究可能会加重受试者的风险或研究者认为不适合参与此项研究。
[0039]
1.2、实验方法
[0040]
1.2.1、分组和用药
[0041]
试验组:氢溴酸樟柳碱片,1mg/次,2次/日,口服;连续治疗,6个月为一个疗程。
[0042]
对照组:复方左旋多巴片,首日137.5mg/次,2次/日,逐天增加137.5mg,直至每日2.2g;维持剂量为550mg/日,口服;连续治疗,6个月为一个疗程。
[0043]
1.2.2、合并用药
[0044]
禁止合并使用所有m胆碱受体拮抗剂。
[0045]
1.2.3、观察指标
[0046]
①
主要结局指标:帕金森病评定量表(updrs)评分总分及updrs
‑ⅱ
(13 个问题)、updrs
‑ⅲ
(14个问题)与updrs
‑ⅳ
(11个问题)三个分量表分项评分,分别评价日常生活活动、运动功能与治疗相关运动并发症的情况。若患者出现“开关”现象,则评价“开”时相患者的状态。updrs
‑ⅱ
、updrs
‑ꢀⅲ
与updrs
‑ⅳ
的总分范围分别为0~52分、0~56分、0~23分,评分越高反映pd患者的症状越重。于治疗前、治疗后1个月、治疗后2个月、治疗后3 个月及治疗后6个月进行评价。
[0047]
②
次要结局指标:1)认知功能评分蒙特利尔认知评估表(moca评分):蒙特利尔认知评估量表(montreal connitive assessment,moca)包括视空间与执行功能(5分)、注意力(3分)、命名(3分)、抽象概括能力(2分)、语言(3分)、定向力(6分)、延迟回忆(5分)以及计算(3分)8个认知域的内容,总分30分,分值<26分评定为存在认知功能障碍。若受教育年限<12年,则测试结果加1分。两组临床疗效以moca分值变化率为临床疗效依据,分值变化率=(治疗后评分-治疗前评分)/治疗前得分
×
100%。无效:变化率<10%,有效:10%≤变
化率<20%,显著有效:变化率≥20%。总体有效率= (显著有效+有效)/总例数
×
100%。于治疗前、治疗后1个月、治疗后2个月、治疗后3个月及治疗后6个月进行评价。
[0048]
2)生活质量评分。从8个维度共39个问题反映pd患者生活质量,每题依据选项评定0~4分,总分范围为0~156分,评分越高反映病情越重。于治疗前、治疗后1个月、治疗后2个月、治疗后3个月及治疗后6个月进行评价。
[0049]
1.2.4、安全性评价
[0050]
观察用药后患者是否发生口干、潮红、视物模糊、头晕、异动、少动等不良反应。
[0051]
1.3、统计学方法
[0052]
不同治疗组各次随访的计量资料将采用均数
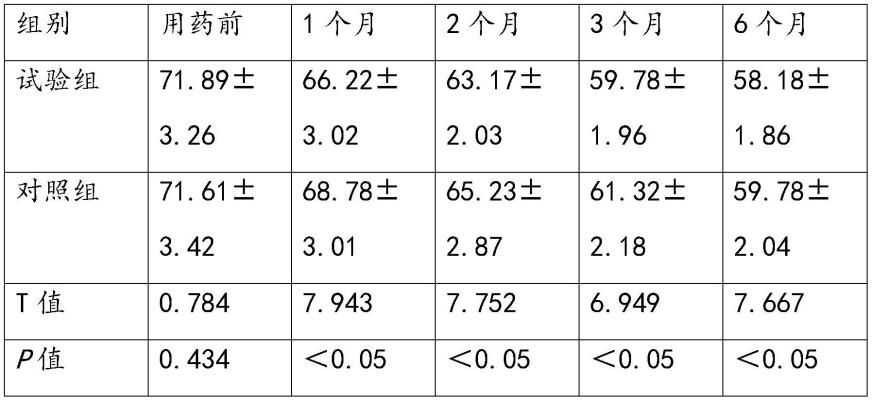
±
标准差进行统计描述。所有统计分析将采用spss 26.0软件统计分析软件编程计算。所有的统计学检验均采用双侧检验,p<0.05则认为所检验的差异有统计意义,可信区间采用95%的可信度。
[0053]
2、结果
[0054]
2.1、两组患者治疗前后各时点updrs评分总分比较
[0055]
治疗前,两组患者updrs评分总分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后1个月、2个月、3个月、6个月,试验组updrs 评分总分与对照组相比,差异均有统计学意义(p<0.05),结果见表2。
[0056]
表2、两组患者updrs评分总分比较
[0057][0058]
2.2、两组患者治疗前后各时点updrs
‑ⅱ
评分、updrs
‑ⅲ
评分、updrs
‑ꢀⅳ
评分比较
[0059]
治疗前,两组患者updrs
‑ⅱ
评分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后1个月、2个月、3个月、6个月,试验组updrs
‑ꢀⅱ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表3。
[0060]
治疗前,两组患者updrs
‑ⅲ
评分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后1个月、2个月、3个月、6个月,试验组updrs
‑ꢀⅲ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表4。
[0061]
治疗前,两组患者updrs
‑ⅳ
评分比较,差异均无统计学意义(p>0.05),具有组间可比性。除治疗后1个月试验组updrs
‑ⅳ
评分与对照组相比,差异无统计学意义(p>0.05)外,治理后2个月、3个月、6个月,试验组updrs
‑ꢀⅳ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表5。
[0062]
表3、两组患者治疗前后各时点updrs
‑ⅱ
评分比较
[0063][0064]
表4、两组患者治疗前后各时点updrs
‑ⅲ
评分比较
[0065][0066]
表5、两组患者治疗前后各时点updrs
‑ⅳ
评分比较
[0067][0068]
2.3、两组患者治疗前后各时点moca评分比较
[0069]
治疗前,两组患者moca评分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后1个月、2个月、3个月、6个月,试验组moca评分与对照组相比,差异均无统计学意
义(p>0.05),结果见表6。
[0070]
表6两组患者治疗前后各时点moca评分比较
[0071][0072]
2.4、两组患者治疗前后各时点生活质量评分比较
[0073]
治疗前,两组患者生活质量评分比较,差异均无统计学意义(p>0.05),具有组间可比性。除治疗后1个月试验组生活质量评分与对照组相比,差异无统计学意义(p>0.05)外,治疗后2个月、3个月、6个月,试验组生活质量评分与对照组相比,差异均有统计学意义(p<0.05),结果见表7。
[0074]
表7、两组患者治疗前后各时点生活质量评分比较
[0075][0076]
2.5、安全性评价
[0077]
试验组共出现9例不良反应,包括口干4例、面部潮红2例、视物模糊3例,不良反应发生率为6%;对照组共出现10例不良反应,包括异动6例、少动4例,不良反应发生率为6.67%。两组不良反应发生率比较,差异无统计学意义(p>0.05)。
[0078]
3、实验结论
[0079]
通过上述实验可以得出,采用氢溴酸樟柳碱片剂治疗帕金森病的患者,相对于现有的治疗方案,不良反应率降低了11.17%。
[0080]
根据updrs评分总分比较,治疗效果进行比较,试验组6个月后updrs 评分总分下降13.71,而对照组updrs评分总分下降11.83,故采用氢溴酸樟柳碱片剂治疗帕金森病的患者,相对于现有的治疗方案,治疗效果提升了 15%。
[0081]
根据表7所示的生活质量评分比较,试验组3个月后生活质量评分下降 13.71,而对照组3个月后生活质量评分下降11.83,故采用氢溴酸樟柳碱片剂治疗帕金森病的患者,相对于现有的治疗方案,生活质量提升了50%。
[0082]
综上所述,氢溴酸樟柳碱片剂在治疗帕金森病用途良好。
[0083]
实施例2、氢溴酸樟柳碱注射液治疗帕金森病急性震颤的临床疗效观察
[0084]
1.1、实验准备
[0085]
本实验采用前瞻性随机对照临床试验方法,选取2020年7月~2021年 11月在研究单位确诊为帕金森病急性震颤的患者,符合中国帕金森病的诊断标准(2016版)及纳入排除标准的患者280例,其中男性150例,女性130 例。按照随机数字表随机分为试验组和对照组,每组140例。试验组患者平均年龄62.23
±
2.31岁,平均病程3.82
±
1.67年;对照组患者平均年龄 62.16
±
2.07岁,平均病程3.61
±
1.78年。两组患者的年龄、病程比较,差异无统计学意义(p>0.05),具有可比性。见表8。
[0086]
表8、两组患者一般资料比较
[0087]
组别年龄(岁)病程(年)试验组(n=140)62.23
±
2.313.82
±
1.67对照组(n=140)62.16
±
2.073.61
±
1.78t值0.2671.018p值0.7900.310
[0088]
诊断标准:参照中国帕金森病的诊断标准(2016版)诊断标准关于帕金森病的诊断标准:
①
运动减少:随意运动迟缓;
②
至少满足下列1项:肌肉僵直,静止性震颤,姿势不稳(排除原发性视觉、前庭、小脑及体感受器功能等病因);
③
左旋多巴制剂或多巴胺激动剂有显著疗效,或乙酰胆碱受体阻滞剂对静止震颤有效;
④
脑部ct或mri无异常改变,但有轻中度脑萎缩或轻度脑室扩大。
[0089]
纳入标准:
①
年龄18岁及以上,性别不限;
②
临床诊断为原发性帕金森病(符合《中国帕金森病的诊断标准2016版》中的相关诊断标准),且伴震颤症状患者;
③
帕金森hoehn-yahr分级为1.5~3期;
④
能够理解病遵守研究流程,书面签署研究知情同意书并表示自愿参加试验的受试者(知情同意书由本人或法定代理人签署)。
[0090]
排除标准:
①
临床症状无震颤表现的帕金森病患者;
②
认知功能障碍者 (mmse<27分);
③
有反复中风或既往颅脑损伤史者;
④
有严重心脏疾患、严重心律失常、心衰者;
⑤
肝肾功能严重异常者(肝功能实验室指标 alt》1.5uln,肾功能实验室指标cr》1.5uln);
⑥
有精神疾病病史和(或) 认知障碍的患者;
⑦
伴有任何器官或系统的恶性肿瘤,或正在进行抗肿瘤治疗,预计生存期<12个月;
⑧
显著的药物或酒精滥用;
⑨
病情严重,预计生存期不足3个月者;
⑩
过敏体质,以及对两种或以上药物或食物过敏;或已知对本药成分过敏;已经妊娠、有妊娠计划或哺乳期的女性受试者;过去3个月参加其它临床试验;具有因使用药物(例如,甲氧氯普胺、氟桂利嗪)、神经系统遗传性代谢病(例如,威尔森氏病)、脑炎、脑血管疾病或退行性疾病(例如,进行性核上性麻痹)而导致的不典型的帕金森病症状;伴有其他情况,且经研究者评估认为参加研究可能会加重受试者的风险或研究者认为不适合参与此项研究。
[0091]
1.2、实验方法
[0092]
1.2.1分组和用药
[0093]
试验组:氢溴酸樟柳碱注射液2mg/次,1次/日,250ml生理盐水稀释后静脉滴注,10d为一个疗程。
[0094]
对照组:左旋多巴注射液,静脉滴注0.2-0.3g/日,用5%-10%葡萄糖注射液稀释后应用,10d为一个疗程。
[0095]
1.2.2、合并用药
[0096]
禁止合并使用所有m胆碱受体拮抗剂。
[0097]
1.2.3、观察指标
[0098]
①
主要结局指标:帕金森病评定量表(updrs)评分:采用updrs
‑ⅲ
(14 个问题)与updrs
‑ⅳ
(11个问题)两个分量表,分别评价运动功能与治疗相关运动并发症的情况。若患者出现“开关”现象,则评价“开”时相患者的状态。updrs
‑ⅲ
与updrs
‑ⅳ
的总分范围分别为0~56分、0~23分,评分越高反映pd患者的症状越重。于治疗前、治疗后5d及治疗后10d进行评价。
[0099]
②
次要结局指标:治疗前、治疗后10d、治疗后30d帕金森病评定量表 (updrs)评分偏移。
[0100]
1.2.4、安全性评价
[0101]
观察用药后患者是否发生口干、潮红、视物模糊、头晕等不良反应。
[0102]
1.3、统计学方法
[0103]
不同治疗组各次随访的计量资料将采用均数
±
标准差进行统计描述。所有统计分析将采用spss 26.0软件统计分析软件编程计算。所有的统计学检验均采用双侧检验,p<0.05则认为所检验的差异有统计意义,可信区间采用95%的可信度。
[0104]
2、结果
[0105]
2.1、两组患者治疗前后各时点updrs
‑ⅲ
、updrs
‑ⅳ
评分比较
[0106]
治疗前,两组患者updrs
‑ⅲ
、updrs
‑ⅳ
评分比较,差异均无统计学意义 (p>0.05),具有组间可比性。治疗后5d及治疗后10d,试验组updrs
‑ⅲ
、 updrs
‑ⅳ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表9、表10。
[0107]
表9、两组帕金森病患者治疗前后各个时间点updrs
‑ⅲ
评分比较(分,)
[0108]
组别治疗前治疗后5d治疗后10d试验组(n=140)46.37
±
4.2722.45
±
4.0125.61
±
2.87对照组(n=140)45.65
±
4.3825.37
±
3.9826.76
±
3.54t值1.3936.1152.986p值0.1650.0000.003
[0109]
表10、两组帕金森病患者治疗前后各个时间点updrs
‑ⅳ
评分比较(分,)
[0110]
组别治疗前治疗后5d治疗后10d试验组(n=140)12.48
±
2.137.22
±
1.877.49
±
2.01对照组(n=140)12.24
±
2.178.37
±
2.019.24
±
2.23t值0.9344.9566.897
p值0.3510.0000.000
[0111]
2.2、两组患者治疗前后各时点updrs评分偏移比较
[0112]
治疗前,两组患者updrs评分偏移比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后10d及治疗后30d,试验组患者updrs评分偏移与对照组相比,差异有统计学意义(p<0.05),结果见表11。
[0113]
表11、两组帕金森病患者治疗前后各个时间点updrs评分偏移比较(分,)
[0114][0115]
2.3、不良反应发生情况
[0116]
试验组出现7例不良反应,包括口干3例,潮红3例,视物模糊1例,不良反应发生率为5%;对照组出现8例不良反应,包括异动4例,少动4 例,不良反应发生率为5.7%。两组不良反应发生率比较,差异没有统计学意义(p>0.05)。
[0117]
3、实验结论
[0118]
通过上述实验可以得出,采用氢溴酸樟柳碱注射液治疗帕金森病急性震颤的患者,相对于现有的治疗方案,不良反应率降低了14%。
[0119]
根据表9的updrs
‑ⅲ
评分比较,治疗效果,试验组10天后updrs
‑ⅲ
评分下降20.76,而对照组updrs
‑ⅲ
评分下降18.89,故采用氢溴酸樟柳碱注射液治疗帕金森病急性震颤的患者,相对于现有的治疗方案,治疗效果提升了9.8%。
[0120]
根据表10所示的updrs
‑ⅳ
评分比较,试验组10天后updrs
‑ⅳ
评分下降4.99,而对照组10天后updrs
‑ⅳ
评分下降3,故采用氢溴酸樟柳碱注射液治疗帕金森病急性震颤的患者,相对于现有的治疗方案,治疗效果提升了 66%。
[0121]
综上所述,氢溴酸樟柳碱注射液在治疗帕金森病急性震颤用途良好。在治疗时间上要更优于氢溴酸樟柳碱片剂。
[0122]
实施例3、氢溴酸樟柳碱注射液与氢溴酸樟柳碱片序贯治疗帕金森病的临床疗效观察
[0123]
1.1、实验准备
[0124]
本实验采用前瞻性随机对照临床试验方法,选取2020年12月~2021年 12月在研究单位确诊为帕金森病的患者,符合中国帕金森病的诊断标准 (2016版)及纳入排除标准的患者350例,其中男性195例,女性155例。按照随机数字表随机分为试验组和对照组,每组175例。试验组患者平均年龄58.43
±
3.48岁,平均病程3.37
±
1.72年;对照组患者平均年龄58.24
ꢀ±
3.14岁,平均病程3.52
±
1.61年。两组患者的年龄、病程比较,差异无统计学意义
(p>0.05),具有可比性。见表12。
[0125]
表12、两组患者一般资料比较
[0126]
组别年龄(岁)病程(年)试验组(n=140)58.43
±
3.483.37
±
1.72对照组(n=140)58.24
±
3.143.52
±
1.61t值0.5360.842p值0.5920.400
[0127]
诊断标准:参照中国帕金森病的诊断标准(2016版)[6]诊断标准关于帕金森病的诊断标准:
①
运动减少:随意运动迟缓;
②
至少满足下列1项:肌肉僵直,静止性震颤,姿势不稳(排除原发性视觉、前庭、小脑及体感受器功能等病因);
③
左旋多巴制剂或多巴胺激动剂有显著疗效,或乙酰胆碱受体阻滞剂对静止震颤有效;
④
脑部ct或mri无异常改变,但有轻中度脑萎缩或轻度脑室扩大。
[0128]
纳入标准:
①
年龄18岁及以上,性别不限;
②
临床诊断为原发性帕金森病(符合《中国帕金森病的诊断标准2016版》中的相关诊断标准);
③
帕金森hoehn-yahr分级为1.5~3期;
④
能够理解病遵守研究流程,书面签署研究知情同意书并表示自愿参加试验的受试者(知情同意书由本人或法定代理人签署)。
[0129]
排除标准:
①
认知功能障碍者(mmse<27分);
②
有反复中风或既往颅脑损伤史者;
③
有严重心脏疾患、严重心律失常、心衰者;
④
肝肾功能严重异常者(肝功能实验室指标alt》1.5uln,肾功能实验室指标cr》1.5uln);
⑤
有精神疾病病史和(或)认知障碍的患者;
⑥
伴有任何器官或系统的恶性肿瘤,或正在进行抗肿瘤治疗,预计生存期<12个月;
⑦
显著的药物或酒精滥用;
⑧
病情严重,预计生存期不足3个月者;
⑨
过敏体质,以及对两种或以上药物或食物过敏;或已知对本药成分过敏;
⑩
已经妊娠、有妊娠计划或哺乳期的女性受试者;过去3个月参加其它临床试验;具有因使用药物(例如,甲氧氯普胺、氟桂利嗪)、神经系统遗传性代谢病(例如,威尔森氏病)、脑炎、脑血管疾病或退行性疾病(例如,进行性核上性麻痹)而导致的不典型的帕金森病症状;伴有其他情况,且经研究者评估认为参加研究可能会加重受试者的风险或研究者认为不适合参与此项研究。
[0130]
1.2、实验方法
[0131]
1.2.1、分组和用药
[0132]
试验组:氢溴酸樟柳碱注射液2mg,1次/日,250ml生理盐水稀释后静脉滴注,连续使用10
±
2天;氢溴酸樟柳碱注射液治疗10天后开始使用氢溴酸樟柳碱片,1mg/次,2次/日,口服,连续治疗3个月。
[0133]
对照组:左旋多巴注射液,静脉滴注0.2-0.3g/日,用5%-10%葡萄糖注射液稀释后应用,连续使用10
±
2天;左旋多巴注射液治疗10天后开始使用复方左旋多巴片,首日137.5mg/次,2次/日,逐天增加137.5mg,直至每日2.2g;维持剂量为550mg/日,口服,连续治疗3个月。
[0134]
1.2.2、合并用药
[0135]
禁止合并使用所有m胆碱受体拮抗剂。
[0136]
1.2.3、观察指标
[0137]
①
主要结局指标:帕金森病评定量表(updrs)评分总分及updrs
‑ⅲ
(14 个问题)与updrs
‑ⅳ
(11个问题)三个分量表分项评分,分别评价运动功能与治疗相关运动并发症的情况。若患者出现“开关”现象,则评价“开”时相患者的状态。updrs
‑ⅲ
与updrs
‑ⅳ
的总分范围分别为0~56分、0~23 分,评分越高反映pd患者的症状越重。于治疗前、治疗后10d、治疗后1 个月、治疗后2个月及治疗后3个月进行评价。
[0138]
②
次要结局指标:1)认知功能评分蒙特利尔认知评估表(moca评分):蒙特利尔认知评估量表(montreal connitive assessment,moca)包括视空间与执行功能(5分)、注意力(3分)、命名(3分)、抽象概括能力(2 分)、语言(3分)、定向力(6分)、延迟回忆(5分)以及计算(3分)8个认知域的内容,总分30分,分值<26分评定为存在认知功能障碍。若受教育年限<12年,则测试结果加1分。两组临床疗效以moca分值变化率为临床疗效依据,分值变化率=(治疗后评分-治疗前评分)/治疗前得分
×ꢀ
100%。无效:变化率<10%,有效:10%≤变化率<20%,显著有效:变化率≥20%。总体有效率=(显著有效+有效)/总例数
×
100%。于治疗前、治疗后10d、治疗后1个月、治疗后2个月及治疗后3个月进行评价。
[0139]
2)生活质量评分。从8个维度共39个问题反映pd患者生活质量,每题依据选项评定0~4分,总分范围为0~156分,评分越高反映病情越重。于治疗前、治疗后10d、治疗后1个月、治疗后2个月及治疗后3个月进行评价。
[0140]
1.2.4、安全性评价
[0141]
观察用药后患者是否发生口干、潮红、视物模糊、头晕、异动、少动等不良反应。
[0142]
1.3、统计学方法
[0143]
不同治疗组各次随访的计量资料将采用均数
±
标准差进行统计描述。所有统计分析将采用spss 26.0软件统计分析软件编程计算。所有的统计学检验均采用双侧检验,p<0.05则认为所检验的差异有统计意义,可信区间采用95%的可信度。
[0144]
2、结果
[0145]
2.1、两组患者治疗前后各时点updrs评分总分比较
[0146]
治疗前,两组患者updrs评分总分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后10天、1个月、2个月、3个月,试验组updrs评分总分与对照组相比,差异均有统计学意义(p<0.05),结果见表13。
[0147]
表13、两组患者updrs评分总分比较
[0148][0149]
2.2、两组患者治疗前后各时点updrs
‑ⅲ
评分、updrs
‑ⅳ
评分比较
[0150]
治疗前,两组患者updrs
‑ⅲ
评分比较,差异均无统计学意义(p>0.05),具有组间可比性。除治疗后10天试验组updrs
‑ⅲ
评分与对照组相比,差异无统计学意义(p>0.05)外,治理后1个月、2个月、3个月,试验组updrs
‑ꢀⅲ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表14。
[0151]
治疗前,两组患者updrs
‑ⅳ
评分比较,差异均无统计学意义(p>0.05),具有组间可比性。除治疗后10天试验组updrs
‑ⅳ
评分与对照组相比,差异无统计学意义(p>0.05)外,治理后1个月、2个月、3个月,试验组updrs
‑ꢀⅳ
评分与对照组相比,差异均有统计学意义(p<0.05),结果见表15。
[0152]
表14、两组患者治疗前后各时点updrs
‑ⅲ
评分比较
[0153][0154]
表15、两组患者治疗前后各时点updrs
‑ⅳ
评分比较
[0155][0156]
2.3、两组患者治疗前后各时点moca评分比较
[0157]
治疗前,两组患者moca评分比较,差异均无统计学意义(p>0.05),具有组间可比性。治疗后10天、1个月、2个月、3个月,试验组moca评分与对照组相比,差异均无统计学意义(p>0.05),结果见表16。
[0158]
表16、两组患者治疗前后各时点moca评分比较
[0159][0160][0161]
2.4、两组患者治疗前后各时点生活质量评分比较
[0162]
治疗前,两组患者生活质量评分比较,差异均无统计学意义(p>0.05),具有组间可比性。除治疗后10天试验组生活质量评分与对照组相比,差异无计学意义(p>0.05)外,治疗后1个月、2个月、3个月,试验组生活质量评分与对照组相比,差异均有统计学意义(p<0.05),结果见表17。
[0163]
表17、两组患者治疗前后各时点生活质量评分比较
[0164][0165]
2.5、安全性评价
[0166]
试验组共出现11例不良反应,包括口干5例、面部潮红3例、视物模糊3例,不良反应发生率为6.29%;对照组共出现13例不良反应,包括异动 6例、少动7例,不良反应发生率为7.43%。两组不良反应发生率比较,差异无统计学意义(p>0.05)。
[0167]
3、实验结论
[0168]
通过上述实验可以得出,采用氢溴酸樟柳碱注射液与氢溴酸樟柳碱片序贯治疗帕金森病的患者,相对于现有的治疗方案,不良反应率降低了18.12%。
[0169]
根据updrs评分总分比较,治疗效果进行比较,试验组6个月后updrs 评分总分下降16.16,而对照组updrs评分总分下降13.55,故采用氢溴酸樟柳碱注射液与氢溴酸樟柳碱片序贯治疗帕金森病的患者,相对于现有的治疗方案,治疗效果提升了19.26%。
[0170]
根据表7所示的生活质量评分比较,试验组3个月后生活质量评分下降 11.37,而对照组3个月后生活质量评分下降8.12,故采用氢溴酸樟柳碱片剂治疗帕金森病的患者,相
对于现有的治疗方案,生活质量提升了40%。
[0171]
综上所述,氢溴酸樟柳碱注射液与氢溴酸樟柳碱片序贯治疗在治疗帕金森病用途良好。治疗效果优于单独使用片剂或者注射剂,且效果有较大的提升。
[0172]
在本说明书的描述中,术语“一个实施例”、“一些实施例”、“具体实施例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或实例。而且,描述的具体特征、结构、材料或特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0173]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1