一种组织粘附膜及其制备方法
1.本发明涉及医用膜的技术领域,尤其是指一种组织粘附膜及其制备方法。
背景技术:
2.临床上组织创伤伤口闭合是个不可避免的过程,传统的缝合手术会对组织造成二次损伤,并且操作时间长,易造成感染风险。组织粘附膜以其方便操作、创口闭合效率高、材料介入少而不产生二次损伤逐渐被重视,其可以取代缝合线在一些外科创伤伤口闭合中的应用。然而作为内科植入型组织粘合贴片对其生物相容性、持续性黏附性能、力学强度提出了更高的要求。
3.现有技术中有与组织粘附膜相似功能的液态粘合剂和粘附性贴片。前者在固化后可以实现组织伤口闭合,但是固化过程中依然容易被组织血液稀释造成不稳定的粘合,同时大量粘合剂会进入血液循环系统的弊端。后者虽然能快速粘合伤口,但是大部分都是利用未反应完全的活性基团与组织表面发生法学反应、会伴随着局部高热量的发生导致炎症,同时过多的降解产物以及外来的异物毒性成分增加了肝脏和肾脏的负担。组织粘附性膜是一种综合性更加有效的创口闭合手段,但是目前研究的生物粘附膜大部分只能应用于皮肤表面,在体内液体环境下难以保持膜的持续性粘附和力学强度,这无疑限制了组织粘附膜进一步的发展。
技术实现要素:
4.本发明的第一目的在于克服现有技术的缺点与不足,提供一种可实现与湿组织快速粘合、力学性能稳定、生物可降解的组织粘附膜。
5.本发明的第二目的在于提供一种组织粘附膜的制备方法。
6.本发明的第一目的通过下述技术方案实现:一种组织粘附膜,包括:超分子聚合物和增强剂形成的功能层;所述超分子聚合物由硫辛酸和生物相容性的稳定剂共聚制备得到;所述增强剂包括阳离子化合物、阳离子聚合物和金属粒子中的至少一种。
7.进一步,所述组织粘附膜还包括牺牲层,所述牺牲层在功能层任意一面或两面。
8.进一步,所述超分子聚合物由多羧基聚合物、苯多酚衍生物、多氰基聚合物、活化酯聚合物中的至少一种构成。
9.进一步,所述稳定剂包括丙烯酸酯基衍生物、巯基衍生物、苯多酚衍生物中的至少一种。
10.进一步,所述丙烯酸酯基衍生物为n-丙烯酰氧基甘氨酸。
11.进一步,所述阳离子化合物可选自硫酸锌、硫酸镁、硫酸铜、硝酸银、氯化铁、氯化亚铁中的至少一种。
12.进一步,所述金属粒子可选自四氧化三铁、氧化铁、氧化锌、铁中的至少一种。
13.进一步,所述组织粘附膜的厚度不大于2mm。
14.进一步,所述牺牲层为聚乙烯醇。
15.本发明的第二目的通过下述技术方案实现:一种组织粘附膜的制备方法,包括以下步骤:
16.配制硫辛酸、稳定剂、增强剂的乙醇混合溶液,热引发聚合,得到超分子聚合物溶液a;
17.将a均匀加至硅片,通过旋涂仪旋涂10-200秒,干燥后得到粘附膜b;
18.将聚乙烯醇水溶液加至b上,通过旋涂仪旋涂10-200秒得到牺牲层,干燥后得到所需的组织粘附膜。
19.进一步,所述硫辛酸、稳定剂、增强剂的摩尔比为1:0.5-1:0.001-0.01。
20.进一步,所述硫辛酸的质量分数为40%~80%。
21.进一步,所述热引发聚合温度为50-100℃。
22.进一步,所述聚乙烯醇的质量分数为5%-30%。
23.进一步,所述旋涂速度为500-5000转每分钟,加速度为50-1000转每分钟。
24.本发明与现有技术相比,具有如下优点与有益效果:
25.1、本发明的组织粘附膜粘合速度快,能持续有效闭合创口堵漏,力学强度维持持久。
26.2、本发明的组织粘附膜成分来自天动植物体内天然成分,生物相容性好,并且具备抗菌抑制炎症的功效。
27.3、本发明的组织粘附膜为疏水粘附膜,氢键作用和高表面能提供强黏附能,无不利活性基团引起刺激或者不适感。
附图说明
28.图1为具体实施方式中提供的一种组织粘附膜的剖视图。
具体实施方式
29.下面对本发明作进一步详细的描述,但本发明的实施方式不限于此。
30.如图1所示,本发明提供了一种组织粘附膜,包括功能层1和牺牲层2,其中,牺牲层2添加在功能层1任一表面,当然,牺牲层2也可以添加在组织粘附层1的两面;功能层1包括超分子聚合物和增强剂;超分子聚合物由硫辛酸和生物相容性的稳定剂共聚制备得到;增强剂包括阳离子化合物、阳离子聚合物和金属粒子中的至少一种。牺牲层2为水溶性聚合物,结合至功能层1可以增厚整体粘附膜,有利于撕拉脱模,并且提高膜在空气中的稳定性,不轻易被卷曲,粘附至组织后在盐水作用下能快速溶去牺牲层,降低膜的厚度,提高表面能,增大膜与组织的粘附性。
31.在一个具体示例中,超分子聚合物由多羧基聚合物、苯多酚衍生物、多氰基聚合物、活化酯聚合物中的至少一种构成。
32.在一个具体示例中,稳定剂包括丙烯酸酯基衍生物、巯基衍生物、苯多酚衍生物中的至少一种。
33.在一个具体示例中,稳定剂为n-丙烯酰氧基甘氨酸。
34.在一个具体示例中,阳离子化合物可选自硫酸锌、硫酸镁、硫酸铜、硝酸银、氯化铁、氯化亚铁中的至少一种。进一步,金属离子能与多羧基衍生物进行络合,提高超分子聚
合物的力学强度,可以提高力学稳定性,进一步,与组织表面也可络合,增强粘附力,进一步络合网络可以在外用试剂edta作用下去除,实现按需组织粘附和脱粘附。
35.在一个具体示例中,金属粒子可选自四氧化三铁、氧化铁、氧化锌、铁中的至少一种。
36.在一个具体示例中,组织粘附膜的厚度不大于2mm。厚度降低,比表面积增大,表面能提高,粘附膜与组织间的氢键作用力增强,粘附力提高。
37.在一个具体示例中,牺牲层为聚乙烯醇。
38.本发明还提供了上述组织粘附膜的制备方法,包括以下步骤:
39.配制硫辛酸、稳定剂、增强剂的乙醇混合溶液,热引发聚合,得到超分子聚合物溶液a;
40.将a均匀加至硅片,通过旋涂仪旋涂10-200秒,干燥后得到粘附膜b;
41.将pva水溶液加至b上,通过旋涂仪旋涂10-200秒得到牺牲层,干燥后得到所需的组织粘附膜;
42.在一个具体示例中,硫辛酸、稳定剂、增强剂的摩尔比为1:0.5-1:0.001-0.01。
43.在一个具体示例中,硫辛酸的质量分数为40%~80%。
44.在一个具体示例中,热引发聚合温度为50-100℃。
45.在一个具体示例中,聚乙烯醇水溶液的质量浓度为5%-30%。
46.在一个具体示例中,旋涂速度为500-5000转每分钟,加速度为50-1000转每分钟。
47.以下结合多个实施例和对比例对本发明上述组织粘附膜进行更详细说明。
48.实施例1
49.1)配制质量分数60%硫辛酸的乙醇溶液,然后加入n-丙烯酰氧基甘氨酸和硫酸锌,其中硫辛酸、n-丙烯酰氧基甘氨酸和硫酸锌的摩尔比为1:0.5:0.01,在75℃下热引发聚合,得到超分子聚合物溶液a;
50.2)将a均匀加至硅片,通过旋涂仪旋涂30秒(转速为3000转/分钟),干燥后得到粘附膜b;
51.3)将质量分数20%的聚乙烯醇水溶液加至b上,通过旋涂仪旋涂30秒(转速为3000转/分钟)得到牺牲层,干燥后得到所需的组织粘附膜。
52.实施例2
53.与实施例1不同的是步骤1)中硫辛酸的质量分数为40%。
54.实施例3
55.与实施例1不同的是步骤1)中硫辛酸、n-丙烯酰氧基甘氨酸和硫酸锌的摩尔比为1:0.5:0.001。
56.实施例4
57.与实施例1不同的是步骤1)中硫辛酸、n-丙烯酰氧基甘氨酸和硫酸锌的摩尔比为1:0.5:0.005。
58.实施例5
59.与实施例1不同的是步骤1)中硫辛酸、n-丙烯酰氧基甘氨酸和硫酸锌的摩尔比为1:0.2:0.01。
60.实施例6
61.与实施例1不同的是步骤1)中硫辛酸、n-丙烯酰氧基甘氨酸和硫酸锌的摩尔比为1:1:0.01。
62.实施例7
63.与实施例1不同的是步骤1)中热聚合的温度为50℃。
64.实施例8
65.与实施例1不同的是步骤2)和3)中的转速为800转每分钟。
66.实施例9
67.与实施例1不同的是步骤3)中聚乙烯醇水溶液的质量分数为15%。
68.对比例1
69.与实施例1不同的是没有步骤3)的牺牲层。
70.对比例2
71.与实施例1不同的是硫辛酸的质量分数为20%。
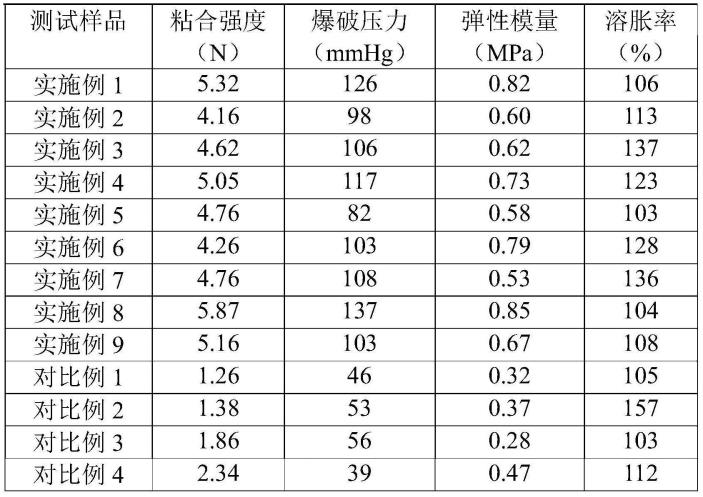
72.对比例3
73.与实施例1不同的是步骤1)中没有稳定剂n-丙烯酰氧基甘氨酸。
74.对比例4
75.与实施例1不同的是步骤1)中没有增强剂硫酸锌。
76.测试评估
77.针对以上实施例和对比例得到的产品进行不同指标测试,采用astm f2258-05《拉伸状态下组织粘合剂强度特性的标准试验方法》进行粘附性能测试;采用astm method f 2392-04《外科密封剂爆破强度标准试验方法》进行爆破压力测试;同时对测试样品弹性模量、水下溶胀性能进行检测,所有样品针对同种测试时保持相同的条件和环境,测试结果如表1。
78.表1
[0079][0080]
通过表1中实施例1、2和对比例2可知硫辛酸的占比对超分子结构产生影响,进而对其粘附性能和弹性模量产生明显的改变。实施例3~6和对比例3、4对比可知稳定剂和增
强剂对超分子的粘合强度力学强度具有显著影响,稳定剂将终止硫辛酸巯基的不稳定过程,对超分子硫辛酸的分子量具有显著调节作用,而增强剂对酸起到明显络合作用,将改变分子的交联密度,同时增强剂锌离子能络合组织表面的酸根,对粘合强度具有改变作用。实施例7表明了改变热聚合稳定将对硫辛酸聚合度产生影响,对整体性能具有调节作用。实施例9和对比例1说明了牺牲层对膜的力学强度具有增强作用,并且方便整体的应用,例如脱模和辅助粘合应用。
[0081]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1